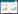文章信息
基金项目
- 广东海洋大学大学生创新创业项目(230429299);广东省农村科技特派员驻镇帮镇扶村项目(A21411);国家重点研发计划项目(2019YFD1002205)
作者简介
- 李甜子(1993—)女,在读硕士生,研究方向为果树生理及分子生物学,E-mail:2252531735@qq.com.
通讯作者
- 杨转英(1975—)女,博士,副教授,研究方向为果树生理及分子生物学,E-mail:332933829@qq.com.
文章历史
- 收稿日期:2022-01-14
【研究意义】火龙果(Hylocereus undulatus Britt)属仙人掌科量天尺属或蛇鞭柱属攀援性肉质植物,又称红龙果、仙蜜果等。根据外观和果肉颜色,火龙果常被分为红皮红肉、红皮白肉和黄皮白肉3种[1]。火龙果可适应多种土壤,病害少,易管理,经济价值高且市场潜力大,在热带和亚热带地区被广泛种植[2],近年种植规模不断扩大[3-4]。火龙果富含碳水化合物、维生素、花青素、氨基酸、蛋白质、有机酸等营养成分,以及锌、镁、钙、铁、铜等有益元素[5],对人体有抗氧化、抗衰老、降血压血脂等作用[6],并且还可以调节血糖、减轻便秘,对糖尿病有非常高的辅助治疗作用,是一种极具开发潜力和开发价值的新型食疗保健水果[7]。因此,研究火龙果果实内在品质的形成机制,对定向调节果实品质和推进火龙果产业健康可持续发展具有重要指导意义。
【前人研究进展】果实中可溶性糖的种类与含量在很大程度上影响果实的甜度和风味品质[8-9]。市面上优质火龙果普遍根据火龙果的甜度(糖的种类和含量)进行定价。果实糖分的积累与代谢是影响果实中可溶性糖的种类与含量的主要原因,而糖分的积累、代谢与相关酶活性有着密切关系[10]。火龙果果肉中的可溶性糖以葡萄糖为主,其次是果糖和蔗糖[11]。与葡萄糖积累与代谢相关的酶有萄糖转运蛋白(glucose trnsporte, GLUT)、己糖转运蛋白(hexose transporter, HXT)等[12]。己糖转运蛋白属于单糖转运蛋白,能够跨膜转运甘露糖、果糖和葡萄糖等己糖类物质[13],在葡萄糖的积累与代谢过程中起着非常重要的作用。研究发现,己糖转运蛋白还参与花粉发育和植株生长,并决定果实的品质[14]。关于己糖转运蛋白在葡萄糖积累与代谢过程中的作用,已有人对甘蔗、甜瓜和苹果等植物进行相关研究[15-17]。
【本研究切入点】目前,对于火龙果的研究大多集中在栽培、采后贮藏、营养成分分析和病虫害防治等方面[8],对火龙果在糖代谢方面的研究则较少。探究己糖转运蛋白在火龙果葡萄糖积累与代谢过程中的作用,有利于进一步改善火龙果的风味品质,为火龙果的选育及推广提供重要技术支撑。【拟解决的关键问题】本研究对经基因克隆得到的火龙果己糖转运蛋白基因进行生物信息学分析,通过HLPC测定果实中可溶性糖的种类及含量,采用实时荧光定量PCR技术对不同株系火龙果、同一果实不同部位中的HXT表达量进行分析。
1 材料与方法 1.1 试验材料供试火龙果来自广东海洋大学校内火龙果资源圃,选取健壮的15号、16号、49号、97号、128号、红皮白肉(HB)、湛红2号(ZH)株系为试验材料(所列火龙果编号为资源圃中对应的编号),在成熟期分别采摘火龙果果实3~5个,取果肉混合作为不同株系火龙果果肉样品。将单个成熟的128号火龙果果肉分成4个部分,分别为近果顶、近果蒂、果心、近果皮(图 1),作为火龙果同一果实不同部位的样品。取样后将单个样品充分混合,液氮速冻后-80℃保存备用。

|
| A:近果顶;B:近果蒂;C:果心;D:近果皮 A: Near fruit apex; B: Near pedicel; C: Core; D: Near pericarp 图 1 128号火龙果果实取样部位 Fig. 1 Sampling parts of No. 128 Pitaya fruit |
1.2 试验方法
1.2.1 火龙果总RNA提取 采用超快型植物总RNA提取试剂盒(华越洋生物科技有限公司),按照说明书方法提取火龙果样品RNA,利用1% 琼脂糖凝胶电泳检测RNA质量,合格RNA置于-80℃冰箱中保存备用。
1.2.2 反转录及HuHXT基因克隆 以火龙果样品RNA为模板,根据RevertAid First Strand cDNA Synthesis Kit(上海纯优生物科技有限公司)说明书进行反转录得到cDNA。以火龙果果肉cDNA为模板克隆火龙果中HuHXT基因(引物序列为F:5′GATCTGGGTATTGCTGGCAA3′,R:5′GGCTGGGCTTAAAGCTCG3′),PCR扩增结果通过电泳进行检测,将目的基因切胶回收,纯化产物后转化到大肠杆菌感受态细胞中,阳性检测合格后送上海生工生物工程有限公司测序。
1.2.3 生物信息学分析 采用NCBI的BLAST分析HuHXT核酸序列的分子质量、碱基组成与碱基同源性等;通过ORF Finder对HuHXT核酸序列进行开放性阅读框分析;用BioEdit软件对man ORF翻译的蛋白分子量、等电点、氨基酸组成等蛋白质理化性质进行分析;通过SMART进行蛋白质结构域分析;用NCBI的BLASTX分析HuHXT核酸序列,选择合适的同源序列并下载生成fasta文件,然后用CLUSTAL软件将下载的蛋白质序列与火龙果己糖转运蛋白序列比对,再用DNAMAN根据结果描绘出系统进化树;用Prediction Serves进行信号肽预测;用ExPASy服务器的ProtScale程序对HuHXT氨基酸序列进行疏水性分析;通过TMHMM Server进行HXT氨基酸序列跨膜区分析;用WoLF PSORT对HuHXT氨基酸序列进行亚细胞定位;采用NetPhos2.0 Server程序进行磷酸化位点分析;分别通过PBIL LYON-GERLAND信息库的Hopfield神经网络和Biozentrum的SWISS-MODEL对HuHXT氨基酸序列进行二级、三级结构预测。
1.2.4 HuHXT基因引物设计与荧光定量PCR 根据获得的己糖转运蛋白基因序列设计出定量PCR引物(表 1),以火龙果Actin基因作为内参、不同火龙果样品cDNA为模板,按照荧光定量PCR试剂盒(瑞真生物科技有限公司)说明书进行HuHXT基因相对表达情况分析。每个样品设3次重复,10 μL反应体系中包含SYBR Green预混液5 μL、超纯水3 μL、Primer Mix 1 μL、cDNA 1 μL。反应条件为50 ℃ 2 min;95 ℃ 2 min;95 ℃ 15 s、56 ℃ 15 s、72 ℃ 30 s,40个循环。根据各样品的Ct值,利用2-ΔΔCt法计算HuHXT的相对表达量。
1.2.5 可溶性糖含量测定 准确称取火龙果果肉1 g,放入研钵后在微波炉中杀酶40 s,加入2 mL超纯水匀浆,再用2 mL超纯水清洗研钵2~3次,合并提取液后定容至10 mL,12 000 r/min离心15 min,取1 mL经C18柱过滤后待测。设4次取样,2次重复。使用美国Agilent 1100LC高效液相色谱仪,配有RID示差检测器,色谱柱为Coregel 87C(Transgenomic CHO-99-5860),流动相为过滤超纯水,流速为1 mL/min,柱温为80 ℃,进样量10 μL,所用标样为分析纯的蔗糖、葡萄糖和果糖。
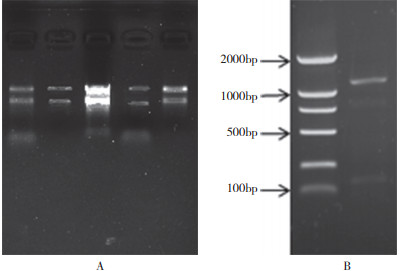
2 结果与分析 2.1 火龙果总RNA提取及HuHXT基因克隆本研究从火龙果果肉中提取的总RNA质量较高,电泳条带清晰,完整性较好(图 2A),可以用来合成第一链cDNA。以反转录得到的cDNA为模板扩增HuHXT基因全长序列,经1% 凝胶电泳检测其长度约为1 200 bp(图 2B)。
|
| 图 2 火龙果RNA(A)和扩增的HuHXT基因片段(B)电泳结果 Fig. 2 Gel electrophoresis of pitaya RNA (A) and amplified HuHXT gene fragment (B) |
2.2 HuHXT的生物信息学分析
2.2.1 基因序列比对分析 经测序发现HuHXT全长1 230 bp(图 3),其中腺嘌呤266个、占21.6%,胞嘧啶251个、占20.4%,鸟嘌呤324个、占26.3%,胸腺嘧啶389个、占31.6%。单链DNA分子量380.65 ku,双链DNA分子量758.26 ku。

|
| 图 3 HuHXT开放阅读框及其编码氨基酸 Fig. 3 HuHXT open reading frame and its encoded amino acids |
利用BioEdit软件对HuHXT氨基酸序列进行蛋白质理化性质分析。HuHXT开放阅读框编码410个氨基酸,其中强碱性氨基酸(K、R)22个,强酸性氨基酸(D、E)18个、疏水氨基酸(A、F、I、L、V、W)165个、不带电荷极性氨基酸(C、N、Q、S、T、Y)79个,分子量为36 441.08 u,等电点为8.86,分子式为C1672H2666N414O458S17,原子总量为5 227,蛋白不稳定系数为35.59,可见HuHXT蛋白为稳定性蛋白。
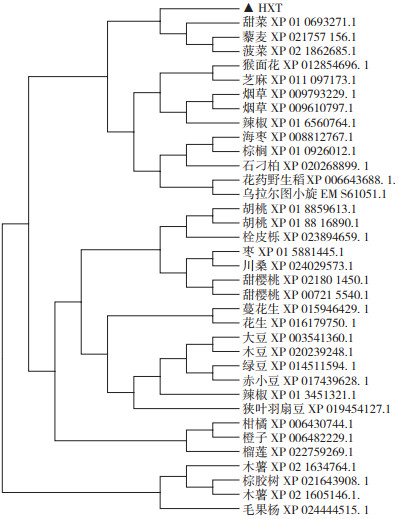
经NCBI同源性分析可知,火龙果HuHXT与甜菜、烟草等HXT同源性较高,用DNAMAN进行比对并构建进化树,结果(图 4)显示,火龙果HuHXT蛋白与甜菜、菠菜、藜麦的HXT蛋白归在一类。
|
| 图 4 HuHXT同源比对进化树 Fig. 4 HuHXT homology comparison evolutionary tree |
2.2.2 信号肽预测 信号肽是指新合成多肽链中用于指导蛋白质跨膜转移(定位)的N- 末端短肽链[18]。由图 5可知,HuHXT第1~34位之间有信号肽的剪切位点,并且表现为非分泌型蛋白。
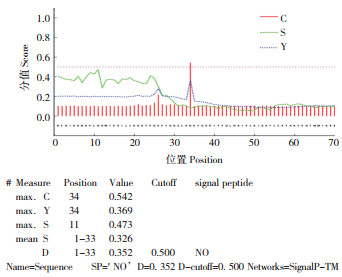
|
| 图 5 HuHXT信号肽预测 Fig. 5 Prediction of HuHXT signal peptide |
2.2.3 疏水性分析 由图 6可知,HuHXT氨基酸链的第109号亮氨酸(Leu)有最高分值(3.311),疏水性最强;第398号异亮氨酸(Ile)有最低分值(-1.778),亲水性最强。其平均疏水性为0.770,整体亲水性小于疏水性,表明HuHXT蛋白为疏水蛋白。
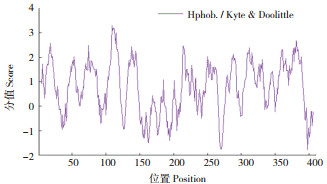
|
| 图 6 HuHXT疏水性分析 Fig. 6 Hydrophobicity analysis of HuHXT |
2.2.4 跨膜区分析 经亚细胞定位预测,结果(图 7)显示,HuHXT存在于生物膜上,包括细胞膜、质膜、高尔基体、内质网(膜)和内质网(管腔)中。通过跨膜区域分析发现,HuHXT明显位于跨膜区,其可能是细胞膜的组成或者膜上的受体[19]。该氨基酸序列长度为410,预测TMH数量为9个,TMH中AAs的Exp数为217.70234,前60个AAs的Exp数为26.16762,N-in的总概率为0.59011%。

|
| 图 7 HuHXT蛋白跨膜区分析 Fig. 7 Analysis of transmembrane region of HuHXT protein |
2.2.5 磷酸化位点分析 蛋白质磷酸化是调节和控制蛋白质活力和功能的最基本、最普遍和最重要的机制,是生物体内一种普通的调节方式[20]。由磷酸化位点的分析结果(图 8)可知,HuHXT有15个Thr、15个Tyr、32个Ser,可能成为蛋白激酶的结合位点,由蛋白质激酶催化的磷酸基转移到底物蛋白质氨基酸残基(Thr、Tyr、Ser)上,或者在信号作用下结合GTP。
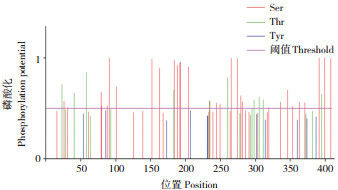
|
| 图 8 HuHXT磷酸化位点分析 Fig. 8 Phosphorylation site analysis of HuHXT |
2.2.6 HuHXT蛋白二级结构预测 由图 9可知,HuHXT序列编码蛋白的二级结构,主要以α–螺旋、不规则盘绕和延伸链构成大体蛋白结构,β–折叠散布于整个蛋白质中。该蛋白除了有Sugar_tr结构域外,还含有SP、xylE、2A0119、MFS、2A0115、synapt_SV2、2A0112、2A0109、2A0106、MFS_1等多个结合域,主要进行糖的运输,转运和结合蛋白、碳水化合物、有机醇和酸、阳离子以及携带铁的化合物,也可临时做D- 木糖转运蛋白XylE、突触小泡蛋白SV2,促进多种底物(包括离子、糖磷酸盐、药物、神经递质、核苷、氨基酸和肽)的细胞质或内膜转运。
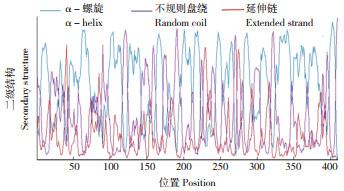
|
| 图 9 HuHXT蛋白二级结构预测 Fig. 9 Prediction of secondary structure of HuHXT protein |
2.2.7 HuHXT蛋白三级结构模拟 模拟HuHXT蛋白三级结构可得到图 10的两个模型,其中模型A为溶质载体家族2(促进葡萄糖转运蛋白)成员3,序列相似范围为15~408,覆盖率达到95%;模型B为H+同向转运蛋白,序列相似范围为2~397,覆盖率达到94%。
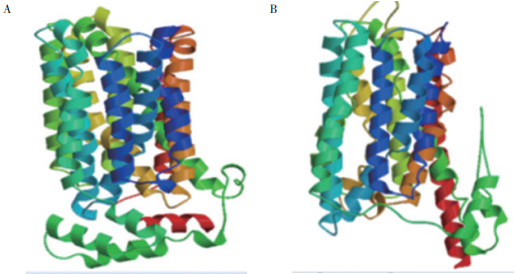
|
| 图 10 HuHXT蛋白三级结构模拟 Fig. 10 Prediction of tertiary structure of HuHXT protein |
2.3 HuHXT基因表达分析
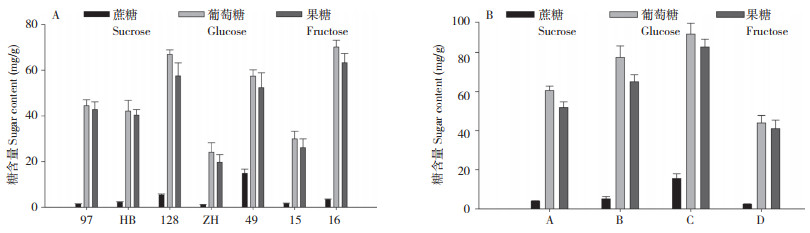
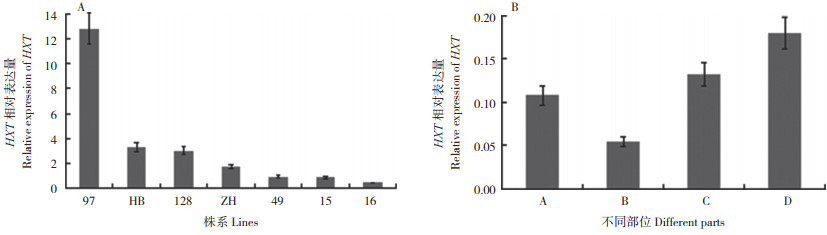
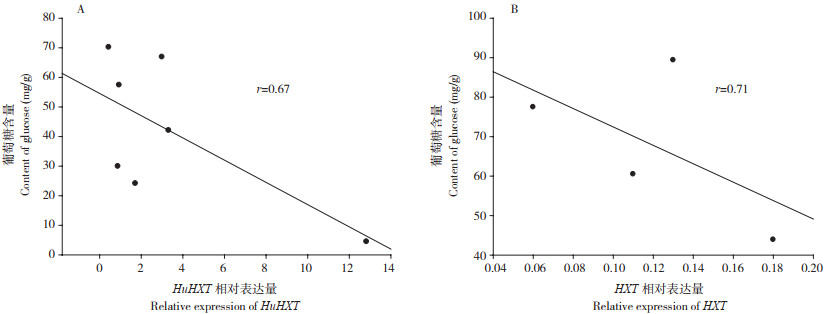
对火龙果7个株系和同一果实不同部位中的可溶性糖组分、含量及HuHXT基因表达量进行分析,结果显示,火龙果果实中的可溶性糖主要有蔗糖、葡萄糖和果糖3种,以葡萄糖和果糖为主,不同株系中可溶性糖含量不同,16号和128号株系较高,葡萄糖、果糖平均含量为70.20、63.30 mg/g和66.90、57.50 mg/g。ZH株系最低,葡萄糖、果糖平均含量为仅24.12、19.73 mg/g(图 11A);同一果实不同部位的糖含量也不同,其中靠近果皮部位最低、葡萄糖含量为43.87 mg/g,果心部位最高、葡萄糖含量可达89.36 mg/g(图 11B)。HuHXT基因在不同株系中表达量存在显著差异,其中97号株系的表达量最高,极显著高于其他6个株系,HB和128号株系的表达量差异不显著,49号、15号和16号株系的表达量相对较低(图 12A)。在同一果实不同部位中HuHXT表达量差异不显著,在靠近果皮部位表达量最高,近果顶和果蒂处表达量较低(图 12B)。由图 13可知,不同株系和部位火龙果果实中的葡萄糖含量与HuHXT水平存在负线性相关关系,即还原糖含量较高的株系或部位HuHXT表达量相对较低,具体机理还需进一步研究。
|
| 图 11 不同株系(A)和不同部位(B)火龙果果实的可溶性糖组分含量比较 Fig. 11 Comparison of soluble sugar contents in pitaya fruits of different lines (A) and different parts (B) |
|
| 图 12 不同株系(A)和不同部位(B)火龙果果实的HuHXT表达量比较 Fig. 12 Comparison of HuHXT expression in pitaya fruits of different lines (A) and different parts (B) |
|
| 图 13 不同株系(A)和不同部位(B)火龙果果实的葡萄糖含量与HuHXT表达量的相关分析 Fig. 13 Correlation analysis of glucose content and HuHXT expression in pitaya fruits of different lines (A) and different parts (B) |
3 讨论
本研究从火龙果中克隆得到1个编码己糖转运蛋白基因HuHXT,该基因长度为1 230 bp,开放阅读框编码410个氨基酸,二级结构以α- 螺旋和无规则卷曲为主。通过生物信息学分析可知,HuHXT为单糖转运蛋白家族中的成员,属于稳定的疏水性蛋白,位于生物膜上,其氨基酸序列与菠菜和甜菜HXT4的同源性均达到88% 以上。推测火龙果中HXT也是一个基因家族,HuHXT是其中一个与菠菜和甜菜HXT4功能相似的基因成员。
果实中糖组分及含量是影响果实品质的重要因素,魏晓钰等[15]将苹果己糖转运蛋白基因MdHT2.2克隆到番茄植株,发现MdHT2.2过量表达降低了转基因克隆番茄株系叶片中的葡萄糖含量。张清等[16]在甘蔗己糖转运蛋白超家族基因演化与表达分析研究中发现,甘蔗己糖转运蛋白HXT2、HXT8、HXT12、HXT13 在甘蔗材料苗期的叶子、成熟期的茎和叶中均高度表达,在甘蔗己糖装载和卸载过程中起着非常重要的作用,从而影响葡萄糖积累与代谢[16]。本研究通过对火龙果不同株系和不同部位中HuHXT的表达量与糖含量进行相关性分析发现,HuHXT基因表达水平与葡萄糖含量存在负线性相关关系,即葡萄糖含量越低的株系或部位,其HuHXT 表达量相对较高,尤其97号火龙果果实中HuHXT表达量是ZH和128号果实的4倍多,而葡萄糖含量较低;16号火龙果HuHXT相对表达量最少,葡萄糖含量却显著高于其他株系。可见,HuHXT在火龙果葡萄糖积累和代谢过程起着重要作用,推测火龙果HuHXT的生理功能是通过膜蛋白主动运输对葡萄糖进行重分配,在成熟果实中HuHXT 表达量越少,储藏的葡萄糖越多,果实品质与风味就越好。后续将对HuHXT基因具体如何参与葡萄糖积累和代谢的相关机制作进一步深入研究。
4 结论本研究通过PCR扩增从火龙果中克隆到1个HXT基因序列,命名为HuHXT,cDNA序列长1 230 bp,编码410个氨基酸。同源性比较表明HuHXT为Sugar-tr基因家族成员,HuHXT与甜菜、菠菜的HXT4序列同源性最高。HuHXT属于稳定蛋白,有32个Ser、15个Thr、15个Tyr,可能为蛋白激酶的结合位点,其疏水性较强,存在于生物膜上;二级结构以α- 螺旋和无规则卷曲为主。成熟期火龙果果实以积累葡萄糖和果糖为主,且不同株系及同一果实不同部位中可溶性糖含量及HuHXT表达量存在显著性差异,其中HuHXT表达量与葡萄糖含量呈负线性相关关系。调控HuHXT基因表达水平有望改善火龙果内在品质形成。
| [1] |
乔谦, 于泳, 王江勇, 陶吉寒. 火龙果研究进展及北方引种可行性分析[J]. 中国农学通报, 2020, 36(25): 53-59. QIAO Q, YU Y, WANG J Y, TAO J H. Hylocereus undulates: research progress and introduction feasibility in North China[J]. Chinese Agricultural Science Bulletin, 2020, 36(25): 53-59. |
| [2] |
禹玉华, 洪向平, 覃金转, 林杰泽, 徐杨玉. 火龙果优异株系广红龙1号的特征特性及栽培技术要点[J]. 热带农业科学, 2021, 41(6): 13-15. DOI:10.12008/j.issn.1009-2196.2021.06.003 YU Y H, HONG X P, QIN J Z, LIN J Z, XU Y Y. The characteristics and key cultural practices of desirablepitaya cultivar'Guanghonglong 1'[J]. Chinese Journal of Tropical Agriculture, 2021, 41(6): 13-15. DOI:10.12008/j.issn.1009-2196.2021.06.003 |
| [3] |
李靓, 朱涵彬, 袁晓晴, 岳晓禹. 火龙果营养成分及保健功能的研究[J]. 现代食品, 2020(10): 26-28. DOI:10.16736/j.cnki.cn41-1434/ts.2020.10.010 LI J, ZHU H B, YUAN X Q, YUE X Y. Study on nutritional composition and healthy function of pitaya fruit[J]. Modern Food, 2020(10): 26-28. DOI:10.16736/j.cnki.cn41-1434/ts.2020.10.010 |
| [4] |
闫臻, 齐钊, 徐敏, 熊睿, 程玉, 韦双双, 阮云泽, 汤华. 淹水胁迫对火龙果植株形态和生理特性的影响[J]. 广东农业科学, 2017, 44(12): 39-44. DOI:10.16768/j.issn.1004-874X.2017.12.007 YAN Z, QI Z, XU M, XIONG R, CH ENG Y, WEI S S, RUAN Y Z, TANG H. Effects of flooding stress on morphological and physiological characteristics of pitaya seedlings[J]. Guangdong Agricultural Sciences, 2017, 44(12): 39-44. DOI:10.16768/j.issn.1004-874X.2017.12.007 |
| [5] |
王壮, 王立娟, 蔡永强, 周俊良, 马玉华. 火龙果营养成分及功能性物质研究进展[J]. 中国南方果树, 2014, 43(5): 25-29. DOI:10.13938/j.issn.1007-1431.2014.05.018 WANG Z, WANG L J, CAI Y Q, ZHOU J L, MA Y H.. Research progress in nutritional components and functional substances of pitaya fruit[J]. South China Fruits, 2014, 43(5): 25-29. DOI:10.13938/j.issn.1007-1431.2014.05.018 |
| [6] |
LOWELL C A, TOMLINSON P T, KOCH K E. Sucrose-metabolizing enzymes in transport tissues and adjacent sink structures in developing citrus fruit[J]. Plant Physiology, 1989, 90(4): 1394-1402. DOI:10.1104/pp.90.4.1394 |
| [7] |
李文云, 彭志军, 王彬, 蔡永强. 火龙果不同品种(品系) 果肉糖、酸含量及组成分析[J]. 贵州农业科学, 2010, 38(11): 215-217. DOI:10.3969/j.issn.1001-3601.2010.11.067 LI W Y, PENG Z J, WANG B, CAI Y Q. Content and composition of soluble sugar and organic acid in flesh of different pitaya varieties[J]. Guizhou Agricultural Sciences, 2010, 38(11): 215-217. DOI:10.3969/j.issn.1001-3601.2010.11.067 |
| [8] |
张绿萍, 袁启凤, 谢璞, 王立娟. 成熟度对紫红龙火龙果贮藏性能及品质的影响[J]. 广东农业科学, 2015, 42(23): 117-121. DOI:10.16768/j.issn.1004-874X.2015.23.066 ZHANG L P, YUAN Q F, XIE P, WANG L J. Effects of harvest maturity on storage properties and quality of dragon fruit[J]. Guangdong Agricultural Sciences, 2015, 42(23): 117-121. DOI:10.16768/j.issn.1004-874X.2015.23.066 |
| [9] |
朱琳. 甘蔗中蔗糖代谢途径关键基因和糖转运蛋白的系统发育研究[D]. 长春: 吉林大学, 2013. ZHU L. The phylogenetic analysis of the key genes in sucrose metablism and the sugar transporter in saccharum[D]. Changchun: Jilin University, 2013. |
| [10] |
FIEUW S, WILLENBRINK J. Sucrose synthase and sucrosephosphate synthase in sugar beet plants (Beta vulgaris L. ssp. altissima)[J]. Journal of Plant Physiology, 1987, 131(1): 153-162. DOI:10.1016/S0176-1617(87)80276-6 |
| [11] |
SCHAFFER A A, ALONI B, FOGELMAN E. Sucrose metabolism and accumulation in developing fruit of Cucumis[J]. Phytochemistry, 1987, 26(7): 1883-1887. DOI:10.1016/s0031-9422(0)81721-5 |
| [12] |
王其海. 桃蔗糖转运蛋白家族基因的克隆与表达分析[D]. 郑州: 河南农业大学, 2015. WANG Q H. Cloning and expression analysis of sucrose transporters in peach〔(Prunus persica (L. ) Batsch〕[D]. Zhengzhou: Henan Agricultural University, 2015. |
| [13] |
KOMOR J K E, THOM M, MARETZKI A. Activity of sucrosephosphate synthase in sugar cane leaves[J]. Phytochemistry, 1987, 27(6): 1605-1608. DOI:10.1016/0031-9422(88)80411-4 |
| [14] |
DALI N, MICHAUD D, YELLE S. Evidence for the involvement of sucrose phosphate synthase in the pathway of sugar accumulation in sucrose-accumulating tomato fruits[J]. Plant Physiology, 1992, 99(2): 434-438. |
| [15] |
魏晓钰. 苹果中糖转运蛋白的鉴定及两个己糖转运蛋白功能的初步研究[D]. 陕西: 西北农林科技大学, 2015. WEI X Y. Identification of the sugar transporter gene families and studyon functions of two hexose sugar transpoters in malus domestica[D]. Shaanxi: Northwest A & F University, 2015. |
| [16] |
张清. 甘蔗糖转运蛋白超家族基因演化与表达分析[D]. 福州: 福建农林大学, 2016. ZHANG Q. The gene evolution and expression of sugar transporter superfamily in saccharum[D]. Fuzhou: Fujian Agriculture and Forestry University, 2016. |
| [17] |
赵爱奇, 刘嘉荣, 郝金凤, 哈斯阿古拉. 甜瓜β- 氨基己糖苷酶基因家族的全基因组分析[J]. 广东农业科学, 2014, 41(8): 185-188. DOI:10.16768/j.issn.1004-874X.2014.08.039 ZHAO A Q, LIU J R, HAO J F, AHASI. Genome-wide analysis of β-Hexosaminidase family genes in Cucumis melo[J]. Guangdong Agricultural Sciences, 2014, 41(8): 185-188. DOI:10.16768/j.issn.1004-874X.2014.08.039 |
| [18] |
任毅. 西瓜果实含糖量QTL定位及糖转运蛋白基因功能初析[D]. 北京: 中国农业科学院, 2016. REN Y. QTL Mapping of sugar content and functional analysis of sugar transporter genes in watermelon fruits[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. |
| [19] |
马飞跃, 帅希祥, 张明, 杜丽清, 李娅, 汤昕明. 火龙果采后贮藏保鲜研究进展[J]. 保鲜与加工, 2021, 21(11): 136-143. DOI:10.3969/j.issn.1009-6221.2021.11.020 MA F Y, SHUA I X X, ZH ANG M, DU L Q, LI Y, TANG X M. Research progress on postharvest preservation technology of pitaya[J]. Storage and Process, 2021, 21(11): 136-143. DOI:10.3969/j.issn.1009-6221.2021.11.020 |
| [20] |
陈忠良, 秦翠鲜, 桂意云, 廖芬, 汪淼, 王震, 龙明华, 黄东亮. 生长前期甘蔗叶片糖分含量及蔗糖磷酸合成酶基因表达分析[J]. 分子植物育种, 2020, 18(13): 4229-4235. DOI:10.13271/j.mpb.018.004229 CHEN Z L, QIN C X, GUI Y Y, LIAO F, WANG M, WANG Z, LONG M H, HUAGN D L. Characterization of sugar content and SPS expression parttern in leaves at the early growth stage of sugarcane[J]. Molecular Plant Breeding, 2020, 18(13): 4229-4235. DOI:10.13271/j.mpb.018.004229 |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49