文章信息
基金项目
- 广东省重点领域研发计划项目(2018B020206001);广东省科技计划项目(2017A010405039)
作者简介
- 阮明君(1996 -),女,在读硕士生,研究方向为有机废弃物处理,E-mail: 395850820@qq.com.
通讯作者
- 胡文锋(1964 -),男,博士,副教授,研究方向为应用微生物、有机废弃物处理,E-mail: johnwfhu@qq.com.
文章历史
- 收稿日期:2021-11-30
2. 生物源生物技术(深圳)股份有限公司,广东 深圳 518000;
3. 广东省农业科学院动物科学研究所,广东 广州 510640
2. Bio-source Biotechnology (Shenzhen) Co., Ltd., Shenzhen 518000, China;
3. Institute of Animal Sciences, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
【研究意义】当前,城市垃圾的年产生量极速增长,预计到2025年,城市生活垃圾将超过5.1亿t。城市生活垃圾在填埋过程中,由于微生物发酵、降解等作用,垃圾中的污染物与降雨等混合后会形成垃圾渗滤液。垃圾渗滤液具有氨氮含量高、有机物成分众多、重金属含量高、水质变化复杂等特点[1],渗滤液中含有的大量氮素会严重污染地表水或地下水,造成水体富营养化,此外,如果垃圾渗滤液不经过有效处理就直接排放,不仅会构成环境问题,污染物还会进入食物链,威胁人类健康。因此,垃圾渗滤液需要进一步处置。目前,垃圾渗滤液处理方法包括物化法、生化法以及组合工艺法等。物化法脱氮一般只能除去氨氮;生物法脱氮能通过硝化和反硝化作用,将有机氮、氨氮转化为气态氮物如N2,从而将氮素从水体中脱除,具有能耗低、安全稳定、脱氮完全等特点[2]。因此,筛选能高效脱氮的微生物,具有实际的应用意义。【前人研究进展】传统的生物脱氮技术分为硝化过程和反硝化过程,硝化过程是由高好氧的自养硝化菌将氨氮氧化为亚硝态氮和硝态氮;反硝化过程为厌氧,由反硝化细菌将亚硝态氮和硝态氮反硝化为气态氮。由于两种微生物生长的条件不同,硝化和反硝化无法在同一条件完成,且自养硝化细菌的生长会受到高浓度氨氮和亚硝态氮的抑制,从而限制了自养硝化细菌更广泛的应用[3]。异养硝化微生物具有繁殖快、耐受高溶氧、环境适应力强以及能同步去除有机物等优点[4],在生物脱氮中具有良好的应用前景。近年来,具有异养硝化作用功能的细菌被作为生物脱氮系统中潜在的微生物群,得到广泛的关注和研究。但是国内外对异养硝化菌的研究起步较晚,在实际的生物脱氮中,菌株受环境因素影响较大,从而限制其应用。报道较多的异养硝化微生物包括不动杆菌属(Acinetobacter sp.)[5]、芽孢杆菌属(Bacillus sp.)[6]、假单胞菌属(Pseudomonaceae sp.)[7]、无色杆菌属(Achromobacter sp.)[8]等。【本研究切入点】目前针对异养硝化菌的研究多集中于菌株的脱氮性能研究,对其处理高浓度垃圾渗滤液废水的实际应用研究较少,但经过生物法处理后的垃圾渗滤液中的氨氮含量能达到排放标准,处理后的污泥含有大量的脱氮微生物,因此,本研究尝试从活性污泥样品中富集、分离异养硝化细菌,并对其进行评价,旨在为异养硝化微生物处理垃圾渗滤液废水的实际应用及理论研究提供支撑。【拟解决的关键问题】开展菌株形态学观察和分子学鉴定,并分析不同因素对菌株降解氨氮效果的影响。将该菌株用于垃圾渗滤液废水中,探究其在渗滤液中的异养硝化作用。
1 材料与方法 1.1 试验材料细菌分离所采集的样品来自某污水处理厂的活性污泥,垃圾渗滤液采自广州市白云区兴丰垃圾填埋场,储存于白色聚乙烯瓶中。垃圾渗滤液呈淡茶色、深褐色,有极重的垃圾腐败臭味。通过测定,垃圾渗滤液废水水质指标为:pH7.8,COD 5 042.51 mg/L,TN 4 697.26 mg/L,NH4+-N 3 456.17 mg/L。
参考李珍阳等[9]的方法配制以下培养基:富集培养基:(NH4)2SO4 0.5 g/L, CH3COONa 5 g/L, 维氏盐溶液50 mL,调节pH至7.5~8.0;分离纯化培养基:(NH4)2SO4 0.5 g/L, CH3COONa 5 g/L, 维氏盐溶液50 mL,琼脂粉20 g/L,调节pH至7.5;筛选培养基:(NH4)2SO4 0.5 g/L,CH3COONa 5 g/L,维氏盐溶液50 mL,调节pH至7.5;维氏盐溶液:K2HPO4 5 g/L, MgSO4·7H2O 2.5 g/L,NaCl 2.5 g/L,FeSO4·7H2O 0.05 g/L,MnSO4·4H2O 0.05 g/L。培养基配制好后,于121 ℃高压灭菌20 min。
1.2 试验方法1.2.1 异养硝化细菌的分离与筛选 称取污泥样品2.0 g,加入装有150 mL的异养硝化富集培养基中,震荡均匀。置于30 ℃、150 r/min条件下振荡培养24 h后,取细菌富集液2 mL,转接于新鲜的异养硝化富集培养基中,继续培养,按上述步骤重复4次,以提高富集液中细菌的浓度。
吸取细菌富集液1 mL,稀释至10-1~10-9等梯度浓度,选择10-4、10-5、10-6稀释浓度,取该浓度梯度的菌液,于异养硝化培养基固体平板涂布,于30 ℃恒温培养箱倒置培养。待平板长出菌落,观察菌落形态,用接种环挑出所有不同形态的单菌落,划线纯化2~3次,直至获得单一形态的纯菌株,对纯化出的单菌落进行编号。
将分离出的纯菌株接种至20 mL异养硝化液体培养基中,于30 ℃、150 r/min条件下振荡培养,24 h后取对照组菌液、样品组菌液,连续5 d检测其氨氮浓度变化,选取有较好降解效果的菌株进行后续实验。
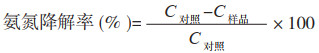
|
1.2.2 异养硝化细菌的鉴定 菌株形态特征观察及生理生化鉴定:观察平板上生长的单菌落形状、大小、粘度等特征;利用光学显微镜对细胞形态、大小等特征进行观察并记录;对菌株进行革兰氏染色,在光学显微镜下观察。
菌株分子学鉴定:把纯化后的菌株接种到筛选培养基中培养24 h后,送至苏州金唯智生物科技有限公司测序,将测序结果在NCBI上进行序列比对,用MEGA X.进行同源性分析,并构建菌株系统发育树。
1.2.3 菌株脱氮性能影响因素研究 实验选取温度、转速、接种量、初始pH、碳源种类5个条件,研究菌株氨、氮降解能力。温度设置为15、20、25、30、35 ℃,转速设置为0、50、100、150、200 r/min,接种量设置为2%、4%、6%、8%、10%,初始pH设置为5.5、6.5、7.5、8.5、9.5,碳源种类包括乙酸钠、柠檬酸钠、葡萄糖、蔗糖、丁二酸钠。根据不同的因素水平设置单一变量,将菌株按不同接种量接种于异养硝化培养基中,摇床振荡培养,每隔24 h取样,以未接菌作为空白对照,检测氨氮浓度变化,并对结果进行记录整理。
1.2.4 菌株在垃圾渗滤液中的脱氮性能研究 在灭菌后垃圾渗滤液中接入菌株,按照6%接种量,于30 ℃、pH7.5、150 r/min条件下进行恒温摇床培养,每隔12 h取样,检测NH4+-N、NO2--N、NO3--N的浓度,并对结果进行记录整理。以灭菌后垃圾渗滤液、不接种菌株作为对照。
1.3 测定指标及方法NH4+-N的测定采用纳氏试剂检测法,参考国家环境保护标准《水质氨氮的测定采用纳氏试剂分光光度法》(HJ 535-2009);NO2--N的测定采用盐酸萘乙二胺检测法,参考国家标准《水质亚硝酸盐氮的测定—分光光度法》(GB 7493- 87);NO3--N的测定采用紫外分光光度法,参考环境保护行业标准《水质硝酸盐氮的测定—紫外分光光度计法》(HJ/T 346-2007);OD600的测定采用光密度法。
试验数据采用SPSS23.0软件的One-way ANVOA程序进行分析,使用Duncan进行方差分析,使用Origin 2018绘制数据图。
2 结果与分析 2.1 菌株筛选结果经过富集培养从污泥中初步分离出5株氨氮降解率高的菌株。将其接种于液体培养基后,以未接种菌株的培养基作为对照,选择氨氮降解率最高、生长能力旺盛的1株菌纯化培养,编号为XJ-1。
2.2 菌株形态、生理生化特征菌株XJ-1在培养基上长势良好,菌落形态特征为乳白色不透明、表面光滑、湿润、边缘整齐(图 1);细胞形态观察及染色结果显示为革兰氏阴性短杆菌(图 2)。

|
| 图 1 菌株XJ-1的菌落形态 Fig. 1 Colony morphology of strain XJ-1 |

|
| 图 2 菌株XJ-1的革兰氏染色结果(× 1000) Fig. 2 Gram staining results of strain XJ-1(× 1000) |
菌株XJ-1的生理生化特性:葡萄糖利用、蔗糖利用、葡萄糖酸盐、丙二酸盐、甘露糖、氧化酶反应、VP、MR、明胶水解试验均为阴性,柠檬酸盐试验为阳性。
2.3 16S rDNA序列及系统发育分析采用PCR扩增技术获取目的基因,通过琼脂糖凝胶电泳对目的基因进行检测,凝胶电泳结果见图 3。XJ-1的核酸序列长度为1 412 bp。

|
| 图 3 菌株XJ-1的凝胶电泳结果 Fig. 3 Gel electrophoresis results of strain XJ-1 |
通过MEGA X构建系统进化树,XJ-1的系统进化树如图 4所示。XJ-1与不动杆菌属(Acinetobacter sp.)中的微生物亲缘关系接近。

|
| 图 4 菌株XJ-1的系统发育树 Fig. 4 Phylogenetic tree of strain XJ-1 |
2.4 不同因素对菌株脱氮效果的影响
2.4.1 温度对脱氮效果的影响 温度是影响脱氮过程的关键因素之一,硝化细菌对温度十分敏感。一般情况下,当环境温度低于10 ℃时,硝化作用会受到严重抑制[10]。由图 5可知,菌株XJ-1能在15~35 ℃条件下生长,并进行硝化作用。当温度为15 ℃时,菌株生长缓慢,氨氮降解率为37.83%;温度升至30 ℃,氨氮降解率最大,为69.64%;随着温度继续增加,菌株在35 ℃下培养后,氨氮降解率降低为58.17%。Zhao等[11]从养猪废水中分离到1株不动杆菌TAC-1,菌株在低温条件下具有较高的氨氮代谢能力,在5 ℃条件下,TAC-1对NH4+-N、NO3--N和NO2--N的降解率分别为94.6%、93.3%和42.4%。试验结果显示,菌株XJ-1在低温条件下也能生长,推测可能是在长期富氮的水体中,往往同时含有NH4+和NO3-,并且低温时水体中的溶解氧水平较高,会存在能够同时进行硝化和反硝化过程的微生物,从而提高水体中NH4+-N或NO3--N的去除效率[12]。因此,菌株XJ-1对低温的耐受力强,能够适应温度波动较大情况下的渗滤液废水处理情况。
|
| 图 5 不同温度对菌株XJ-1氨氮降解率的影响 Fig. 5 Effe cts of different temperatures on ammonia nitrogen degradation rate of strain XJ-1 |
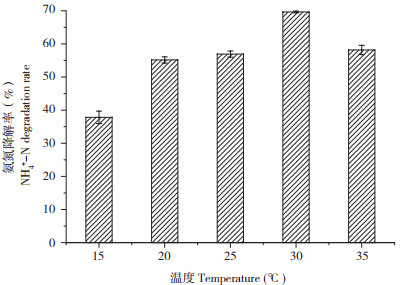
2.4.2 转速对异养硝化特性的影响 Qin等[13]指出,进行振荡培养时,培养基内的溶解氧在达到饱和前,与摇床的转速呈正相关,随着振荡速度的增加,培养液中的溶解氧水平逐渐增加。因此,试验可以设置不同的转速值,以改变培养基中的溶解氧含量。溶解氧是氨氧化过程中的重要因素,是好氧微生物进行硝化过程的重要电子受体,对微生物生长和氨氧化效率具有重要的影响,溶氧量越大,微生物对氨氮的利用率越高[14]。试验结果显示,在0~150 r/min范围内,随着转速提高,溶解氧水平增加,氨氮降解率有所提高,当转速为150 r/min时,氨氮降解率达到67.26%。但当转速为200 r/min时,氨氮降解率有所下降,但差异不明显(图 6)。
|
| 图 6 不同转速对菌株XJ-1氨氮降解率的影响 Fig. 6 Effects of different shaking speeds on ammonia nitrogen degradation rate of strain XJ-1 |
2.4.3 接种量对脱氮效果的影响 接种量的大小会影响到微生物生长速度。接种量过低,菌株的生长适应期会延长,培养时间会增加,影响脱氮效果;接种量适当增加,可以提高硝化效率;随着接种量继续增大, 培养基的营养物质无法满足菌株的生长需求,限制了菌体的继续生长,且会使已有的菌株发生自溶,导致微生物活性降低[15]。试验选择5个梯度浓度的接种量,由图 7可知,当接种量为6%时,菌株XJ-1的氨氮降解效果最好,达到68.93%,但各接种量处理间的氨氮降解率差异不明显。当菌体细胞生长进入稳定期,氨氮降解率均较高,表明氨氮的降解不仅是由于细胞生长所引起,其细胞代谢也可能起到重要作用。吴建江等[16]对菌株XS76进行培养,结果表明2%~10%接种量下的氨氮降解率无较大差异,且氨氮残留量和菌体生长量接近,培养基中的pH值均有升高的趋势。因此,试验结果与前人研究相似,同时考虑到接种量升高会增加成本,故选取6%作为后续实验接种量。

|
| 图 7 不同接种量对菌株XJ-1氨氮降解率的影响 Fig. 7 Effects of different inoculation amounts on ammonia nitrogen degradation rate of strain XJ-1 |
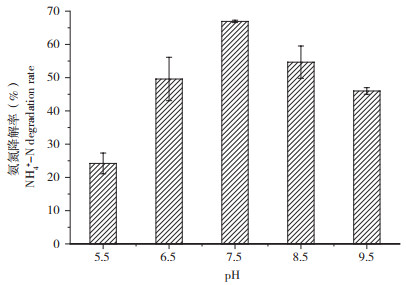
2.4.4 pH对异养硝化特性的影响 pH升高或降低,微生物的细胞膜电位会发生改变,酶的活性也发生改变,影响微生物生长[17]。因此,选择合适的初始pH,对菌株硝化能力具有重要意义。由图 8可知,当pH为5.5时,氨氮降解率为24.21%,随着pH升高至7.5,氨氮降解率为66.92%;当pH升高至9.5,微生物活性受到抑制,氨氮降解率降为45.99%。Zhang等[18]提出,生物脱氮系统对pH较为敏感。一般情况下,pH与硝化强度高度相关,低pH导致异养硝化速率降低,弱碱性条件促进硝化作用,低pH条件抑制异养硝化菌的活性(ANB);同时,氨单加氧酶(AMO)是硝化作用的关键酶之一,pH值变化也会影响培养基中游离氨和AMO活性[19]。本研究分离的XJ-1菌株在弱酸、中性、弱碱条件下均能生长,且在弱碱条件生长性能更好,与前人研究结果一致。
|
| 图 8 不同pH对菌株XJ-1氨氮降解率的影响 Fig. 8 Effects of different pH on ammonia nitrogen degradation rate of strain XJ-1 |
2.4.5 碳源种类对异养硝化特性的影响 碳源为微生物生命活动提供能量的同时,也能参与其各种代谢过程,因此,探究最适合微生物降解氨氮的碳源有助于菌株XJ-1处理废水。葡萄糖、蔗糖、乙酸、柠檬酸和琥珀酸都是培养异养硝化菌常用的碳源,但不同微生物对碳源的利用存在明显差异,同一菌株的硝化能力随碳源的不同也会有差异,当碳源类型为丙酮酸、柠檬酸或醋酸时,培养后pH会升高;当蔗糖和葡萄糖作为碳源时,培养后pH会降低[20]。试验结果(图 9)表明,菌株XJ-1能在以乙酸钠、柠檬酸钠和丁二酸钠为碳源的培养基中生长,对蔗糖的利用程度非常低,几乎不能在以葡萄糖为碳源的培养基生长;菌株以乙酸钠为碳源的培养基中,菌株XJ-1的降解率为69.56%,菌株XJ-1利用有机酸盐明显优于葡萄糖和蔗糖等常用糖类,推测存在以下原因:当使用糖类作为碳源时,培养后pH会降低,不利于异养硝化菌生长;异养硝化菌属于化能异养微生物,三羧酸循环是此类微生物生物氧化的重要途径之一,乙酸钠能被微生物较好地利用,主要是因为有机酸盐相比于糖类分子量小,结构简单,更利于异养硝化细菌的直接利用吸收,这与菌株HY13[21]、Y1[22]、TN-10[23]对有机酸盐的利用率高于糖类的结论一致。因此,在实际应用中,应选择能被微生物利用的合适碳源。

|
| 图 9 不同碳源对菌株XJ-1氨氮降解率的影响 Fig. 9 Effects of different carbon source types on ammonia nitrogen degradation rate of strain XJ-1 |
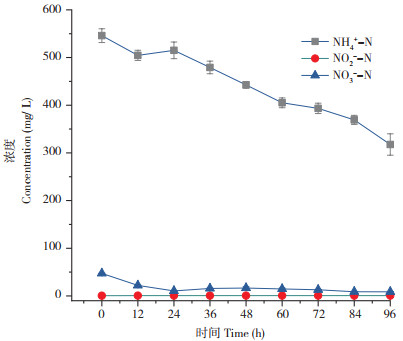
2.4.6 菌株在渗滤液中的异养硝化作用 将菌株XJ-1接种到灭菌后的垃圾渗滤液废水中,经培养96 h后,NH4+-N、NO2--N、NO3--N浓度随时间的变化如图 10所示。由图 10可知,NH4+-N浓度从初始的545.91 mg/L降至317.58 mg/L,降解率达到62. 82%,垃圾渗滤液废水中,有机物成分复杂,不同的碳源种类为菌体的生长提供了能量来源,提高了细菌的硝化作用和脱氮效率,菌株XJ-1对于高浓度氨氮废水的处理具有良好的效果。在培养结束后,检测渗滤液废水在整个反应过程中NO2--N、NO3--N的浓度变化,结果未见明显积累,推测可能是由于菌株XJ-1中存在的氨单加氧酶(AMO)将氨氮转化为羟胺或菌体的胞内氮[24];此外,也有可能是菌株XJ-1消耗了生成的NO2--N,NO3--N参加了反硝化反应。以上结果能说明菌株XJ-1不同于传统硝化细菌的硝化反应,该菌株不仅具有异养硝化能力,还有可能存在反硝化能力。
|
| 图 10 菌株XJ-1在垃圾渗滤液中的异养硝化特性 Fig. 10 Heterotrophic nitrification characteristics of strain XJ-1 in landfill leachate |
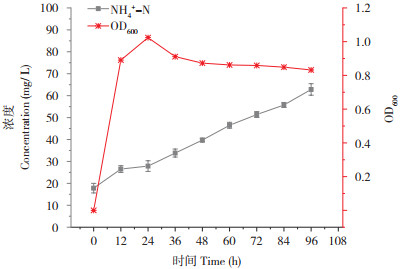
由图 11可知,培养6~18 h内,菌株处于对数生长期,营养物质充足,生长迅速。培养24 h,菌株XJ-1的OD600最大浓度值为1.026,培养24 h后开始有较为明显的下降趋势,此时菌数量减少,培养36~96 h内,菌株处于稳定期,OD600变化不明显。菌株XJ-1的生长伴着氨氮的降解,培养96 h后,氨氮降解率达到62.82%。
|
| 图 11 菌株XJ-1的生长及在垃圾渗滤液中的氨氮降解率 Fig. 11 Growth of strain XJ-1 and ammonia nitrogen degradation rate in landfill leachate |
3 讨论
由于垃圾渗滤液废水中高浓度的氨氮会严重影响微生物生长,甚至致其失活,导致垃圾渗滤液难以处理。本试验发现,菌株XJ-1接种于高浓度渗滤液废水,经过96 h培养后,与未接种菌株的废水对比,菌株XJ-1对渗滤液废水的脱氮效率为62.82%。与Tai等[25]的农杆菌属异养硝化菌BT1试验效果相比,本试验菌株氨氮降解率相对较低,推测高浓度氨氮对菌株的生长有一定的抑制作用。因此,后续研究应加强对菌株在不同因素的条件优化,如碳氮比、盐度、无机离子等条件的优化,以进一步提高异养硝化能力和在高浓度废水中的应用价值。
(1)碳氮比:碳源和氮源是微生物生长的重要因素,C/N直接影响着异养硝化菌的生长与硝化效率[26]。在传统硝化过程中,自养细菌容易被抑制,不适合处理高氨氮和有机物浓度高的废水,因此,常规硝化一般在降低C/N或稀释后进行。提高有机碳浓度将显著提高异养硝化菌的处理效率,大多数研究表明,C/N越高,对氨的去除越有利[27],但超过一定的C/N范围,C/N的进一步增加并不会对硝化性能产生影响[28]。
(2)盐度:在高盐度的垃圾渗滤液废水中,由于渗透压的急剧增加、微生物代谢的变化和酶活性受到抑制,微生物的处理效率很低[29]。当含盐量超过2%时,硝化菌的生长受到抑制[30],这是由于盐减少了培养基和细胞之间化合物的运输,改变了微生物的代谢,导致脱水和细胞裂解,直接干扰微生物的生长和氨氧化的速率[31]。由于垃圾渗滤液中来源广泛,不止是生活污水和工业废水,含盐度高,组成成分十分复杂。因此,选择合适的盐度,对于异养硝化微生物的筛选及处理含盐废水十分重要。
(3)无机盐离子:无机离子能参与调节细胞内外渗透压、pH或氧化还原电位,可以作为硝化作用的辅酶或激活酶,对微生物的生长代谢至关重要[32]。研究指出,Fe2+、Fe3+、Ca2+、Zn2+、Mg2+、Mn2+等金属可以提高异养硝化菌对NH4+-N、TN和TOC的去除率,Mg2+能增强菌株的同化作用[33]。Li等[34]指出,Mg2+、Zn2+和Mn2+可以增强AMO酶的活性,催化NH4+转化为NH2OH,提高脱氮效率。垃圾渗滤液废水中含有较高浓度的无机离子,但其对异养硝化菌株脱氮的影响少有报道,这限制了异养硝化菌株的进一步应用。
目前,多数已报道的文献注重于菌株脱氮性能的鉴定,对菌株氨氧化功能基因的研究鲜有报道。Fang等[35]从表层沉积物中分离到具有异养硝化和好氧反硝化作用的酵母株K1,检测到氨单加氧酶编码活性位点A的功能基因,亚硝酸盐还原酶活性位点K的基因;Ren等[36]分离出1株具有异养硝化和好氧反硝化能力的新菌株HND19,从该菌株中成功扩增出参与脱氮过程的功能基因。因此,后续研究还可对菌株XJ-1参与脱氮过程的重要基因进行扩增,探究XJ-1在硝化过程中的NH2OH转化规律,以进一步证明XJ-1的异养硝化特性、好氧反硝化功能。
4 结论从活性污泥中分离出1株能降解氨氮的异养硝化菌,命名为XJ-1,经形态分析、生理生化鉴定、75 16S rDNA基因序列比对和系统发育树构建,鉴定该菌株为不动杆菌属(Acinetobacter sp.)。经单因素优化后,当接种量为6%、pH为7.5、温度为30 ℃、摇床转速为150 r/min时,氨氮降解率较高;将该菌株用于垃圾渗滤液废水中,对其在渗滤液中的异养硝化作用进行评价,灭菌后初始氨氮浓度为545.91 mg/L,经过96 h培养,氨氮浓度降至317.58 mg/L,氨氮降解率达到62.82%,NO2--N、NO3--N未见明显积累,证明该菌株具有一定的硝化能力。
| [1] |
袁维芳, 王浩, 汤克敏, 陈娟娟. 垃圾渗滤液处理技术及工程化发展方向[J]. 环境保护科学, 2020, 46(1): 76-83. DOI:10.16803/j.cnki.issn.1004-6216.2020.01.014 YUAN W F, WANG H, TANG K M, CHEN J J. Landfill leachate treatment techniques and engineering development direction: A review[J]. Environmental Protection Science, 2020, 46(1): 76-83. DOI:10.16803/j.cnki.issn.1004-6216.2020.01.014 |
| [2] |
YAO S, NI J, MA T, LI C. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium, Acinetobacter sp. HA2[J]. Bioresource Technology, 2013, 139: 80-86. DOI:10.1099/mic.0.000047 |
| [3] |
MOBARRY B K, WAGNER M, URBAIN V, RITTMANN B E, STAHL D A. Phylogenetic probes for analyzing abundance and spatial organization of nitrifying bacteria[J]. Applied and environmental microbiology, 1996, 62(6). DOI:10.1128/AEM.62.6.2156-2162.1996 |
| [4] |
葛启隆. 波茨坦短芽孢杆菌异养硝化性能与关键酶活性研究[J]. 太原学院学报(自然科学版), 2017, 35(2): 31-35. DOI:10.14152/j.cnki.2096-191X.2017.02.007 GE Q L. Research on Heterotrophic nitrifi cation of brevibacillus and its key enzyme activitie[J]. Journal of Taiyuan University (Natural Science Edition), 2017, 35(2): 31-35. DOI:10.14152/j.cnki.2096-191X.2017.02.007 |
| [5] |
辛玉峰, 曲晓华, 袁梦冬, 荆延德. 一株异养硝化-反硝化不动杆菌的分离鉴定及脱氮活性[J]. 微生物学报, 2011, 51(12): 1646-1654. DOI:10.13343/j.cnki.wsxb.2011.12.007.wsxb.2011.12.007 XIN Y F, QU X H, YUA M D, JING Y D. I s ol at ion a nd identification of a heterotrophic nitrifying and aerobic denitrifying Acinetobacter sp.YF14 and its denitrification activity[J]. Acta Microbiologica Sinica, 2011, 51(12): 1646-1654. DOI:10.13343/j.cnki.wsxb.2011.12.007.wsxb.2011.12.007 |
| [6] |
ROUT P R, BHUNIA P, DASH R R. Simultaneous removal of nitrogen and phosphorous from domestic wastewater using Bacillus cereus GS-5 strain exhibiting heterotrophic nitrification, aerobic denitrification and denitrifying phosphorous removal[J]. Bioresource Technology, 2017, 244(1): 484-495. DOI:10.1016/j.biortech.2017.07.186 |
| [7] |
刘志培, 刘双江. 硝化作用微生物的分子生物学研究进展[J]. 应用与环境生物学报, 2004, 4(4): 521-525. DOI:10.3321/j.issn:1006-687X.2004.04.028 LIU Z P, LIU S J. Advances in the molecular biology of nitrifying microorganisms[J]. Chinese Journal of Applied and Environmental, 2004, 4(4): 521-525. DOI:10.3321/j.issn:1006-687X.2004.04.028 |
| [8] |
VANDAMME P A, PEETERS C, INGANAS E, CNOCKAERT M, HOUF K, SPILKER T, MOORE ER B, LIPUMA J J. Taxonomic dissection of Achromobacter denitrificans Coenye et al. 2003 and proposal of Achromobacter agilis sp nov., nom. rev., Achromobacter pestifer sp nov., nom. rev., Achromobacter kerstersii sp nov and Achromobacter deleyi sp nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(9): 3708-3717. DOI:10.1099/ijsem.0.001254 |
| [9] |
李珍阳, 姜润, 刘琳, 李思琦, 王晓慧. 低温异养硝化菌的筛选、鉴定及降解特性研究[J]. 生物技术通报, 2021, 37(10): 45-56. DOI:10.13560/j.cnki.biotech.bull.1985.2020-1315 LI Z Y, JIANG R, LIU L, LI S Q, WANG X H. Screening of lowtemperature heterotrophic nitrifying bacteria and their physiological and biochemical characteristics[J]. Biotechnology Bulletin, 2021, 37(10): 45-56. DOI:10.13560/j.cnki.biotech.bull.1985.2020-1315 |
| [10] |
RODRIGUEZ-CABALLERO A, HALLIN S, PAHLSON C, ODLARE M, DAHLQUIST E. Ammonia oxidizing bacterial community composition and process performance in wastewater treatment plants under low temperature conditions[J]. Water Science and Technology, 2012, 65(2): 197-204. DOI:10.2166/wst.2012.643 |
| [11] |
ZHAO T, CHEN P, ZHANG L, ZHANG L, GAO Y, AI S, LIU H, LIU X. Heterotrophic nitrification and aerobic denitrification by a novel Acinetobacter sp. TAC-1 at low temperature and high ammonia nitrogen[J]. Bioresource Technology, 2021, 339: 125620. DOI:10.1016/J.BIORTECH.2021.125620 |
| [12] |
李明堂, 王玉军, 赵淑杰, 王章霞, 赵兰坡. 一株约氏不动杆菌对氨氮的低温去除特性研究[J]. 农业环境科学学报, 2013, 32(10): 2055-2060. DOI:10.11654/jaes.2013.10.022 LI M T, WANG Y J, ZHAO S J, WANG Z X, ZHAO L P. Characteristics of NH4+-N removal by Acinetobacter johnsonii at low temperature[J]. Journal of Agro-Environment Science, 2013, 32(10): 2055-2060. DOI:10.11654/jaes.2013.10.022 |
| [13] |
QIN W, LI W, GONG X, HUANG X, FAN W, ZHANG D, YAO P, WANG X, SONG Y. Seasonal-related effects on ammonium removal in activated carbon filter biologically enhanced by heterotrophic nitrifying bacteria for drinking water treatment[J]. Environmental Science and Pollution Research, 2017, 24(24): 19569-19582. DOI:10.1007/s11356-017-9522-3 |
| [14] |
ZHOU Q, TAKENAKA S, MURAKAMI S, SEESURIYACHAN P, KUNTIYA A, AOKI K. Screening and characterization of bacteria that can utilize ammonium and nitrate ions simultaneously under controlled cultural conditions[J]. Journal of Bioscience and Bioengineering, 2007, 103(2): 185-191. DOI:10.1263/jbb.103.185 |
| [15] |
芮传芳, 吴涓, 李玉成. 异养硝化细菌的筛选、鉴定及其氨氮转化特性的研究[J]. 生物学杂志, 2010, 29(1): 37-41. DOI:10.3969/j.issn.2095-1736.2012.01.037 RUI C F, WU J, LI Y C. Screening and identification of a heterotrophic nitrifying bacterial strain and its ammonia transformation characteristics[J]. Journal of Biology, 2010, 29(1): 37-41. DOI:10.3969/j.issn.2095-1736.2012.01.037 |
| [16] |
吴建江, 王兆阳, 许培雅. 一株高效异养硝化菌的分离、鉴定及其氨氮去除特性[J]. 中国环境科学, 2013, 33(7): 1309-1315. DOI:10.3969/j.issn.1000-6923.2013.07.019 WU J J, WANG Z Y, XU P Y. Isolation and identification of an efficiently heterotrophic nitrifier, and its removal characterization of a mmonia nit rogen[J]. China Environmental S cience, 2013, 33(7): 1309-1315. DOI:10.3969/j.issn.1000-6923.2013.07.019 |
| [17] |
王洁, 蓝江林, 刘波. 一株异养硝化细菌的分离鉴定和脱氮特性研究[J]. 农业环境科学学报, 2013, 32(4): 805-810. DOI:10.11654/jaes.2013.04.022 WANG J, LAN J L, LIU B. Isolation and denitrification characteristics of a heterotrophic nitrification bacterium[J]. Journal of AgroEnvironment Science, 2013, 32(4): 805-810. DOI:10.11654/jaes.2013.04.022 |
| [18] |
ZHANG M, LI A, YAO Q, WU Q, ZHU H. Nitrogen removal characteristics of a versatile heterotrophic nitrifying-aerobic denitrifying bacterium, Pseudomonas bauzanensis DN13-1, isolated from deep-sea sediment[J]. Bioresource Technology, 2020, 305: 122626. DOI:10.1016/j.biortech.2019.122626 |
| [19] |
ZHANG Q, L IU Y, AI G, MI AO L, ZHENG H, L IU Z. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7[J]. Bioresource Technology, 2012, 108: 35-44. DOI:10.1016/j.biortech.2011.12.139 |
| [20] |
REN Y, YANG L, LIANG X. The characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium, Acinetobacter junii YB[J]. Bioresource Technology, 2014, 171: 1-9. DOI:10.1016/j.biortech.2014.08.058 |
| [21] |
钱春园, 郭晓泽, 高锋, 陶琼, 郑舟, 薛彬, 郭远明. 异养硝化菌的分离及在养殖废水处理中的应用[J]. 浙江海洋大学学报(自然科学版), 2017, 36(6): 481-486. DOI:10.3969/j.issn.1008-830X.2017.06.003. QIAN C Y, GUO X Z, GAO F, TAO Q, ZHENG Z, XUE B, GUO Y M. Isolation of the heterotrophic nitrification bacteria and its application in aquaculture wastewater treatment[J]. Journal of Zhejiang Ocean University (Natural Science), 2017, 36(6): 481-486. DOI:10.3969/j.issn.1008-830X.2017.06.003. |
| [22] |
L I U Y, Y UA N X, L I U Z. O pt im izat ion, pu r i f icat ion, a nd characterization of hydroxylamine oxidoreductase from Acinetobacter sp. Y1[J]. Applied Biochemistry and Biotechnology, 2019, 66(4): 494-501. DOI:10.1002/bab.1745 |
| [23] |
LI D, LIANG X, JIN Y, WU C, ZHOU R. Isolation and nitrogen removal characteristics of an aerobic heterotrophic nitrifying-denitrifying bacterium, Klebsiella sp. TN-10[J]. Applied Biochemistry and Biotechnology, 2019, 188(2): 540-554. DOI:10.1007/s12010-018-02932-9 |
| [24] |
康鹏亮, 张海涵, 黄廷林, 陈胜男, 商潘路, 冯稷, 贾竞宇. 湖库沉积物好氧反硝化菌群脱氮特性及种群结构[J]. 环境科学, 2018, 39(5): 2431-2437. DOI:10.13227/j.hjkx.201710229 KANG P L, ZHANG H H, HUANG T L, CHEN S N, SHANG P L, FENG J, JIA J Y. Denitrification characteristics and community structure of aerobic denitrifiers from lake and reservoir sediments[J]. Environmental Science, 2018, 39(5): 2431-2437. DOI:10.13227/j.hjkx.201710229 |
| [25] |
TAI Y, DENG J, REN H, HUANG Z, RUAN W. Isolation and identification of a heterotrophic nitrifying strain of Agrobacterium sp. and its ammoxidation performance[J]. Chinese Journal of Applied and Environmental Biology, 2020, 26(2): 325-331. DOI:10.19675/j.cnki.1006-687x.2019.04031 |
| [26] |
SONG T, ZHANG X, LI J, WU X, FENG H, DONG W. A review of research progress of heterotrophic nitrification and aerobic denitrification microorganisms (HNADMs)[J]. The Science of the Total Environment, 2021, 801: 149319. DOI:10.1016/j.scitotenv.2021.149319 |
| [27] |
CHEN Q, NI J. Heterotrophic nitrification-aerobic denitrification by novel isolated bacteria[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(9): 1305-1310. DOI:10.1007/s10295-010-0911-6 |
| [28] |
王兆阳, 陈国耀, 姜珂, 许培雅. 1株耐冷兼性嗜碱好氧反硝化菌的分离鉴定及反硝化特性[J]. 环境科学, 2014, 35(6): 2341-2348. DOI:10.13227/j.hjkx.2014.06.042 WANG Z Y, CHEN G Y, JIANG K, XU P Y. Identification and denitrification characteristics of a psychrotolerant facultative basophilic aerobic denitrifier[J]. Environmental Science, 2014, 35(6): 2341-2348. DOI:10.13227/j.hjkx.2014.06.042 |
| [29] |
DUAN J, FANG H, SU B, CHEN J, LIN J. Characterization of a halophilic heterotrophic nitrification-aerobic denitrification bacterium and its application on treatment of saline wastewater[J]. Bioresource Technology, 2015, 179: 421-428. DOI:10.1016/j.biortech.2014.12.057 |
| [30] |
DINCER AR, K ARGI F. Salt inhibition of nitrification and denitrification in saline wastewater[J]. Environmental Technology, 1999, 20(11): 1147-1153. DOI:10.1016/S0141-0229(01)00312-X |
| [31] |
SHODA M, ISHIKAWA Y. Heterotrophic nitrification and aerobic denitrification of high-strength ammonium in anaerobically digested sludge by Alcaligenes faecalis strain No. 4[J]. Journal of Bioscience and Bioengineering, 2014, 117(6): 737-741. DOI:10.1016/j.jbiosc.2013.11.018 |
| [32] |
林国庆, 初慧, 朱恒华, 杨丽芝, 唐晓梦, 苏胜, 张丽春. 离子类型对石油污染含水层中微生物去除苯的影响[J]. 地质学报, 2019, 93(S1): 266-272. DOI:10.19762/j.cnki.dizhixuebao.2019237 LIN G Q, CHU H, ZHU H H, YANG L Z, TANG X M, SU S, ZHANG L C. Effect of ion types on the removal of benzene by microorganisms in petroleum-contaminated aquifer[J]. Acta Geologica Sinica, 2019, 93(S1): 266-272. DOI:10.19762/j.cnki.dizhixuebao.2019237 |
| [33] |
ZHAO B, TIAN M, AN Q, YE J, GUO JS. Characteristics of a heterotrophic nitrogen removal bacterium and its potential application on treatment of ammonium-rich wastewater[J]. Bioresource Technology, 2017, 226: 46-54. DOI:10.1016/j.biortech.2016.11.120 |
| [34] |
LI C, YANG J, WANG X, WANG E, LI B, HE R, YUAN H. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a phosphate accumulating bacterium Pseudomonas stutzeri YG-24[J]. Bioresource Technology, 2015, 182: 18-25. DOI:10.1016/j.biortech.2015.01.100 |
| [35] |
FANG J, LIAO S, ZHANG S, LI L, TAN S, LI W, WANG A, YE J. Characteristics of a novel heterotrophic nitrification-aerobic denitrification yeast, Barnettozyma californica K1[J]. Bioresource Technology, 2021, 339: 125665. DOI:10.1016/j.biortech.2021.125665 |
| [36] |
REN J, BAI X, LIU Y, HUANG X. Simultaneous nitrification and aerobic denitrification by a novel isolated Ochrobactrum anthropi HND19[J]. Bioresource Technology, 2021, 340: 125582. DOI:10.1016/j.biortech.2021.125582 |
(责任编辑 杨贤智)
 2022, Vol. 49
2022, Vol. 49