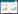文章信息
基金项目
- 广东省农业科学院驻镇帮扶村农村科技特派员项目(KTP20210010);广东省企业科技特派员项目(GDKTP2020026600)
作者简介
- 王庆(1997-), 女, 在读硕士生, 研究方向为兽药研制, E-mail: 18734409164@163.com.
通讯作者
- 彭新宇(1967-), 男, 硕士, 研究员, 研究方向为兽药研制, E-mail: 996202250@qq.com.
文章历史
- 收稿日期:2022-01-25
2. 广东省农业科学院动物卫生研究所/广东省畜禽疫病防治研究重点实验室/农业农村部兽用药物与诊断技术广东科学观测实验站/广东省中兽药工程技术研究中心, 广东 广州 510640;
3. 广州市江丰实业股份有限公司, 广东 广州 510510;
4. 广州市江丰实业翁源有限公司, 广东 韶关 512600
2. Institute of Animal Health, Guangdong Academy of Agricultural Sciences/Guangdong Key Laboratory of Livestock Disease Prevention/Guangdong Scientific Observation and Experiment Station of Veterinary Drugs and Diagnostic Techniques, Ministry of Agriculture and Rural Affairs/Guangdong Engineering Research Center of Traditonal Medicine, Guangzhou 510040, China;
3. Guangzhou Kwangfeng Industrial Co., Ltd., Guangzhou 510510, China;
4. Guangzhou Kwangfeng Wengyuan Industrial Co., Ltd., Shaoguan 512600, China
【研究意义】鸡球虫病是由一种或多种艾美尔球虫(Eimeria spp.)寄生于鸡肠道引起的寄生虫病,是集约化、规模化养鸡场常见的疾病之一[1]。其致病机理主要是球虫寄生在鸡肠道粘膜内,破坏鸡肠道粘膜的完整性,引起肠道出血,造成肠道消化吸收机能障碍,而且肠道粘膜损伤致使其他条件性致病菌感染几率提高,易继发其他细菌感染[2-4]。该病一般暴发于3~6周龄雏鸡,死亡率可高达80%,幸存下来的鸡只生产性能也会严重受损[1]。据估计,全世界养鸡业每年因鸡球虫损失高达20亿美元[5]。我国是世界第二养鸡大国,鸡肉产量约占世界总量的12%。因此,有效防治鸡球虫病发展对鸡养殖业具有重大意义。
【前人研究进展】目前控制鸡球虫病的主要手段,一是在饲料中添加抗球虫药,二是幼龄鸡口服活卵囊疫苗[6-7]。常用球虫药大致包括两类,一类为聚醚类离子载体抗生素,如莫能霉素、盐霉素、那拉霉素、森杜拉霉素、马杜拉霉素、拉沙洛霉素和海南霉素等;另一类为化学合成类抗球虫药,如克球粉、尼卡巴嗪、氨丙啉、地克珠利、球痢灵等。然而随着抗球虫药的广泛应用,球虫耐药性也随之出现[7-9]。为延缓耐药性的产生,常采用在肉鸡不同批次间或不同生长阶段使用作用机制不同的药物(即轮换用药或穿梭用药),但是球虫耐药性发展形势仍未得到缓解[9-10]。鸡球虫活卵囊疫苗免疫原理是鸡低水平多次感染球虫产生免疫力,即口服疫苗球虫在鸡体内繁殖产生虫卵排出体外,之后鸡再次从垫料中摄取孢子化虫卵而再次感染,如此循环2~3次,使鸡对同类球虫产生免疫力[7]。但由于球虫免疫为带虫免疫,使用球虫疫苗往往会降低鸡群生产性能,造成饲料消耗增加,对经济效益造成消极影响[8],而且目前仍不能准确控制球虫疫苗接种后鸡群从垫料摄入孢子化卵囊的数量,致使有部分鸡摄入卵囊过多出现拉血等症状;此外,使用球虫卵囊疫苗也会增加鸡产气荚膜梭菌感染的几率,促使坏死性肠炎的发生[11-12]。由于球虫耐药性普遍且球虫疫苗免疫技术仍有待完善,因此目前防治鸡球虫病仍面临巨大挑战。为了在耐药情况严峻的形势下有效控制鸡球虫病,同时考虑到食品安全因素,人们不再只是依赖抗球虫药物,而是寻求更加安全有效的方法。目前已有很多养殖场采用抗球虫药和球虫疫苗联合应用的方法以充分发挥球虫疫苗的优势、延长抗球虫药的有效使用期。
【本研究切入点】目前球虫疫苗和抗球虫药物的联合使用方式有两种,一种是穿梭使用方案(也称生物穿梭方案),即同一批养殖鸡群,在雏鸡阶段接种球虫疫苗,之后使用抗球虫药;另一种为轮换使用方案,即一批或多批鸡群养殖均采用球虫疫苗控制球虫病,之后一批鸡再使用抗球虫药控制球虫病。研究表明,采用轮换使用方案,对恢复球虫药物敏感性产生积极影响并取得良好经济效益[13-14]。而生物穿梭方案国内外均有使用,但其对球虫耐药性的相关研究报道很少。为探讨生物穿梭方案对养殖场中球虫耐药性的影响,本研究从前期使用球虫疫苗、中后期使用预防抗球虫药(即采用生物穿梭方案)的肉鸡养殖场采集粪便,分离球虫虫株,测试其耐药性,同时在只使用抗球虫药物预防的鸡场分离球虫进行对比测试。【拟解决的关键问题】通过对比分析仅使用球虫药物鸡场内分离得到的球虫和使用生物穿梭方案鸡场分离得到的球虫的耐药性,以评价生物穿梭方案对球虫的药物敏感性恢复是否能够产生积极作用。
1 材料与方法 1.1 试验材料1.1.1 供试虫株 供试球虫虫株于2021年4月分离自广州市花都区和清远英德市。两地所有采样鸡场各5个,均使用广州某饲料厂同种饲料,饲养同一品种麻黄肉鸡。花都采样鸡场均在4日龄雏鸡的饮水中添加1头份某品牌球虫活疫苗,30日龄后饲料中添加抗球虫药,至采样时为止,鸡场均已连续采用上述生物穿梭方案12个月。而英德采样鸡场长期在饲料中仅添加抗球虫药预防球虫病,未曾使用过球虫疫苗。
雏鸡30日龄时对每个鸡场采集鸡粪,用饱和盐水漂浮法分离虫卵,孢子化后用单卵囊法分离。每个鸡场分别得到2个柔嫩艾美尔球虫虫株,存于2.5% 重铬酸钾溶液中,置于4 ℃保存。攻虫前将同一来源地分离所得球虫分别等比例混合,分别标记为花都虫株和英德虫株。
1.1.2 试验动物 供试肉鸡为1日龄麻黄肉鸡公鸡苗,购自广州市江丰实业股份有限公司,饲养在严格消毒无球虫的动物房和金属笼内,自由饮水,自由采食。
1.1.3 供试药物 供试药物6种:25% 尼卡巴嗪预混剂(江西新鼎科技有限公司)、25% 二硝托胺预混剂(浙江荣耀生物科技股份有限公司)、25% 氯羟吡啶预混剂(广东省前沿动物保健有限公司)、1% 马杜霉素预混剂(山东齐发药业有限公司)、尼卡巴嗪马杜霉素合剂(25% 尼卡巴嗪预混剂和1% 马杜霉素预混剂1 ︰ 1混合),拌料用量均为500 g/t;15% 甲基盐霉素预混剂〔礼蓝(上海)动物保健有限公司〕,拌料用量为600 g/t。
1.2 试验方法1.2.1 试验处理 雏鸡18日龄时,逐羽称重,剔除体质量过大、过小、体弱雏鸡,随机分组,各处理10羽。试验设空白对照、花都虫株攻虫对照、英德虫株攻虫对照、花都虫株攻虫用药处理、英德虫株攻虫用药处理,花都、英德虫株攻虫用药处理各6个,各处理饲料中分别添加上述6种药物。12个攻虫用药处理分别从18日龄开始给予相应抗球虫药物8 d。除空白对照外,其余各处理肉鸡于19日龄口服接种5×104个球虫孢子化卵囊。每天观察并记录各处理肉鸡的饮水、采食、粪便以及死亡等情况,及时剖解死亡鸡,分析死亡原因。攻虫7 d后,将鸡只脱颈处死,称重,剖检,观察并记录盲肠病变,收集盲肠内容物并刮取盲肠粘膜。
1.2.2 病理显微观察 盲肠样本经4% 多聚甲醛固定24 h后,经修剪、脱水、包埋、切片、染色、封片等程序制作切片。采用显微镜观察切片,在不同倍数下观察组织病变情况。
1.2.3 球虫耐药性判定与评价[15] 以抗球虫指数(Anticoccidial Index, ACI)、最适抗球虫活性百分比(Percent of Optimum Anticoccidial Activity,POAA)、病变记分减少率(Reduction of Lesion Scores,RLS)、相对卵囊产量(Relative Oocyst Productivity,ROP)4项指标综合判定球虫耐药性。
(1)ACI=(存活率+ 增重率)-(病变值+ 卵囊值)。ACI ≥ 180判为优秀,160<ACI<179判为良好(记作-),120<ACI<159判为轻度或中度耐药(记作±),ACI<120判为无效、严重耐药(记作+)。

|
病变值:两侧盲肠病变不一致时,以病变严重的一侧记分。0分:无明显病变;1分:盲肠壁有少量散在瘀点,肠壁不增厚,内容物正常;2分:病变数量较多,盲肠内容物明显带血,盲肠肠壁稍增厚,内容物正常;3分:盲肠因充满大量血液或肠芯而肿大,肠芯内含有粪便;4分:鸡只死亡。
卵囊值:收集盲肠内容物并刮取盲肠粘膜,加入1% 胰蛋白酶,37 ℃消化2 h后用血小板计数法计算每只鸡盲肠匀浆内的卵囊百万数,计数结果 < 0.1、0.1~1、2~5、6~10、>11对应的卵囊值分别记作0、1、2、3、4。
(2)POAA=(攻虫用药处理GRS- 攻虫对照GRS)/(空白对照GRS- 攻虫对照GRS),GRS=笼末重/ 笼初重。POAA ≤ 50% 判为具有耐药性(记作+),>50% 为敏感(记作-)。
(3)RLS(%)=(攻虫对照的平均病变值- 攻虫用药处理的平均病变值)/ 攻虫对照的平均病变值×100。RLS<50% 判为具有耐药性(记作+),≥ 50% 为完全敏感(记作-)。
(4)ROP(%)=攻虫用药处理排出的卵囊总数/ 攻虫对照的卵囊总数×100。ROP ≥ 15% 判定具有耐药性(记作+),< 15% 为敏感(记作-)。
(5)耐药性综合评价:通过ACI、POAA、RLS、ROP指数对球虫耐药性进行综合评价:++++/+++,判定球虫严重耐药;++,判定球虫中度耐药;+,判定球虫轻度耐药。
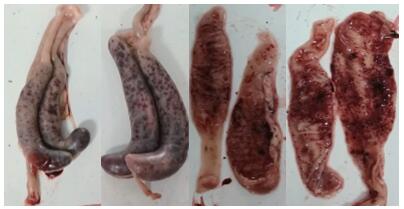
2 结果与分析 2.1 临床症状和剖检病变花都虫株和英德虫株的攻虫对照肉鸡均在感染4~5 d后排稀便和血便,剖检病死鸡可见盲肠肿大、出血,盲肠内血液与肠内容物混合凝结,或呈粘稠状,或呈干酪样物质凝块(图 1);其他各攻虫用药处理肉鸡的盲肠呈现不同程度病变,粘膜出血,肠壁增厚,严重者盲肠明显肿大、肠壁密布出血点,肠内容物与血液混合凝结。
|
| 图 1 死亡肉鸡的盲肠病征 Fig. 1 Cecum lesion characteristics of dead broilers |
2.2 盲肠组织病变情况
与空白对照肉鸡的正常盲肠组织切片(图 2A)对比可见,花都虫株攻虫对照(图 2B)和英德虫株攻虫对照(图 2C)肉鸡的盲肠组织溃疡,累及粘膜下层;盲肠粘膜层大量上皮及肠腺丧失,结缔组织增生,伴有较多炎性细胞浸润,包括淋巴细胞、粒细胞等。粘膜层可见较多卵囊,广泛存在于肠腺上皮、腺腔以及结缔组织内,多处有虫卵透过粘膜肌层浸润至粘膜下层。粘膜下层有较多淋巴组织和结缔组织增生,局部水肿,致使粘膜下层增宽。
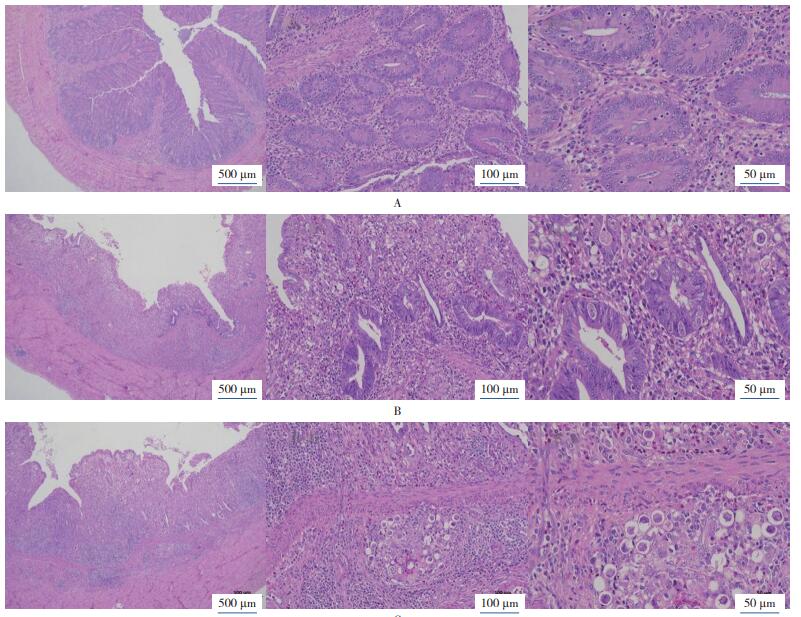
|
| 图 2 空白对照(A)、花都虫株攻虫对照(B)、英德虫株攻虫对照(C)肉鸡的盲肠组织切片 Fig. 2 Caecum tissue sections of broilers in blank control (A), Huadu isolates challenge control(B) and Yingde isolates challenge control(C) |
2.3 6种药物对不同来源虫株的ACI比较
试验各处理的存活率、增重率、病变值、卵囊值以及ACI指数值结果见表 1。对花都虫株,尼卡巴嗪、氯羟吡啶、马杜霉素3种药物均表现为ACI < 120,其他药物为120 < ACI < 159,据此判断花都虫株对尼卡巴嗪、氯羟吡啶、马杜霉素严重耐药,对其他3种药物中度耐药。而英德虫株对6种药物均表现为120 < ACI < 159,判断英德虫株对供试所有药物均中度耐药。
2.4 6种药物对不同来源虫株的POAA比较
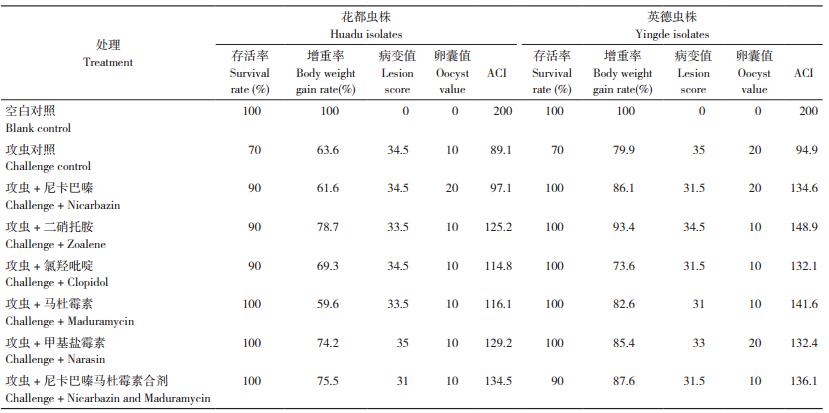
试验各处理的体重变化以及POAA结果见表 2。对花都虫株,仅尼卡巴嗪马杜霉素合剂的POAA>50%、为65.95%,其他药物的POAA < 50%,判断花都虫株仅对尼卡巴嗪马杜霉素合剂表现敏感,对其他5种药物表现耐药。英德虫株对6种药物均表现为POAA>50%,据此判断对供试所有药物均表现敏感,其中对二硝托胺、甲基盐霉素的POAA>75%。
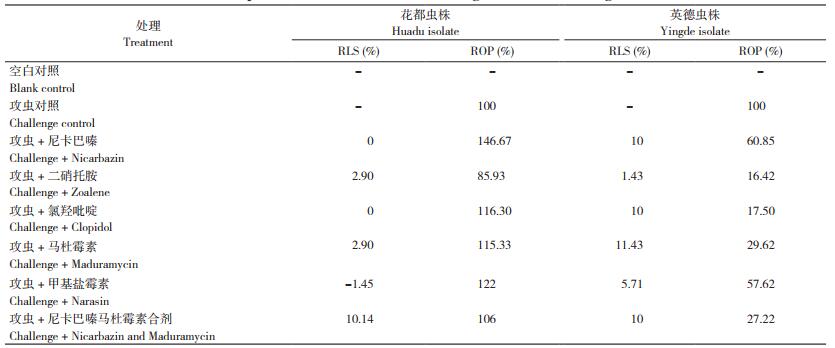
2.5 6种药物对不同来源虫株的RLS和ROP比较
试验各处理的RLS值和ROP值结果见表 3。花都、英德虫株对6种药物均表现出RLS < 50%、ROP>15%,据此判断花都虫株和英德虫株对供试所有药物均表现耐药,且花都虫株球虫卵囊产量基本不受抗球虫药物影响。
|
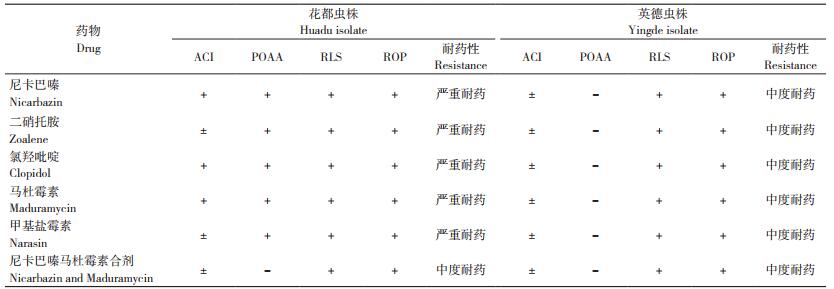
2.6 不同来源虫株对6种药物的耐药性综合评价
从ACI、POAA、RLS、ROP 4个耐药性指标(表 4)综合判断,花都虫株对尼卡巴嗪马杜霉素合剂中度耐药,对其余5种药物严重耐药;英德虫株对供试的6种药物均表现中度耐药;两个来源虫株均表现出多重耐药。
|
3 讨论
评价鸡球虫耐药性常用的指标有抗球虫指数(ACI)、最适抗球虫活性百分比(POAA)、病变计分减少率(RLS)和相对卵囊产量(ROP)等,这4个指标从不同侧面反映球虫耐药性。其中ACI较为均衡地从存活率、增重、卵囊产量、病变等4个方面反映抗球虫药的效果,而POAA、RLS和ROP则分别从增重、病变和卵囊产量反映球虫耐药性。试验综合4个指标对2个来源的柔嫩艾美尔球虫虫株的耐药性进行判断,可见花都、英德虫株对常用6种药物均表现出明显的耐药性且表现为多重耐药,这与国内外关于鸡球虫耐药性形势报道一致[16-23]。试验结果反映了鸡球虫耐药性的严重性,抗球虫药在控制球虫病发展的应用中处于严峻困境。
本研究球虫虫株样本来源的两地鸡场所用的肉鸡品种、饲料均相同。其中花都5个鸡场采用了球虫活卵囊疫苗和抗球虫药物穿梭方案控制球虫病已有1年,而英德5个鸡场长期只使用抗球虫药预防球虫病,从未使用过球虫疫苗。试验结果发现,花都虫株和英德虫株均表现为多重耐药性,这提示生物穿梭方案并不能明显改善鸡场球虫的耐药性。究其原因,在于球虫活卵囊疫苗和抗球虫药物穿梭使用过程中,鸡群对球虫产生抗体从而控制球虫病的发展,但野生虫株仍在环境中存活,生长后期抗球虫药物的配合使用在消除疫苗对鸡体造成的亚感染状态方面起到一定作用,但促进生长的同时也使得环境中的球虫虫株再次处于抗球虫药物的筛选压力下,不利于鸡场内球虫虫株药物敏感性的恢复。
而有关球虫活卵囊疫苗和抗球虫药物轮换使用方案的效果研究表明,轮换使用方案可以改善球虫耐药性[14, 24]。Vereecken等[24]对某鸡场接种鸡球虫疫苗前后分离得到的球虫虫株进行药物敏感性检测,发现接种疫苗后分离所得球虫虫株对药物敏感性有所恢复。通过对比分析发现,轮换方案中使用球虫疫苗的时间比穿梭方案更长,可更有效地将野生耐药虫株占比降到更低。此外,有研究表明采用轮换方案时,在一批或几批鸡使用疫苗后,出栏时需要保留一部分垫料,从而使疫苗虫株在环境中延续到下一批鸡养殖周期,保持敏感虫株在环境中的种群数量优势。Chapman等[13]提出利用球虫活疫苗与药物轮换使用,有可能恢复场地球虫的敏感性,并提出每年三轮换的控制计划,即4个月采用药物控制球虫方法养2批鸡,彻底消毒清场;接着4个月采用球虫疫苗养2批鸡;再接着4个月采用药物养2批鸡;再4个月采用药物养二批鸡,彻底消毒清场……如此循环,其中,药物转疫苗前要彻底清栏,而疫苗转药物前不要彻底清栏。Snyder等[18]也发现每批鸡出栏后清除垫料会限制疫苗虫株在场地中形成优势,也缩短了药物敏感性提高的持续时间。
4 结论本研究分离得到的不同来源鸡柔嫩艾美尔球虫虫株,均对尼卡巴嗪、二硝托胺、氯羟吡啶、马杜霉素、甲基盐霉素、尼卡巴嗪马杜霉素合剂6种药物表现出中度到严重耐药,可见目前鸡场的球虫耐药性仍然很严重,且呈现多重耐药性。与仅使用抗球虫药物防制方案的鸡场相比,采用球虫疫苗和抗球虫药穿梭方案鸡场分离得到的柔嫩艾美尔球虫对常见的6种抗球虫药仍然表现中度耐药,虫株对药物敏感性未见明显恢复,提示疫苗与药物穿梭使用对恢复抗球虫药物敏感性作用不明显。
| [1] |
索勋, 李国清. 鸡球虫病学[C]. 北京: 中国农业大学出版社, 1998. SUO X, LI G Q. Coccidia and coccidiosis of domestic fowl[C]. Beijing: China Agricultural University Press, 1998. |
| [2] |
MADLALA T, OKPEKU M, ADELEKE M A. Understanding the interactions between Eimeria infection and gut microbiota, towards the control of chicken coccidiosis: a review[J]. Parasite, 2021, 28: 48. DOI:10.1051/parasite/2021047 |
| [3] |
ZHOU B H, JIA L S, WEI S S, DING H Y, YANG J Y, WANG H W. Effects of Eimeria tenella infection on the barrier damage and microbiota diversity of chicken cecum[J]. Poult Science, 2020, 99(3): 1297-1305. DOI:10.1016/j.psj.2019.10.073 |
| [4] |
CHEN H L, ZHAO X Y, ZHAO G X, HUANG H B, LI H R, SHI C W, YANG W T, JIANG Y L, WANG J Z, YE L P, ZHAO Q, WANG C F, YANG G L. Dissection of the cecal microbial community in chickens after Eimeria tenella infection[J]. Parasit Vectors, 2020, 13(1): 56. DOI:10.1186/s13071-020-3897-6 |
| [5] |
BLAKE D P, Knox J, DEHAECK B, HUNTINGTON B, RATHINAM T, RAVIPATI V, AYOADE S, GILBERT W, ADEBAMBO A O, JATAU I D, RAMAN M, PARKER D, RUSHTON J, TOMLEY F M. Re-calculating the cost of coccidiosis in chickens[J]. Veterinary Research, 2020, 51(1): 115. DOI:10.1186/s13567-020-00837-2 |
| [6] |
WITCOMBE D M, SMITH N C. Strategies for anti-coccidial prophylaxis[J]. Parasitology, 2014, 141(11): 1379-1389. DOI:10.1017/S0031182014000195 |
| [7] |
PEEK H W, LANDMAN W J. Coccidiosis in poultry: anticoccidial products, vaccines and other prevention strategies[J]. Veterinary Quarterly, 2011, 31(3): 143-161. DOI:10.1080/01652176.2011.605247 |
| [8] |
WILLIAMS R B. Anticoccidial vaccines for broiler chickens: pathways to success[J]. Avian Pathol, 2002, 31(4): 317-353. DOI:10.1080/03079450220148988 |
| [9] |
CHAPMAN H D. Biochemical, genetic and applied aspects of drug resistance in Eimeria parasites of the fowl[J]. Avian Pathol, 1997, 26(2): 221-244. DOI:10.1080/03079459708419208 |
| [10] |
PEEK H W, LANDMAN W J M. Resistance to anticoccidial drugs of Dutch avian Eimeria spp. field isolates originating from 1996, 1999 and 2001[J]. Avian Pathol, 2003, 32(4): 391-401. DOI:10.1080/0307945031000121149 |
| [11] |
DIERICK E, DUCATELLE R, VAN IMMERSEEL F, GOOSSENS E. Research note: The administration schedule of coccidia is a major determinant in broiler necrotic enteritis models[J]. Poult Science, 2021, 100(3): 100806. DOI:10.1016/j.psj.2020.10.060 |
| [12] |
TSIOURIS V, GEORGOPOULOU I, BATZIOS C, PAPPAIOANNOU N, DIAKOU A, PETRIDOU E, DUCATELLE R, FOTOMARIS P. The role of an attenuated anticoccidial vaccine on the intestinal ecosystem and on the pathogenesis of experimental necrotic enteritis in broiler chickens[J]. Avian Pathol, 2013, 42(2): 163-170. DOI:10.1080/03079457.2013.776161 |
| [13] |
CHAPMAN H D, JEFFERS T K. Vaccination of chickens against coccidiosis ameliorates drug resistance in commercial poultry production[J]. International Journal for Parasitolgy Drugs Drug Resistance, 2014, 4(3): 214-217. DOI:10.1016/j.ijpddr.2014.10.002 |
| [14] |
CHAPMAN H D, JEFFERS T K. Restoration of sensitivity to salinomycin in Eimeria following 5 flocks of broiler chickens reared in floor-pens using drug programs and vaccination to control coccidiosis[J]. Poult Science, 2015, 94(5): 943-946. DOI:10.3382/ps/pev077 |
| [15] |
孔繁瑶, 宁长申, 殷佩云. 15株柔嫩艾美耳球虫Eimera tenella对五种抗球虫药的抗药性调查研究[J]. 北京农业大学学报, 1994(3): 302-308. KONG F Y, NING C S, YING P Y. Investigation on the resistance of 15 strains of Eimera tenella to five anticoccidial drugs[J]. Journal of Beijing Agricultural University, 1994(3): 302-308. |
| [16] |
陈玉婷, 彭新宇, 袁明贵, 孙俊颖, 何立美, 尹烨华, 魏光伟. 3株柔嫩艾美耳球虫野外分离株的药物敏感性试验研究[J]. 广东农业科学, 2013(22): 125-128. DOI:10.16768/j.issn.1004-874X.2013.22.049 CHEN Y T, PENG X Y, YUAN M G, SUN J Y, HE L M, YIN Y H, WEI G W. Study on drug-sensitivity test of three wild strains of Eimeria tenella[J]. Guangdong Agricultural Sciences, 2013(22): 125-128. DOI:10.16768/j.issn.1004-874X.2013.22.049 |
| [17] |
LAN L H, SUN B B, ZUO B X, CHEN X Q, DU A F. Prevalence and drug resistance of avian Eimeria species in broiler chicken farms of Zhejiang Province, China[J]. Poult Science, 2017, 96(7): 2104-2109. DOI:10.3382/ps/pew499 |
| [18] |
SNYDER R P, GUERIN M T, HARGIS B M, KRUTH P S, PAGE G, REJMAN E, ROTOLO J L, SEARS W, ZELDENRUST E G, WHLE J, BARTA J R. Restoration of anticoccidial sensitivity to a commercial broiler chicken facility in Canada[J]. Poult Science, 2021, 100(2): 663-674. DOI:10.1016/j.psj.2020.10.042 |
| [19] |
MESA C, GÓMEZ-OSORIO L M, LÓPEZ-OSORIO S, WILLIAMS S M, CHAPARRO-GUTIÉRREZ J J. Survey of coccidia on commercial broiler farms in Colombia: frequency of Eimeria species, anticoccidial sensitivity, and histopathology[J]. Poult Science, 2021, 100(8): 101239. DOI:10.1016/j.psj.2021.101239 |
| [20] |
TAN L, LI Y, YANG X, KE Q, LEI W, MUGHAL M N, FANG R, ZHOU Y, SHEN B, ZHAO J. Genetic diversity and drug sensitivity studies on Eimeria tenella field isolates from Hubei Province of China[J]. Parasit Vectors, 2017, 10(1): 137. DOI:10.1186/s13071-017-2067-y |
| [21] |
DJEMAI S, MEKROUD A, JENKINS M C. Evaluation of ionophore sensitivity of Eimeria acervulina and Eimeria maxima isolated from the Algerian to Jijel Province poultry farms[J]. Veterinary Parasitology, 2016, 224(undefined): 77-81. DOI:10.1016/j.vetpar.2016.04.040 |
| [22] |
彭新宇, 蔡建平, 魏文康, 张健騑, 吴惠贤, 谢明权. 广东省鸡球虫的抗药性研究进展[J]. 广东畜牧兽医科技, 2001(3): 11-14. PENG X Y, CAI J P, WEI W K, ZHANG J F. Research progress on drug resistance of chicken coccidia in Guangdong Province[J]. Guangdong Agricultural Sciences, 2001(3): 11-14. |
| [23] |
彭新宇, 张健騑, 魏文康, 吴惠贤, 谢明权. 柔嫩艾美耳球虫野外分离株对3种化学合成药物的抗药性[J]. 中国兽医学报, 2000, 20(1): 48-50. DOI:10.16303/j.cnki.1005-4545.2000.01.014 PENG X Y, ZHANG J F, WEI W K, WU H X, XIE M Q. Resistance of field isolates of Eimeria tenella to three chemically synthesized drugs[J]. Chinese Journal of Veterinary Science, 2000, 20(1): 48-50. DOI:10.16303/j.cnki.1005-4545.2000.01.014 |
| [24] |
VEREECKEN M, DEHAECK B, RATHINAM T, SCHELSTRAETE W, De GUSSEM K, CHAPMAN H D. Restoration of the sensitivity of Eimeria acervulina to anticoccidial drugs in the chicken following use of a live coccidiosis vaccine[J]. Veterinary Parasitology, 2021, 29: 109416. DOI:10.1016/j.vetpar.2021.109416 |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49