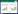文章信息
基金项目
- 广西自然科学基金(2017GXNSFAA198142);广西林业科技项目(桂林科字〔2014〕第25号);广西高校大学生创新创业训练计划项目(201910593321)
作者简介
- 徐蕾(1995—),女,佤族,硕士,研究方向为昆虫生理生态学,E-mail:903108032@qq.com.
通讯作者
- 杨振德(1966—),男,博士,教授,研究方向为森林保护学,E-mail:dzyang68@126.com.
文章历史
- 收稿日期:2022-02-07
2. 广西大学林学院,广西 南宁 530004;
3. 广西高校林业科学与工程重点实验室,广西 南宁 530004;
4. 巴马瑶族自治县自然资源局核桃产业发展中心,广西 巴马 547500
2. Forestry College, Guangxi University, Nanning 53000, China;
3. University Key Laboratory of Forestry Science and Engineering of Guangxi, Nanning 53000, China;
4. Walnut Industry Development Center, Natural Resources Bureau of Bama Yao Autonomous County, Bama 547500, China
【研究意义】云斑白条天牛Batocera lineolata隶属于鞘翅目Coleoptera天牛科Cerambycidae,主要为害寄主有核桃、桉树、杨树、桑树等,成虫和幼虫均可造成为害,成虫啃食被害树的树皮和嫩枝,幼虫蛀食被害树韧皮部和木质部,严重时影响树木的生长甚至导致树木死亡[1]。近年来,广西河池市大力发展核桃产业,虽然已取得一定经济成效,但云斑白条天牛的为害也日趋严重,严重影响着核桃产量,除此之外,在广西钦州市多个林场和地区的桉树林调查中也发现了云斑白条天牛的为害,因此,在发展核桃产业以及桉树种植上一定要高度重视对云斑白条天牛的防治工作。研究寄主转换对云斑白条天牛幼虫肠道细菌多样性的影响对云斑白条天牛生防菌的开发利用具有重要意义。【前人研究进展】昆虫肠道内存在大量微生物,在影响其宿主生长发育、营养代谢和疾病防御的同时还对宿主的寿命、交配与繁殖能力有着一定影响[2-3],相较真菌而言,细菌在昆虫的肠道中起到主要作用[4]。宿主与细菌之间互相影响,借助对营养物质的吸收利用,维系其消化道内细菌的平衡[5-6]。有研究表明,昆虫体内细菌优势菌门以变形菌门和厚壁菌门为主,除了变形菌门和厚壁菌门外,还有其他优势菌门,如赤拟谷盗Tribolium castaneum成虫肠道细菌优势菌门分别属于变形菌门、厚壁菌门和放线菌门;光肩星天牛Anoplophora glabripennis肠道优势菌门中除含有变形菌门和厚壁菌门外,还有放线菌门和拟杆菌门[7-9]。通过鞘翅目昆虫肠道优势菌属的研究发现,松墨天牛(Monochamus alternatus)幼虫肠道优势菌属为伊丽莎白菌属(Elizabethkingia)[10],桑天牛(Apriona germari)成虫肠道优势菌属为产酸雷克伯氏菌(Klebsiella oxytoca)[11]。昆虫在转换寄主后可能会形成不同的寄主适应机制,其个体具有可塑性,共生微生物种群处于动态变化中,也存在着转化关系[12]。陈萍等[13]研究寄主转换对稻纵卷叶螟(Cnaphalocrocis medinalis)寄主种群适合度及生命表参数的影响,得出玉米(Zea mays L.)比水稻(Oryza sativa L.)更有利于提高稻纵卷叶螟的适合度和种群增长;肖留斌等[14]研究绿盲蝽(Apolygus lucorum)转换寄主后对寄主转换的适应性及生理响应,得出转换寄主后绿盲蝽的生长发育速率与种群趋势增殖指数等生命参数均有所下降,绿盲蝽对棉花具有较高的适应性。【本研究切入点】运用传统的微生物培养与16SrRNA基因测序相结合的方法以及利用Illumina HiSeq技术检测转换寄主饲养云斑白条天牛幼虫后其肠道细菌多样性的变化情况,探讨肠道细菌在云斑白条天牛幼虫寄主转换中的作用,从肠道微生物的角度阐明云斑白条天牛的寄主适应机制,对云斑白条天牛肠道细菌进行进一步的研究。【拟解决的关键问题】研究结果为从肠道细菌的角度解析云斑白条天牛的寄主适应性以及开发利用微生物等方面提供理论依据。
1 材料与方法 1.1 试验材料云斑白条天牛雌雄成虫于2019年3月采自河池市巴马瑶族自治县的核桃林(周边无桉树),成虫用新鲜的核桃木段在室内饲养,5月份开始收集雌雄成虫交配后所产下的卵,把卵放置于垫有湿润滤纸的培养皿于27 ℃的条件下孵化培养。孵化后的幼虫放入核桃木段中饲养1周,于5月中旬选取生长状况良好且大小较一致的天牛幼虫进行寄主转换试验。供试核桃和桉树均采自广西大学林学院校内教学实践基地。其中,核桃6年生,树高6.5 m,胸径16.7 cm;广林9号桉树(Eucalyptus grandis×E.urophylla)3年生,树高7.2 m,胸径12.6 cm。
1.2 寄主转换试验取新鲜的核桃/桉树嫩枝,用中药粉碎机粉碎后作为幼虫饲料饲养天牛幼虫,置于无菌玻璃培养皿中,分别放入5 g磨好的饲料进行饲养,每个培养皿中放入1头四龄幼虫天牛。试验设核桃饲料饲养和寄主转换饲养2个处理,每个处理3次重复,每个重复1头天牛幼虫。为了减轻幼虫对饲料变化过于突然所造成的不适,提高饲养的成活率,寄主转换试验采用混合饲料过渡饲养的方法,用核桃桉树1 ∶ 1的饲料饲养15 d后换成仅用桉树饲料再饲养,6头天牛幼虫在饲喂30 d后用于试验。
1.3 云斑白条天牛幼虫肠道可培养细菌的分离与鉴定云斑白条天牛幼虫肠道参照傅慧静等[10]的方法进行解剖,单头幼虫为1个样本,每个处理3次重复,每个重复1头云斑白条天牛幼虫。解剖前先饥饿处理幼虫48 h,使其排空体内的食物残渣,然后用75% 的酒精浸泡天牛幼虫3 min,用无菌水多次清洗,洗净后再用灭菌的解剖工具进行解剖,取出完整肠道移至玻璃匀浆器中,加5 mL无菌水研磨至匀浆状,即为幼虫肠道匀浆液。肠道匀浆液中的可培养细菌参照朱林慧等[15]方法进行分离与纯化,直至得到纯的单克隆菌株。把分离出的单一菌株送至北京睿博兴科生物技术有限公司测序,将得到的基因序列在GenBank数据库中进行比对(http://www.ncbi.nlm.nih.gov/BLAST/),再结合菌落特征,参照《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》(第八版),将菌株鉴定为属。
1.4 云斑白条天牛幼虫肠道微生物高通量测序取出1.3提取的云斑白条天牛幼虫肠道匀浆液,以4 ℃ 12 000 r/min离心10 min,分离上清液和沉淀的菌体,弃上清,以菌体为样本提取云斑白条天牛幼虫肠道细菌的总DNA,使用“MN NucleoSpin 96 Soi”DNA提取试剂盒,参照说明书的方法对云斑白条天牛幼虫的肠道细菌的总DNA进行提取,基因扩增区域为V3-V4区,上游引物为338F5'-ACTCCTACGGGAGGCAGCA-3',下游引物为806R5'-GGACTACHVG GGTWTCTAAT-3'[11],PCR扩增反应体系为50 ng提取的肠道细菌总DNA+0.3 μL *Vn F(10 μmol/L)+0.3 μL * Vn R (10 μmol/L)+5 μL KOD FX Neo Buffer+2 μL dNTP (2 mmol/L each)+0.2 μL KOD FX Neo,再加入超纯水补足至10 μL。反应条件:95 ℃ 5 min;(95 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s)×25个循环,72 ℃ 7min,4 ℃保温。PCR扩增后在1.8% 的琼脂糖凝胶,120 V 40 min的电泳上进行检测,把扩增产物送至北京百迈克生物科技有限公司进行Illumina HiSeq 2500测序。
1.5 统计分析将Illumina HiSeq测序得到的原始数据用FLASH v1.2.7软件,通过overlap对每个样品的reads进行拼接,得到的拼接序列即Raw Tags数据;使用Trimmomatic v0.33软件,对拼接得到的Raw Tags进行过滤,得到Clean Tags数据;使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据Effective Tags。根据97% 的序列相似度,将所有序列进行同源比对并聚类成OTUs。利用QIIME软件计算α多样性指数,包括观测物种(ACE)、Chao1指数、Simpson指数和Shannon指数,运用Excel 2010对数据进行分析处理并制作相应的表格,用SPSS 22.0软件进行ANOVA单因素方差分析和多重比较。
2 结果与分析 2.1 云斑白条天牛幼虫肠道可培养细菌的菌落特征根据菌株的菌落特征,获得19株可培养细菌,其中核桃饲养的天牛幼虫10株,寄主转换后桉树饲养的天牛幼虫9株(表 1)。
|
2.2 分离的可培养菌株16SrRNA序列分析
从原寄主饲养的云斑白条天牛幼虫肠道分离的10株细菌属于厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),共涉及6个属,其中2株(HT1、HT2)属于肠球菌属(Enterococcus),4株(HT3、HT4、HT5、HT6) 属于克雷伯氏菌属(Klebsiella),HT7属于假单胞菌属(Pseudomonas),HT8属于沙雷氏菌属(Serratia),HT9属于拉乌尔菌属(Raoultella),HT10属于Gibbsiella属(表 2)。

|
从寄主转换的云斑白条天牛幼虫肠道分离的9株细菌属于厚壁菌门和变形菌门,共涉及6个属,其中2株(AS2、AS3)属于沙雷氏菌属(Serratia),2株(AS4、AS5)属于肠杆菌属(Enterobacter),2株(AS6、AS7)属于克雷伯氏菌属(Klebsiella),AS1属于拉乌尔菌属(Raoultella),AS8属于假单胞菌属(Pseudomonas),AS9属于肠球菌属(Enterococcus)。
2个处理分离出的可培养细菌种类很相似,均分离出6个属的可培养细菌,有5个属为共有菌属。其中肠球菌属细菌Enterococcus canintestini strain 0.23、假单胞菌属细菌Pseudomonas sp. strain THP6、拉乌尔菌属细菌Raoultella ornithinolytica strain YL-LS2为2个处理分离出的共有细菌,而Gibbsiella属细菌Gibbsiella quercinecans strain FRB97为HT组分离出的特有细菌,肠杆菌属细菌Enterobacter sp. strain YB48和Enterobacter sp. strain WA14-4-3为AS组分离出的特有细菌。
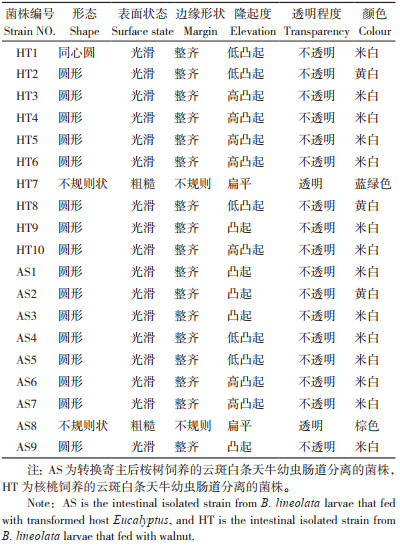
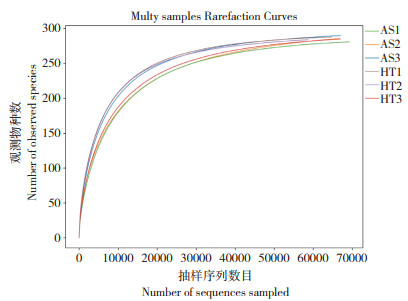
2.3 高通量测序结果2.3.1 OTU聚类分析 原寄主饲养的云斑白条天牛幼虫肠道细菌通过聚类分析分别获得288、284、285个OTUs,转换寄主饲养的云斑白条天牛幼虫肠道细菌通过聚类分析分别获得281、286、290个OTUs,物种统计结果表明,云斑白条天牛幼虫肠道样本中细菌共隶属于20个门32个纲55个目90个科170个属187个种(表 3),从样品稀释曲线看,随着测序数量的增加,曲线由陡然上升趋向平缓,随后进入平台期(图 1),说明试验中的6个样本所检测到的微生物接近真实情况。
|
|
| AS为转换寄主后桉树饲养的云斑白条天牛幼虫肠道分离的菌株,HT为原生寄主核桃饲养的云斑白条天牛幼虫肠道分离的菌株,样品名后数字1~3代表不同重复 AS is the intestinal isolated strain from B. lineolata larvae that fed with transformed host Eucalyptus, and HT is the intestinal isolated strain from B. lineolata larvae that fed with walnut, with the numerals 1-3 after the sample name representing different repeats 图 1 云斑白条天牛幼虫肠道细菌物种稀释曲线 Fig. 1 Rarefaction curves of the observed species of intestinal bacteria in Batocera lineolata larvae |
2.3.2 肠道细菌的种类组成及其丰度 在门分类阶元上,原寄主饲养的云斑白条天牛幼虫(HT)和转换寄主饲养的云斑白条天牛幼虫(AS)肠道细菌分别属于变形菌门、厚壁菌门、拟杆菌门(Bacteroidetes) 和放线菌门(Actinobacteria) 等20个门。其中,HT的优势菌门为变形菌门、厚壁菌门和拟杆菌门细菌,3种优势菌丰度分别占总数的82.21%,12.59% 和2.31%;AS的优势菌门为变形菌门、拟杆菌门和厚壁菌门细菌,3种优势菌丰度分别占总数的84.26%,4.37% 和6.11%,转换寄主饲养后,AS肠道中厚壁菌门的相对丰度较HT的降低,拟杆菌门的相对丰度则相对增加,但变形菌门仍是HT和AS的最主要优势菌门(图 2A)。
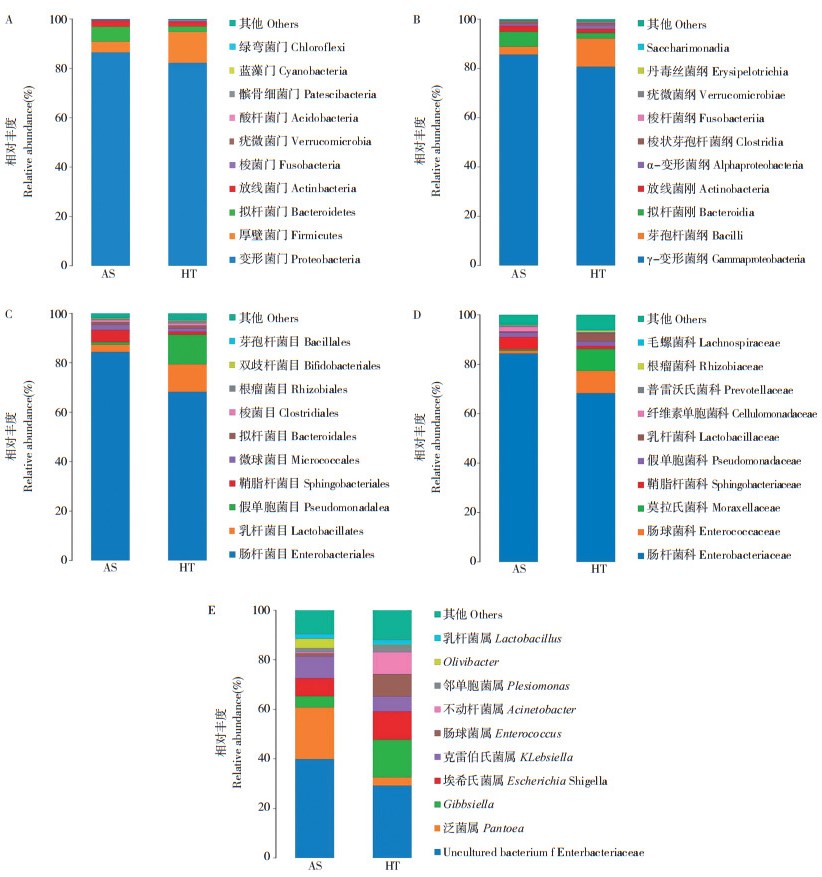
|
| AS为转换寄主后桉树饲养的云斑白条天牛幼虫肠道分离的菌株,HT为原生寄主核桃饲养的云斑白条天牛幼虫肠道分离的菌株 AS is the intestinal isolated strain from B. lineolata larvae that fed with transformed host Eucalyptus, and HT is the intestinal isolated strain from B. lineolata larvae that fed with walnut 图 2 云斑白条天牛幼虫肠道细菌在门(A)、纲(B)、目(C)、科(D) 和属(E)水平的组成 Fig. 2 Composition of intestinal bacteria in Batocera lineolata larvae at the phylum (A), class (B), order (C), family (D) and genus (E) levels |
在纲分类阶元上,HT和AS云斑白条天牛幼虫肠道细菌分别属于γ-变形菌纲(Gammaproteobacteria)、芽孢杆菌纲(Bacilli)、拟杆菌纲(Bacteroidia)等32个纲。其中γ- 变形菌纲为优势菌纲,在HT中占比80.72%,AS中占比85.65%;转换寄主饲养后γ- 变形菌纲的相对丰度呈上升趋势,同样呈上升趋势的还有拟杆菌纲,相对丰度由2.30% 上升至6.10%;以及芽孢杆菌纲,相对丰度由3.19% 升至11.45%(图 2B)。
在目分类阶元上,HT和AS云斑白条天牛幼虫肠道细菌在肠杆菌目(Enterobacteriales)、乳杆菌目(Lactobacillales)、假单胞菌目(Pseudomonadales)、鞘脂杆菌目(Sphingobacteriales)等55个目中均有分布。可以看出,2个处理的幼虫肠道优势菌目都是肠杆菌目,其中HT天牛肠道中,肠杆菌目和假单胞菌目细菌丰度较高,占比分别为68.25%,12.06%;AS天牛肠道中,肠杆菌目和鞘脂杆菌目细菌丰度较高,占比分别为84.37% 和4.97%,转换寄主饲养后,肠杆菌目和鞘脂杆菌目丰度升高,假单胞菌目和乳杆菌目丰度降低(图 2C)。
在科分类阶元上,HT和AS云斑白条天牛幼虫肠道细菌共隶属于90个科。可以看出,2个处理的幼虫肠道优势菌科都是肠杆菌科(Enterobacteriaceae),其中HT云斑白条天牛幼虫肠道细菌的优势菌科分别为肠杆菌科(68.25%),肠球菌科(Enterococcaceae)(9.08%),莫拉氏菌科(Moraxellaceae)(8.89%)和乳杆菌科(Lactobacillaceae)(1.96%);AS云斑白条天牛幼虫肠道细菌的优势菌科分别为肠杆菌科(84.37%)、鞘脂杆菌科(Sphingobacteriaceae)(4.97%)、纤维素单胞菌科(Cellulomonadaceae)(1.87%)和假单胞菌科(Pseudomonadaceae)(0.41%),转换寄主饲养后,肠杆菌科、乳杆菌科相对丰度呈上升趋势,肠球菌科和莫拉氏菌科呈下降趋势(图 2D)。
在属分类阶元上,HT和AS样本共注释到170个属的细菌。其中HT天牛幼虫肠道细菌主要隶属于肠杆菌科下未确定属(Uncultured bacterium f Enterobacteriaceae)(29.28%)、Gibbsiella属(15.22%)和埃希氏菌属(Escherichia-Shigella)(11.45%);转换寄主后天牛幼虫肠道细菌主要隶属于肠杆菌科下未确定属(39.96%)、泛菌属(Pantoea)(20.79%)、克雷伯氏菌属(8.83%)和埃希氏菌属(7.22%),转换寄主饲养后,肠杆菌科下未确定属、泛菌属和克雷伯氏菌属呈上升趋势,而Gibbsiella属和埃希氏菌属则呈下降趋势,但2个处理云斑白条天牛幼虫肠道优势菌属都是肠杆菌科下未确定属(图 2E)。
2.3.3 寄主转换对云斑白条天牛幼虫肠道细菌组成的影响 对获得的OTUs进行均一化处理后,将2组幼虫肠道共有和不同的OTU绘制成韦恩图(图 3)。韦恩图显示2组天牛肠道均检测出OTU 299个,在这些OTU当中,有298个OTU是共有的,仅有1个OTU是特有OTU,从这些数据可以看出2组肠道细菌组成是很相似的。

|
| AS为转换寄主后桉树饲养的云斑白条天牛幼虫肠道分离的菌株,HT为原生寄主核桃饲养的云斑白条天牛幼虫肠道分离的菌株 AS is the intestinal isolated strain from B. lineolata larvae that fed with transformed host Eucalyptus, and HT is the intestinal isolated strain from B. lineolata larvae that fed with walnut 图 3 韦恩图显示原寄主和转换寄主饲养云斑白条天牛后幼虫肠道细菌群落OTUs Fig. 3 Venn analysis of OTUs of the intestinal bacteria in Batocera lineolata larvae fed on original host and transformed host |
2.3.4 肠道细菌Alpha多样性分析 本研究选取ACE、Chao1、Shannon和Simpson 4个常用指数分析云斑白条天牛幼虫肠道菌群的多样性。由表 4可知,2个处理云斑白条天牛幼虫肠道中细菌种类均具有较高的丰富度和多样性,但寄主转换前后的云斑白条天牛细菌多样性无显著差异。

|
3 讨论
昆虫肠道复杂多样,因此也为细菌的生存与定殖提供了独特的环境[16]。同为鞘翅目天牛科昆虫,多食性的云斑白条天牛与寡食性的松褐天牛(Monochamus alternatus),其幼虫肠道的最主要优势菌门是相同的,都为变形菌门,但次优势菌门及其他优势菌门和菌属之间则存在一定差异[17]。对天牛科昆虫肠道优势菌属进行研究发现,松褐天牛幼虫肠道优势菌属为伊丽莎白菌属(Elizabethkingia)[10],桑天牛(Apriona germari)成虫肠道优势菌属为产酸雷克伯氏属(Klebsiella oxytoca)[11],青杨天牛(Saperda populnea)成虫肠道优势菌属为Wolbachia属[18],本研究中云斑白条天牛幼虫肠道优势菌属为肠杆菌科下未确定属,由此可看出,物种不同、虫态不同,其肠道消化道的形态和理化性质差别很大,肠道细菌也存在很大差异,这些差异取决于宿主昆虫的食物来源和行为特性等[19]。天牛在选择食物来源时,体内的感觉器官和神经系统都参与作用。云斑白条天牛为多食性昆虫,取食范围较广,核桃、桉树、桑树、杨树等均可被其取食,而松褐天牛仅取食松科植物,钦俊德[20]给出解释,这可能与寡食性昆虫的味觉对植物所含的抑食因素更为敏感有关,因此在取食行为上对食物的选择更为严格,两者的取食行为也有所不同。
肠道细菌高通量测序研究结果表明,转换寄主后Gibbsiella属、肠球菌属细菌的相对丰度降低,泛菌属细菌的相对丰度有所升高,这种差异可能是由于寄主的转换所引起的。泛菌属广泛存在于自然界中,在植物、昆虫及人类体内均有发现,有研究表明泛菌属可以为宿主提供必需的氨基酸或维生素[21-22]。王瀚等[23]在核桃黑斑病病部组织中发现成团泛菌(Pantoea agglomerans),表明该菌会使核桃黑斑病发病增速,为害性增强。关于Gibbsiella属细菌的研究较少,国外有学者从橡树Quercus spp. 和取食橡子的亚洲黑熊(Ursus thibetanus)口腔中分离得到该菌,研究表明它能够产生胞外多糖[24]。Gibbsiella属细菌在桑天牛[11]、松墨天牛[10]等天牛肠道中均未发现,而朱林慧等[15]以及我们在云斑白条天牛幼虫肠道细菌的研究中却发现了该菌的存在,且占有一定的丰度,至于该菌是天牛肠道中本身存在的菌还是通过取食寄主后进入到体内的,以及它在天牛肠道中起到什么作用、Gibbsiella属细菌的具体功能等问题还需进一步研究。另外,中低丰度的肠球菌属细菌同样也是昆虫肠道中常见的细菌[25-26],肠球菌属的细菌可以产生乙酸盐,能通过降低肠液的pH值来保护宿主,还具有解毒功能[27]。张勇等[28]研究饲料类型对茶尺蠖(Ectropis obliqua)幼虫肠道细菌多样性时发现不同饲料条件下茶尺蠖幼虫肠道优势菌都是肠球菌属,该研究也表明肠球菌属可以降低肠液中的pH从而保护宿主。本研究发现,寄主转换后肠道中肠球菌属的丰度值降低,推测转换寄主饲养可能导致云斑白条天牛幼虫肠道中的pH发生改变,从而导致肠球菌属的数量减少,关于菌属的功能及寄主转换导致肠道酸碱环境改变的推论有待进一步研究。虽然优势菌群在昆虫肠道中起到主要作用,但一些非优势菌种也可能在宿主的肠道中具有十分重要的功能[29]。例如,非优势菌Olivibacter属和乳杆菌属(Lactobacillus)细菌,有研究表明,Olivibacter sp. 菌可导致黄瓜(Cucumis sativus L.)枯萎病,为有害细菌[30];而植物乳杆菌(Lactobacillus plantarum)则对黑腹果蝇(Drosophila melanogaster)的觅食和产卵均具有引诱力[31],为有益细菌。因此,在研究肠道细菌优势种时,也需继续研究潜在发挥关键作用的非优势种,甚至研究未能培养细菌的作用。
4 结论原寄主饲养的云斑白条天牛幼虫与转换寄主饲养的云斑白条天牛幼虫肠道细菌种类组成相似。2种处理均分离得到6个属的可培养细菌,其中有5个属为共有菌属;转换寄主与原寄主饲养的云斑白条天牛幼虫肠道优势菌属均为肠杆菌科下未确定属(Uncultured bacterium f Enterobacteriaceae),2组天牛肠道中仅检测出1个特有OTU,寄主转换前后云斑白条天牛肠道细菌多样性(α多样性指数)无显著差异,由此可以得出,云斑白条天牛幼虫肠道细菌群落整体多样性比较丰富且菌群较为稳定,短期内改变寄主很难使其肠道细菌多样性发生改变。
| [1] |
肖刚柔. 中国森林昆虫[M]. 北京: 中国林业出版社, 1992: 472-473. XIAO G R. Forest Pest and Disease[M]. Beijing: China Forestry Press, 1992: 472-473. |
| [2] |
陈金华. 桑粒肩天牛幼虫肠道微生物多样性的分子生物学方法研究[D]. 重庆: 重庆大学, 2008. CHEN J H. Study on diversity of gut flora of Apriona germari (hope) larvar, by molecular methods[D]. Chongqing: Chongqing University, 2008 |
| [3] |
周帆, 庞志倡, 余小强, 汪肖云. 昆虫肠道微生物的研究进展和应用前景[J]. 应用昆虫学报, 2020, 57(3): 600-607. ZHOU F, PANG Z C, YU X Q, WANG X Y. Insect gut microbiota research: progress and aplications[J]. Chinese Journal of Applied Entomology, 2020, 57(3): 600-607. |
| [4] |
GUARNER F, JUAN-R M. Gutflora in health and disease[J]. The Lancet(British Edition), 2003, 361(9356): 512-519. |
| [5] |
YILMAX H, KAZIM S, HATICE K. The first study on the bacterial flora of the european spruce bark beetle, Dendroctonus micans (Coleoptera: Scolytidae)[J]. Biológia, 2006, 61(6): 679-686. |
| [6] |
MOORE GORDON E. Microflora from the alimentary tract of healthy southern pine beetles, Dendroctonus frontalis(Scolytidae), and their possible relationship to pathogenicity[J]. Journal of Invertebrate Pathology, 1972, 19(1): 72-75. DOI:10.1016/0022-2011(72)90191-7 |
| [7] |
魏晓莹, 郭晨亮, 褚栋. 昆虫体内微生物多样性的影响因素研究进展[J]. 生物安全学报, 2019, 28(3): 170-176. DOI:10.3969/j.issn.2095-1787.2019.03.002 WEI X Y, GUO C L, CHU D. Progress in influencing factors influencing microbial diversity in insects[J]. Biosafety, 2019, 28(3): 170-176. DOI:10.3969/j.issn.2095-1787.2019.03.002 |
| [8] |
王争艳, 王洋, 何梦婷, 鲁玉杰. 不同地理种群赤拟谷盗肠道细菌群落多样性分析[J]. 应用昆虫学报, 2020, 57(3): 617-622. WANG Z Y, WANG Y, HE M T, LU Y J. Diversity of intestinal bacteria in different geographic populations of Tribolium castaneum(Coleoptera: Tenebrionidae)[J]. Journal of Applied Entomology, 2020, 57(3): 617-622. |
| [9] |
PATRICK D S, ITALO D, JO H, KENNETH F R. Bacteria associated with the guts of two wood-boring beetles: Anoplophora glabripennis and Saperda vestita(Cerambycidae)[J]. Environmental Entomology, 2006, 35(3): 625-629. DOI:10.1603/0046-225X-35.3.625 |
| [10] |
傅慧静, 胡霞, 吴松青, 王荣, 梁光红, 黄世国, 张飞萍. 松褐天牛幼虫肠道黏质沙雷氏菌培养条件与木质素降解功能[J]. 林业科学, 2020, 56(2): 106-115. FU H J, HU X, WU S Q, WANG R, LIANG G H, HUANG S G, ZHANG F P. Culture conditions and lignin-degrading function of Serratia marcescens living in the larval gut of Monochamus alternatus[J]. Forestry Science, 2020, 56(2): 106-115. |
| [11] |
袁秀洁. 桑天牛成虫肠道优势细菌菌群研究[D]. 保定: 河北农业大学, 2010. YUAN X J. The dominant intestinal bacteria flora in Apriona germari adult[D]. Baoding: Hebei Agricultural University, 2010. |
| [12] |
王渭霞, 朱廷恒, 赖凤香. 昆虫共生微生物及其功能研究进展[J]. 昆虫学报, 2021, 64(1): 121-140. DOI:10.16380/j.kcxb.2021.01.013 WANG W X, ZHU T H, LAI F X. Research advances in symbiotic microorganisms in insects and their functions[J]. Acta Entomologica Sinica, 2021, 64(1): 121-140. DOI:10.16380/j.kcxb.2021.01.013 |
| [13] |
陈萍, 刘欢, 侯茂林. 寄主转换对稻纵卷叶螟寄主种群适合度及生命表参数的影响[J]. 昆虫学报, 2021, 64(3): 400-408. DOI:10.16380/j.kcxb.2021.03.012 CHEN P, LIU H, HOU M L. Effects of host switch on the performance and life-table parameters of host populations of Cnaphalocrocis medinalis (Lepidoptera: Pyralidae)[J]. Acta Entomologica Sinica, 2021, 64(3): 400-408. DOI:10.16380/j.kcxb.2021.03.012 |
| [14] |
肖留斌, 谭永安, 孙洋, 赵洪霞, 吴国强, 柏立新. 绿盲蝽对寄主转换的适应性及生理响应[J]. 中国农业科学, 2013, 46(23): 4941-4949. DOI:10.3864/j.issn.0578-1752.2013.23.010 XIAO L B, TAN Y A, SUN Y, ZHAO H X, WU G Q, BAI L X. Adaptability and physiological response to host plant species switching in Apolygus lucorum[J]. Scientia Agricultura Sinica, 2013, 46(23): 4941-4949. DOI:10.3864/j.issn.0578-1752.2013.23.010 |
| [15] |
朱林慧, 方小英, 段慧娟, 徐蕾, 杨振德. 云斑白条天牛幼虫肠道细菌的分离与鉴定[J]. 广西林业科学, 2020, 49(3): 373-379. DOI:10.19692/j.cnki.gfs.2020.03.011 ZHU L H, FANG X Y, DUAN H J, XU L, YANG Z D. Isolation and identification of intestinal bacteria in larvae of Batocera lineolata[J]. Guangxi Forestry Science, 2020, 49(3): 373-379. DOI:10.19692/j.cnki.gfs.2020.03.011 |
| [16] |
盘碧琼, 苏冉冉, 郑霞林, 陆温, 王小云. 天牛肠道细菌多样性及其降解纤维素研究进展[J]. 华中昆虫研究, 2020, 16(1): 107-115. PAN B Q, SU R R, ZHENG X L, LU W, WANG X Y. Progress in intestinal bacterial diversity and cellulose degradation in cattle[J]. Central China Insect Research, 2020, 16(1): 107-115. |
| [17] |
陈宏健, 郝德君, 田敏, 周杨, 夏小洪, 赵欣怡, 乔恒, 谈家金. 室内饲养松墨天牛幼虫不同肠段细菌的群落结构及功能分析[J]. 南京林业大学学报(自然科学版), 2021, 45(3): 143-151. DOI:10.12302/j.issn.1000-2006.202004009 CHEN H J, HAO D J, TIAN M, ZHOU Y, XIAX H, ZHAO X Y, QIAO H, TAN J J. The community structure and functional analysis of intestinal bacteria in Monochamus alternatus larvae reared indoors[J]. Journal of Nanjing Forestry University(Natural Sciences Edition), 2021, 45(3): 143-151. DOI:10.12302/j.issn.1000-2006.202004009 |
| [18] |
曹鹏熙, 李鑫钟, 刘怡萱, 陈舒婷, 刘星. 拉萨市三个区域青杨天牛肠道细菌结构组成与多样性研究[J]. 环境生态学, 2021, 3(7): 31-35, 41. CAO X P, LI X Z, LIU Y X, CHEN S T, LIU X. Study on intestinal bacterial structure and diversity of Saperda populnea in three areas of Lhasa[J]. Environmental Ecology, 2021, 3(7): 31-35, 41. |
| [19] |
陈勃生, 鲁兴萌, 邵勇奇. 鳞翅目昆虫肠道微生物的多样性及其与宿主的相互作用[J]. 昆虫学报, 2017, 60(6): 710-722. DOI:10.16380/j.kcxb.2017.06.011 CHEN B S, LU X M, SHAO Y Q. Diversity of the gut microbiota in lepidopteran insects and their interaction with hosts[J]. Acta Entomologica Sinica, 2017, 60(6): 710-722. DOI:10.16380/j.kcxb.2017.06.011 |
| [20] |
钦俊德. 诠释植食性昆虫是怎样选择食料植物的[J]. 生物学通报, 2003(6): 1-3. QIN J D. Explain how phytophagous insects choose feeding plants[J]. Bulletin of Biology, 2003(6): 1-3. |
| [21] |
DURON O, NOËL V. A wide diversity of Pantoea lineages are engaged in mutualistic symbiosis and cospeciation processes with stinkbugs[J]. Environmental Microbiology Reports, 2016, 8(5): 715-727. DOI:10.1111/1758-2229.12432 |
| [22] |
王娟, 高泽中, 蒋一婷, 万冬梅. 不同食性野生鸟类肠道微生物研究进展[J]. 生态学报, 2021, 41(20): 7939-7945. WANG J, GAO Z Z, JIANG Y T, WAN D M. Research advances in the intestinal microbes in wild birds with different feeding habits[J]. Acta Ecologica Sinica, 2021, 41(20): 7939-7945. |
| [23] |
王瀚, 王让军, 田凤鸣, 赵淑玲, 何九军, 李志虎, 王一峰, 卓平清, 王明霞. 陇南核桃致病性成团泛菌的分离鉴定及其致病性研究[J]. 福建农业学报, 2016, 31(10): 1086-1090. DOI:10.19303/j.issn.1008-0384.2016.10.016 WANG H, WANG R J, TIAN F M, ZHAO S L, HE J J, LI Z H, WANG Y F, ZHUO P Q, WANG M X. Indentification and pathogenicity assay of pathogen of blight disease on walnut trees in Longnan[J]. Fujian Journal of Agricultural Science, 2016, 31(10): 1086-1090. DOI:10.19303/j.issn.1008-0384.2016.10.016 |
| [24] |
SAITO M, NORIKO S-K, KAZUKO T. Gibbsiella dentisursi sp. nov., isolated from the bear oral cavity[J]. Microbiology and Immunology, 2012, 56(8): 506-512. DOI:10.1111/j.1348-0421.2012.00464.x |
| [25] |
杨云秋, 张勇, 陈亦然, 张灿, 赵天宇, 龙雁华. 昆虫肠道细菌的功能和研究方法[J]. 安徽农业大学学报, 2018, 45(3): 512-518. DOI:10.13610/j.cnki.1672-352x.20180619.007 YANG Y Q, ZHANG Y, CHEN Y R, ZHANG C, ZHAO T Y, LONG Y H. Function and research methods of insect intestinal bacteria[J]. Journal of Anhui Agricultural University, 2018, 45(3): 512-518. DOI:10.13610/j.cnki.1672-352x.20180619.007 |
| [26] |
GUAN C H, JU J H, BORLEE B R, WILLIAMSON L L, SHEN B, RAFFA K F, HANDELSMAN J O. Signal mimics derived from a metagenomic analysis of the gypsy moth gut microbiota[J]. Applied and Environmental Microbiology, 2007, 73(11): 3669-3676. DOI:10.1128/AEM.02617-06 |
| [27] |
MEAD L J, KHACHATOURIANS G G, JONES G A. Microbial Ecology of the gut in laboratory stocks of the migratory grasshopper, Melanoplus sanguinipes(Fab.)(Orthoptera: Acrididae)[J]. Applied and Environmental Microbiology, 1988, 54(5): 1174-1181. DOI:10.1128/aem.54.5.1174-1181.1988 |
| [28] |
张勇, 赵天宇, 邓竣丹, 吴珍珍, 杨云秋, 龙雁华. 饲料类型对茶尺蠖幼虫肠道细菌多样性及幼虫存活率的影响[J]. 微生物学报, 2019, 59(5): 881-890. DOI:10.13343/j.cnki.wsxb.20180336 ZHANG Y, ZHAO T Y, DENG J D, WU Z Z, YANG Y Q, LONG Y H. Effect of feed on gut bacterial diversity and larval survival of Ectropis obliqua (Lepidoptera: Geometridae)[J]. Acta Microbiologica Sinica, 2019, 59(5): 881-890. DOI:10.13343/j.cnki.wsxb.20180336 |
| [29] |
ANNAH S R, RAGHUVEER P, ADAM R B, BRENDAN J M, BOHANNAN K G. Individual members of the microbiota disproportionately modulate host Innate Immune responses[J]. Cell Host & Microbe, 2015, 18(5): 613-620. |
| [30] |
孙瑞梁. 连作和芽胞杆菌对黄瓜枯萎病菌菌丝际细菌的影响[D]. 北京: 中国农业科学院, 2018. SUN R L. Influence of cucumber monoculture and Bacillus on the Fusarium oxsporum-Feeding Bacteria[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. |
| [31] |
王露, 魏博帆, 李苗苗, 李晓哲, 王博, 阚云超, 乔惠丽. 植物乳杆菌、苹果醋酸杆菌和酿酒酵母三种微生物对黑腹果蝇行为和发育的影响[J]. 昆虫学报, 2021, 64(4): 460-470. DOI:10.16380/j.kcxb.2021.04.005 WANG L, WEI B F, LI M M, LI X Z, WANG B, KAN Y C, QIAO H L. Effects of three microbes, Lactobacillus plantarum, Acetobacter malorum, and Saccharomyces cerevisiae, on the behavior anddevelopment of Drosophila melanogaster[J]. Acta Entomologica Sinica, 2021, 64(4): 460-470. DOI:10.16380/j.kcxb.2021.04.005 |
(责任编辑 杨贤智)
 2022, Vol. 49
2022, Vol. 49