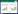文章信息
基金项目
- 广东省基础与应用基础研究基金(2019A1515111061)
作者简介
- 白永亮(1986—),男,博士,高级工程师,研究方向为农产品加工,E-mail:546232815@qq.com.
通讯作者
- 夏雨(1984—),男,硕士,高级工程师,研究方向为焙烤食品加工,E-mail:275817834@qq.com.
文章历史
- 收稿日期:2022-02-28
2. 中山洪力健康食品产业研究院有限公司,广东 中山 528437
2. Zhongshan Hongli Health Food Industry Research Institute Co., Ltd., Zhongshan 528437, China
【研究意义】苦荞(Fagopyrum tataricum)为蓼科(Polygonaceae)荞麦属(Fagopyrum)一年生双子叶作物[1],具有生育期短、耐冷凉、耐贫瘠、适应性较强等特点,常作为山区、丘陵区轮作换茬的重要作物之一[2-3],主要分布于我国西南、华北、西北等省区。随着食品加工技术的不断发展,以苦荞作为原料开发的休闲产品和健康饮品逐渐面市,如苦荞面、苦荞茶和苦荞饼干等。但由于苦荞口味苦涩、加工性能较差,所以产品中添加量甚少、使用率不高。萌发是一种安全、健康、快速和简便的加工改性方法,已经被广泛应用于大豆、绿豆和花生等作物原料[4-5]。【前人研究进展】萌发不仅可以提高苦荞内对人体有益的活性成分含量,还能降低其中有毒、有害或抗营养物质的含量[6-7]。研究表明,黄酮作为苦荞的主要活性成分,具有丰富的药理功效,萌发过程中黄酮含量显著提升[8-12],且受到苦荞预处理方式[10]、温度[8]以及光照[13-14]等因素的影响。马辉等[10]通过微波处理苦荞种子,研究萌发苦荞中总黄酮等含量的变化规律,结果表明采用微波协同L-phe处理的条件下,萌发7 d的苦荞芽苗的总黄酮含量最高。李晓丹等[11]采用金属盐溶液浸种萌发苦荞种子,表明采用1 000 mg/L硫酸铝溶液进行萌发处理后,每100 g干重总黄酮含量可达1 347.1 mg。王珺儒等[15]在苦荞萌发过程中进行了红光、白光和蓝光等不同光源处理,结果表明蓝光条件下可促进苦荞合成芦丁、槲皮苷和槲皮素,提高其抗氧化活性。【本研究切入点】萌发可以作为一种提高黄酮含量和抗氧化性的有效方法,研究苦荞萌发的环境变量因素对苦荞黄酮积累的影响具有重要意义。【拟解决的关键问题】本研究基于黄酮含量的积累,对苦荞萌发工艺进行优化,得出最优的萌发工艺参数,进而探究萌发对苦荞抗氧活性的影响,为苦荞在功能性食品原料中的应用提供技术基础。
1 材料与方法 1.1 试验材料苦荞籽粒:产自云南昭通,云南朱提苦荞生物科技开发有限公司
试剂:次氯酸钠溶液,分析纯,天津市百世化工有限公司;无水乙醇,分析纯,湖南江虹试剂有限公司;芦丁标准品(浓度 > 98%),上海研谨生物科技有限公司;亚硝酸钠、硝酸铝、氢氧化钠,分析纯,上海麦克林生化科技有限公司。
仪器设备:TH2-82A型气浴恒温振荡器,常州市化能实验仪器厂;LHS-150/250HC-Ⅱ恒温恒湿箱,上海一恒科学仪器有限公司;GXZ-500D型恒温恒湿光照培养箱,宁波东南仪器有限公司;THZ-82型水浴恒温振荡器,常州亚特实验仪器有限公司;紫外可见光分光光度计,上海现科分光仪器有限公司;TG16G型高速离心机,常州金坛良友仪器有限公司。
1.2 试验方法1.2.1 苦荞萌发样品预处理 选取没有破损、颗粒大小均匀、成熟饱满的苦荞种子,用蒸馏水洗净。用5% NaClO溶液浸泡消毒15 min,用蒸馏水反复洗净。在直径15 cm的培养皿中放入已消毒的苦荞籽粒200粒,置于一定温度和湿度的恒温恒湿培养箱中进行浸麦处理。浸麦后的苦荞籽粒均匀撒在铺有双层纱布的培养皿中,置于一定温度、湿度和光照强度的恒温恒湿培养箱中进行萌发处理,3次重复。萌发结束后马上用液氮对苦荞芽进行冷冻,放入冷库预冻24 h后,置于-40℃、0.01 MPa的环境下真空冷冻24 h,之后置于高速粉碎机中在液氮保护下进行磨粉,萌动苦荞粉过孔径0.250 mm筛,用封口袋包装,于-4℃保存,备用。
1.2.2 单因素试验 前期在浸麦温度20℃下采用“浸二断六”的方式浸麦40 h后,分别考察萌发温度(15、20、25、30、35℃)、光照强度(2 500、5 000、7 500、10 000、12 500 lx)、相对湿度(65%、70%、75%、80%、85%)以及萌发时间(24、32、40、48、56 h)对萌发苦荞黄酮含量的影响。单因素试验在基础条件为萌发温度25 ℃、萌发时间48 h、相对湿度80%、光照强度7 500 lx的条件下进行。
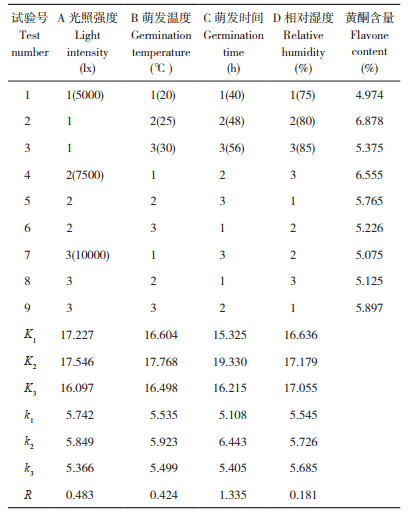
1.2.3 正交试验 以萌发温度、萌发时间、相对湿度和光照强度为考察因素,以苦荞黄酮含量为考察指标,优化萌发工艺参数,从中筛选最优工艺条件和技术参数。根据单因素试验结果设计的正交试验因素水平见表 1。
|
1.2.4 总黄酮含量测定 参照张强等[16]方法并进行适当改进。
1.2.5 主要黄酮类化合物种类鉴定 基于UHPLC-QE-MS的方法进行黄酮类化合物种类测定。色谱柱:Thermo Scientific Hypersil GOLD C18(100 mm×2.1 mm×3 μm);柱温:30 ℃;流速:0.4 mL/min;进样量:5.0 μL;流动相A:0.1%甲酸水;流动相B:乙腈;定量分析质谱仪器:ThermoFisher TSQ Altis;扫描模式:SRM;喷雾电压:3.8 kV;金属毛细管温度:350℃;鞘气流速:30 arb;辅助气流速:10 arb;喷雾温度:150℃;碰撞能量:20 eV。
1.2.6 抗氧化活性测定 (1)DPPH·自由基清除率。参照Gorjanović 等[17]方法并作适当修改:将苦荞和苦荞芽分别经真空冷冻干燥后,粉碎过0.250 mm筛,用乙醇在70℃恒温水浴锅中浸提6 h,冷却后抽滤,用乙醇定容于50 mL容量瓶中,作为待测液体备用。取300 μL待测液体,加入2.0 mL 0.093 mmol/L DPPH·溶液混合均匀,在黑暗处放置30 min后于517 nm波长处测定吸光度,以体积分数80% 乙醇作空白对照。
(2)ABTS+·自由基清除率。参照Kim等[18]、Oh等[19]方法并作适当修改。待测液制备同(1),取25 mL 7.4 mmol/L ABTS原液与25 mL 2.45 mmol/L过硫酸钾混合,在黑暗中放置12~16 h,然后用无水乙醇稀释50倍,得到ABTS+·溶液。吸取1 mL待测液,加入4 mL ABTS+·溶液,混合均匀后在734 nm波长处测吸光度,以无水乙醇作空白对照。
(3)亚铁还原能力。参照Lu等[20]方法并作适当修改。待测液制备同(1),吸取900 μL待测液,加入270 μL去离子水、2.7 mL FRAP试剂〔用40 mmol/L盐酸配制2.5 mL 10 mmol/L的TPTZ,再与2.5 mL 20 mmol/L FeCl3和25 mL 0.3 mol/L的醋酸缓冲液(pH 3.6)混合,加热至37℃制成〕,混合均匀后37℃水浴30 min,在595 nm波长处测定吸光度,以80% 乙醇作空白对照。所有样品均设3次重复。

|
式中,A样为样品吸光值,A空为空白对照吸光值。
试验数据采用GraphPad Prism7.04软件进行分析,采用SPSS Statistics10.0软件进行显著性分析。
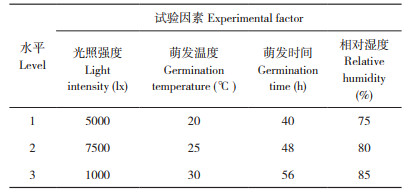
2 结果与分析 2.1 苦荞萌发工艺单因素试验2.1.1 光照强度对苦荞黄酮含量的影响 在萌发温度25℃、萌发时间48 h、相对湿度80%条件下,不同光照强度对苦荞黄酮含量的影响如图 1所示。当光照强度为2 500~7 500 lx时,苦荞黄酮含量随着光照强度提高而显著增加,并于光照强度7 500 lx达到最大值;当光照强度为7 500~12 500 lx时,苦荞黄酮含量随着光照强度提高而显著降低(P < 0.05)。综上,选择光照强度7 500 lx进行后续试验。
|
| 小写英文字母不同者表示差异显著 Different lowercase letters indicate significant differences 图 1 光照强度对黄酮含量的影响 Fig. 1 Effect of light intensity on flavone content |
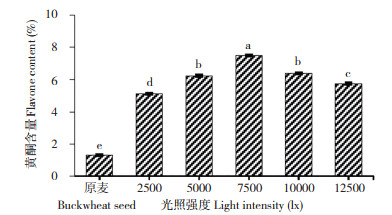
2.1.2 萌发温度对苦荞黄酮含量的影响 在萌发时间48 h、相对湿度80%、光照强度7 500 lx条件下,不同萌发温度对苦荞黄酮含量的影响如图 2所示。从图 2可以看出,适当升高萌发温度可显著提高苦荞黄酮含量,在25 ℃下黄酮含量达到最大值;但随着温度不断升高,会对苦荞种子生长发育造成影响。综上,选择萌发温度25 ℃进行后续试验。
|
| 小写英文字母不同者表示差异显著 Different lowercase letters indicate significant differences 图 2 萌发温度对黄酮含量的影响 Fig. 2 Effect of germination temperature on flavone content |
2.1.3 萌发时间对苦荞黄酮含量的影响 萌发温度25℃、相对湿度80%、光照强度7 500 lx条件下,不同萌发时间对苦荞黄酮含量的影响如图 3所示。从图 3可以看出,苦荞的黄酮含量随着萌发时间增加而显著提高,在萌发48 h达到峰值,此时苦荞芽粉中总黄酮含量高达7.65%,48~56 h逐渐趋于平缓,表明芽粉中活性成分的合成积累主要发生在萌发初期。综上,选择萌发时间48 h进行后续试验。
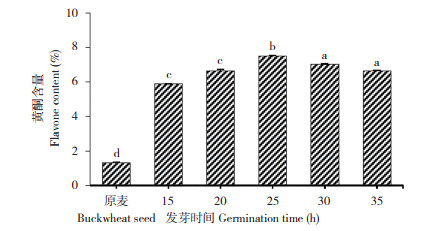
|
| 小写英文字母不同者表示差异显著 Different lowercase letters indicate significant differences 图 3 萌发时间对黄酮含量的影响 Fig. 3 Effect of germination time on flavone content |
2.1.4 相对湿度对苦荞黄酮含量的影响 在萌发温度25 ℃、萌发时间48 h、光强7 500 lx条件下,不同相对湿度对苦荞黄酮含量的影响如图 4所示,当相对湿度由65% 提高至80% 时,苦荞黄酮含量显著提高并达到峰值,相对湿度80%~85% 黄酮含量无显著变化。综上,选择相对湿度80% 进行后续试验。
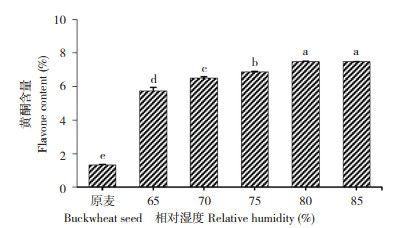
|
| 小写英文字母不同者表示差异显著 Different lowercase letters indicate significant differences 图 4 相对湿度对黄酮含量的影响 Fig. 4 Effect of relative humidity on flavone content |
2.2 苦荞萌发工艺的正交试验
在单因素试验基础上,选用L9(34)正交试验设计,优化影响苦荞黄酮含量的萌发条件。由表 2极差分析结果可以看出,4个因素对苦荞黄酮含量影响的主次顺序为C > A > B > D,即萌发时间对苦荞黄酮含量影响较大,光照强度和萌发温度次之,相对湿度对苦荞黄酮含量影响相对较小。由K值可以看出A2B2C2D2为最优组合,因此苦荞最优萌发工艺为萌发温度25℃、萌发时间48 h、光照强度7 500 lx、相对湿度80%。在此最佳工艺条件下,萌发苦荞黄酮含量为7.489%,较原麦(1.562%)高5.927个百分点。
|
2.3 苦荞萌发前后的黄酮化合物种类测定结果
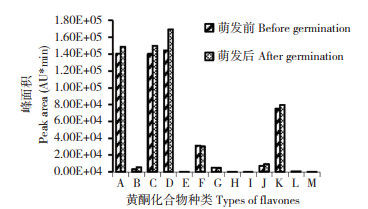
在萌发时间48 h、光照强度7 500 lx、萌发温度25℃、相对湿度80% 的最优萌发工艺条件下,苦荞萌发结果见图 5,萌发前后苦荞的主要黄酮类化合物包括金丝桃苷、芦丁、异槲皮苷、4'-O-葡萄糖苷牡荆素、山奈酚3- 葡萄糖鼠李糖苷、槲皮素、木犀草素、异鼠李素、橙黄决明素-β-D-葡萄糖苷、棕矢车菊素、异鼠李素-3- 邻甲基橙皮苷、山奈酚-3-O- 芸香苷以及山奈酚-7-O-β-D- 吡喃葡萄糖苷,萌发后苦荞中的4'-O- 葡萄糖苷牡荆素、异槲皮苷、金丝桃苷、芦丁、异鼠李素-3- 邻甲基橙皮苷和棕矢车菊素含量显著提高,槲皮素含量显著降低。可见,苦荞经过萌发后,除槲皮素外的各类黄酮化合物峰面积均有明显升高,总黄酮含量显著提高。因此,萌发可以增加苦荞中黄酮化合物的含量,进而提高苦荞的抗氧化能力。
|
| A~M分别为金丝桃苷、芦丁、异槲皮苷、4'-O-葡萄糖苷牡荆素、山奈酚3-葡萄糖鼠李糖苷、槲皮素、木犀草素、异鼠李素、橙黄决明素β-D-葡萄糖苷、棕矢车菊素、异鼠李素-3- 邻甲基橙皮苷、山奈酚-3-O- 芸香苷、山奈酚-7-O-β-D- 吡喃葡萄糖苷 A-M represent hyperoside, rutin, isoquercitrin, 4'-O-glucosylvitexin, kaempferol 3-glucorhamnoside, quercetin, luteolin, isorhamnetin, aurantio-obtusin beta-D-glucoside, jaceosidin, isorhamnetin-3-O-nehesperidine, kaempferol-3-O-rutinoside, kaempferol-7-O-beta-D-glucopyranoside, respectively 图 5 苦荞萌发前后黄酮类化合物峰面积的变化 Fig. 5 Changes of peak areas of Fagopyrum tataricum flavones before and after germination |
2.4 苦荞萌发前后的抗氧化活性测定结果
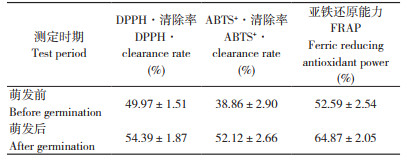
在萌发温度25℃、萌发时间48 h、光照强度7 500 lx、相对湿度80% 的最优萌发工艺条件下萌发,苦荞的抗氧化活性见表 3。由表 3可知,苦荞萌发后,DPPH·自由基清除率、ABTS+·自由基清除率以及亚铁还原能力均显著提高,表明萌发能够提高其抗氧化活性。苦荞抗氧化活性提高可能与萌发过程中各种内源酶被激活导致黄酮类化合物含量变化有关,同时也与黄酮类化合物种类有关,不同种类黄酮类化合物对抗氧化活性的贡献需进一步研究[21]。
|
3 讨论
目前,苦荞萌发工艺研究主要集中在以萌芽特性(发芽势、萌芽率、芽长)为指标的工艺优化方面,通过控制萌发条件提高苦荞萌发率、增强苦荞萌发活力[22-23],但以功能性成分为衡量指标的工艺优化研究相对较少。本研究基于苦荞萌发过程中黄酮类化合物的积累,探讨了萌发时间、光照强度、萌发温度和相对湿度4个因素对苦荞萌发前后黄酮化合物种类和含量的影响。本研究获得的产品为苦荞芽,与吴志伟[24]、赵佳利等[25]研究的苦荞芽菜有所区别,但环境因素影响的结果相似。本研究中,除萌发时间外,光照强度是影响苦荞黄酮积累的显著因素之一。研究表明,黄酮的合成与苯丙环代谢密切相关,光照通过影响苯丙氨酸解氨酶(PAL)的活性促进苯丙环代谢,进而提高苦荞黄酮含量[26]。也有研究表明,光照与否对苦荞总黄酮含量影响不大,但避光条件培养的芽重、胚轴和胚根长度都优于光照条件[27],这可能与选取的光照条件有关。
本研究测定的苦荞萌发后总黄酮含量达到7.489%,与童晓萌等[8]、许先猛等[28]测得的黄酮含量(10.34 mg/g和62.6 mg/g)相比,本萌发工艺得到的黄酮含量较高,具有显著优势。本研究中,苦荞萌发前后黄酮类化合物的种类不变,主要包括4'-O- 葡萄糖苷牡荆素、金丝桃苷、异槲皮苷、槲皮素和异鼠李素-3- 邻甲基橙皮苷,与许先猛等[28]研究的黄酮种类有所差异。对比前人相关研究,不同品种和产地的苦荞中含有的黄酮种类有所差异。例如,徐宝才等[29]采用的四川苦荞中主要含有槲皮素-3- 芸香糖葡萄糖苷、芦丁、山奈酚-3- 芸香糖苷和槲皮素,而闫超等[30]研究的内蒙古苦荞中的黄酮主要包括芦丁和少量的槲皮素、儿茶素、表儿茶素和山奈酚。
本研究比较了苦荞萌发前后的抗氧化性变化,通过DPPH自由基清除率、ABTS自由基清除率和亚铁还原能力的体外抗氧化指标进行测定,应进一步通过测定体内抗氧化活性解释苦荞黄酮的抗氧化机理。此外,可以研究苦荞黄酮种类与抗氧化性的相关性,后续通过特定黄酮的调控,更大程度提高苦荞黄酮的抗氧化性。从种子萌发过程代谢途径方面来看,不同萌发时期所涉及的黄酮代谢途径可能有一定差异。因此,进一步研究苦荞萌发过程中的代谢途径,通过调控促进苦荞功能性成分合成,对深入研究苦荞种子萌发的调控机制具有重要意义。
4 结论本研究通过单因素试验考察了萌发时间、光照强度、萌发温度和相对湿度对苦荞萌发的总黄酮含量的影响,除萌发时间外,光照强度是影响黄酮积累的主要因素。通过正交试验优化后,苦荞最佳萌发工艺为萌发时间48 h、光照强度7 500 lx、萌发温度25℃、相对湿度80%,在此条件下,苦荞总黄酮含量达7.489%,比苦荞原麦黄酮含量1.562% 提高了5.927个百分点。萌发前后,苦荞中主要的黄酮化合物种类不变,主要包括4'-O-葡萄糖苷牡荆素、异槲皮苷、槲皮素、金丝桃苷、芦丁、异鼠李素-3- 邻甲基橙皮苷和棕矢车菊素,除槲皮素外其他种类均有提升。萌发后苦荞的抗氧化活性显著提高,DPPH自由基清除率由萌发前49.97% 提高到54.39%,ABTS自由基清除率由38.86% 提高到52.12%,FRAP由萌发前的52.59% 提高到64.87%。
| [1] |
范昱, 丁梦琦, 张凯旋, 唐宇, 方沩, 杨克理, 张宗文, 程剑平, 周美亮. 中国野生荞麦种质资源概况与利用进展[J]. 植物遗传资源学报, 2020, 21(6): 1395-1406. DOI:10.13430/j.cnki.cnki.jpgr.20200317002 FAN Y, DING M Q, ZHANG K X, TANG Y, FANG W, YANG K L, ZHANG Z W, CHENG J P, ZHOU M L. Overview and utilization of wild germplasm resources of the genus Fagopyrum mill in China[J]. Journal of Plant Genetic Resources, 2020, 21(6): 1395-1406. DOI:10.13430/j.cnki.cnki.jpgr.20200317002 |
| [2] |
吴曹阳, 梁诗涵, 邱军, 高金锋, 高小丽, 王鹏科, 冯佰利, 杨璞. 基于连续12年国家苦荞区域试验的中国苦荞品种选育现状分析[J]. 中国农业科学, 2020, 53(19): 3878-3894. DOI:10.3864/j.issn.0578-1752.2020.19.003 WU C Y, LIANG S H, QIU J, GAO J F, GAO X L, WANG P K, FENG B L, YANG P. An examination on breeding status quo of Chinese tartary buckwheat varieties based on the national cross-country tests of tartary buckwheat varieties in China over 12 consecutive years[J]. Scientia Agricultura Sinica, 2020, 53(19): 3878-3894. DOI:10.3864/j.issn.0578-1752.2020.19.003 |
| [3] |
贾瑞玲, 赵小琴, 南铭, 陈富, 刘彦明, 魏立平, 刘军秀, 马宁. 64份苦荞种质资源农艺性状遗传多样性分析与综合评价[J]. 作物杂志, 2021(3): 19-27. DOI:10.16035/j.issn.1001-7283.2021.03.003 JIA R L, ZHAO X Q, NAN M, CHEN F, LIU Y M, WEI L P, LIU J X, MA N. Genetic diversity analysis and comprehensive evaluation of agronomic characters of 64 tartary buckwheat germplasm resources[J]. Crop Journal, 2021(3): 19-27. DOI:10.16035/j.issn.1001-7283.2021.03.003 |
| [4] |
李笑梅. 大豆萌发工艺条件及成分含量变化研究[J]. 食品科学, 2010, 31(16): 29-32. LI X M. Optimization of technological conditions for soybean germination and change in chemical composition during germination[J]. Food Science, 2010, 31(16): 29-32. |
| [5] |
茹万飞. 不同萌发条件及成熟度对花生芽营养成分及白藜芦醇含量的研究[D]. 沈阳: 辽宁大学, 2018. RU W F. Study on different germination conditions and maturity of peanut bud nutrients and resveratrol content[D]. Shenyang: Liaoning University, 2018. |
| [6] |
高立城, 夏美娟, 白文明, 李忠豪, 王鹏科, 高金锋. 甜荞和苦荞萌发过程中营养成分分析[J]. 营养学报, 2019, 41(6): 617-619. DOI:10.13325/j.cnki.acta.nutr.sin.2019.06.018 GAO L C, XIA M J, BAI W M, LI Z H, WANG P K, GAO J F. Nutritional analysis of common buckwheat and tartary buckwheat during germination[J]. Journal of Nutrition, 2019, 41(6): 617-619. DOI:10.13325/j.cnki.acta.nutr.sin.2019.06.018 |
| [7] |
高芬, 王宇婷, 石磊. 荞麦发芽过程中植酸含量变化的研究[J]. 农产品加工, 2019(13): 59-61, 66. DOI:10.16693/j.cnki.1671-9646(X).2019.07.016 GAO F, WANG Y T, SHI L. Study on the change of phytic acid content in buckwheat germination process[J]. Farm Products Processing, 2019(13): 59-61, 66. DOI:10.16693/j.cnki.1671-9646(X).2019.07.016 |
| [8] |
童晓萌, 柴春祥, 王永强. 萌发对苦荞籽粒品质的影响及工艺优化[J]. 食品与机械, 2021, 37(4): 176-183. DOI:10.13652/j.issn.1003-5788.2021.04.033 TONG X M, CHAI C X, WANG Y Q. Effect of germination on grain quality of tartary buckwheat and optimization of technology[J]. Food & Machinery, 2021, 37(4): 176-183. DOI:10.13652/j.issn.1003-5788.2021.04.033 |
| [9] |
杨柳. 苦荞的萌发工艺及萌发苦荞黄酮提取纯化的工艺研究[D]. 太谷: 山西农业大学, 2014. YANG L. The research on germination process of buckwheat and the extraction purification technology about the germinated buckwheat flavonoids[D]. Taigu: Shanxi Agricultural University, 2014. |
| [10] |
马辉, 卞紫秀, 陈雪怡, 储钰, 王顺民. 微波协同L-phe处理对萌发苦荞中主要营养成分的影响[J]. 安徽工程大学学报, 2019, 34(6): 1-7. MA H, BIAN Z X, CHEN X Y, CHU Y, WANG S M. Effects of microwave assisted L-phe treatment on main nutrients in germinating tartary buckwheat[J]. Journal of Anhui Polytechnic University, 2019, 34(6): 1-7. |
| [11] |
李晓丹, 王莉, 王韧, 陈正行. 金属盐离子对苦荞萌发及其总黄酮含量的影响[J]. 中国粮油学报, 2012, 27(10): 26-31. DOI:10.3969/j.issn.1003-0174.2012.10.006 LI X D, WANG L, WANG R, CHEN Z X. Effects of metal salt ions on germination and total flavonoids content of tartary buckwheat[J]. Journal of the Chinese Cereals and Oils Association, 2012, 27(10): 26-31. DOI:10.3969/j.issn.1003-0174.2012.10.006 |
| [12] |
BAO T, WANG Y, LI Y T, GOWD V, NIU X H, YANG H Y, CHEN L S, CHEN W, SUN C D. Antioxidant and antidiabetic properties of tartary buckwheat rice flavonoids after in vitro digestion[J]. Journal of Zhejiang University-Science B(Biomed & Biotechnol), 2016, 17(12): 941-951. |
| [13] |
吕兵兵, 姚攀锋, 王官凤, 李成磊, 赵海霞, 王晓丽. 光周期对苦荞芽菜生长与品质的影响[J]. 西北植物学报, 2019, 39(10): 1785-1794. DOI:10.7606/j.issn.1000-4025.2019.10.178 LYU B B, YAO P F, WANG G F, LI C L, ZHAO H X, WANG X L. Effects of photoperiod on growth and quality of tartary buckwheat sprouts[J]. Acta Botanica Boreali-Occidentalia Sinica, 2019, 39(10): 1785-1794. DOI:10.7606/j.issn.1000-4025.2019.10.178 |
| [14] |
崔琳琳, 周一鸣, 季红斌, 唐文, 周小理. 不同光质对苦荞萌发过程中的黄酮类化合物及其抗氧化活性的影响[J]. 食品工业科技, 2016, 37(6): 104-108. DOI:10.13386/j.issn1002-0306.2016.06.012 CUI L L, ZHOU Y M, JI H B, TANG W, ZHOU X L. Effects of light quality on flavonoids and antioxidant properties of germinated tartary buckwheat[J]. Science and Technology of Food Industry, 2016, 37(6): 104-108. DOI:10.13386/j.issn1002-0306.2016.06.012 |
| [15] |
王珺儒, 易倩, 帖青清, 彭镰心, 赵钢. 不同光质对苦荞芽黄酮类物质及抗氧化活性的影响[J]. 食品科技, 2019, 44(5): 213-218. DOI:10.13684/j.cnki.spkj.2019.05.039 WANG J R, YI Q, TIE Q Q, PEN L X, ZHAO G. Effect on flavonoids and antioxidant activity of the bud of tartary buckwheat after treatment of different LED light sources[J]. Food Science and Technology, 2019, 44(5): 213-218. DOI:10.13684/j.cnki.spkj.2019.05.039 |
| [16] |
张强, 李艳琴. 苦荞菜中总黄酮的测定[J]. 食品与药品, 2007(4): 24-25. ZHANG Q, LI Y Q. Determination of total flavonoids from tartary buckwheat[J]. Food and Drug, 2007(4): 24-25. |
| [17] |
GORJANOVIĆ S, KOMES D, PASTOR F T, BELŠČAK-CVITANOVIĆ A, PEZO L, HEČIMOVIĆ I, SUŽNJEVIĆ D. Antioxidant capacity of teas and herbal infusions: polarographic assessment[J]. Journal of Agricultural and Food Chemistry, 2012, 60(38): 9573-9580. DOI:10.1021/jf302375t |
| [18] |
KIM H J, TSOY I, PARK J M, CHUNG J I, SHIN S C, CHANG K C. Anthocyanins from soybean seed coat inhibit the expression of TNF-α-induced genes associated with ischemia/reperfusion in endothelial cell by NF-KB-dependent pathway and reduce rat myocardial damages incurred by ischemia and reperfusion in vivo[J]. FEBS Letters, 2006, 580(5): 1391-1397. DOI:10.1016/j.febslet.2006.01.062 |
| [19] |
OH J, JO H, CHO A R, KIM S J, HAN J. Antioxidant and antimicrobial activities of various leafy herbal teas[J]. Food Control, 2013, 31(2): 403-409. DOI:10.1016/j.foodcont.2012.10.021 |
| [20] |
LU X N, ROSS C F, POWERS J R, POWERS D E A, BARBARA A R. Determination of total phenolic content and antioxidant activity of garlic (Allium sativum) and elephant garlic (Allium ampeloprasum) by attenuated total reflectance fourier transformed infrared spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2011, 59(10): 5215-5221. DOI:10.1021/jf201254f |
| [21] |
黄元射, 何绍红, 张启堂. 高黄酮苦荞品系的筛选[J]. 广东农业科学, 2012, 39(18): 20-22. DOI:10.16768/j.issn.1004-874X.2012.18.046 HUANG Y S, HE S H, ZHANG Q T. Selection on highflavonoids producing Fagopyrum tataricum[J]. Guangdong Agricultural Sciences, 2012, 39(18): 20-22. DOI:10.16768/j.issn.1004-874X.2012.18.046 |
| [22] |
李晓丹. 苦荞胁迫萌发及功能性成分的研究[D]. 无锡: 江南大学, 2013. LI X D. Study on tartary buckwheat germination in stress and its functional components[D]. Wuxi: Jiangnan University, 2013. |
| [23] |
王小松, 万燕, 乐梨庆, 安琪, 公续霄. 赤霉素对铅胁迫下苦荞种子萌发及幼苗生理特性的影响[J]. 山西农业科学, 2021, 49(11): 1269-1273. DOI:10.3969/j.issn.1002-2481.2021.11.04 WANG X S, WAN Y, YUE L Q, AN Q, GONG X X. Effects of gibberellin on seed germination and seedling physiological characteristics of tartary buckwheat under lead stress[J]. Journal of Shanxi Agricultural Sciences, 2021, 49(11): 1269-1273. DOI:10.3969/j.issn.1002-2481.2021.11.04 |
| [24] |
吴志伟. 苦荞芽苗菜培养条件的优化及其品质分析[D]. 成都: 成都大学, 2021. DOI: 10.27917/d.cnki.gcxdy.2021.000172. WU Z W. Optimization on culture conditions of tartary buckwheat sprouts and its quality analysis[D]. Chengdu: Chengdu University, 2021. DOI: 10.27917/d.cnki.gcxdy.2021.000172.cnki.gcxdy.2021.000172. |
| [25] |
赵佳利, 张晓娜, 黄娟, 李洪有, 石桃雄, 陈庆富, 邓娇. 两种光照处理下苦荞芽菜的代谢物分析[J]. 植物科学学报, 2019, 37(6): 808-819. DOI:10.11913/PSJ.2095-0837.2019.60808 ZHAO J L, ZHANG X N, HUANG J, LI H Y, SHI T X, CHEN Q F, DENG J. Metabolite analysis of Fagopyrum tataricum(L.) gaertner sprouts treated by two kinds of illumination[J]. Plant Science Journal, 2019, 37(6): 808-819. DOI:10.11913/PSJ.2095-0837.2019.60808 |
| [26] |
居鑫, 陈沁, 陈景斌, 陈华涛, 薛晨晨, 袁星星, 李娜, 苏娜娜, 崔瑾, 陈新. 光质对小豆芽苗菜生长和类黄酮的影响及其机理初步探究[J]. 食品工业科技, 2019, 40(16): 64-70. DOI:10.13386/j.issn1002-0306.2019.16.011.j.issn1002-0306.2019.16.011 JU X, CHEN Q, CHEN J B, CHEN H T, XUE C C, YUAN X X, LI N, SU N N, CUI J, CHEN X. Effects of light quality on growth and flavonoids of Adzuki bean sprouts and its preliminary mechanism[J]. Science and Technology of Food Industry, 2019, 40(16): 64-70. DOI:10.13386/j.issn1002-0306.2019.16.011.j.issn1002-0306.2019.16.011 |
| [27] |
张玉梅, 卢红梅, 陈莉, 何星, 张贵花, 张丽. 光照与否对苦荞芽苗的影响[J]. 食品科技, 2018, 43(6): 183-188. DOI:10.13684/j.cnki.spkj.2018.06.034 ZHANG Y M, LU H M, CHEN L, HE X, ZHANG G H, ZHANG L. Effect of light or not on sprout of buckwheat[J]. Food Science and Technology, 2018, 43(6): 183-188. DOI:10.13684/j.cnki.spkj.2018.06.034 |
| [28] |
许先猛, 卞紫秀, 王顺民, 陆宁, 张慧敏, 王俊珍. 微波协同L-苯丙氨酸处理对苦荞萌发中黄酮的影响[J]. 食品工业科技, 2022, 43(5): 191-198. DOI:10.13386/j.issn1002-0306.2021060227 XU X M, BIAN Z X, WANG S M, LU N, ZHANG H M, WANG J Z. Effects of microwave-assisted L-phenylalanine treatment on the flavonoids of tartary buckwheat during germination[J]. Science and Technology of Food Industry, 2022, 43(5): 191-198. DOI:10.13386/j.issn1002-0306.2021060227 |
| [29] |
徐宝才, 肖刚, 丁霄霖, 李丹. 液质联用分析测定苦荞黄酮[J]. 食品科学, 2003(6): 113-117. XU B C, XIAO G, DING X L, LI D. Determination of flavonoids in tartary buckwheat by LC-MS[J]. Food Science, 2003(6): 113-117. |
| [30] |
闫超, 张晶, 郭军, 张美莉, 米智慧. 内蒙古荞麦黄酮类化合物成分研究//第十二届全国营养科学大会论文汇编[C]. 北京, 2015: 167. YAN C, ZHANG J, GUO J, ZHANG M L, MI Z H. Study on flavonoids from buckwheat in Inner Mongolia//Compilation of papers of the 12th National Nutrition Science Conference[C]. Beijing, 2015: 167. |
(责任编辑 邹移光)
 2022, Vol. 49
2022, Vol. 49