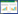文章信息
基金项目
- 国家自然科学基金(32160268);云南省教育厅科学研究基金(2022Y887)
作者简介
- 白农恩(2001—),女,哈尼族,在读本科生,研究方向为微生物生态学,E-mail:bne918666@qq.com.
通讯作者
- 杨晓燕(1977—),女,博士,教授,研究方向为微生物生态学,E-mail:yangxy@eastern-himalaya.cn.
文章历史
- 收稿日期:2022-03-13
【研究意义】叶际是指整个植物地上部分的外表面,生存在叶际表面的微生物称叶际微生物[1-3]。叶际作为一个独特的微生境,富含丰富的微生物类群,包括真菌、细菌、病毒和原生动物等[4-5]。已有研究表明,叶际微生物能够帮助植物对抗病原微生物、耐受逆境(干旱、紫外线、霜冻等)、促进营养吸收,以及调节植物代谢平衡等[6],而叶际微生物除对植物有积极影响外,也会对植物产生许多负面作用,如病原菌的积累会使植物发病[7]。因此,了解叶际微生物群落结构及其形成机制对植物健康管理和微生物资源开发具有重要意义。
【前人研究进展】叶际微生物的研究起步较晚,研究的广度和深度不如根际微生物,但叶际微生物对于植物的健康生长发育同等重要。目前根际微生物在植物健康方面的研究已经相对成熟,但对叶际微生物的研究仍然停留在探索初期[8-11]。这不仅阻碍了对植物与叶际微生物互作关系的认知,也限制了叶际微生物资源的开发与应用。细菌是自然环境中最主要的微生物类群之一,已有研究表明,植物和叶际微生物之间互相影响,双方处在一个动态平衡的过程中。相对于根际部分,叶际部分所占植物个体的比例较根际大得多,因此对于叶际微生物的研究,既有挑战也有机遇。随着叶际微生物功能(如改变宿主微环境、防御病害、生物固氮、促进植物生长等)的不断发掘,叶际细菌正逐渐被人们所关注[12-13]。
【本研究切入点】在同一小生境条件下,植物种类差异以及植物与微生物间的相互作用对叶际微生物细菌群落的影响均较大。植物自身特性对细菌群落的影响不仅反映了植物与微生物间的相互作用,还能直接反映植物的健康状况,能够为园林植物的健康管理提供具体指导。在小生境下对不同植物的叶际微生物多样性、群落组成差异等进行比较,探究叶片微生境差异对叶际细菌群落组成的影响,是亟需解决的科学问题。【拟解决的关键问题】本研究以云南省大理市大理大学古城校区一小生境为研究区域,选择我国西南片区最常见的3种园林乔木为研究对象,使用Illumina高通量测序技术对大理大学古城校区50 m半径圆内统一朝向东边栽种的3种园林植物(枇杷树Eriobotyra japonica、广玉兰Magnolia grandiflora和大青树Ficus altissima)不同大小叶片上的叶际细菌多样性和群落结构进行比较分析。该研究区域土壤为棕壤,年平均气温为14.9 ℃,年日照时数2 227.5 h,无霜期227 d,年平均降水量1 051.1 mm,属高原地方性气候,四季温差不大,干湿季分明,校园内环境条件基本一致,能够满足本研究对小生境的需求。3种园林植物中,大青树属于落叶阔叶植物,而广玉兰和枇杷树属于常绿阔叶植物。大青树叶片双面光滑富含蜡质,幼嫩部分稍被毛。广玉兰叶面蜡质最多,叶片背面有短绒毛。枇杷树叶面有褶皱,还有一层蜡质,且双面被毛。这3种植物自身显著的特性将塑造不同的叶际微生境,为本研究提供了很好的分析基础。而本研究使用的高通量测序技术能够高灵敏度、高效、准确、无偏向性、全面分析叶际细菌的多样性[14-16],是目前微生物生态学研究首选的技术之一[17-18]。综上,本研究所选择的研究对象、研究区域和试验技术均为小生境下3种园林植物叶际细菌群落结构及多样性解析提供了保障。
1 材料与方法 1.1 试验材料1.1.1 样品采集 2021年3月6日,以大理大学古城校区(25° 40' 19'' N、100° 9' 17'' E)为研究区域,选择以研究区域内最大的1棵大青树为中心,在其50 m半径圆内朝向东边再选择1棵广玉兰和1棵枇杷树,按叶片长度大小(小:5~10 cm;中:10~15 cm,大:约15 cm)进行树叶样品采集。使用无菌剪刀和镊子分别采集3种植物不同大小叶片各3份,共采集27份样品,即大青树3片大叶子dl1、dl2、dl3,3片中叶子dm1、dm2、dm3和3片小叶子ds1、ds2、ds3;广玉兰3片大叶子gl1、gl2、gl3,3片中叶子gm1、gm2、gm3和3片小叶子gs1、gs2、gs3;枇杷树3片大叶子pl1、pl2、pl3,3片中叶子pm1、pm2、pm3和3片小叶子ps1、ps2、ps3。将叶片置于一次性自封袋中,贴上标签后立即送至实验室对样品进行处理。
1.1.2 样品预处理 向装有样品的自封袋中加入25 mL PBS缓冲液(pH=8),超声洗涤1 min,涡旋10 s,再以超声清洗,涡旋2次,将洗涤液收集于50 mL无菌离心管中,重复此操作1次。将两次操作所得洗涤液置于50 mL无菌离心管中,8 000 r/min离心10 min,获得沉淀样品(液氮速冻),以干冰保存送样至深圳微科盟科技集团有限公司进行高通量测序分析。
1.2 试验方法1.2.1 DNA提取和PCR扩增 根据E.Z.N.A.® soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.)说明书提取样品总DNA,DNA浓度和纯度利用NanoDrop 2000进行检测,利用1% 琼脂糖凝胶电泳检测DNA提取质量。采用引物对338 F(5x-ACTCCTACGGGAGGCAGCAG-3x)和806 R(5x-GGACTACHVGGGTWTCTAAT-3x)对V3~V4可变区进行PCR扩增(PCR仪:ABI GeneAmp® 9700型),扩增程序为:95 ℃预变性3 min;95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s,27个循环;72 ℃延伸10 min。扩增体系为20 μL,包括4 μL 5×FastPfu缓冲液、2 μL 2.5 mmol/L dNTPs,0.8 μL 5 μmol/L引物、0.4 μL FastPfu聚合酶;10 ng DNA模板[19]。
1.2.2 PCR产物纯化和测序 使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City, CA, USA)对PCR产物进行纯化,Tris-HCl洗脱,2% 琼脂糖电泳检测。使用TruSeqDNA PCR-Free Library Preparation Kit(Axygen Biosciences, Union City, CA, USA)建库试剂盒进行文库构建,构建好的文库经Qubit定量和文库检测合格后,使用Nova Seq 6000 PE 250平台上机测序。
1.3 数据处理运用Qiitme2 dada2插件[20]对测序所得序列进行质控、修剪、去噪、拼接,以及去除嵌合体,得到扩增子测序变体表格(Amplicon Sequence Variants,ASV)。将ASV的代表序列与Greengenes数据库(http://greengenes.secondgenome.com,根据338 F、806 R引物对将数据库修剪到V3、V4区域)进行比对,得到物种的分类信息表。采用Qiime2 feature-table插件[21]剔除所有污染性的线粒体和叶绿体序列,再使用Qiime2 Core-Diversity[22-23]进行Alpha多样性、Beta多样性等分析。
2 结果与分析 2.1 3种园林植物叶际细菌群落测序文库评价本研究在供试的枇杷树、广玉兰和大青树所有叶样中共获得1 549 867条细菌的高质量序列,平均每片叶片检测到57 402条序列,各处理样品文库覆盖率均达到100%。随机抽取检测样本序列,将抽取的序列数与其代表的ASV数绘制稀释曲线,随着序列数的增加,曲线逐渐趋于稳定,继续增加检测样本没有产生更多新的ASV(图 1),说明本研究测序深度合适,可以进行后续数据分析。
|
| 图 1 3种园林植物叶际细菌群落的Alpha多样性稀释曲线 Fig. 1 Rarefaction curves of alpha diversity in phyllosphere bacterial communities of three garden plants |
2.2 3种园林植物叶际细菌群落注释比例分析
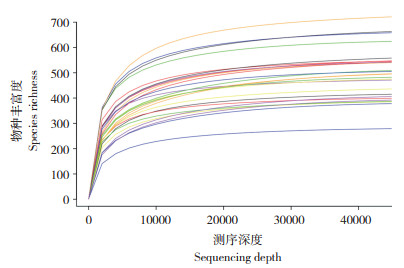
通过将ASV的代表序列与微生物参考数据库进行比对注释,得到每个ASV对应的物种分类信息,共注释到19门46纲75目148科259属141种。3种园林植物叶际细菌群落中注释到各阶元的比例如图 2所示,大青树注释到门、纲、目、科、属、种的比例依次为92.00%、87.84%、76.00%、69.06%、57.32%、25.80%,广玉兰注释到门、纲、目、科、属、种的比例依次为91.67%、84.21%、83.51%、70.56%、54.07%、22.71%,枇杷树注释到门、纲、目、科、属、种的比例依次为89.47%、89.80%、85.54%、67.97%、60.51%、22.50%。可见,3种园林植物叶际细菌群落注释到各阶元的比例均呈逐渐下降趋势。
|
| 图 2 3种园林植物叶际细菌群落在各个阶元的注释比例 Fig. 2 Annotation ratios of phyllosphere bacterial communities of three garden plants in each order |
2.3 3种园林植物叶际细菌群落组成
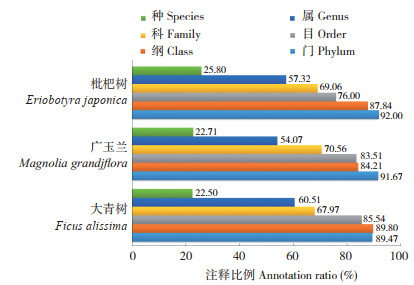
2.3.1 在门水平上的组成和群落结构分析 在大青树、广玉兰和枇杷树的叶际共注释到25个门的细菌群落(19个已知门和6个未知门),其中,变形菌门(Proteobacteria)细菌在3种园林植物叶际中占绝对优势,占比均达70% 以上,其次分别是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria);软壁菌门(Tenericutes)只在大青树和枇杷树中注释到,硝化螺旋菌门(Nitrospirae)只在大青树和广玉兰中注释到(图 3)。
|
| 图 3 3种园林植物叶际细菌群落的门水平组成 Fig. 3 Phylum level composition of phyllosphere bacterial communities of three garden plants |
2.3.2 在属水平上的组成和群落结构分析 在大青树、广玉兰和枇杷树的叶际共注释到259个属的细菌群落(图 4),排名前5的优势菌属均为鞘氨醇单胞菌属(Sphingomonas)、甲基杆菌属(Methylobacterium)、螺状菌属(Spirosoma)、薄层菌属(Hymenobacter)和无色杆菌属(Achromobacter)。其中,鞘氨醇单胞菌属在广玉兰、大青树和枇杷树的占比相差不大,分别为31.00%、23.00%、22.00%。其余属在3种植物中所占比例存在较大差异,甲基杆菌属在大青树、广玉兰和枇杷树的占比分别为50.00%、18.00%、10.00%;螺状菌属在枇杷树、广玉兰和大青树中的占比分别为25%、16%、12%;薄层菌属在枇杷树中占比最高(47%),在大青树和广玉兰中分别占比7% 和6%;无色杆菌属在枇杷树中含量最高(41%),在大青树中占比0.8%,在广玉兰中含量最高(2%)。
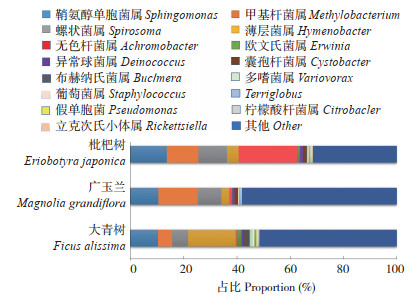
|
| 图 4 3种园林植物叶际细菌群落的属水平组成 Fig. 4 Genus level composition of phyllosphere bacterial communities of three garden plants |
由图 5可知,无色杆菌属为枇杷树的第一优势菌属,薄层菌属为大青树的第一优势菌属,甲基杆菌属为广玉兰的第一优势菌属,每种植物的第一优势菌属与其在另外两种植物的占比均明显不同。
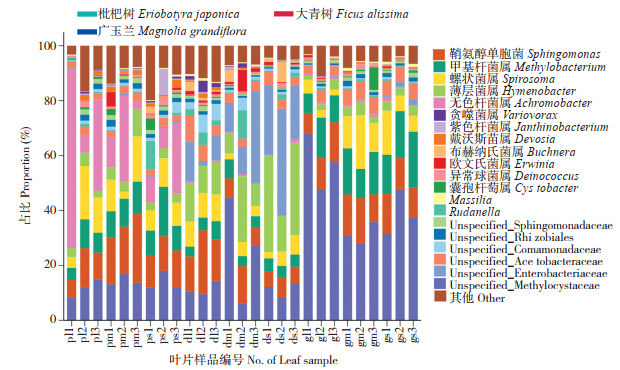
|
| 图 5 27个叶片样品叶际细菌群落的属水平组成 Fig. 5 Genus level composition of phyllosphere bacterial communities of 27 leaf samples |
2.4 3种园林植物叶际细菌群落多样性分析
2.4.1 Alpha多样性分析 3种园林植物叶际细菌群落Alpha多样性分析结果见表 1。整体上,枇杷树叶际细菌群落多样性水平高于大青树和广玉兰;广玉兰的Chao1指数、Shannon指数和Simpson指数均最小;枇杷树的Chao1指数远大于大青树,Shannon指数和Simpson指数略小于大青树。
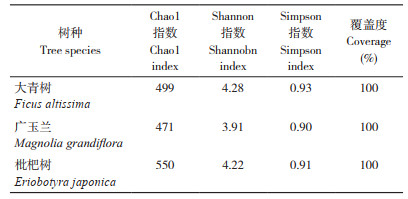
|
2.4.2 ASV统计和分类学分析 3种园林植物叶际细菌群落共有的ASV序列有454个,大青树、广玉兰和枇杷树样品中特有的ASV序列分别为808、1 462、1 623,其中广玉兰和枇杷树特有的ASV数目远大于大青树(图 6)。
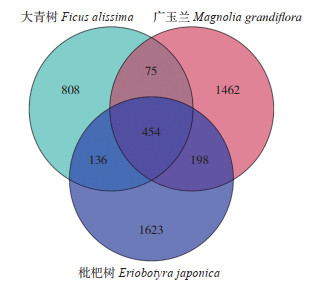
|
| 图 6 3种园林植物叶际细菌群落的ASV韦恩图 Fig. 6 ASV Venn diagrams of phyllosphere bacterial communities of three garden plants |
2.4.3 Beta多样性分析 基于Beta多样性分析的3种园林植物叶际细菌群落的NMDS分析结果(图 7)显示,大青树、广玉兰和枇杷树的叶片细菌群落明显分成3个区域,其同一植物叶片的细菌群落聚集在一起,不同植物种类的叶片细菌群落分布于不同象限。
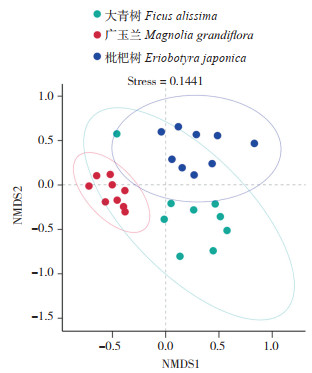
|
| 图 7 3种园林植物叶际细菌群落的NMDS分析结果 Fig. 7 NMDS analysis results of phyllosphere bacterial communities of three garden plants |
3 讨论 3.1 3种园林植物的叶际细菌群落组成和多样性存在差异
为了探究小生境条件下由园林植物自身特性造成的叶际细菌群落差异,本研究去除了空间距离、地理位置、季节、光照等环境因素对叶际微生物群落构建和多样性产生的影响[24],选择以大理大学古城校区内50 m范围内朝向东边的枇杷树、广玉兰和大青树3种园林植物的叶片为研究对象,聚焦不同植物种类的叶际细菌群落组成和多样性差异。结果表明,3种园林植物的叶际存在结构复杂多样的细菌群落,细菌多样性从高到低依次为枇杷树、广玉兰和大青树。3种园林植物的叶际细菌群落有共有的门、属,也有共有的优势门和优势属,但软壁菌门只在大青树和枇杷树中注释到,硝化螺旋菌门只在大青树和广玉兰中注释到,而广玉兰和枇杷树特有的门和属最多。NMDS分析结果表明,不同植物种类的叶际细菌群落存在差异,但同一植物不同大小叶片间的细菌群落相似,且同一植物、不同大小叶片间的第一优势菌属也一样。表明3种植物叶际细菌群落结构存在较大差异,同一植物不同大小叶片间的细菌群落相似,即同一植物的叶际微生境相似。
3.2 植物自身特性会塑造独特的叶际细菌群落已有研究发现,植物叶片蜡质层厚度的差异会影响其对微生物的吸附能力,蜡质层越厚则叶片吸附的微生物越少,反之,蜡质层越薄的叶片能吸附更多的微生物[25]。不同种类的植物叶片被毛情况不相同,被毛的多少间接影响微生物与植物的接触面积及其栖息环境,从而影响叶际微生物多样性和群落结构。本研究选取的3种园林植物中,枇杷树叶面不仅有褶皱,还有蜡质层,且双面被毛;广玉兰叶片蜡质最多,但叶片背面有短绒毛;大青树叶片双面光滑富含蜡质,幼嫩部分稍被毛。结果显示,枇杷树的Chao1指数最高,大青树次之,广玉兰最低;枇杷树和大青树叶际细菌的Shannon指数和Simpson指数无明显差异,但均高于广玉兰,说明蜡质层和被毛的有无和多少确实会影响叶际细菌群落。此外,大青树属于落叶阔叶植物,而广玉兰和枇杷树属于常绿阔叶植物,落叶植物的细菌群落构建时间短,与植物的相互作用相较于不落叶的植物也更短,因此,广玉兰和枇杷树的叶际细菌相对于大青树更多样复杂,表明植物自身特性主导了叶际细菌群落构建过程及结果,即植物自身特性会塑造独特的叶际细菌群落。
此外,通过高通量测序技术检测到的3种园林植物叶际细菌在种水平上的注释度仅占20% 左右,还存在大量未知细菌,这提示我们在未来的研究中需要继续加大纯培养力度和宏基因测序深度,从个体到群体对叶际细菌开展持续研究挖掘叶际细菌资源。
4 结论在小生境范围内,大理大学古城校区3种主要园林植物(枇杷树、广玉兰和大青树)的叶际均具有较高的细菌多样性,不同植物的叶际细菌群落组成和多样性存在较大差异,而同一植物不同大小叶片间的细菌群落则相似,植物自身特性是造成这种结果的首要原因,表明植物自身特性主导了叶际细菌群落构建的过程和结果,即植物自身特性会塑造独特的叶际细菌群落。3种园林植物叶际都具有菌株资源挖掘潜力。植物叶际细菌群落的构建过程及结果与植物的生长习性高度相关,在开展后续相关研究时需要注意植物种类的选择。
| [1] |
杨宽, 王慧玲, 叶坤浩, 王佩, 孟广云, 罗成, 郭力维. 叶际微生物及与植物互作的研究进展[J]. 云南农业大学学报(自然科学), 2021, 36(1): 155-164. DOI:10.12101/j.issn.1004-390X(n).202006048 YANG K, WANG H L, YE K H, WANG P, MENG G Y, LUO C, GUO L W. Advances in research on phyllosphere microorganisnls and their interaction with plants[J]. Journal of Yunnan Agricultural University (Natural Science), 2021, 36(1): 155-164. DOI:10.12101/j.issn.1004-390X(n).202006048 |
| [2] |
RUINEN J. Occurrence of Beijerinckia species in the phyllosphere[J]. Nature, 1956, 177(4501): 220-221. DOI:10.1038/177220a0 |
| [3] |
LINDOW S E, BRANDL M T. Microbiology of the phyllosphere[J]. Applied and Environmental Microbiology, 2003, 69(4): 1875-1883. DOI:10.1128/AEM.69.4.1875-1883.2003 |
| [4] |
刘利玲, 李会琳, 蒙振思, 彭进友, 李晓东, 彭超, 路璐, 胥晓. 青杨雌雄株叶际微生物群落多样性和结构的差异[J]. 微生物学报, 2020, 60(3): 556-569. DOI:10.13343/j.cnki.wsxb.20190230 LIU L L, LI H L, MENG Z S, PENG J Y, LI X D, PENG C, LU L, XU X. Diversity and structure of phyllosphere microbial communities of male and female poplar plants[J]. Microbiologica Sinica, 2020, 60(3): 556-569. DOI:10.13343/j.cnki.wsxb.20190230 |
| [5] |
KISHORE G K, PANDE S, PODILE A R. Biological control of late leaf spot of peanut (Arachis hypogaea) with chitinolytic bacteria[J]. Phytopathology, 2005, 95(10): 1157-1165. DOI:10.1094/PHYTO-95-1157 |
| [6] |
贾彤, 郭婷艳, 王瑞宏, 柴宝峰. 铜尾矿白羊草重金属含量对叶际和根际真菌群落的影响[J]. 环境科学, 2020, 41(11): 5193-5200. DOI:10.13227/j.hjkx.202004239 JIA T, GUO T Y, WANG R H, CHAI B F. Effects of heavy metal content on phyllosphere and rhizosphere fungal communities ofleymus chinensis from copper tailings[J]. Environmental Science, 2020, 41(11): 5193-5200. DOI:10.13227/j.hjkx.202004239 |
| [7] |
高爽, 刘笑尘, 董铮, 刘茂炎, 戴良英. 叶际微生物及其与外界互作的研究进展[J]. 植物科学学报, 2016, 34(4): 654-661. DOI:10.11913/PSJ.2095-0837.2016.40654 GAO S, LIU X C, DONG Z, LIU M Y, DAI L Y. Advances in studies of Phyllosphere Microorganisms and their interactions with the outside world[J]. Plant Science Journal, 2016, 34(4): 654-661. DOI:10.11913/PSJ.2095-0837.2016.40654 |
| [8] |
郭徐鹏. 毛白杨叶际微生物多样性及对杨树溃疡病生物防治研究[D]. 杨凌: 西北农林科技大学, 2009. GUO X P. Study on microbial diversity of phyllosphere and biological control of poplar canker disease[D]. Yangling: Northwest A & F University, 2009. |
| [9] |
刘天波, 滕凯, 周向平, 蔡海林, 肖志鹏, 肖艳松, 杨红武, 尹华群, 周志成, 易图永. 拮抗菌群对烟草野火病的防治效果及叶际微生物群落多样性的影响[J]. 微生物学通报, 2021, 48(8): 2643-2652. DOI:10.13344/j.mi-crobil.china.200844 LIU T B, TENG K, ZHOU X P, CAI H L, XIAO Z P, XIAO Y S, YANG H W, YIN H Q, ZHOU Z C, YI T Y. Effects of antagonistic bacteria on the control effect of tobacco wildfire disease and the diversity of phyllosphere microbial community[J]. Microbiology Bulletin, 2021, 48(8): 2643-2652. DOI:10.13344/j.mi-crobil.china.200844 |
| [10] |
阚望, 许姗姗, 杨太源, 刘悦, 王连春, 李红祥, 谭元花, 吴德喜, 李成云. 西双版纳热带雨林植物叶际细菌群落研究[J]. 西南农业学报, 2020, 33(3): 631-636. DOI:10.16213/j.cnki.scjas.2020.3.025 KAN W, XU S S, YANG T Y, LIU Y, WANG L C, LI H X, TAN Y H, WU D X, LI C Y. Study on bacterial community of plant iInterleaf in Xishuangbanna tropical rain forest[J]. Southwest China Journal of Agricultural Sciences, 2020, 33(3): 631-636. DOI:10.16213/j.cnki.scjas.2020.3.025 |
| [11] |
荆梦, 宿燕明, 谷立坤, 白志辉, 庄国强, 彭霞薇. 吡虫啉杀虫剂对桃树叶际微生物群落结构的影响[J]. 环境科学与技术, 2011, 34(5): 1-6. DOI:10.3969/j.issn.1003-6504.2011.05.001 JING M, SU Y M, GU L K, BAI Z H, ZHUANG G Q, PENG X W. Effects of imidacloprid insecticide on microbial community structure in peach leaves[J]. Environmental Science & Technology, 2011, 34(5): 1-6. DOI:10.3969/j.issn.1003-6504.2011.05.001 |
| [12] |
潘建刚, 呼庆, 齐鸿雁, 张洪勋, 庄国强, 白志辉. 叶际微生物研究进展[J]. 生态学报, 2011, 31(2): 583-592. DOI:10.3321/j.issn:0253-9829.2006.02.001 PAN J G, HU Q, QI H Y, ZHANG H X, ZHUANG G Q, BAI Z H. Advances in Phyllosphere microorganisms[J]. Acta Ecologica Sinica, 2011, 31(2): 583-592. DOI:10.3321/j.issn:0253-9829.2006.02.001 |
| [13] |
周凌云, 向芬, 刘红艳, 李维, 周琳, 银霞, 曾泽萱, 王振中. 茶白星病不同病情等级下叶际细菌群落多样性与功能预测[J]. 茶叶通讯, 2019, 46(1): 24-31. DOI:10.3969/j.issn.1009-525X.2019.01.005 ZHOU L Y, XIANG F, LIU H Y, LI WEI, ZHOU L, YIN X, ZENG Z X, WANG Z Z. Prediction of bacterial community diversity and function under different disease levels of tea white star disease[J]. Tea Communications, 2019, 46(1): 24-31. DOI:10.3969/j.issn.1009-525X.2019.01.005 |
| [14] |
王红阳, 康传志, 王升, 蒋待泉, 彭政, 徐扬, 杜用玺, 张燕, 刘大会, 郭兰萍. 基于高通量测序和传统培养分离方法的药用植物内生菌资源研究策略[J]. 中国中药杂志, 2021, 46(8): 1910-1919. DOI:10.19540/j.cnki.cjcmm.20210127.101 WANG H Y, KANG C Z, WANG S, JIANG D Q, PENG Z, XU Y, DU Y X, ZHANG Y, LIU D H, GUO L P. Research strategy of endophytic bacteria resources in medicinal plants based on High-throughput Sequencing and traditional culture and isolation methods[J]. China Journal of Chinese Materia Medica, 2021, 46(8): 1910-1919. DOI:10.19540/j.cnki.cjcmm.20210127.101 |
| [15] |
陈佩, 刘莹, 翟彩宁, 党辉. 基于高通量测序技术分析汉中地区泡菜水细菌多样性[J]. 中国酿造, 2021, 40(12): 93-97. DOI:10.11882/j.issn.0254-5071.2021.12.017 CHEN P, LIU Y, ZHAI C N, DANG H. Analysis of bacterial diversity in pckle water in Hanzhong region based on High-throughput Sequencing technology[J]. Brewed in China, 2021, 40(12): 93-97. DOI:10.11882/j.issn.0254-5071.2021.12.017 |
| [16] |
CALLAHAN B J, MCMURDIE P J, ROSEN M J, ANDREW W H, AMY J A J, SUSAN P H, HOLMES S P. DADA2: High-resolution sample inference from Illumina Amplicon data[J]. Nat Methods, 2016, 13(7): 581-583. DOI:10.1038/nmeth.3869 |
| [17] |
WANG L, ZHANG X, LI Y. The drivers of bacterial community underlying biogeographical pattern in mollisol area of china[J]. Ecotoxicology and Environmental Safety, 2019, 177: 93-99. DOI:10.1016/j.ecoenv.2019.03.114 |
| [18] |
白晓旭, 史荣久, 尤业明, 盛华芳, 韩斯琴, 张颖. 河南宝天曼不同林龄与林型森林土壤的细菌群落结构与多样性[J]. 应用生态学报, 2015, 26(8): 2273-2281. DOI:10.13287/j.1001-9332.20150610.003 BAI X X, SHI R J, YOU Y M, SHENG H F, HAN S Q, ZHANG Y. Soil bacterial community structure and diversity in different forest ages and forest types in Baotianman, Henan Province[J]. Chinese Journal of Applied Ecology, 2015, 26(8): 2273-2281. DOI:10.13287/j.1001-9332.20150610.003 |
| [19] |
WANG W, ZHAI S, XIA Y. Ochratoxin A induces liver inflammation: involvement of intestinal microbiota[J]. Microbiome, 2019, 7(1): 151. DOI:10.1186/s40168-019-0761-z |
| [20] |
CALLAHAN B J, MCMURDIE P J, ROSEN M J, HAN A W, JOHNSON A J, HOLMES S P. DADA2: High-resolution sample inference from Illumina amplicon data[J]. Nat Methods, 2016, 13(7): 581-583. DOI:10.1038/nmeth.3869 |
| [21] |
BOKULICH N A, KAEHLER B D, RIDEOUT J R. Optimizing taxonomic classification of marker-gene amplicon sequences with QⅡME 2's q2-feature-classifier plugin[J]. Microbiome, 2018, 6(1): 90. DOI:10.1186/s40168-018-0470-z |
| [22] |
WANG X, TSAI T, DENG F. Longitudinal investigation of the swine gut microbiome from birth to market reveals stage and growth performance associated bacteria[J]. Microbiome, 2019, 7(1): 109. DOI:10.1186/s40168-019-0721-7 |
| [23] |
BOLYEN E, RIDEOUT JR, DILLON MR. Reproducible, interactive, scalable and extensible microbiome data science using QⅡME 2[J]. Nat Biotechnol, 2019, 37(8): 852-857. DOI:10.1038/s41587-019-0209-9 |
| [24] |
沙小玲, 梁胜贤, 庄绪亮, 韩庆莉, 白志辉. 植物叶际固氮菌研究进展[J]. 微生物学通报, 2017, 44(10): 2443-2451. DOI:10.13344/j.microbiol.china.170089 SHA X L, LIANG S X, ZHUANG X L, HAN Q L, BAI Z H. Research progress of nitrogen-fixing bacteria in plant phyllosphere[J]. Microbiology Bulletin, 2017, 44(10): 2443-2451. DOI:10.13344/j.microbiol.china.170089 |
| [25] |
王聪. EGCG对苹果果实油腻化的影响[D]. 杨凌: 西北农林科技大学, 2018. WANG C. The effect of EGCG on greasiness of apple fruit[D]. Yangling: Northwest A & F University, 2018. |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49