文章信息
基金项目
- 国家自然科学基金(32001613);广东省自然科学基金(2022A1515012135,2022A1515012328);广州市科技计划项目(202102021004)
作者简介
-
周炼,遗传学博士,助理研究员,硕士生导师。从事水稻生殖发育(花药发育、减数分裂)和抗生物/非生物逆境胁迫(低温萌发、黑条矮缩病)相关领域的功能基因组学研究。主持中国博士后科学基金面上项目、国家自然科学基金青年项目、广东省自然科学基金面上项目、广州市科技计划项目等5项。参与国家自然科学基金面上项目、广东省自然科学基金面上项目等10余项。以第一作者(含并列第一作者)在Journal of Experimental Botany、Rice、New Phytologist等杂志上发表SCI论文4篇。以第一完成人获授权发明专利2件。
周炼(1987—),女,博士,助理研究员,研究方向为水稻分子遗传,E-mail:zhoulian@gdaas.cn.
通讯作者
- 赵均良(1979—),男,博士,副研究员,研究方向为水稻分子遗传,E-mail:zhao_junliang@gdaas.cn.
文章历史
- 收稿日期:2022-07-19
【研究意义】全球有超过50% 人口以水稻为主粮,水稻是我国种植面积最大、总产量最多的粮食作物。水稻生产在我国粮食生产中占有极其重要的地位,对我国粮食安全具有举足轻重的作用。然而,随着农村主要劳动力向城市转移,农村劳动力短缺已成为水稻生产中的突出问题。采取轻简化、机械化的生产方式,是解决这一问题的根本出路。水稻直播是将预萌发过的种子直接撒播到田里进行生产,具有节本、省工、高效等优势,深受农民青睐[1-2]。近年来水稻直播在全国快速发展,有助于缓解农业生产中劳动力短缺的问题。尤其是双季稻区,双季直播稻不仅灌溉用水减少,而且生育期缩短,有助于缓解两造之间衔接紧张的问题。水稻直播有湿直播、半湿直播和旱直播3种主要方式。无论哪种方式,都面临适宜直播使用的水稻品种缺乏这个共同难题。其主要原因是由于当前使用的直播稻品种多是从传统移栽品种中筛选而来,而直播所需要的耐淹水、耐低温萌发、早生快发、抗倒伏等能力往往不是传统移栽品种选育的主要目标,因此这些品种大多缺乏直播所需的关键性状,不能很好地发挥品种的产量优势。另外,我国大部分稻作区在早稻或一季稻的播种期都会遭遇“倒春寒”或“寒露风”等15℃以下的低温天气影响,本研究团队前期研究也发现广东主推优良品种中超过90% 的品种低温萌发力在10%~50%。因而,鉴定调控水稻直播关键性状的功能基因,解析其分子调控机制,运用分子辅助技术选育适合直播的品种,是解决目前水稻直播难题最有效的方法之一,对于直播稻的深入推广和应用具有重要意义。
【前人研究进展】随着水稻直播面积的扩大,育成品种低温萌发力低下、无法满足直播需要的矛盾愈发凸显,关于水稻耐低温萌发的分子遗传研究逐渐成为热点。随着分子标记技术的发展,国内外多个团队利用“双亲”遗传材料,如DH群体[3-5]、重组自交系/回交系[6-14]、杂交F 2:3群体[15-16]、染色体片段代换系[17-18]等,和自然品种[19-23]开展了水稻低温萌发力QTL的定位。据统计,迄今共鉴定出超过40个低温萌发力QTL位点,广泛分布于水稻的12条染色体,但只有位于第3染色体的qLTG3-1[7]、位于第7染色体的OsSAP16[23]和来自野生稻的LTG5[24]被成功克隆和确认功能。qLTG3-1是第一个被克隆的水稻低温萌发力基因,对耐低温萌发的贡献率达35.0%。qLTG-3-1是一个富含甘氨酸(GRP)的未知功能蛋白,根据其氨基酸序列、时空表达模式的分析以及组织切片结果,推测其可能作用于促进种胚外层包裹组织的液泡化降解,从而增强种子的低温萌发力[7]。OsSAP16是水稻18个SAP成员之一,拥有保守的A20/AN1-C2H2锌指结构域,不同品种中OsSAP16等位基因的功能差异可能来自于表达水平,提高或降低OsSAP16表达量,相应地能够增强或降低水稻低温萌发力,但其调控水稻低温萌发的分子机理仍然未知[23]。LTG5来自普通野生稻Y12-4,编码一个葡萄糖基转移酶,超表达LTG5基因可以显著地提高种子的低温萌发率[24],但其分子机制尚不清楚。
【本研究切入点】基因的表达情况往往与其功能高度相关。随着组学测序的兴起,利用多组学数据相结合能够快速地锁定QTL定位区间的候选基因。Mao等[25]、Yang等[26]利用全基因组关联分析(GWAS)和转录组测序相结合,将QTL位点的候选基因缩小到两个基因。Yang等[27]在GWAS的基础上结合单倍体型分析和基因表达数据,快速地将候选基因锁定到两个基因的范围。本研究以已获得的水稻低温萌发转录组测序数据为切入点,深入分析、挖掘新的水稻低温萌发调控基因及其分子作用机理,筛选到一个差异表达基因OsYIPL1,通过构建OsYIPL1过表达遗传转化材料,结合其萌发相关表型,探究OsYIPL1在调控水稻低温萌发中的功能。【拟解决的关键问题】本研究拟克隆新的水稻低温萌发力相关基因,进一步解析其分子调控机理,为水稻低温萌发品种改良和分子育种提供新的理论基础。
1 材料与方法 1.1 试验材料1.1.1 供试材料 日本晴(Nip)由本实验室自行繁殖和保存。遗传转化所用的受体亲本日本晴由武汉伯远生物科技有限公司提供。萌发试验所用的野生型及转基因材料于2021年早季种植于广东省农业科学院南区试验基地,3月4日播种,4月8日移栽,每个株系种植2行,每行8株,株行距为19.8 cm×19.8 cm,采用常规栽培和水肥管理。种子于7月上旬收获,晒干后室温存储3个月,用于常温和低温萌发力评价。
1.1.2 供试载体及样品 pOX载体由华南农业大学遗传工程实验室改造及保存,是在pCAMBIA1300骨架上将35S启动子替换为水稻Ubiquitin启动子。转录组测序数据分析流程详情见Yang等[26]验证所用RNA样品为转录组测序备份样品。R1、R2为高LTG品种,S1、S2为低LTG品种。T0、T1、T2和T3分别为低温萌发0、48、96、144 h等处理阶段。
1.2 试验方法1.2.1 萌发试验 每个水稻品系取300粒饱满的种子置于49 ℃恒温箱处理96 h以打破休眠。常温浸种24 h,蒸馏水冲洗3~5次,每50粒种子均匀放置于铺有滤纸的9.0 cm培养皿中,加5 mL蒸馏水,分别置于28 ℃和13 ℃人工气候箱中进行萌发试验,每个处理3次重复。以芽长≥ 2 mm作为萌发标准,28 ℃每天统计种子的萌发势,共统计5 d;13 ℃每隔一天统计种子的低温萌发势,连续观察10 d。以萌发势作为衡量种子萌发能力的指标。
1.2.2 RNA提取、反转录及qRT-PCR检测 根据试验设计分别选取新鲜的种胚、叶片等材料,迅速投入液氮冻存,经机械研磨成细粉状,按照植物总RNA小提试剂盒B(Magen,R4151-02B)的操作流程获得各组织的总RNA。用PrimeScript™ RT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒(TAKARA,RR047A)合成cDNA。设计OsYIPL1特异的定量引物(Q-F,GCCTACCTCTTCGACCACG;Q-R,CCGTATGCAGTCCGGTCATC),使用MagicSYBR Mixture(康为世纪,CW3008)试剂和CFX96PCR扩增仪(Bio-Rad)进行PCR扩增,反应程序为:95 ℃ 3 min;95 ℃ 10 s,57 ℃ 20 s,72 ℃ 20 s,读板,共40个循环;以OsUBI作为内参(UbiQF,ACCACTTCGACCGCCACTACT;Ubi-QR,ACGCCTAAGCCTGCTGGTT),对CT值进行计算分析,获得检测样品中OsYIPL1的相对表达情况。
1.2.3 载体构建及遗传转化 以日本晴种胚cDNA为模板,用引物pOX-F(acttctgcagggtacATGGGGCTGCTGTTCGTG)和pOX-R(aacgcgtactagtaagctTCACCGGGCTTCTTTCCAC)(划线序列为pOX载体序列)扩增OsYIPL1的CDS全长。pOX载体用Kpn Ⅰ和Hind Ⅲ双酶切后回收,与OsYIPL1扩增产物用ClonExpress Ⅱ One Step Cloning Kit(诺唯赞,C112-01)通过同源重组连接,转化大肠杆菌DH10B感受态,涂布于LB/Kan平板。阳性克隆经测序鉴定后,提取质粒。正确的pOX-YIPL1质粒寄送到武汉伯远生物科技有限公司,委托其进行后续的遗传转化。
1.2.4 转基因植株的鉴定 取转基因苗和对照日本晴的叶片,分别提取gDNA和总RNA。用潮霉素特异引物Hpt-F(ATTTGTGTACGCCCGACAGT)和Hpt-R(GTGCTTGACATTGGGGAGTT),以转基因植株gDNA为模板,检测转化载体的存在。总RNA按照1.2.2的方法,检测OsYIPL1的表达量,筛选真正的过表达株系。
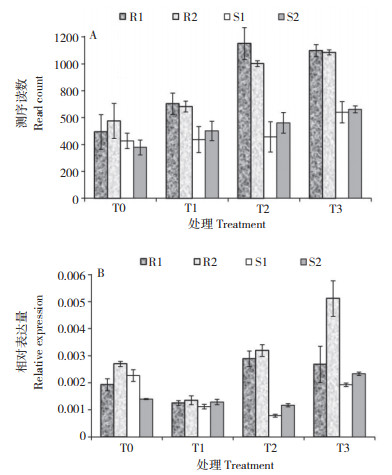
2 结果与分析 2.1 OsYIPL1是水稻低温萌发差异表达基因在Yang等[26]研究基础上,利用已获得的不同水稻品种、低温萌发转录组测序数据,筛选到另一个差异表达基因LOC_Os10g22410。其基因注释是与果蝇Yippee基因[28]同源的锌指结合蛋白编码基因,本研究将其命名为OsYIPL1(Yippeelike 1)。转录组数据显示(图 1A),在种子萌发中后期,高LTG品种(R1、R2)中OsYIPL1的表达量显著高于低LTG品种(S1、S2),尤其是低温萌发96 h后的T2阶段,差异达到2.1倍。实时荧光定量RT-PCR的结果(图 1B)同转录组测序结果一致,低温萌发96 h后高LTG品种中OsYIPL1的表达量平均是低LTG品种的3.1倍,证明OsYIPL1确实在高LTG品种的低温萌发过程中表达更高。
|
| A:转录组测序数据;B:qRT-PCR验证数据;R1、R2:高LTG品种;S1、S2:低LTG品种 A: RNA-seq data; B: qRT-PCR verification data; R1 and R2: high LTG accessions; S1 and S2: low LTG accessions 图 1 OsYIPL1在不同水稻品种低温萌发过程中的表达变化 Fig. 1 Expression changes of OsYIPL1 in different rice accessions during low-temperature germination |
2.2 OsYIPL1的时空表达模式
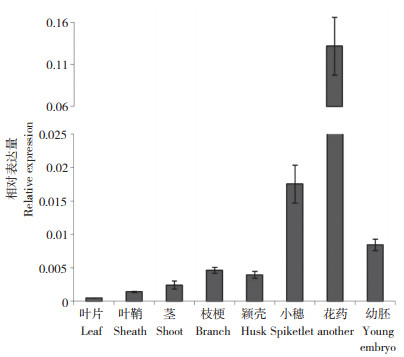
为研究OsYIPL1的生物学功能,首先探索其在不同水稻组织中的时空表达模式。以日本晴的叶片、叶鞘、茎、枝梗、颖壳、小穗(颖花)、花药和幼胚(授粉后7 d)为组织材料,水稻OsUBI基因为内参,OsYIPL1的CDS序列148~226区段的特异扩增片段(引物Q-F/R)为目标,检测其相对表达情况。结果显示(图 2),OsYIPL1在叶片中的表达量最低,其次是叶鞘、茎和枝梗,在生殖器官小穗、花药、幼胚中的表达量较高。其中在小穗、花药和幼胚中表达量分别是其在叶片的35、265和17倍。
|
| 图 2 OsYIPL1在不同水稻组织中的时空表达模式 Fig. 2 Temporal and spacial expression pattern of OsYIPL1 in different rice tissues |
2.3 OsYIPL1超表达株系的检测
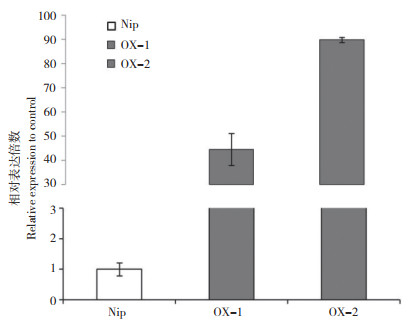
以日本晴为受体材料,利用pOX载体过量表达OsYIPL1,T 0代共获得6株转化阳性植株。通过定量检测,其中有两株OX-1和OX-2中OsYIPL1的表达量是对照野生型的44.5和89.8倍(图 3)。OX-1和OX-2便作为OsYIPL1超表达株系,用于后续试验。
|
| Nip为转化受体材料,阴性对照 Nip is the transformation receptor material, as the negative control 图 3 OsYIPL1转基因株系的表达量检测 Fig. 3 Detection of expression level of OsYIPL1 in transgenic lines |
2.4 OsYIPL1调控水稻种子萌发
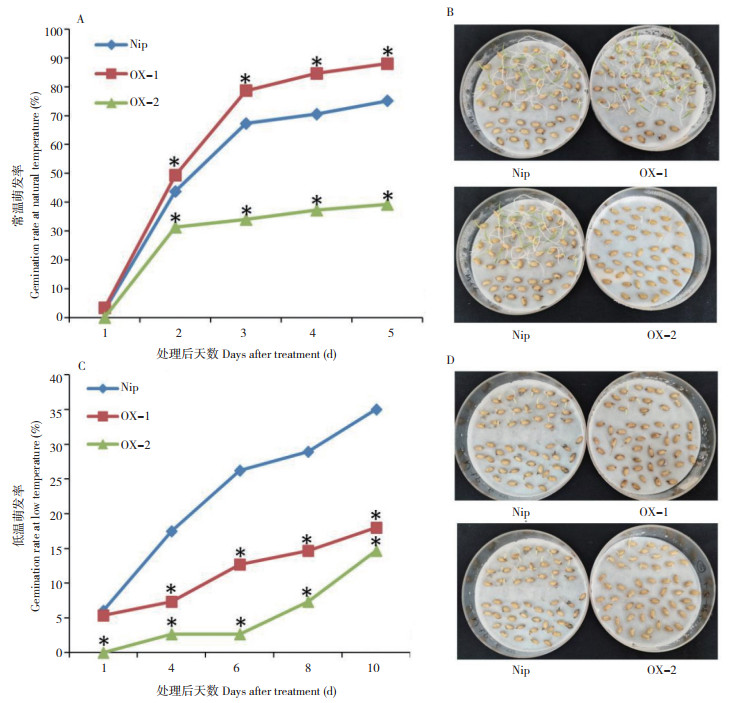
为进一步研究OsYIPL1超表达对于水稻种子萌发的影响,以同时收获的日本晴野生型和OX-1、OX-2转基因T 2代成熟种子为材料,进行常温(28℃)和低温(13℃)萌发试验。结果表明,在常温下(图 4A、B)OX-1比野生型萌发快,且每日的萌发率都高于对照:处理后1 d比对照提高24.9%,处理后2 d提高12.8%,处理后3 d提高16.9%,处理后4 d提高20.0%,处理后5 d提高17.2%,平均比对照提高18.3%;而OX-2则相反,处理后5 d,仍然只有39.2% 的种子萌发,萌发率远远低于对照:处理后1 d下降100%,处理后2 d下降28.2%,处理后3 d下降49.5%,处理后4 d下降47.2%,处理后5 d下降47.8%,平均下降54.54%。在低温下(图 4C、D),OX-1和OX-2的萌发率都低于对照,且OX-2降低得更多,OX-1的低温萌发率比对照平均下降43.8%,OX-2比对照平均下降81.5%。表明适当提高OsYIPL1的表达水平(如OX-1),可以促进常温下水稻种子萌发,过高则抑制(如OX-2);过表达OsYIPL1会抑制低温下水稻种子萌发,且这种抑制随OsYIPL1表达量的升高而增强。
|
| A:对照Nip和过表达株系OX-1、OX-2常温萌发的逐日萌发率;B:对照Nip和过表达株系OX-1、OX-2常温处理后5 d的种子表现;C:对照Nip和过表达株系OX-1、OX-2低温萌发的隔日萌发率;D:对照Nip和过表达株系OX-1、OX-2低温处理后10 d的种子表现 A: Daily germination ratios of Nip and the two over-expression lines, OX-1 and OX-2, at normal temperature (28 ℃); B: Seeds performance of Nip and the two over-expression lines, OX-1 and OX-2, after germination for five days at normal temperature; C: Germination ratios of Nip and the two over-expression lines, OX-1 and OX-2, recorded every two days at normal temperature (28 ℃); D: Seeds performance of Nip and the two over-expression lines, OX-1 and OX-2, after germination for ten days at low temperature 图 4 OsYIPL1过表达株系T2代种子在常温和低温下的萌发结果 Fig. 4 Germination results of the T2 generation seeds of OsYIPL1 over-expression lines at normal and low temperatures |
3 讨论 3.1 提高直播稻成苗率的方法
“出苗、防草、抗倒”是水稻直播适应性的3个重要方面[29]。为提高直播稻的成苗率,尤其是低温、低氧条件下的萌发率,常用的措施有种子播前处理和种子包衣。研究表明,种子播前用50 mol/L亚硒酸钠或100 mg/L水杨酸处理,可以促进种子淀粉代谢和提前萌发。种子包衣通常包含杀虫剂、营养物质等,有助于种子萌发和幼苗生长,降低病虫害[30]。除撒播外,条播、穴播等直播方式也应用于实际生产,以降低鼠鸟害、成苗率低、倒伏等造成的损失[31],但这两种方式都增加了水稻生产的成本。也有研究也致力于从优良的育成品种中筛选早生快发、耐淹水萌发的水稻品种,以应用于水稻直播,是否适用于大面积生产效果还未知[32]。因而,鉴定和克隆水稻低温、耐淹萌发力相关基因并开展分子育种,培育耐低温、淹水萌发的直播稻品种,才是最经济、高效的方式。
3.2 OsYIPL1调控水稻种子萌发的机制分析文献资料显示,动物中Yippee类似(YPEL)蛋白家族是一个高度保守的锌指结合蛋白家族,由两对半胱氨酸及其间的52个氨基酸组成金属(锌)结合口袋[28]。OsYIPL1中的Yippee结构域也是完全一样的结构。另外,生物信息学分析表明,几乎在所有的真核生物中都存在Yippee同源基因,说明Yippee类似蛋白可能在维持生命活动中发挥重要且保守的作用。人类基因组中存在5个YPEL家族基因,可能参与细胞循环、衰老和肿瘤发展。其中YPEL1、YPEL2和YPEL5的表达与肾透明细胞癌病患的存活率呈正相关:表达越高,存活时间越长[33]。拟南芥中存在7个Yippee同源基因,关于其基因功能的研究甚少,仅有的数据表明,它们在拟南芥响应双生病毒感染、盐胁迫、花粉萌发和花粉管伸长、种子萌发的转录组数据中呈现差异表达[34-37]。
水稻萌发包括种子吸水膨胀、大分子物质合成和细胞增殖直至胚芽鞘突破种皮等几个阶段,种子外部表皮细胞变薄、酶解,内部胚由脱水、静止状态进入代谢旺盛并不断生长的状态。本研究通过转录表达分析,鉴定到一个全新的与水稻低温萌发相关的功能基因OsYIP1。OsYIP1在耐低温发芽和不耐低温发芽的材料中有明显差异表达,同时其在水稻生殖器官中有高表达。进一步转基因试验表明,适度提高OsYIP1的表达量,可以提高水稻的常温发芽能力。因此,推测OsYIPL1可能是一个新的调控水稻萌发的功能基因。OsYIP1作为一个锌指结合蛋白,可能通过调节细胞增殖相关基因的表达,促进胚根和胚芽鞘的不断伸长和生长。另一方面,OsYIPL1可能也参与非生物胁迫如低温等的响应,抑制生命活动的发生。因而在水稻低温萌发过程中其作用可能是双重的,需要更进一步的研究数据来解析。
3.3 OsYIPL1在水稻遗传改良中的应用前景关于水稻低温萌发的应用研究,主要集中于qLTG3-1的品种改良和标记辅助育种。Iwata等[38]将来自Kasalath的qLTG3-1[7]和qLTG11[39]导入3个粳稻品种,发现qLTG3-1在这3个品种的遗传背景下均发挥功效,但其在籼稻背景的效应还未知。Fujino研究团队以来自Italica Livorno的qLTG3-1作为功能型等位基因,对来自19个国家的62份亚洲栽培稻品种进行了等位基因序列分析[7]。杨梯丰等[41]根据序列分析结果设计了分子标记,应用于水稻低温萌发分子辅助育种。
水稻中存在5个Yippee同源基因,其中4个是Os07g0584000、Os11g0551800、Os12g0484700和Os03g0698500。它们之间的功能可能存在冗余、分化或者拮抗。本研究结果表明,适度地增加OsYIPL1的表达可以促进水稻种子在常温下的萌发速度;而在低温等恶劣条件下,过高表达OsYIPL1反而抑制种子萌发,一方面可能是种子触发自身的保护机制,另一方面则可能是同源基因之间的反馈抑制调节。因而,需要系统地研究水稻中YIPL家族的所有成员的功能,厘清分子调控机制,才可以精准地将其应用于调控水稻低温萌发。
4 结论低温萌发是一个复杂的生物过程,由微效多基因控制,利用全基因组关联分析和转录组测序等手段可以有效挖掘相关调控基因。低温萌发转录组测序数据分析表明,OsYIPL1在不同低温萌发力品种中呈现差异表达,尤其是低温萌发96 h后,高LTG品种中OsYIPL1的表达量是低LTG品种的2倍以上。OsYIPL1是与果蝇Yippee同源的锌指结合蛋白,其编码基因特异的在水稻花药和幼胚中高表达。在水稻品种日本晴中过表达OsYIPL1,获得两个阳性转基因株系OX-1、OX-28,其中OsYIPL1的表达量是野生型的44.5和88.9倍。萌发试验表明,在常温下,OX-1的萌发率比野生型平均提高了18.3%;而OX-2比野生型平均下降了54.5%。在低温下,OX-1和OX-2的萌发率均比野生型低,平均下降43.8% 和81.5%。说明过表达OsYIPL1可以在一定程度上提高水稻种子在常温下的萌发速率,但是过高则抑制;在低温下,OsYIPL1的过表达会抑制水稻种子的萌发,且这种抑制随OsYIPL1表达量的升高而增强。由于OsYIPL1相关的研究几乎没有,其分子作用机理和应用研究有待进一步开展。
| [1] |
陈风波, 陈培勇. 中国南方部分地区水稻直播采用现状及经济效益评价-来自农户的调查分析[J]. 中国稻米, 2011, 17(4): 1-5. DOI:10.3969/j.issn.1006-8082.2011.04.001 CHEN F B, CHEN P Y. Current situation and economic benefit evaluation of rice direct seeding in some areas of South China, invastigation and analysis from farmers[J]. China Rice, 2011, 17(4): 1-5. DOI:10.3969/j.issn.1006-8082.2011.04.001 |
| [2] |
汪向东, 陈再高. 水稻直播生产现状及发展对策[J]. 现代农业科技, 2019(15): 49-51. WANG X D, CHEN Z G. Current situation and development strategy of direct rice production[J]. Modern Agricultural Science and Technology, 2019(15): 49-51. |
| [3] |
滕胜, 曾大力, 钱前, 国广泰史, 黄大年, 朱立煌. 低温条件下水稻发芽力QTL的定位分析[J]. 科学通报, 2001, 46(13): 1104-1108. DOI:10.3321/j.issn:0023-074X.2001.13.012 TENG S, ZENG D L, QIAN Q, KUNIHIRO Y, HUANG D N, ZHU L H. Mapping analysis of QTL for germinability of rice under low temperature[J]. Chinese Science Bulletin, 2001, 46(13): 1104-1108. DOI:10.3321/j.issn:0023-074X.2001.13.012 |
| [4] |
陈亮, 楼巧君, 孙宗修, 邢永忠, 余新桥, 罗利军. 水稻低温发芽力的QTL定位[J]. 中国水稻科学, 2006, 20(2): 159-164. DOI:10.16819/j.1001-7216.2006.02.008 CHEN L, LOU Q J, SUN Z X, XING Y Z, YU X Q, LUO L J. QTL mapping of low temperature germinability in rice[J]. Chinese Journal of Rice Science, 2006, 20(2): 159-164. DOI:10.16819/j.1001-7216.2006.02.008 |
| [5] |
KIM N, JAN R, PARK J R, ASIF S, ZHAO D D, KIM E G, JANG Y H, EOM G H, LEE G S, KIM K M. QTL mapping and candidate gene analysis for seed germination response to low temperature in rice[J]. International Journal of Molecular Sciences, 2022, 23(13). DOI:10.3390/ijms23137379 |
| [6] |
FUJINO K, SEKIGUCHI H, SATO T, KIUCHI H, NONOUE Y, TAKEUCHI Y, ANDO T, LIN S Y, YANO M. Mapping of quantitative trait loci controlling low-temperature germinability in rice (Oryza sativa L.)[J]. Theoretical and Applied Genetics, 2004, 108(5): 794-799. DOI:10.1007/s00122-003-1509-4 |
| [7] |
FUJINO K, SEKIGUCHI H, MATSUDA Y, SUGIMOTO K, ONO K, YANO M. Molecular identification of a major quantitative trait locus, qLTG3-1, controlling low-temperature germinability in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(34): 12623-12628. DOI:10.1073/pnas.0805303105 |
| [8] |
HOU M Y, WANG C M, JIANG L, WAN J M, HIDESHI Y, ATSUSHI Y. Inheritance and QTL mapping of low temperature germinability in rice (Oryza sativa L.)[J]. Acta Genetica Sinica, 2004, 31(7): 701-706. |
| [9] |
姜旋, 李辰昱, 毛婷. 水稻低温发芽性QTL的分子标记定位[J]. 武汉植物学研究, 2005, 23(3): 216-220. DOI:10.3969/j.issn.2095-0837.2005.03.003 JIANG X, LI C Y, MAO T. Mapping of QTLcontrolling low temperature germinability in rice[J]. Plant Science Journal, 2005, 23(3): 216-220. DOI:10.3969/j.issn.2095-0837.2005.03.003 |
| [10] |
LI L, LIU X, XIE K, WANG Y, LIU F, LIN Q, WANG W, YANG C, LU B, LIU S, CHEN L, JIANG L, WAN J. qLTG-9, a stable quantitative trait locus for low-temperature germination in rice (Oryza sativa L.)[J]. Theoretical and Applied Genetics, 2013, 126(9): 2313-2335. DOI:10.1007/s00122-013-2137-2 |
| [11] |
杨洛淼, 王敬国, 刘化龙, 孙健, 郑洪亮, 邹德堂. 寒地粳稻发芽期和芽期的耐冷性QTL定位[J]. 作物杂志, 2014(6): 44-51. DOI:10.16035/j.issn.1001-7283.2014.06.009 YANG L M, WANG J G, LIU H L, SUN J, ZHENG H L, ZOU D T. Mapping of QTL for cold tolerance in japonica rice at germination and bud stages in cold regions[J]. Crops, 2014(6): 44-51. DOI:10.16035/j.issn.1001-7283.2014.06.009 |
| [12] |
JIANG S, YANG C, XU Q, WANG L, YANG X, SONG X, WANG J, ZHANG X, LI B, LI H, LI Z, LI W. Genetic dissection of germinability under low temperature by building a resequencing linkage map in japonica rice[J]. International Journal of Molecular Sciences, 2020, 21(4): 1284. DOI:10.3390/ijms21041284 |
| [13] |
YANG J, LI D, LIU H, LIU Y, HUANG M, WANG H, CHEN Z, GUO T. Identification of QTLs involved in cold tolerance during the germination and bud stages of rice (Oryza sativa L.) via a high-density genetic map[J]. Breed Science, 2020, 70(3): 292-302. DOI:10.1270/jsbbs.19127 |
| [14] |
NA JEEB S, ALI J, MAHENDER A, PANG Y L, ZILHAS J, MURUGAIYAN V, VEMIREDDY L R, LI Z. Identification of maineffect quantitative trait loci (QTLs) for low-temperature stress tolerance germination- and early seedling vigor-related traits in rice (Oryza sativa L.)[J]. Molecular Breeding, 2020, 40(1): 10. DOI:10.1007/s11032-019-1090-4 |
| [15] |
HAN L Z, ZHANG Y Y, QIAO Y L, CAO G L, ZHANG S Y, KIM J H, KOH H J. Genetic and QTL analysis for low-temperature vigor of germination in rice[J]. Acta Genetica Sinica, 2006, 33(11): 998-1006. DOI:10.1016/s0379-4172(06)60135-2 |
| [16] |
JIANG L, LIU S, HOU M, TANG J, CHEN L, ZHAI H, WAN J. Analysis of QTLs for seed low temperature germinability and anoxia germinability in rice (Oryza sativa L.)[J]. Field Crops Research, 2006, 98(1): 68-75. DOI:10.1016/j.fcr.2005.12.015 |
| [17] |
JI S L, JIANG L, WANG Y H, ZHANG W W, LIU X, LIU S J, CHEN L M, ZHAI H Q, WAN J M. Quantitative trait loci mapping and stability for low temperature germination ability of rice[J]. Plant Breeding, 2009, 128(4): 387-392. DOI:10.1111/j.1439-0523.2008.01533.x |
| [18] |
PAN Z, TAN B, CAO G, ZHENG R, LIU M, ZENG R, WANG S, ZHU H, YE H, ZHAO G, CAO W, LIU G, ZHANG G, ZHOU Y. Integrative QTL identification, fine mapping and candidate gene analysis of a major locus qLTG3a for seed low-temperature germinability in rice[J]. Rice (N Y), 2021, 14(1): 103. DOI:10.1186/s12284-021-00544-2 |
| [19] |
PAN Y, ZHANG H, ZHANG D, LI J, XIONG H, YU J, LI J, RASHID M A, LI G, MA X, CAO G, HAN L, LI Z. Genetic analysis of cold tolerance at the germination and booting stages in rice by association mapping[J]. PLoS ONE, 2015, 10(3): e0120590. DOI:10.1371/journal.pone.0120590 |
| [20] |
SALES E, VIRUEL J, DOMINGO C, MARQUES L. Genome wide association analysis of cold tolerance at germination in temperate japonica rice (Oryza sativa L.) varieties[J]. PLoS ONE, 2017, 12(8): e0183416. DOI:10.1371/journal.pone.0183416 |
| [21] |
SHAKIBA E, EDWARDS J D, JODARI F, DUKE S E, BALDO A M, KORNILIEV P, MCCOUCH S R, EIZENGA G C. Genetic architecture of cold tolerance in rice (Oryza sativa) determined through high resolution genome-wide analysis[J]. PLoS ONE, 2017, 12(3): e0172133. DOI:10.1371/journal.pone.0172133 |
| [22] |
WANG H, LEE A R, PARK S Y, JIN S H, LEE J, HAM T H, PARK Y, ZHAO W G, KWON S W. Genome-wide association study reveals candidate genes related to low temperature tolerance in rice (Oryza sativa) during germination[J]. 3 Biotech, 2018, 8(5): 235. DOI:10.1007/s13205-018-1252-9 |
| [23] |
WANG X, ZOU B, SHAO Q, CUI Y, LU S, ZHANG Y, HUANG Q, HUANG J, HUA J. Natural variation reveals that OsSAP16 controls low-temperature germination in rice[J]. Journal of Experimental Botany, 2018, 69(3): 413-421. DOI:10.1093/jxb/erx413 |
| [24] |
PAN Y, LIANG H, GAO L, DAI G, CHEN W, YANG X, QING D, GAO J, WU H, HUANG J, ZHOU W, HUANG C, LIANG Y, DENG G. Transcriptomic profiling of germinating seeds under cold stress and characterization of the cold-tolerant gene LTG5 in rice[J]. BMC Plant Biology, 2020, 20(1): 371. DOI:10.1186/s12870-020-02569-z |
| [25] |
MAO F, WU D, LU F, YI X, GU Y, LIU B, LIU F, TANG T, SHI J, ZHAO X, LIU L, JI L. QTL mapping and candidate gene analysis of low temperature germination in rice (Oryza sativa L.) using a genome wide association study[J]. Peer Journal, 2022, 10: e13407. DOI:10.7717/peerj.13407 |
| [26] |
YANG T, ZHOU L, ZHAO J, DONG J, LIU Q, FU H, MAO X, YANG W, MA Y, CHEN L, WANG J, BAI S, ZHANG S, LIU B. The candidate genes underlying a stably expressed QTL for low temperature germinability in rice (Oryza sativa L.)[J]. Rice (N Y), 2020, 13(1): 74. DOI:10.1186/s12284-020-00434-z |
| [27] |
YANG J, YANG M, SU L, ZHOU D, HUANG C, WANG H, GUO T, CHEN Z. Genome-wide association study reveals novel genetic loci contributing to cold tolerance at the germination stage in indica rice[J]. Plant Science, 2020, 301: 110669. DOI:10.1016/j.plantsci.2020.110669 |
| [28] |
ROXSTRP-LOMDQIOST K, FAYE I. The Drosophila gene Yippee reveals a novel family of putative zinc binding proteins highly conserved among eukaryotes[J]. Insect Molecular Biology, 2001, 10(1): 77-86. DOI:10.1046/j.1365-2583.2001.00239.x |
| [29] |
闫晓霞, 王丰, 柳武革, 廖亦龙, 朱满山, 付崇允, 霍兴, 刘迪林. 水稻直播适应性的遗传基础与育种策略[J]. 广东农业科学, 2022, 49(1): 1-13. DOI:10.16768/j.issn.1004-874X.2022.01.001 YAN X X, WANG F, LIU W G, LIAO Y L, ZHU M S, FU C Y, HUO X, LIU D L. Gentic basis of direct seeding adaptability in rice and its breeding strategy[J]. Guangdong Agricultural Sciences, 2022, 49(1): 1-13. DOI:10.16768/j.issn.1004-874X.2022.01.001 |
| [30] |
WANG W, CHEN Q, HUSSAIN S, MEI J, DONG H, PENG S, HUANG J, CUI K, NIE L. Pre-sowing seed treatments in direct-seeded early rice: consequences for emergence, seedling growth and associated metabolic events under chilling stress[J]. Scientific Reports, 2016, 6: 19637. DOI:10.1038/srep19637 |
| [31] |
WANG D, CHEN S, WANG Z, JI C, XU C, ZHANG X, CHAUHAN B S. Optimizing hill seeding density for high-yielding hybrid rice in a single rice cropping system in south China[J]. PLoS ONE, 2014, 9(10): e109417. DOI:10.1371/journal.pone.0109417 |
| [32] |
方志强, 陆展华, 王石光, 刘维, 卢东柏, 王晓飞, 巫浩翔, 陈浩, 何秀英. 不同种植模式对水稻生长的影响及适宜直播品种的筛选[J]. 广东农业科学, 2022, 49(6): 1-10. DOI:10.16768/j.issn.1004-874X.2022.06.001 FANG Z Q, LU Z H, WANG S G, LIU W, LU D B, WANG X F, WU H X, CHEN H, HE X Y. Effects of different planting patterns on rice growth and selection of rice varieties suitable for direct seeding[J]. Guangdong Agricultural Sciences, 2022, 49(6): 1-10. DOI:10.16768/j.issn.1004-874X.2022.06.001 |
| [33] |
WANG L, ZHANG Z, ZHOU X, WU J, HONG Z. Comprehensive analysis of the expression and prognosis of YPEL family members in clear cell renal cell cancer[J]. Oncology Reports, 2022, 48(1): 134. DOI:10.3892/or.2022.8345 |
| [34] |
HE X J, MU R L, CAO W H, ZHANG Z G, ZHANG J S, CHEN S Y. AtNAC2, a transcription factor downstream of ethylene and auxin signaling pathways, is involved in salt stress response and lateral root development[J]. The Plant Journal, 2005, 44(6): 903-916. DOI:10.1111/j.1365-313X.2005.02575.x |
| [35] |
WANG Y, ZHANG W Z, SONG L F, ZOU J J, SU Z, WU W H. Transcriptome analyses show changes in gene expression to accompany pollen germination and tube growth in Arabidopsis[J]. Plant Physiology, 2008, 148(3): 1201-1211. DOI:10.1104/pp.108.126375 |
| [36] |
ASCENCIO-IBANEZ J T, SOZZANI R, LEE T J, CHU T M, WOLFINGER R D, CELLA R, HANLEY-BOWDOIN L. Global analysis of Arabidopsis gene expression uncovers a complex array of changes impacting pathogen response and cell cycle during geminivirus infection[J]. Plant Physiology, 2008, 148(1): 436-454. DOI:10.1104/pp.108.121038 |
| [37] |
DEKKERS B J, PEARCE S, VAN BOLDEREN-VELDKAMP R P, MARSHALL A, WIDERA P, GILBERT J, DROST H G, BASSEL G W, MULLER K, KING J R, WOOD A T, GROSSE I, QUINT M, KRASNOGOR N, LEUBNER-METZGER G, HOLDSWORTH M J, BENTSINK L. Transcriptional dynamics of two seed compartments with opposing roles in Arabidopsis seed germination[J]. Plant Physiology, 2013, 163(1): 205-215. DOI:10.1104/pp.113.223511 |
| [38] |
IWATA, N, FUJINO K. Genetic effects of major QTLs controlling lowtemperature germinability in different genetic backgrounds in rice (Oryza sativa L.)[J]. Genome, 2010, 53(10): 763-768. DOI:10.1139/g10-060 |
| [39] |
MIURA K, LIN S Y, YANO M, NAGAMINE T. Mapping quantitative trait loci controlling low temperature germinability in rice (Oryza sativa L.)[J]. Breeding Science, 2001, 51(4): 293-299. DOI:10.1270/jsbbs.51.293 |
| [40] |
FUJINO K, SEKIGUCHI H. Origins of functional nucleotide polymorphisms in a major quantitative trait locus, qLTG3-1, controlling low-temperature germinability in rice[J]. Plant Molecular Biology, 2011, 75(1-2): 1-10. DOI:10.1007/s11103-010-9697-1 |
| [41] |
杨梯丰, 张子怡, 董景芳, 周炼, 张少红, 刘斌, 赵均良. 水稻低温发芽力QTL qLTG3-1基因内分子标记的开发及其在华南籼稻中的应用评价[J]. 广东农业科学, 2021, 48(10): 32-41. DOI:10.16768/j.issn.1004-874X.2021.10.004 YANG T F, ZHANG Z Y, DONG J F, ZHOU L, ZHANG S H, LIU B, ZHAO J L. Development of intragenic molecular marker in QTL qLTG3-1 related to low temperature germinability of rice and evaluation of its application in indica rice of south China[J]. Guangdong Agricultural Sciences, 2021, 48(10): 32-41. DOI:10.16768/j.issn.1004-874X.2021.10.004 |
(责任编辑 白雪娜)
 2022, Vol. 49
2022, Vol. 49




