文章信息
基金项目
- 广州市科技计划项目(20210208041);广州市农村科技特派员项目(20212100075)
作者简介
- 李香荣(1996—),女,在读硕士生,研究方向为水稻抗白叶枯病基因的挖掘,E-mail:1095220479@qq.com; 刘维,副研究员,主要从事水稻遗传育种和优良农艺性状基因挖掘利用研究。主持广东省自然科学基金面上项目、广州市基础与应用基础研究项目、广东省科技计划项目等11项。获各级科技成果奖励5项,育成通过国家及省级以上审定品种57个/次,获农业农村部授权植物新品种权9项,完成成果转化金额520万元。作为广东省、广州市及各地市科技特派员和产业园专家服务团成员,对接产业服务“三农”,截至2020年在省内累计推广水稻面积约1700万亩。在Frontiers in Plant Science、《中国水稻科学》、《植物遗传资源学报》等期刊发表第一作者论文9篇.
通讯作者
- 刘维(1983—),女,硕士,副研究员,研究方向为水稻新品种选育与重要农艺性状基因鉴定,E-mail:liuwei@gdaas.cn.
文章历史
- 收稿日期:2022-07-22
2. 南昌大学生命科学技术学院,江西 南昌 330000
2. College of Life Science and Technology, Nanchang University, Nanchang 330000, China
水稻(Oryza sativa L.)是亚洲乃至世界最重要的粮食作物之一,在农业生产中具有极其重要的地位[1]。我国水稻耕作面积仅次于印度,但稻谷总产量居世界之首,约占我国粮食总产量的40% 以上,其高产、稳产性是保证我国粮食安全的重要指标。当前,水稻病害仍是稻谷产量损失的重大原因[2],其中由革兰氏阴性黄单胞杆菌致病变种(Xanthomonas oryzae pv. oryzae,Xoo)引起的白叶枯病(Bacterial Blight,BB)是南方稻区主要的细菌性病害,它通过侵染水稻维管束,在稻叶叶尖和叶边缘产生黄绿色斑点,随后侵染至木质部的导管,并导致叶片枯萎变成灰白色,严重降低水稻的光合作用,引致减产(一般20%~30%,严重时达50%,甚至颗粒无收)和损害稻米品质[3-4]。华南稻区高温高湿且台风暴雨频发的天气有利于白叶枯病的暴发与流行,而且华南双季稻连作的栽培模式更容易导致该病害的发生。目前,对白叶枯病的主要防治手段仍是化学防治,但施用大量化学药剂不但造成农药残留、环境污染,对人类和动物产生危害,而且增加生产成本。
利用寄主植物抗性是防治白叶枯病的首选策略。培育与种植抗白叶枯病水稻品种是当前世界公认的防治该病害最为安全、经济、环保、有效的手段,而不断鉴定发现抗病种质,发掘广谱抗白叶枯病基因是进行抗病育种的前提。然而,仅用常规方法很难培育出对白叶枯病具有持久广谱抗性的水稻品种。在自然和人工选择的双重压力下病原菌不断变异,特别是华南稻区白叶枯菌表现出种群多、毒性强等特点,如强毒菌V型菌和IX型菌在华南稻区首先被发现并向全国蔓延,进而造成品种抗性减弱甚至丧失,抗病品种变成感病品种[5]。因此,对已知抗白叶枯病基因进行评价与合理利用,不断筛选新的优良抗病种质资源,发掘鉴定新的广谱抗病基因,对培育具有持久抗性的水稻品种、保证水稻高产稳产优质显得十分必要。现代生物技术工具(特别是分子标记)的应用,促进了抗白叶枯病基因的克隆。本文归纳总结了近年来在水稻白叶枯病研究方面取得的一些进展,对生产上应用较好的3个主效抗白叶枯病基因进行了详细阐述与评价,并对白叶枯病抗病育种现状进行总结和展望,以期为生产上有效防治该病害提供参考。
1 水稻白叶枯病基因的挖掘和研究黄单胞杆菌主要通过Ⅲ型分泌系统分泌不同的效应蛋白来攻击宿主植物,抑制宿主免疫并从中获取营养。水稻黄单胞杆菌的Ⅲ型分泌系统效应蛋白可分为两大类,即转录激活因子类效应蛋白(Transcription Activator-Like Effectors,TALE)和非TALE(又称为Xops)[6-7],水稻在应对白叶枯病菌效应蛋白入侵时采取多种方式进行防御。白叶枯病菌与水稻互作,符合“基因对基因”(gene-for-gene)关系,水稻的抗病(R)基因或感病(S)基因被病菌中对应匹配的无毒(arv)基因或毒性(vir)基因激活,水稻才表现出抗病或感病。
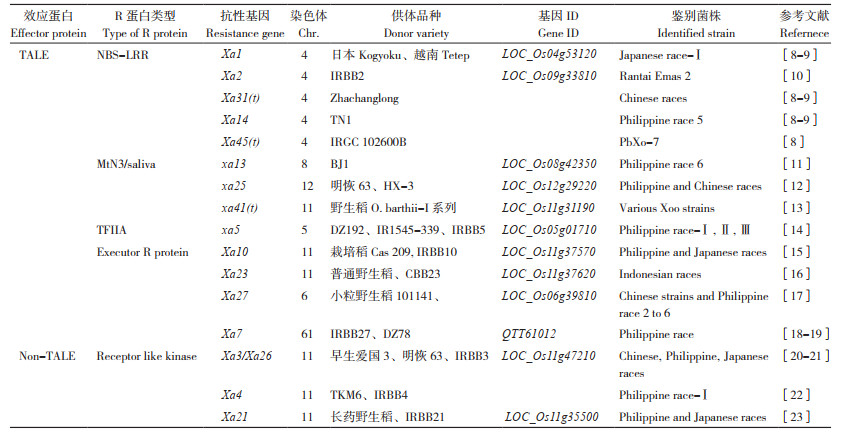
目前,经国际注册确认和期刊报道的水稻白叶枯病抗性基因有46个、感病基因有2个,这些基因对不同白叶枯致病小种有不同的抗谱。而已被分离克隆的主效基因或等位基因只有16个,分别为Xa1、Xa2、Xa31、Xa14、Xa45(t)、xa13、xa25、xa41(t)、xa5、Xa10、Xa23、Xa27、Xa7、Xa3/Xa26、Xa4和Xa21(表 1)。根据对TALE效应蛋白和非TALE效应蛋白的不同抗病机制与蛋白结构,上述16个抗病基因主要编码NBSLRR(Nucleotide binding site-leucine-rich repeats)类〔Xa1、Xa2、Xa14、Xa31(t) 和Xa45(t)〕、MtN3/saliva家族〔xa13、xa25、xa41(t)〕、转录因子Ⅱ A(TFIIA)γ亚基(xa5)、Executor R Protein Receptor(Xa10、Xa23、Xa27、Xa7)、类受体激酶(Receptor-Like Kinase,RLK)(Xa21、Xa3/Xa26、Xa4)等5类蛋白质。
2 我国水稻白叶枯病菌致病型划分与抗性基因评价
为了解我国水稻白叶枯病菌致病型的分化和变异动态,合理布局生产上的抗病品种,植物病理学家分别采集不同稻作区水稻白叶枯病标准病叶,分离得到白叶枯病原菌,应用不同类型寄主鉴别材料,根据寄主和病原菌之间的互作反应划分不同的致病型。方中达等[24]利用中国水稻白叶枯病统一鉴别寄主金刚30、Tetep、南粳15、Java14、IR26对全国各地的菌系进行联合鉴定,最后将我国白叶枯病菌划分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ和Ⅶ共7个致病型。王春连等[25]除发现7个与全国菌系联合鉴定相同的致病型外,在云南还发现1个致病性较弱的新致病型。曾列先等[6]在广东省水稻白叶枯病病区采集标准病叶,分离提纯到53个病原菌株,采用中国水稻白叶枯病统一鉴别寄主金刚30、Tetep、南粳15、Java14、IR24,发现了1个新模式强致病菌型,该致病型可使上述鉴别寄主全部感病,其致病谱广、毒性强,是一个高致病性菌株,且广东生产上的主栽水稻品种对该菌型均无明显抗性,严重威胁广东水稻的安全生产,因此及早寻找具有针对性的有效抗性基因是防制该病的有效手段。李岗[26]用采自全国12个省主要稻区的103个水稻白叶枯菌,对30个水稻品种进行毒性试验,发现水稻品种IRBB3(Xa3)和IRBB4(Xa4)对50% 以上的测试菌感病,而它们所含的抗病基因Xa3和Xa4是传统品种中广泛利用的抗病基因。近等基因系品种IRBB21(Xa21)拥有最广的单基因抗性谱,IRBB50(Xa4+xa5)和IRBB54(xa5+Xa21)是抗病表现最好的双抗病基因组合品种。陈功友等[27]在全国范围内采集了500多株患水稻白叶枯病的水稻,并通过Southern杂交对每个菌株的TALE基因进行检测,选择含抗病基因Xa3、Xa4、xa5、Xa7、Xa13、Xa21、Xa23的近等基因系和轮回亲本IR24以及完成测序的日本晴等为鉴定材料,结果发现含xa5、Xa7和Xa23基因的材料仅能被少数菌株侵染,对白叶枯病具有广谱抗性。基于此,后文针对具有广谱抗性且应用广泛的Xa23、Xa7和xa5基因作进一步总结归纳。
3 广谱抗病基因Xa23、Xa7和xa5的研究历程 3.1 Xa23的发现与作用机制水稻白叶枯病抗性基因Xa23来源于我国普通野生稻,对国内外现有的白叶枯病鉴别菌株都表现出全生育期高抗性。1987—1991年,中国农业科学院与广西农业科学院合作,经多菌系复选筛选,从普通野生稻中筛选出全生育期高抗国际广致病菌菲律宾6号小种(P6)的新抗源RBB16,由于P6能侵袭所有已命名的栽培稻抗白叶枯病基因,推测RBB16可能携带新的抗病基因[28-29]。该抗性源携带的基因于2001年被国际水稻新基因命名委员会正式命名为Xa23。Xa23具有全生育期抗性、完全显性、抗性谱广等优点,是当前水稻抗白叶枯病育种中应用最广泛的抗病基因之一[30-33]。
3.1.1 Xa23的遗传机理与定位克隆 章琦等[34]将Xa23基因转入栽培稻金刚30中,选育得到近等基因系CBB23,CBB23全生育期高抗28个菌系(包括10个菲律宾鉴别小种、7个中国致病型小种、3个日本小种和8个韩国主要致病小种),其抗谱和抗性遗传能力均超过国内外广泛应用的Xa21基因。通过利用携带新基因的1对近等基因系构建F2作图群体,筛选出160个单株利用SSR标记进行基因定位,最初定位于水稻第11号染色体上,与标记OSR06和RM224图距分别为5.3、27.7 cM。随后潘海军等[35]和王春连[36]构建了以金刚30为母本、CBB23为父本的F2扩大群体2 562株,利用SSR和RAPD引物将Xa23精细定位于第11号染色体长臂的标记RpdH5和RM206之间,遗传距离分别为7.0、1.9 cM。王春连[36]通过EST分子标记继续缩小区间,将Xa23限定于标记C189和CP02662之间,遗传距离缩小至0.8、1.3 cM,通过对候选基因分析,预测认为最有可能的候选基因是LOC_Os11g37620。
王春连[36]用距离基因0.8 cM的EST标记C189,扩增Xa23的近等基因系CBB23的基因组片段为探针,筛选水稻明恢63的TAC文库和广陆矮4号的PAC文库;对获得的7个阳性克隆用酶切法和Tail-PCR法进行末端片段分离,获得15个末端片段,检测抗感亲本之间的多态性,发现7个末端片段;用这些末端片段作RFLP标记,对F2群体进行检测和连锁分析,结果发现这些标记与目标基因的遗传距离依次为0.4、0.4、0.4、0.5、0.6、0.6、1.1 cM。虽然69B、70N和81N这3个片段与Xa23的遗传距离均为0.4 cM,但序列比对发现69B与70N的物理距离为35 kb,与81N为95 kb,69B为距Xa23最近。Lj13和Xa23之间的遗传距离为1.1 cM,位于基因的另一侧,而Lj204(Lj74)、Lj210、Lj215、Lj55与Xa23基因共分离。王春连继而构建了pCCl BAC库,利用紧密连锁标记Lj211和共分离标记Lj74对BAC文库进行筛选,共获得5个阳性克隆,并建立了1个交叉克隆群,最终将Xa23基因锁定在BAC克隆608中,利用脉冲电泳检测到约80 kb的插入片段。随后利用鸟枪法对BAC克隆608进行测序,获得了72 115 bp的DNA序列。基因预测显示共有12个开放阅读框(ORF),根据ORF编码产物的同源性比较和分子标记定位结果,最终确定候选基因为6个ORF。最终该团队利用农杆菌介导的转化方法将筛选出的10个候选基因克隆载体转化感病品种,用潮霉素和Southern杂交检测抗性植株的拷贝数,发现高抗和中抗植株中同时存在单拷贝和双拷贝,从而成功克隆该基因。
3.1.2 Xa23介导的抗病机制 Xa23属于Executor抗性基因,EBE启动子上的AvrXa23可以与Xoo中广泛存在的无毒效应因子AvrXa23结合,诱导Xa23基因的转录表达。Xa23编码蛋白在受感染的宿主细胞中产生HR反应,直接杀死受感染的细胞,限制细菌在宿主体内的继续繁殖,从而有效抵御白叶枯病进一步侵袭[36]。
Xa23蛋白序列中与HR相关的氨基酸研究表明,Xa23的氨基端和羧基端在引起HR反应中发挥的作用是相互独立的,不能实现功能互补,且改变位于羧基和氨基两末端的关键氨基酸残基的酸碱性质不会影响最终HR表型的结果。同时,崔华[37]还证实了Xa23的3个跨膜结构域在HR诱导功能中的重要存在价值。Xa23基因编码1个执行R蛋白,但是该基因与当前已知的R基因并无太大同源性。Xa23编码1个由113个氨基酸组成的蛋白,该蛋白与已知的执行子R蛋白Xa10有一半相同,预测Xa23跨膜螺旋结构与Xa10重叠[37]。与Xa10不同的是,Xa23的转录由AvrXa23(在所有Xoo中检测到的类激活因子)特异性激活,且其与感病的等位基因xa23具有相同的ORF,但它们的启动子区域不同,Xa23缺乏与AvrXa23的TALE结合原件。这说明执行子R基因家族成员蛋白通过与病原菌中同源的TALE识别而产生广谱抗性。
3.1.3 Xa23的进化机制 Xa23等位基因仅出现在稻属中,其编码区序列有较高的同源性。天然栽培稻中没有检测到EBEAvrXa23,显性抗病基因Xa23只存在于野生稻中。278份代表性水稻材料中只有97份含有Xa23/xa23基因,表明该基因在水稻中并不广泛。Xa23/xa23等位基因启动子的核苷酸序列多样性显著高于其编码区,分为Pro-A、B、C、D、E共5种单倍型。Pro-A是唯一含有EBEAvrXa23的单倍型,且只有这种单倍型具有抗病功能。5种单倍型在地理分布上没有显著差异,Pro-A仅存在于野生稻中,其他4种单倍型分布于野生稻和栽培稻中,其中Pro-D单倍型的比例高达26.8%[37]。Xa23来源于普通野生稻,在水稻驯化育种过程中可能存在瓶颈效应[38]。
3.2 Xa7的发现与作用机制Xa7的研究始于20世纪70年代,最早从孟加拉国栽培品种DV85中被发现[39],对PXO61、PXO86、PXO79和SCB4-1具有抗性,是孕穗期抗性的显性基因。国际水稻所将Xa7基因转育到感病品种IR24中,获得近等基因系IRBB7。Xa7属于显性R基因,对白叶枯病菌具有高抗、广谱、持久和耐热的抗性[40]。
3.2.1 Xa7的遗传机理与定位克隆 在过去40多年中,由于Xa7基因的广谱抗病性,它一直是研究者所聚焦的重要基因。尽管Xa7基因发现得较早,但其定位与克隆的过程却比较漫长,原因在于该基因遗传位点的序列与参考基因组存在很大差异,导致国内外很多实验室在Xa7基因的定位克隆上一直未获成功[41]。1995年,Kaji等[42]将Xa7基因定位于107.5 cM的范围内。Porter等[43]利用近等基因系IRBB7构建作图群体,通过AFLP、STS、SSR等系列多态性分子标记,将Xa7定位在M1和M3之间约2.7 cM的距离。Chen等[44]利用IR24/IRBB7 F2作图群体,根据粳稻品种日本晴的参考基因组将Xa7基因定位于118.5 kb的区间内。经过众多研究者的不懈努力,最近该基因克隆取得了突破性进展,Chen等[44]和Luo等[45]两个研究团队于2021几乎同时克隆出Xa7基因。Wang等[46]通过构建BAC文库填补了Xa7定位基因座中的基因组缺口,与日本晴相比,IRBB7中存在100 kb非共线序列,利用BAC的顺序重叠克隆进行互补转化,发现Xa7属于孤儿基因,编码一种与已知抗性蛋白不同的小蛋白。Xa7启动子中的27 bp效应物结合元件EBE对于AvrXa7诱导表达模型是必需的。Xa7锚定在内质网中,并触发水稻和烟草中的程序性细胞死亡。众多实验证据表明,Xa7对白叶枯病菌具有广谱抗性,抗几乎所有日本小种或亚种,同时也抗多种菲律宾小种[47]。与主效抗病基因Xa4和Xa10相比,Xa7具有更持久的水稻白叶枯病菌抗性[48]。
3.2.2 Xa7介导的抗病机制与进化 AvrXa7是由Xoo的avrXa7基因所编码的TALE蛋白,具有双重功能,不仅可引发Xa7所介导的抗病性,同时还可与OsSWEET14启动子上的TALE结合元件EBE结合,诱导OsSWEET14基因的表达,导致水稻感病[49-50]。pthXo3是PXO61的毒性基因,编码TALE蛋白。研究发现,pthXo3与avrXa7高度同源,其编码蛋白PthXo3同样可识别Xa7和OsSWEET14的启动子EBE序列,提示pthXo3可能是Xa7的另一个无毒基因[51]。研究表明,Xoo的两个重要TALE(AvrXa7和PthXo3)对Xa7启动子EBE的识别结合功能可能是导致Xa7具有广谱抗性的重要原因,后续仍需要强有力的实验结果来证明。此外,诸多证据表明,Xa7在高温条件下对白叶枯病具有更好的抗性,而其他大多数R基因却相反[52],目前还不清楚高温条件下R基因丧失抗性的具体机制。不同温度处理试验发现,高温条件下Xoo可诱导Xa7基因更快更高表达,推测可能是提前激活并增强水稻对Xoo的防御反应[53]。对3 000多个水稻品种的分析表明,Xa7基因在大多数品种、地方品种和野生稻材料中都不存在,但在与水稻属最近的外群Leersia perrieri(中国菰与假稻)中发现了高度同源的Xa7。
3.3 xa5的发现与作用机制xa5在孟加拉国地区的澳大利亚水稻品种DV85、DV86和DZ78中发现,对PXO61和PXO86具有抗性,最初定位于第5号染色体上[54]。该基因最初发现于供体品种DZ192中,对菲律宾生理小种1、2、3、5同时具有抗性。在国际水稻所的种质资源圃中鉴定到一系列携带该基因的资源,并将这些品种归类于DZ192群,利用此类材料与IR24配制近等基因系IRBB5。
3.3.1 xa5的遗传机理与定位克隆 来自水稻的xa5抗性基因对水稻白叶枯病菌引起的水稻白叶枯病具有隐性、小种特异性抗性。Blair等[55]通过构建F2作图群体,获得1 016个植株,在水稻5号染色体远端设置44个DNA标记,绘制了xa5周围染色体区域的高分辨率遗传图,筛选重组单株;之后用接种菲律宾白叶枯病菌株PXO61的F3家族对重组F2个体进行后代检测,发现xa5基因被映射到标记RS7和RM611之间约0.5 cM区间范围内,该区间跨度约70 kb,共包含11个ORF。该位点的序列数据是从覆盖部分区域的Indica(IR24等位线,IRBB21)BAC中生成的,并与其他重叠的India(cv 9311)和Japonica(cv Nipponbare)序列进行比较。候选基因分析显示,1个基础转录因子(TFIIa)、1个ABC转运体、1个tRNA合成酶、1个MAP激酶和1个半胱氨酸蛋白酶,以及4个未知、假设或推测的蛋白质,可能是抗性基因的产物。钟义明等[56]根据国际水稻基因组测序计划(IRGSP)、中国超杂交稻基因组计划(SRGP)等,开发出12个SSLP和CAPS标记,用于进一步精细定位,最终将xa5基因定位于标记K5和T4之间0.3 cM的区间范围,约为24 kb,且与标记T2共分离。对24 kb序列分析表明,1个ABC转运体和1个基础转录因子(TFIIa)可能是xa5抗性基因的产物。Iyer等[54]发现xa5基因的cDNA全长为906 bp,结构中包含有3个外显子,编码由106个氨基酸组成的蛋白产物,该蛋白产物是一个转录因子TFIIA的γ亚基;此外,还发现非SWEET等位基因的隐性抗白叶枯病基因xa5的作用范围更广。
3.3.2 xa5介导的抗病机制 Iyer等[54]研究发现,隐性基因xa5与显性基因Xa5相比,仅有两个核苷酸的差异,使得第39位的谷氨酸(抗病)突变成缬氨酸(感病),从而造成功能转变,并且这种氨基酸位点的突变造成的功能转变也存在其他抗病和感病品种中。Iyer等[57]发现,xa5介导的隐性抗病反应是抑制病原菌的转移而不是限制病原菌的增殖,表明其抗病表型与基因型的相关性都是保守的。xa5是全生育期抗性不完全隐性基因,与其等位显性基因Xa5一样是组成型表达。该基因的编码产物是转录因子TFIIA的γ亚基,TFIIAγ是真核生物的转录因子,与果蝇和人的TFIIAγ有50% 的同源性,与拟南芥、玉米、大麦、甘蔗和小麦有85%~93% 的同源性,大多数植物和水稻具有相同的TFIIA γ易感性等位基因[58]。
4 水稻白叶枯病抗病育种现状近年来,水稻白叶枯病呈逐年加重趋势,“老病新发”问题越来越严重,抗白叶枯病基因的鉴定和利用加快了其抗病育种的进程,拓宽了栽培稻抗病性的遗传来源。目前,利用抗白叶枯病基因的方法主要是通过常规育种结合分子标记辅助选择(MAS)。近年来,随着基因编辑技术的发展和完善,编辑易感基因以获得抗病材料的方法得到应用。尽管迄今为止已有40多个抗白叶枯病基因报道,但由于大多数抗性基因的抗谱较窄、隐性基因利用率低、抗病基因的不同功能不能重叠等原因,这些基因很少真正应用于育种实践。Xa3和Xa4基因曾在水稻白叶枯病抗性育种中发挥重要作用,但随着病原菌的不断变异,它们逐渐失去对白叶枯病菌的抗性。Xa21基因具有相对较广的抗谱,一直在水稻抗白叶枯病育种中发挥作用。Xa7和Xa23基因的克隆为水稻抗白叶枯病提供了新的基因资源,对国内外所有已鉴定的菌株都具有高度抗性,并且在水稻整个生长期都具有抗性且完全显性,导入效应也明显,具有广阔的应用前景。
4.1 分子标记辅助育种随着生物技术的不断发展,近年来MAS在作物育种中的应用越来越广泛,特别是在提高作物抗性和精准育种以提高品质方面。优良的基因是MAS的前提,高效准确的分子标记是MAS成功的关键。
MAS育种克服了常规育种周期长、繁琐等缺点,通过利用与抗白叶枯病基因紧密连锁的分子标记来跟踪目标基因,不受环境条件的限制和病原菌生理小种的影响,可在早代进行选择,短时间内可选育出持久抗白叶枯病的水稻品种。如兰艳荣等[59]利用常规杂交回交和MAS,获得4个分别携带Xa21和Xa7基因的株系,成功改良了华201S的白叶枯病抗性。多基因聚合育种比如利用优化的分子标记和抗性鉴定,以杂交稻重要亲本明恢86为对象,选育出同时携带Xa21和Xa23的抗病品种。作者所在课题组利用常规转育和MAS相结合的方式,聚合Xa23、Pi1、Pi2基因改良两系不育系粤晶1S的抗性,最终获得改良不育系台S和沃S,通过广东省品种审定委员会鉴定并向四川台沃种业有限责任公司进行成果转化[60];获得高抗白叶枯病水稻品种粤新银占2号(粤审稻20120041)、粤特油占(粤审稻20200060),并通过广东省品种委员会审定[61]。然而,不是所有抗病基因都可以累加聚合,如隐性广谱抗病基因xa5(转录因子TFⅡA γ小亚基),病原菌分泌效应子蛋白进入细胞后,不能利用宿主细胞的转录翻译系统来转录,宿主表现出抗病。而当xa5与Xa23、Xa27、Xa7聚合时,病原菌效应子AvrXa23、AvrXa27、AvrXa7也不能利用宿主细胞的转录翻译系统进行转录,Xa23、Xa27、Xa7也就不能被病原菌诱导表达,抗病机制没有启动,不但没有增加水稻自身抗性,反而失去原本的抗病性。
4.2 转基因育种抗病品种的培育不是一劳永逸的,需要不断利用轮换基因和多基因聚合等技术,以获得广谱并且具有持久抗性的品种。该方法在一定程度上可有效解决传统育种中籼-粳杂交不育和栽培稻-野生稻杂交不亲和等问题,并可大大缩短育种时间。刘玉晴[62]利用农杆菌介导法,将构建的OsPR1a-OX转化载体转入到水稻受体4021中,筛选鉴定OsPR1A超表达阳性纯合株系OsPR10aRNai和OsPR10a-OX,提高了对白叶枯病菌的抗性。黄大年等[63]利用转基因的方法,通过在中百4号和京引119中转入抗菌肽B基因,获得具有明显白叶枯病抗性的京引119-B植株。何利娟[64]利用适用于多靶点的CRISPR/Cas9基因编辑载体,构建靶向OsPi21和OsBON1基因的CRISPR/Cas9基因编辑载体,利用农杆菌介导的水稻遗传转化方法,获得水稻日本晴转基因植株,检测并得到相关转基因突变材料。张小红等[65]利用转基因方法,获得了Xa23的转基因水稻,通过对这些转基因水稻进行鉴定和分析,发现它们都具有明显的白叶枯病抗性。虽然通过转基因方法可获得白叶枯病抗性水稻,但获得的水稻属于转基因水稻,到目前为止转基因水稻尚未在国内获批进行商业种植。
4.3 基因编辑育种多数白叶枯抗病基因基于感病基因的点突变产生,如隐性抗病基因xa5是因1个氨基酸突变导致;SWEET感病基因家族Xa13、Xa25和Xa41由于启动子存在TALE结合元件,被病原菌识别而诱导表达[66]。基因编辑感病基因启动子区,影响SWEET基因启动子效应结合元件与TALE蛋白结合,从而获得白叶枯病抗性品种的方式具有广阔的应用前景。陈功友等[27]通过CRISPR/Cas9基因编辑技术对水稻品种Kitaake的3个感病基因Xa13/OsSWEET11、Xa25/OsSWEET13、11N3/OsSWEET14进行编辑,成功创制高抗白叶枯病的材料。Yang等[67]通过修饰OsSWEET基因启动子区,成功获得白叶枯病抗病品种。此外,某些TALE依赖的显性Xa基因表达受到限制。因此,通过编辑显性抗病基因的启动子以扩大基因抗谱,创造高品质抗白叶枯病水稻,同样具有广阔的应用前景。
5 展望白叶枯病的发病范围广泛,世界范围内除南极洲外其余各洲均有发现,尤其是中亚地区的中国、日本、印度等国家较严重。水稻病害是其产量损失的重大威胁,随着生态环境的变化,高温高湿天气频发,沿海地区台风侵扰,水稻种子南繁北调,白叶枯病呈逐年加重的趋势。化学农药对该病害有一定的防治作用,但会造成环境污染生态破坏,并且增加种稻生产成本。利用寄主自身对白叶枯病的原始抗性,不仅能确保水稻产量,还能减轻因大量施用农药而造成的环境污染。经过科研工作者的大量的育种实践证明,挖掘并应用白叶枯病抗性基因被认为是当今农业生产上最有效、经济和环保的防治白叶枯病的方法,具有广泛的应用前景。
水稻的R基因和白叶枯病的TAL基因是长期相互选择的结果,选择压力使得这两类基因呈现多样性,人类为防治白叶枯病所做的工作将是持久的。目前,抗谱较广的基因有xa5、Xa7和Xa23,Xa7基因于2021年才克隆,其抗谱仅次于Xa23,Xa23是分子育种使用最广泛的一个基因,其田间效果总体最好,显性抗病基因的聚合能有效增强水稻品种的抗病性。隐性抗病基因xa5编码转录因子TFⅡA γ小亚基,影响病原菌分泌一种效应子蛋白进入细胞后利用宿主细胞转录,宿主表现出抗病性。正因为其作用机制不同,在xa5分别与Xa7和Xa23聚合后,并不能使抗性叠加,Xa7和Xa23基因的抗性被沉默。可见,并不是所有的白叶枯抗病基因都可以累加聚合,基础研究对基因作用机制的研究十分有必要且须进一步加强。
利用转基因育种可以获得抗白叶枯病水稻品种,但目前转基因水稻尚未获得种植许可,仍然处于材料储备阶段。利用基因编辑隐性抗病基因启动子区间TALE蛋白的结合位点,病原菌无法诱导感病基因表达,从而成功创制高抗白叶枯病水稻材料,这也是未来值得研究的方向之一。
| [1] |
AINSWORTH E A. Rice production in a changing climate: a metaanalysis of responses to elevated carbon dioxide and elevated ozone concentration[J]. Global Change Biology, 2008, 14: 1642. DOI:10.1111/j.1365-2486.2008.01594.x |
| [2] |
余四斌, 孙文强, 王记林, 黎志康. 水稻种质资源及其在功能基因组中的应用[J]. 生命科学, 2016, 28(10): 1122-1128. DOI:10.13376/j.cbls/2016150 YU S B, SUN W Q, WANG J L, LI Z K. Rice germplasm resources and their application in functional genome[J]. Life Science, 2016, 28(10): 1122-1128. DOI:10.13376/j.cbls/2016150 |
| [3] |
LIU W, LIU J, TRIPLETT L, LEACH J E, WANG G L. Novel insights into rice innate immunity against bacterial and fungal pathogens[J]. Annual Review of Phytopathol, 2014, 52: 213-224. DOI:10.1146/annurev-phyto-102313-045926 |
| [4] |
冯爱卿, 陈深, 汪聪颖, 陈凯玲, 封金奇, 杨健源, 曾列先, 朱小源. 7种杀菌剂对水稻白叶枯病防效评价[J]. 植物保护, 2020, 46(4): 282-286. DOI:10.16688/j.zwbh.2019239 FENG A Q, CHEN S, WANG C Y, CHEN K L, FENG J Q, YANG J Y, ZENG L X, ZHU X Y. Evaluation on the control effiffifficacy of seven fungicides against rice bacterial blight[J]. Plant Protection, 2020, 46(4): 282-286. DOI:10.16688/j.zwbh.2019239 |
| [5] |
陈深, 汪聪颖, 苏菁, 冯爱卿, 朱小源, 曾列先. 华南水稻白叶枯病菌致病性分化检测与分析[J]. 植物保护学报, 2017, 44(2): 217-22. DOI:10.13802/j.cnki.zwbhxb.2017.2015165 CHEN S, WANG C Y, SU J, FENG A Q, ZHU X Y, ZENG L X. Detection and analysis of pathogenicity differentiation of rice bacterial blight pathogen in South China[J]. Journal of Plant Protection, 2017, 44(2): 217-222. DOI:10.13802/j.cnki.zwbhxb.2017.2015165 |
| [6] |
曾列先, 朱小源, 杨健源, 伍圣远, 陈珍, 陈深. 广东水稻白叶枯病菌新致病型的发现及致病性测定[J]. 广东农业科学, 2005, 32(2): 58-59. DOI:10.16768/j.issn.1004-874X.2005.02.024 ZENG L X, ZHU X Y, YANG J Y, WU S Y, CHEN Z, CHEN S. The discovery of a new pathogen of rice bacterial blight in Guangdong and its pathogenicity determination[J]. Guangdong Agricultural Sciences, 2005, 32(2): 58-59. DOI:10.16768/j.issn.1004-874X.2005.02.024 |
| [7] |
SONG W Y, WANG G L, Chen L L, KIM H S, Pi L Y, HOLSTEN T, GARDNER J, WANG B, ZHAI W X, ZHU L H, FAUQUET C, RONALD P. A receptor kinase-like protein encoded by the rice disease resistance gene, Xa21[J]. Science, 1995, 270: 1804-1806. DOI:10.1126/science.270.5243.1804 |
| [8] |
YOSHIMURA S, UMEHARA Y, KURATA N, NAGAMURA Y, SASAKI T, MINOBE Y, IWATA N. Identifification of a YAC clone carrying the Xa-1 allele, a bacterial blight resistance gene in rice[J]. Theoretical and Applied Genetics, 1996, 93: 117-122. DOI:10.1007/BF00225736 |
| [9] |
JI C H, JI Z Y, LIU B, CHENG H, LIU H, LIU S Z, YANG B, CHEN G Y. Xa1 allelic R genes activate rice blight resistance suppressed by interfering TAL effectors[J]. Plant Communications, 2020(4): 100087. DOI:10.1016/j.xplc.2020.100087 |
| [10] |
ZHANG B M, ZHANG H T, LI F, OU Y Y D, YUAN M, LI X H, XIAO J H, WANG S P. Multiple alleles encoding atypical NLRs with unique central tandem repeats in rice confer resistance to Xanthomonas oryzae pv. oryzae[J]. Plant Communications, 2020(4): 100088. DOI:10.1016/j.xplc.2020.100088 |
| [11] |
ANTOY G, ZHOU J H, HUANG S, LI T, LIU B, WHITE F, YANG B. Rice xa13 recessive resistance to bacterial blight is defeated by Induction of the disease susceptibility gene Os-11N3[J]. The Plant Cell, 2010, 22(11): 3864. DOI:10.1105/tpc.110.078964 |
| [12] |
ZHOU J H, PENG Z, LONG J Y, SOSSO D, LIU B, EOM J, HUANG S, LIU S Z, CRUZ C V, FORMMER W B, WHITE F F, YANG B. Gene targeting by the TAL effector PthXo2 reveals cryptic resistance gene for bacterial blight of rice[J]. Plant Journal, 2015, 82(4): 632-643. DOI:10.1111/tpj.12838 |
| [13] |
HU T M, SABOT F, GHESQUIERE A, KOEBNIK R, BORIS S. A knowledge-based molecular screen uncovers a broad spectrum OsSWEET14 resistance allele to bacterial blight from wild rice[J]. The Plant Journal, 2015, 84(4): 694-703. DOI:10.1111/tpj.13042 |
| [14] |
IYER A S, MCCOUCH S R. The rice bacterial blight resistance gene xa5 encodes a novel form of disease resistance[J]. Mol Plant Microbe Interact, 2004, 17(12): 1348-1354. DOI:10.1094/MPMI.2004.17.12.1348 |
| [15] |
TIAN D S, WANG J X, ZENG X, GU K Y, QIU C X, YANG X B, ZHOU Z Y, GOH M L, LUO Y C, MURATA H M, WHITE F F, YIN Z C. The rice TAL effector-dependent resistance protein Xa10 triggers cell death and calcium depletion in the endoplasmic reticulum[J]. The Plant Cell, 2014, 26(1): 497. DOI:10.1105/tpc.113.119255 |
| [16] |
WANG C L, ZHANG X P, FAN Y, GAO Y, ZHU Q L, ZHENG C K, QIN T F, LI Y Q, CHE J Y, ZHANG M W, YANG B, LIU Y G, ZHAO K J. Xa23 is an executor R protein and confers broad-spectrum disease resistance in rice[J]. Molecular Plant Pathology, 2015, 8: 290-302. DOI:10.1016/j.molp2014.10.010.DOI:10.1093/mp/ssu132 |
| [17] |
GU K Y, YANG B, TIAN D, WU L F, WANG D J, SREEKALA C, YANG F, CHU Z Q, WANG G L, WHITE F F, YIN Z C. R gene expression induced by a type-Ⅲ effffector triggers disease resistance in rice[J]. Nature, 2005, 435: 1122-1125. DOI:10.1038/nature03630 |
| [18] |
CHEN X F, LIU P, MEI L, HE X L, CHEN L, LIU H, SHEN S, JI Z D, ZHENG X X, ZHANG Y C, GAO Z Y, ZENG D L, QIAN Q, MA B J. Xa7, a new executor Rgene that confers durable and broadspectrum resistance to bacteria-blight disease in rice[J]. Plant Communications, 2021, 2: 100143. DOI:10.1016/j.xplc.2021.100143 |
| [19] |
LUO D P, HUGUET-TAPIA J C, RABORN R T, WHⅡTE F F, BRENDEL V P, YANG B. The Xa7 resistance gene guards the susceptibility gene SWEET14 of rice against exploitation by bacterial blight pathogen[J]. Plant Communications, 2021, 2: 100164. DOI:10.1016/j.xplc.2021.100164 |
| [20] |
XIANG Y, CAO Y L, XU C G, LI X H, WANG S P. Xa3, conferring resistance for rice bacterial blight and encoding a receptor kinase-like protein, is the same as Xa26[J]. Theoretical and Applied Genetics, 2006, 113(7): 1347-55. DOI:10.1007/s00122-006-0388-x |
| [21] |
SUN X Y, CAO Y L, YANG Z F, XU C G, LI X H, WANG S P, ZHANG Q F. Xa26, a gene conferring resistance to Xanthomonas oryzae pv. oryzae in rice, encodes an LRR receptor kinase-like protein[J]. Plant Journal, 2004(37): 517-527. DOI:10.1046/j.1365-313x.2003.01976.x |
| [22] |
HU K M, CAO J, ZHANG J, XIA F, K E Y G, ZHANG H T, XIE W Y, LIU H B, CUI Y, CAO Y L, SUN X L, XIAO J H, LI X H, ZHANG S P, WANG Q L. Improvement of multiple agronomic traits by a disease resistance gene via cell wall reinforcement[J]. Nature Plants, 2017(3): 17009. DOI:10.1016/j.molp.2014.10.010 |
| [23] |
SONG W Y, WANG G L, CHEN L L, KIM H S, PI L Y, HOLSTEN T, GARDNER J, WANG B, ZHAI W X, ZHU L H, FAUQUET C, RONALD P. A receptor kinase-like protein encoded by the rice disease resistance gene, Xa21[J]. Science, 1995(270): 1804-1806. DOI:10.1126/science.270.5243.1804 |
| [24] |
方中达, 许志刚, 过崇俭, 殷尚智, 伍尚忠, 徐羡明, 章琦. 中国水稻白叶枯病菌致病型的研究[J]. 植物病理学报, 1990(2): 3-10. DOI:10.13926/j.cnki.apps.1990.02.001 FANG Z D, XU Z G, GUO C J, YIN S Z, WU S Z, XU X M, ZHANG Q. Study on pathotypes of rice bacterial blight in China[J]. Acta Phytopathologica Sinica, 1990(2): 3-10. DOI:10.13926/j.cnki.apps.1990.02.001 |
| [25] |
王春连, 章琦, 周永力, 赵炳宇. 我国长江以南地区水稻白叶枯病原菌遗传多样性分析[J]. 中国水稻科学, 2001(2): 52-57. 16819/j.1001-7216.2001.02.010. WANG C L, ZHANG Q, ZHOU Y L, ZHAO B Y. Analysis of genetic diversity of rice bacterial blight pathogens in the south of the Yangtze River in China[J]. Chinese Journal of Rice Science, 2001 (2): 52-57. 16819/j.1001-7216.2001.02.010. |
| [26] |
李岗. 中国水稻白叶枯菌致病多样性和遗传多样性分析与avrBs3/pthA家族新成员介导的表型研究[D]. 南京: 南京农业大学, 2008. LI G. Analysis of pathogenic diversity and genetic diversity of rice bacterial blight in China and phenotypic study mediated by new members of the avrBs3/pthA family[D]. Nanjing: Nanjing Agricultural University, 2008. |
| [27] |
陈功友, 徐正银, 杨阳阳, 邹丽芳, 朱勃. 我国水稻白叶枯病菌致病型划分和水稻抗病育种中应注意的问题[J]. 上海交通大学学报, 2019, 37(1): 67-73. DOI:10.3969/j.issn.1671-9964.2019.01.012 CHEN G Y, XU Z Y, YANG Y Y, ZOU L F, ZHU B. Pathogeny classification of rice bacterial blight and problems needing attention in rice disease resistance breeding in China[J]. Journal of Shanghai Jiaotong University, 2019, 37(1): 67-73. DOI:10.3969/j.issn.1671-9964.2019.01.012 |
| [28] |
章琦, 王春连, 赵开军, 杨文才, 乔枫, 周永力, 江祺祥, 刘古春. 携有抗白叶枯病新基因Xa23水稻近等基因系的构建及应用(英文)[J]. 中国水稻科学, 2002(3): 9-13. DOI:10.16819/j.1001-7216.2002.03.002 ZHANG Q, WANG C L, ZHAO K J, YANG W C, QIAO F, ZHOU Y L, JIANG Q X, LIU G C. Construction and application of rice near isogenic lines carrying a new gene for bacterial blight resistance Xa23[J]. Chinese Journal of Rice Science, 2002(3): 9-13. DOI:10.16819/j.1001-7216.2002.03.002 |
| [29] |
章琦, 杨文才, 施爱农, 王春莲, 阙更生, 赵炳宇, 邢全党. 3个粳稻抗白叶枯病近等基因系的构建[J]. 作物学报, 1998(6): 799-804. DOI:10.3321/j.issn:0496-3490.1998.06.026 ZHANG Q, YANG W C, SHI A N, WANG C L, QUE G S, ZHAO B Y, XING Q D. Construction of three near isogenic lines of japonica rice resistant to bacterial blight[J]. Acta Agronomica Sinica, 1998(6): 799-804. DOI:10.3321/j.issn:0496-3490.1998.06.026 |
| [30] |
陈建民, 付志英, 权宝权, 田大刚, 李刚, 王锋. 分子标记辅助培育双抗稻瘟病和白叶枯病杂交稻恢复系[J]. 分子植物育种, 2009, 7(3): 465-470. CHEN J M, FU Z Y, QUAN B Q, TIAN D G, LI G, WANG F. Molecular marker assisted breeding of hybrid rice restorer lines with double resistance to rice blast and bacterial blight[J]. Molecular Plant Breeding, 2009, 7(3): 465-470. |
| [31] |
夏志辉, 赵显峰, 范海阔, 金良, 高利芬, 罗越华, 翟文学. 分子标记辅助选择Xa23基因改良杂交稻亲本的白叶枯病抗性[J]. 分子植物育种, 2010, 8(4): 652-656. XIA Z H, ZHAO X F, FAN H K, JIN L, GAO L F, LUO Y H, ZHAI W X. Molecular marker assisted selection of Xa23 gene to improve bacterial blight resistance of hybrid rice parents[J]. Molecular Plant Breeding, 2010, 8(4): 652-656. |
| [32] |
郑家团, 涂诗航, 张建福, 郑轶, 赵开军, 张水金, 谢华安. 含白叶枯病抗性基因Xa23水稻恢复系的分子标记辅助选育[J]. 中国水稻科学, 2009, 23(4): 437-439. DOI:10.3969/mpb.007.000465 ZHENG J T, TU S H, ZHANG J F, ZHENG Y, ZHAO K J, ZHANG S J, XIE H A. Molecular marker assisted selection of rice restorer line containing Xa23 bacterial blight resistance gene[J]. Chinese Journal of Rice Science, 2009, 23(4): 437-439. DOI:10.3969/mpb.007.000465 |
| [33] |
章琦, 赵炳宇, 赵开军, 王春连, 杨文才, 林世成, 阙更生, 周永力, 李道远, 陈成斌, 朱立煌. 普通野生稻的抗水稻白叶枯病(Xanthomonas oryzaepv.oryzae)新基因Xa-23(t) 的鉴定和分子标记定位[J]. 作物学报, 2000(5): 536-542. DOI:10.3321/j.issn:0496-3490.2000.05.004 ZHANG Q, ZHAO B Y, ZHAO K J, WANG C L, YANG W C, LIN S C, QUE G S, ZHOU Y L, LI D Y, CHEN C B, ZHU L H. Identification and molecular marker mapping of Xa-23 (t), a new gene for resistance to rice bacterial blight (Xanthomonas oryzaepv. oryzae) in common wild rice[J]. Acta Agronomica Sinica, 2000(5): 536-542. DOI:10.3321/j.issn:0496-3490.2000.05.004 |
| [34] |
章琦, 王春连, 赵开军, 杨文才, 乔枫, 周永力, 江祺祥, 刘古春. 携有抗白叶枯病新基因Xa23水稻近等基因系的构建及应用[J]. 中国水稻科学, 2002(3): 9-13. DOI:10.16819/J.1001-7216.2002.03.002 ZHANG Q, WANG C L, ZHAO K J, YANG W C, QIAO F, ZHOU Y L, JIANG Q X, LIU G C. Construction and application of rice nearisogenic lines carrying a new bacterial blight resistance gene Xa23[J]. Chinese Journal of Rice Science, 2002(3): 9-13. DOI:10.16819/J.1001-7216.2002.03.002 |
| [35] |
潘海军, 王春连, 赵开军, 章琦, 樊颖伦, 周少川, 朱立煌. 水稻抗白叶枯病基因Xa23的PCR分子标记定位及辅助选择[J]. 作物学报, 2003(4): 501-507. DOI:10.3321/j.issn:0496-3490.2003.04.005 PAN H J, WANG C L, ZHAO K J, ZHANG Q, FAN Y J, ZHOU S C, ZHU L H. PCR molecular marker mapping and assisted selection of rice bacterial blight resistance gene Xa23[J]. Acta Agronomica Sinica, 2003(4): 501-507. DOI:10.3321/j.issn:0496-3490.2003.04.005 |
| [36] |
王春连. 水稻抗白叶枯病基因Xa23的图位克隆[D]. 北京: 中国农业科学院, 2006. WANG C L. Mapping cloning of rice bacterial blight resistance gene Xa23[D]. Beijing: Chinese Academy of Agricultural Sciences, 2006. |
| [37] |
崔华. 水稻抗白叶枯病基因Xa23的进化机制及Xa23与HR功能相关的重要氨基酸的分析[D]. 北京: 中国农业科学院, 2018. CUI H. The evolutionary mechanism of rice bacterial blight resistance gene Xa23 and the analysis of important amino acids related to Xa23 and HR functions[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. |
| [38] |
RONALD P C, ALBANOl B, TABIEN R, ABENES L, WU K. S, MCCOUCH S, TANKSLEY S D. Genetic and physical analysis of the rice bacterial blight disease resistance locus Xa21[J]. Molecular and General Genetics, 1992(1): 113-120. DOI:10.1007/BF00279649 |
| [39] |
SIDHU G S, KHUSH G S, MEW T W. Genetic analysis of bacterial blight resistance in seventy-four cultivars of rice, Oryza sativa L[J]. Theoretical and Applied Genetics, 1978, 53: 105-111. DOI:10.1007/BF00272687 |
| [40] |
VERACRUZ C M, BAI J, ONA I, LEUNG H, NELSON R J, MEW T W, LEACH J E. Predicting durability of a disease resistance gene based on an assessment of the fifitness loss and epidemiological consequences of avirulence gene mutation[J]. Proceedings of the National Academy of Sciences, 2000, 97: 13500-13505. DOI: 10.1073/pnas.250271997.
|
| [41] |
WHITE F F, YANG B. Host and pathogen factors controlling the riceXanthomonas oryzae interaction[J]. Plant Physiology, 2009, 150: 1677-1686. DOI: 10.1073/pnas.250271997.
|
| [42] |
KAJI R, OGAWA T. Identifification of the located chromosome of the resistance gene, Xa7, to bacterial leaf blight in rice[J]. Breeding Science, 1995, 45: 79. |
| [43] |
PORTER B W, CHITTOOR J M, YANO M, SASAKI T, WHITE, F F. Development and mapping of markers linked to the rice bacterial blight resistance gene Xa7[J]. Crop Science, 2003, 43: 1484-1492. DOI:10.2135/cropsci2003.1484 |
| [44] |
CHEN S, HUANG Z, ZENG L X, YANG J Y, ZHU X Y. Highresolution mapping and gene prediction of Xanthomonas oryzae pv. oryzae resistance gene Xa7[J]. Molacular Breeding, 2008, 22: 433-441. DOI:10.1007/s11032-008-9187-1 |
| [45] |
LUO D, HUHUET-TAPIA J C, RABORN R T, WHITE F F. The Xa7 resistance gene guards the susceptibility gene SWEET14 of rice against exploitation by bacterial blight pathogen[J]. Plant Communications, 2021(2): 100164. DOI:10.1016/j.xplc.2021.100164 |
| [46] |
WANG C, CHEN S, FENG A, SU J, WANG W, FENG J, CHEN B, ZHANG M, YANG J, ZENG L, ZHU X. Xa7, a Small orphan gene harboring promoter trap for AvrXa7, Leads to the durable resistance to Xanthomonas oryzae Pv. oryzae[J]. Rice, 2021, 14(1): 48. DOI:10.1186/s12284-021-00490-z |
| [47] |
OGAWA T, YAMATO T, KHUSH G, M EW, T W. Breeding of nearisogenic lines of rice with single genes for resistance to bacterial blight pathogen (Xanthomonas campestris pv. or yzae)[J]. Japanese Jounral Breeding, 1991, 41: 523-529. DOI:10.1094/PDIS.2001.85.5.506 |
| [48] |
VERA C M, BAI J, ONA I, LEUNG H, NELSON R, MEW T W, LEACH J E. Predicting durability of a disease resistance gene based on an assessment of the fifitness loss and epidemiological consequences of avirulence gene mutation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97: 13500-13505. DOI: 101073/pnas.250271997.
|
| [49] |
HOPKINS C M, WHITE F F, CHOI S H, GUO A, LEACH J. E.. Identifification of a family of avirulence genes from Xanthomonas oryzae pv. oryzae[J]. Molecular Plant Microbe Interacionst, 1992(5): 451-459. DOI:10.1094/MPMI-5-451 |
| [50] |
ANTONY G, ZHOU J, HUANG S, LI T, LIU B, FRANK WHITE, YANG B. Rice xa13 recessive resistance to bacterial blight is defeated by induction of the disease susceptibility gene Os-11N3[J]. Plant Cell, 2010, 22: 3864-3876. DOI:10.1105/tpc.110.078964 |
| [51] |
ANTONY G, ZHOU J, HUANG S, LI T, LIU B, WHITE F, YANG B. Rice xa13 recessive resistance to bacterial blight is defeated by induction of the disease susceptibility gene[J]. New Phytology, 2010, 185: 568-576. DOI:10.1111/j.1469-8137.2009.03076.x |
| [52] |
COHEN S P, LIU H, ARGUESO C T, PERERIRA A, VERA CRUZ C, VERDIER V, LEACH J E. RNA-Seq analysis reveals insight into enhanced rice Xa7-mediated bacterial blight resistance at high temperature[J]. PLOS ONE, 2017, 12: 0187625. DOI:10.1371/journal.pone.0187625 |
| [53] |
DOSSA G S, QUIBOD I, ATIENZA-GRANDE G, OLIVA R, MSISS E, VERA CRUZ C, WYDRA K. Rice pyramided line IRBB67 (Xa4/Xa7) homeostasis under combined stress of high temperature and bacterial blight[J]. Science Report, 2020, 10: 683. DOI:10.1038/s41598-020-57499-5 |
| [54] |
IYER A S, MCCOUCH S R. The rice bacterial blight resistance gene xa5 encodes a novel form of disease resistance[J]. Molecular Plant Microbe Interacionst, 2004, 17: 1348-1354. DOI:10.1094/MPMI.2004.17.12.1348 |
| [55] |
BLAIR M W, GARRIS A J, IYER A S, CHAPMAN B, KRESOVICH S, MCCOUCH S R. High resolution genetic mapping and candidate gene identification at the xa5 locus for bacterial blight resistance in rice (Oryza sativa L.)[J]. Theor Appl Genet, 2003, 107(1): 62-73. DOI:10.1007/s00122-003-1231-2 |
| [56] |
钟义明, 江光怀, 陈学伟, 夏志辉, 李晓兵, 朱立煌, 翟文学. 水稻含隐性抗白叶枯病基因xa5的24kb片段的鉴定与基因预测[J]. 科学通报, 2003(19): 2057-2061. DOI:10.3321/j.issn:0023-074X.2003.19.011 ZHONG Y M, JIANG G H, CHEN X W, XIA Z H, LI X B, ZHU L H, ZHAI W X. Identification and gene prediction of 24kb fragment containing recessive bacterial blight resistance gene xa5 in rice[J]. Science Bulletin, 2003(19): 2057-2061. DOI:10.3321/j.issn:0023-074X.2003.19.011 |
| [57] |
IYER A S, JIANG H, HUANG L, MCCOUCH S R. Genetic and functional characterization of the rice bacterial blight disease resistance gene xa5[J]. Phytopathology, 2008, 98: 289-295. DOI:10.1094/PHYTO-98-3-0289 |
| [58] |
JIANG G H, XIA Z H, ZHOU Y L, WAN J, LI D Y, CHEN R S, ZHAO W X, ZHU L H. Testifying the rice bacterial blight resistance gene xa5 by genetic complementation and further analyzing xa5 (Xa5) in comparison with its homolog TFⅡA gamma1[J]. Mol Genet Genomics, 2006, 275(4): 354-66. DOI:10.1007/s00438-005-0091-7 |
| [59] |
兰艳荣, 王俊义, 王弋, 牟同敏. 分子标记辅助选择改良水稻光温敏核不育系201S的白叶枯病抗性[J]. 中国水稻科学, 2011, 25(2): 169-174. DOI:10.3969/j.issn.1001-7216.2011.02.008 LAN Y R, WANG J Y, WANG Y, MOU T M. Molecular marker assisted selection for improving bacterial blight resistance of photoperiod temperature sensitive genic male sterile line 201S in rice[J]. Chinese Journal of Rice Science, 2011, 25(2): 169-174. DOI:10.3969/j.issn.1001-7216.2011.02.008 |
| [60] |
WANG S, LIU W, LU D, LU Z, WANG X, XUE J, HE X. Distribution of bacterial blight resistance genes in the main cultivars and application of Xa23 in rice breeding[J]. Front Plant Science, 2020(11): 555228. DOI:10.3389/fpls.2020.555228 |
| [61] |
刘维, 何秀英, 廖耀平, 程永盛, 卢东柏, 陆展华, 陈钊明, 陈粤汉. 利用分子标记辅助选择育种(MAS)技术改良水稻恢复系粤恢826[J]. 南方农业学报, 2017, 48(10): 1748-1754. DOI:10.3969/j.issn.2095-1191.2017.10.04 LIU W, HE X Y, LIAO Y P, CHEN YS, LU D B, LU Z H, CHEN Z M, CHEN Y H. Improving rice restorer line Yuehui 826 by using molecular marker assisted selection breeding (MAS) technology[J]. Journal of Southern Agriculture, 2017, 48(10): 1748-1754. DOI:10.3969/j.issn.2095-1191.2017.10.04 |
| [62] |
刘玉晴. OsPR10A在Xa21介导的水稻白叶枯病抗性反应中的功能研究[D]. 保定: 河北农业大学, 2021. LIU Y Q. Study on the function of OsPR10A in Xa21 mediated resistance to rice bacterial blight[D]. Baoding: Hebei Agricultural University, 2021. |
| [63] |
黄大年, 朱冰, 杨炜, 薛锐, 肖晗, 田文忠, 李良材, 戴顺洪. 抗菌肽B基因导入水稻及转基因植株的鉴定[J]. 中国科学(C辑), 1997, 27(1): 55-62. HUANG D N, ZHU B, YANG W, XUE R, XIAO H, TIAN W Z, LI L C, DAI S H. Identifification of antimicrobial peptide B gene introduced into rice and transgenic plant[J]. Science in China (Series C), 1997, 27(1): 55-62. |
| [64] |
何利娟. 水稻OsWRKY28基因表达调控途径分析及其抗白叶枯病机理的探索[D]. 金华: 浙江师范大学, 2019. HE L J. Analysis on the regulation pathway of OsWRKY28 gene expression in rice and exploration on the mechanism of resistance to bacterial blight[D]. Jinhua: Zhejiang Normal University, 2019. |
| [65] |
张小红, 王春连, 李桂芬, 张小科, 梁云涛, 孙亮庆, 赵开军. 转Xa23基因水稻的白叶枯病抗性及其遗传分析[J]. 作物学报, 2008, 34(10): 1679-1687. DOI:10.1093/dnares/3.5.297 ZHANG X H, WANG C L, LI G F, ZHANG X K, LIANG Y T, SUN L Q, ZHAO K J. Genetic analysis on bacterial blight resistance of Xa23-transgenic rice[J]. Acta Agronomic Sinica, 2008, 34(10): 1679-1687. DOI:10.1093/dnares/3.5.297 |
| [66] |
SA J S, UMEH Y, KURATA N, ASHIKAWA I, SASAKI T. Construction of YAC contigs on rice chromosome 5[J]. DNA Research, 1996(3): 297-302. DOI:10.1093/dnares/3.5.297 |
| [67] |
YANG B, WHITE F F. Diverse members of the AvrBs3/PthA family of type Ⅲ effectors are major virulence determinants in bacterial blight disease of rice[J]. Molocular Plant-Microbe Interact, 2004, 17: 1192-1200. DOI:10.1094/MPMI.2004.17.11.1192 |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49