文章信息
基金项目
- 广东省重点领域研发计划项目(2020B0202090003);广东省自然科学基金(2021A1515010820); 广东省现代农业产业技术体系水稻产业创新团队项目(2022KJ105);广东省学科类重点实验室运行经费项目(2020B1212060047)
作者简介
- 潘朝阳(1995—),男,在读硕士生,研究方向为植物表型组学研究,E-mail:1063039190@qq.com; 陆展华, 博士, 副研究员, 广东省农业科学院水稻研究所水稻抗病育种研究室副主任(主持工作), 主要从事水稻抗病遗传和育种研究。主持中国博士后科学基金、广东省自然科学基金、广东省驻镇帮镇扶村科技特派员项目、广州市科技计划等项目10项, 参加国家、广东省重点研发项目等各级项目15项。近年来在 The Plant Journal 等国内外期刊发表研究论文20余篇, 其中第一作者或通信作者10篇。获广东省农业技术推广奖1项, 广东省农业科学院科学技术奖1项。作为主要完成人育成水稻品种39个次、鉴定不育系3个.
通讯作者
- 陆展华(1987—),男,博士,副研究员,研究方向为水稻遗传育种,E-mail:aaslzh@163.com.
文章历史
- 收稿日期:2022-07-22
2. 华中农业大学植物科学技术学院, 湖北 武汉 430070
2. College of Plant Science and Technology, Huazhong Agricultural University, Wuhan 430070, China
表型组学是利用多尺度、多维度的全方位数据,包括空间尺度上小至核苷酸序列和细胞,大至组织、器官、个体、群体及整个生育期的时间维度信息,系统地研究某一生物或细胞在各种不同环境条件下所有表型的学科[1]。随着植物表型获取技术和设备的不断完善,以及基因组学、蛋白组学、代谢组学、生物信息学和大数据计算的快速发展,高通量表型组学分析在种质资源鉴定、遗传图谱绘制、功能基因挖掘等方面发挥着越来越重要的作用[2]。
表型组学的优势和潜力还体现在多组学研究的交叉结合与关联分析,可针对植物的细胞、组织、器官和群体等不同层面以及不同生长发育时期进行综合分析,以绘制各项生命活动过程中的调控网络,解析植物的生物学规律,真正服务于农业生产[3]。因此,充分挖掘基因组、转录组和蛋白质组等各种组学的信息,加快高通量、高分辨率的表型研究,对全面了解基因型、表型和环境之间的关系,发现并揭示植物重要基因的功能,加强和提升我国在植物功能基因组及作物遗传改良领域的地位具有非常重要的意义。
表型是基因型与环境相互作用的产物。由于表型本身的复杂性和动态变化,研究者通常只专注于少数几个表型进行研究,而且传统研究过程中表型数据的获取依靠人工或简单设备测量,劳动量大、效率低,易受主观因素影响。随着不同尺度表型组学研究平台的发展,表型组学通过多尺度传感器、光学成像技术可以高通量、精准获取作物表型数据,已在水稻、玉米、大豆等主要粮油作物株高测量、叶面积指数测定、植物病虫害监测、产量估测等研究领域运用[3-5],实现了农作物产量、抗性等重要农艺性状的解析,为农作物育种、栽培和精准农业提供基于大数据的决策支持[5-7],对作物育种领域复杂的田间表型鉴定具有重要的借鉴意义。
本文综述了表型组学的发展历程及其在农作物研究领域中的应用,深入剖析了其在农作物根系、冠层结构、生物和非生物胁迫研究中的应用,旨在为农作物田间表型数据的高通量获取和解析提供依据,加速表型组学在农作物育种中的应用。
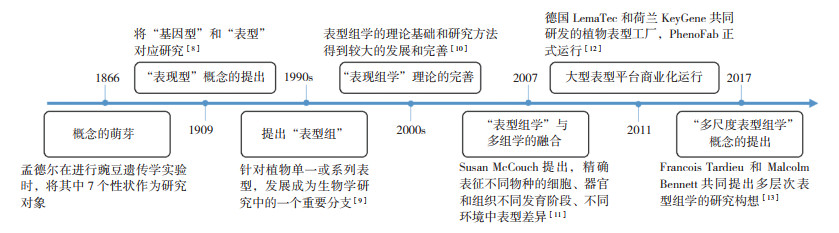
1 表型组学发展历程“表型”一词体现了所研究的性状变异的遗传来源以及非遗传来源(通常指环境)之间的相互作用[8]。早在1866年,孟德尔将豌豆的7个性状作为“表型”研究“遗传因子”,开启近代遗传学研究进程。1909年丹麦生物学家约翰逊将孟德尔提出的“遗传因子”定义为“基因”,正式提出“表现型”这一概念:一种特定的基因型可能表现不同的表现型,而一个特定的表型可能对应不同的基因型[8]。20世纪90年代,针对植物单一或系列表型(phenome)的研究开始受到广泛关注,并逐渐发展成为生物学研究中的一个重要分支[9]。21世纪初,相对于单一性状,植物表型组能为植物研究提供全面的科学证据,尤其是伴随着基因组学的快速发展,表型组学的理论基础和研究方法得到较大完善[10]。2007年,美国康奈尔大学植物分子遗传育种学家Susan McCouch认为,表型组学研究应与高分辨率连锁图谱、全基因组关联分析和基因组选择模型等技术紧密结合,通过建立强大的表型分型系统,精确表征不同物种的细胞、器官和组织在不同发育阶段、不同环境中的表型差异[11],表型组学研究已从细胞层面上升到群体层面。2011年,德国LemnaTec公司和荷兰KeyGene公司共同研发的植物表型工厂PhenoFab正式运行,标志着大型表型平台正式应用于商业化育种[12]。截至2020年,国内外众多科研单位建立了高通量的表型组学研究平台,如澳大利亚植物表型研究中心(APPF)、德国Jülich植物表型研究中心(JPPC)、英国国家植物表型研究中心(NPPC)、加拿大植物表型与影像研究中心(P2IRC),以及我国的华中农业大学作物表型中心、南京农业大学植物表型学研究中心等,大大加速了表型组学的应用和发展。2017年,法国植物表型协会主席、法国国家农业研究院(INRA)作物生理生态学家Francois Tardieu和英国诺丁汉大学植物学家Malcolm Bennett共同提出多尺度表型组(Multiscale phenomics)研究的构想(图 1) [13]。从概念提出至今,表型组学以其强大的数据获取和解析能力持续致力于研究环境、基因和表型之间的相互作用,广泛应用于基础研究和应用基础研究。
|
| 图 1 表型组学的发展历程 Fig. 1 Development history of phenomics |
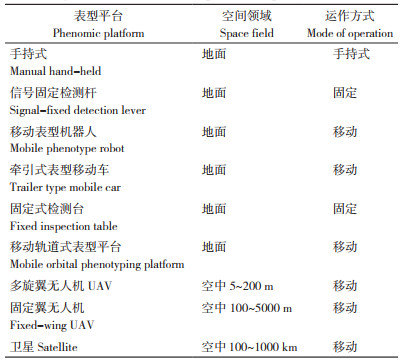
2 高通量表型平台和成像系统技术研究进展 2.1 表型平台的空间领域与运作方式分类概述
随着机器人技术、传感器技术、高通量成像技术的快速发展,植物表型组学的研究已经进入高通量、高精度、自动化、无损伤的大数据时代[13]。根据空间领域和运作方式,表型平台可分为手持式、信号固定检测杆、移动表型机器人、牵引式表型移动车、固定式检测台、移动轨道式表型平台、小型无人机、固定翼无人机、卫星遥感等(表 1)。其中,手持式配有数据采集系统,该系统可以搭载数码相机、多光谱和热敏传感器等传感器来获取相应的表型特征[14];该方式方便灵活,但费时、费力、通量较低。无人车的优势是可以携带更大的电源和不同种类的传感器,使得传感器的测量不受限于光照条件,但缺点是通量较低以及对土壤条件不敏感[15]。轨道表型平台将RGB相机、多光谱/ 超光谱相机以及热相机和激光传感器等安装在轨道上,它的优势是可以同时监测不同的性状,并对农作物生长、生理、形态等进行无损检测[16]。农业机器人已逐渐成为助推智能农机升级、智慧农业产业快速发展的重要抓手,也是我国追赶国际技术前沿的战略机遇[17-18]。无人机遥感系统可以高通量地获取多个地块的高时空分辨率图像,精准分析农业气象条件、土壤条件、作物表型等参数的空间变异性及其相互关系。无人机遥感系统已被应用于农作物覆盖度、株高、倒伏面积、生物量、叶面积指数、冠层温度等农情信息的监测研究[19]。这些表型获取平台已实现从宏观到微观多个尺度,全方位服务于作物学研究和农业生产领域。
一般来说,通过地面可以获得更高分辨率的图像,对农作物的性状特征捕获地更为详细,但地面平台在覆盖范围较小、工作效率不高。与地面表型平台相比,空中表型平台能够以相对较高的效率来获取图像,而且覆盖区域更大。但空中表型平台没有统一的使用标准,这些都制约着表型组学的大规模应用。
2.2 表型平台成像系统概述图像采集技术是表型组学的重要基础。根据不同的研究需要,针对不同组织器官的特征以及图像性质,可以将图像采集技术分为二维和三维(表 2)。二维图像采集主要集中于可见光、高光谱、多光谱等不同光谱下的光学成像,利用植物在不同光谱波段对光的吸收反射特性来提取相关的表型参数。在众多成像技术中,RGB成像是最受欢迎的方法,不仅可应用于反映植物形态结构特征,还可应用于病原菌胁迫表型分析[11, 21-22]。多光谱和高光谱相机依赖于太阳辐射与农作物之间的光谱反射作用,可以用来监测病虫害、产量等表型性状[20, 23-25]。由于太阳辐射被叶片色素(如叶绿素)吸收,单叶或冠层在可见光光谱范围的反射率较低,在绿色光谱区域的反射率峰值约为550 nm,反射率随着可见光谱区向近红外光谱区过渡而急剧增加[26-27]。热成像相机可用于测量热光谱红外区域的红外辐射,作为水分胁迫重要指标之一[21]。
激光雷达是一种新兴的主动遥感技术,能够精确获取农作物的空间形态数据,在高通量农作物表型监测中有广阔应用前景,激光雷达通过集成高分辨率相机、热成像仪、高光谱成像仪等传感器,能够通量化同步获取农作物各生长时期的多源表型数据,并提取株高、株幅、叶长、叶宽、叶倾角和叶面积等参数,为植物生物学和基因组学分析提供数据支持[28-29]。X射线CT成像技术在根系和茎秆结构研究中得到了较好应用。CT最重要的组成部分是X射线源、样品台、检测器和重建算法[30]。当X射线穿过样品时与样品材料相互作用,被吸收或被散射,密度更大的材料和质量更大的元素往往会造成更高的衰减。这种X射线强度的变化被探测器以X射线照相的形式捕捉到,最终生成样本内部结构的体积图,从而实现无损检测。
3 表型组学在作物研究领域的应用作物学研究涉及到大量田间表型数据,传统的田间性状调查通常需要对单株单一性状进行逐一调查,易受主观因素、测量工具和环境的影响,无法满足全基因组、转录组等各种组学的需要,而且传统的作物生长分析往往采用破坏性的采样方式。随着表型组学的快速发展,基于图像的表型技术利用数字图像来表征植物的形态和生理反应,可以在短时间内通过图像处理计算分析出植物的表型参数。此外,高通量表型组学研究设施集传送系统、采集相机、控制系统及分析存储系统于一体,能够全自动、无损伤地获取植物全生育期的多维度表型信息[1, 12]。随着传感器成本的下降和计算机处理能力的提升,以及获取大量复杂表型的传感器的自动表型平台的开发,高通量表型技术在农作物育种应用中显示出巨大潜力[13]。
3.1 表型组学在作物根系研究中的应用了解根系的结构及其发育过程对解析植物适应性机制和应答机制的分子遗传机理具有重要作用。Shi等[34]采用特殊的长通滤波器,对在透明培养皿表面生长的根部进行近红外(NIR)成像监测其根系生长,结果显示白光会触发向光反应,而通过使用NIR滤光片则可以避免光效应,从而确认该方法适合无干扰检测黑暗中的根系研究。梁丽秀等[35]基于Matlab算法进行根系的图像分割,将获得的水稻根系图像先进行预处理,然后建立主干-分支的连接算法进行自适应阈值分割图像,获取根系的结构特征。Bodenr等[36]提出基于微根窗技术、自动传送技术、图像处理以及计算机大规模运算技术于一体的高通量植物根系表型系统,根系表型装置根桶(Rhizo tube)的出现可以满足高通量、快速的表型分析要求。但微根窗技术所获得的图像噪点多、画质不清晰,制约其大规模应用。CT技术广泛应用于医学、材料学研究中,近年来也应用于农业和植物科学研究(图 2)。CT可以对根系进行高通量、无损检测,增加根与土壤的对比度,再利用中值滤波和边缘算法分离根段。Tardieu等[37]运用X射线CT成像技术建立了水稻根系构型(Root system architecture,RSA)可视化高通量处理流程,对土壤中根系进行细致无损的观察。基于X射线CT成像技术的无损、高通量优点,该技术被逐渐应用于茎秆、稻穗、籽粒3D表型性状的研究,促进了水稻功能基因组和农作物育种技术的发展。

|
| A:番茄根部木质部结构形态(红色),出现明显的栓塞现象,影响水的运输[38];B:番茄叶柄中的维管细胞结构影响水和同化物向叶片流动[39];C:叶片结构决定CO2和H2O的运输[40];D:番茄种子结构影响种子发芽[41];E:番茄细胞的形状、大小和细胞间隙影响成熟期呼吸气体的交换 A: Morphology of xylem structure (red) in tomato root with significant embolism occurs, affecting water transport[38]; B: Cellular structure of vasculature in a tomato leaf petiole affects the flux of water and assimilate to leaves[39]; C: Leaf structure determines CO2 and H2O transport[40]; D: Tomato seed structure affects seed germination[41]; E: Shape and size of tomato cells and intercellular spaces affect respiratory gas exchange during ripening 图 2 CT技术在作物研究中的应用[30] Fig. 2 Application of CT in crop research[30] |
3.2 表型组学在作物冠层生物量估测中的应用
作物冠层结构和生物量直接决定了作物的产量水平。目前基于冠层结构的光学图像分析已应用于多种粮食作物研究,为产量预测提供重要依据[42]。唐延林等[43]对水稻抽穗后不同时期冠层的高光谱反射率进行研究,结果表明高光谱遥感方法可以应用于水稻产量估测,其中以高光谱植被指数R990-R440、R1200-R440的效果最佳。Jin等[29]利用定位定向系统算法,将AquaCrop模型与光学和雷达成像数据相结合,开发了一种冬小麦产量估算方法,结果表明预测产量与实测产量之间存在高度相关性。Zhang等[44]以农作物冠层高光谱遥感机理为基础,融合新型特征选择算法与迁移学习技术,提出冬小麦叶片叶绿素含量反演新方法。Liang等[45]基于无人机多光谱影像构建了水稻冠层氮含量提取模型,利用该模型可以高效提取不同水稻品种在全生育期内的冠层氮含量变化曲线,进而筛选出氮高效利用的水稻品种。无人机拍摄RGB图像基于运动恢复结构(Motion recovery structure)也可以估算农作物的冠层高度,并运用支持向量机、随机森林、逻辑回归3种算法来验证估产的精度[46-47]。可见,利用无人机等方法获取的作物冠层结构光学数据对产量构成要素的评估具有重要应用价值。
3.3 表型组学在作物非生物胁迫研究中的应用非生物胁迫是影响作物丰产稳产性的重要因素之一。农作物在生殖期和灌浆期对高温和干旱胁迫高度敏感,在此期间遭受胁迫会导致农作物产量显著降低[48]。Klein等[49]使用Scanalyzer 3D表型分析系统每隔7 d拍摄1次可见光和NIR波长下3张正交图像,发现RGB图像可以更好地识别植物形态,而NIR图像可以揭示叶片水分含量。通过图像分析可检测到的叶片萎蔫,也可以成为水分胁迫的一个指标。Zhou等[50]利用RGB相机、红外热像仪和多光谱相机组成的无人机成像系统,对116个基因型的大豆生育期影像数据进行分析,通过提取归一化差异植被指数(NDVI)、绿基NDVI(gNDVI)、温度、色相、颜色饱和度、冠层大小和株高等7个图像特征来量化冠层萎蔫状态。
另一种估算水分胁迫的方法是使用基于高光谱或多光谱图像的模型或指数。Laraswati等[51]基于图像的表型分析方法结合选择指数和多变量分析,在短时间内轻松表征水稻形态变化,并将这种方法应用于干旱胁迫下的水稻品种筛选。利用低空无人机搭载超高清可见光相机的方式,还可高通量(5 min约400个小区)、高频次(每天多次采集数据)获取大田动态表型性状,突破了大田水稻干旱表型性状采集的技术瓶颈,有效提高了数据采集的效率和精准度,使田间复杂农艺性状的高通量获取和解析成为可能。
3.4 表型组学在作物生物胁迫研究中的应用病虫害的发生也是造成作物产量损失和品质下降的重要因素之一。因此,在病虫害发生初期进行预警,对作物的丰产稳产具有重要作用。在特定的环境条件和管理措施下,早期植物密度是决定基因型发展的基本性状[52]。利用数字图像处理技术在无控制条件下识别多种植物病害是Barbedo等提出的[22, 53]。Zhang等[54]采用可见近红外高光谱成像仪采集感染水稻白叶枯病后不同时间的叶片光谱图像,根据光谱指数简单算式的计算结果,对不同基因型水稻品种在不同染病时间的病害等级,利用光谱特征进行了快速定性评价。Guo等[55]利用数码相机观察褐飞虱和白背飞虱取食过程中水稻幼苗的颜色变化,并通过数字图像分析法得出基于红-绿-蓝反射率和植被指数的排序方法比基于色调的饱和度和亮度的两种颜色指数更能区分品种间的损伤反应。虽然有许多成像技术可用于识别农作物病虫害,但正确使用分析这些图像并对其进行分类的算法也在整个过程中发挥着重要作用。
4 表型组学研究展望表型组学概念提出后,已随着多组学、跨学科交叉融合技术的飞速发展,极大地促进了功能基因组学的研究。近年来,一些大型的表型组学研究装置、装备以及大数据分析平台的建设进一步推动了表型组学的发展和应用。但是目前仍存在一些尚待解决的问题,如多功能、高通量的表型鉴定平台可以获取大量的数据资料,但数据的储存和解析需要多设备和分析技术的支撑。为提高表型组学成像系统所采集到图像的质量、分辨率和维度数,已研发出大量仪器设备和分析平台,但这些仪器设备成本较高且不能同时保证多种参数的数据质量,限制其更广泛的应用[56]。因此,成像传感器、图形处理器和计算机视觉技术的不断提升,仍是未来表型组学需要不断突破的方向之一。
对表型组学来说,多元数据的综合分析可以解释一些新的生物学现象,这就要求在表型设施平台建设及数据采集方面应尽量多考虑多种类型数据的采集。由于单个传感器获取的数据特征有限,通过结合多种成像传感器或成像技术以获得更多的表型特征和更全面的数据集,从不同层面、不同尺度揭示更多常规手段难以挖掘的调控机制,从而突破单一成像技术的局限性[1]。因此,除了多组学技术的深度融合外,利用不同测量设备的组合分析,全面解析作物生长发育规律也将成为表型组学研究的发展趋势。
近地面表型平台在特定表型获取中具有极大的潜力,如车载平台、导轨式平台以及观测塔等,然而其难以完成跨区域作业,并且工作效率和时空分辨率仍受较大限制。相对于这些技术,无人机遥感平台凭借机动灵活、成本低、空间覆盖广等优势,对田间表型的获取可操作性更高,并且能够快速准确地监测田间农作物的生长变化[57-58]。无人机通过搭载可见光、高光谱、激光雷达等先进传感器,为高效获取各类植物表型数据(包括生物量、冠层覆盖度、株高、叶面积指数和氮含量等)提供了可行途径,已逐渐成为获取作物田间表型的重要手段[44-47]。因此,随着大数据存储和解析技术的提高,以无人机为代表的近地遥感高通量表型平台,将在未来作物表型尤其是株型、产量、收获指数等复杂农艺性状研究中发挥重要作用。
| [1] |
胡伟娟, 傅向东, 陈凡, 杨维才. 新一代植物表型组学的发展之路[J]. 植物学报, 2019, 54(5): 558-568. DOI:10.11983/CBB19141 HU W J, FU X D, CHEN F, YANG W C. A path to next generation of plant phenomics[J]. Chinese Bulletin of Botany, 2019, 54(5): 558-568. DOI:10.11983/CBB19141 |
| [2] |
玉光惠, 方宣钧. 表型组学的概念及植物表型组学的发展[J]. 分子植物育种, 2009, 7(4): 639-645. DOI:10.3969/mpb.007.000639 YU G H, FANG X G. The concept of phenomics and the development of plant phenomics[J]. Molecular Plant Breeding, 2009, 7(4): 639-645. DOI:10.3969/mpb.007.000639 |
| [3] |
周济, FRANCOIS T, TONY P, JOHN D, DANIEL R, NEIL H, SIMON G, 程涛, 朱艳, 王秀娥, 姜东, 丁艳锋. 植物表型组学: 发展、现状与挑战[J]. 南京农业大学学报, 2018, 41(4): 580-588. DOI:10.7685/jnau.201805100 ZHOU J, FRANCOIS T, TONY P, JOHN D, DANIEL R, NEIL H, SIMON G, CHENG T, ZHU Y, WANG X E, JIANG D, DING Y F. Plant phenotyping: development, status and challenges[J]. Journal of Nanjing Agricultural University, 2018, 41(4): 580-588. DOI:10.7685/jnau.201805100 |
| [4] |
袁培森, 薛铭家, 熊迎军, 翟肇裕, 徐焕良. 基于无人机高通量植物表型大数据分析及应用研究综述[J]. 农业大数据学报, 2021, 3(3): 62-75. DOI:10.19788/j.issn.2096-6369.200307 YUAN P S, XUE M J, XIONG Y J, ZHAI ZH Y, XU HU L. Summary of high-throughput plant phenotype big data analysis application research based on UAV[J]. Journal of Agricultural Big Data, 2021, 3(3): 62-75. DOI:10.19788/j.issn.2096-6369.200307 |
| [5] |
傅友强, 钟旭华, 黄农荣, 潘俊峰, 胡香玉, 胡锐, 李妹娟, 梁开明. 基于无人机多光谱遥感的水稻冠层光谱特征和氮素营养关系研究[J]. 广东农业科学, 2021, 48(10): 121-131. DOI:10.16768/j.issn.1004-874X.2021.10.013 FU Y Q, ZHONG X H, HUANG N R, PAN J F, HU X Y, HU R, LI M G, LIANG K M. Study on the relationship between spectral characteristics of rice canopy and nitrogen nutrition based on UAV multispectral remote sensing[J]. Guangdong Agricultural Sciences, 2021, 48(10): 121-131. DOI:10.16768/j.issn.1004-874X.2021.10.013 |
| [6] |
肖汉祥, 李燕芳, 袁龙宇, 张振飞. 我国农用无人机在水稻生产中的应用现状与展望[J]. 广东农业科学, 2021, 48(8): 139-147. DOI:10.16768/j.issn.1004-874X.2021.08.017 XIAO H X, LI Y F, YUAN L Y, ZHANG ZH F. Application status and prospect of agricultural UAV in rice production in China[J]. Guangdong Agricultural Sciences, 2021, 48(8): 139-147. DOI:10.16768/j.issn.1004-874X.2021.08.017 |
| [7] |
徐兴, 徐胜, 刘永鑫, 陈佳森, 蔡仲勋, 余展韶. 小型无人机机载农药变量喷洒系统设计[J]. 广东农业科学, 2014, 41(9): 207-210. DOI:10.16768/j.issn.1004-874X.2014.09.018 XU X, XU SH, LIU Y X, CHEN J S, CAI ZH X, YU ZH SH. Design of small UAV airborne pesticide variable spraying system[J]. Guangdong Agricultural Sciences, 2014, 41(9): 207-210. DOI:10.16768/j.issn.1004-874X.2014.09.018 |
| [8] |
DE VIENNE D. What is a phenotype? History and new developments of the concept[J]. Genetica, 2022, 150(3/4): 153-158. DOI:10.1007/s10709-021-00134-6 |
| [9] |
BILDER R M, SABB F W, CANNON T D, LONDON E D, JENTSCH J D, PARKER D S, POLDRACK R A, EVANS C, FREIMER N B. Phenomics: the systematic study of phenotypes on agenome-wide scale[J]. Neuroscience, 2009, 164(1): 30-42. DOI:10.1016/j.neuroscience.2009.01.027 |
| [10] |
COBB J N, DECLERCK G, GREENBERG A, CLARK R, MCCOUCH S. Next-generation phenotyping: requirements and strategies for enhancing our understanding of genotype-phenotype relationships and its relevance to crop improvement[J]. Theoretical and Applied Genetic, 2013, 126(4): 867-87. DOI:10.1007/s00122-013-2066-0 |
| [11] |
CASAGRANDE C R, SANTANA G C, MEDA A R, GARCIA A, SOUZA CARNEIRO P C, NARDINO M, BOREM A. Association between unmanned aerial vehicle high‐throughput canopy phenotyping and soybean yield[J]. Agronomy Journal, 2022, 114(3): 1581-1598. DOI:10.1002/agj2.21047 |
| [12] |
YAMAGISHI Y, KATO Y, NINOMIYA S, GUO W. Image-based phenotyping for non-destructive in situ rice (Oryza sativa L.) tiller counting using proximal sensing[J]. Sensors (Basel), 2022, 22(15). DOI:10.3390/s22155547 |
| [13] |
PERSA R, RIBEIRO P D, JARQUIN D. The use of high-throughput phenotyping in genomic selection context[J]. Crop Breeding and Applied Biotechnology, 2021, 21(S): e38592156. DOI:10.1590/1984-70332021v21sa19 |
| [14] |
WANG L, JIN J, SONG Z, WANG J, ZHANG L, REHMAN T U M D, CARPENTER N R, TUINSTRA M R. LeafSpec: an accurate and portable hyperspectral corn leaf imager[J]. Computers and Electronics in Agriculture, 2020, 169: 105209. DOI:10.1016/j.compag.2019.105209 |
| [15] |
IQBAL J, XU R, HALLORAN H, LI C. Development of a multi-purpose autonomous differential drive mobile robot for plant phenotyping and soil sensing[J]. Electronics, 2020, 9(9): 1550. DOI:10.3390/electronics9091550 |
| [16] |
KIM S L, KIM N, LEE H, LEE E, CHEON K S, KIM M, BAEK J, CHOI I, JI H, YOON I S, JUNG K H, KWON T R, KIM K H. High-throughput phenotyping platform for analyzing drought tolerance in rice[J]. Planta, 2020, 252(3): 38. DOI:10.1007/s00425-020-03436-9 |
| [17] |
刘成良, 贡亮, 苑进, 李彦明. 农业机器人关键技术研究现状与发展趋势[J]. 农业机械学报, 2022, 53(7): 1-22, 55. DOI:10.6041/j.issn.1000-1298.2022.07.001 LIU C L, GONG L, YUAN J, LI Y M. Research status and development trend of key technologies of agricultural robots[J]. Transactions of the Chinese Society for Agricultural Machinery, 2022, 53(7): 1-22, 55. DOI:10.6041/j.issn.1000-1298.2022.07.001 |
| [18] |
李丹丹, 史云, 李会宾, 韩伟, 段玉林, 吴文斌. 农业机器人研究进展评述[J]. 中国农业信息, 2018, 30(6): 1-17. DOI:10.12105/j.issn.1672-0423.20180601 LI D D, SHI Y, LI H B, HAN W, DUAN Y L, WU W B. Review on research progress of agricultural robots[J]. China Agricultural Informatics, 2018, 30(6): 1-17. DOI:10.12105/j.issn.1672-0423.20180601 |
| [19] |
韩文霆, 张立元, 牛亚晓, 史翔. 无人机遥感技术在精量灌溉中应用的研究进展[J]. 农业机械学报, 2020, 51(2): 1-14. DOI:10.6041/j.issn.1000-1298.2020.02.001 HAN W T, ZHANG L Y, NIU Y X, SHI X. Research progress of UAV remote sensing technology in precision irrigation[J]. Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(2): 1-14. DOI:10.6041/j.issn.1000-1298.2020.02.001 |
| [20] |
SHAKOOR N, LEE S, MOCKLER T C. High throughput phenotyping to accelerate crop breeding and monitoring of diseases in the field[J]. Current Opinion in Plant Biology, 2017, 38: 184-192. DOI:10.1016/j.pbi.2017.05.006 |
| [21] |
JOALLAND S, SCREPANTI C, LIEBISCH F, VARELLA H V, GAUME A, WALTER A. Comparison of visible imaging, thermography and spectrometry methods to evaluate the effect of heterodera schachtii inoculation on sugar beets[J]. Plant Methods, 2017, 13: 73. DOI:10.1186/s13007-017-0223-1 |
| [22] |
谢鹏尧, 富昊伟, 唐政, 麻志宏, 岑海燕. 基于RGB图像的冠层尺度水稻叶瘟病斑检测与抗性评估[J]. 浙江大学学报(农业与生命科学版), 2021, 47(4): 415-428. DOI:10.3785/j.issn.1008-9209.2021.05.131 XIE P Y, FU H W, TANG Z H, MA Z H, CEN H Y. Canopy scale rice leaf blast spot detection and resistance evaluation based on RGB images[J]. Journal of Zhejiang University (Agriculture and Life Sciences), 2021, 47(4): 415-428. DOI:10.3785/j.issn.1008-9209.2021.05.131 |
| [23] |
SOUZA A, YANG Y. High-throughput corn image segmentation and trait extraction sing chlorophyll fluorescence images[J]. Plant Phenomics, 2021, 2021: 9792582. DOI:10.34133/2021/9792582 |
| [24] |
ZHAO X H, ZHANG J C, HUANG Y B, TIAN Y Y, LIN Y. Detection and discrimination of disease and insect stress of tea plants using hyperspectral imaging combined with wavelet analysis[J]. Computers and Electronics in Agriculture, 2022, 193: 106717. DOI:10.1016/j.compag.2022.106717 |
| [25] |
ŻELAZNY W R, CHRPOVá J, HAMOUZ P. Fusarium head blight detection from spectral measurements in a field phenotyping setting a pre-registered study[J]. Biosystems Engineering, 2021, 211: 97-113. DOI:10.1016/j.biosystemseng.2021.08.019 |
| [26] |
KUMAGAI E, BURROUGHS C H, PEDERSON T L, MONTES C M, PENG B, KIMM H, GUAN K, AINSWORTH E A, BERNACCHI C J. Predicting biochemical acclimation of leaf photosynthesis in soybean under in-field canopy warming using hyperspectral reflectance[J]. Plant Cell Environment, 2022, 45(1): 80-94. DOI:10.1111/pce.14204 |
| [27] |
LU N, WU Y, ZHENG H, YAO X, ZHU Y, CAO W, CHENG T. An assessment of multi-view spectral information from UAV-based color-infrared images for improved estimation of nitrogen nutrition status in winter wheat[J]. Precision Agriculture, 2022, 23(5): 1653-1674. DOI:10.1007/s11119-022-09901-7 |
| [28] |
郭庆华, 吴芳芳, 庞树鑫, 赵晓倩, 陈琳海, 刘瑾, 薛宝林, 徐光彩, 李乐, 景海春, 储成才. Crop 3D- 基于激光雷达技术的作物高通量三维表型测量平台[J]. 中国科学: 生命科学, 2016, 46(10): 1210-1221. DOI:10.1360/N052016-00009 GUO Q H, WU F F, PANG S X, ZHAO X Q, CHEN L H, LIU J, XUE B L, XU G C, LI L, JING H C, CHU C C. Crop 3D-a high-throughput three-dimensional phenotype measurement platform based on lidar technology[J]. Scientia Sinica (Vitae), 2016, 46(10): 1210-1221. DOI:10.1360/N052016-00009 |
| [29] |
JIN X L, KUMAR L, LI Z, FENG H, XU X, YANG G, WANG J. A review of data assimilation of remote sensing and crop models[J]. European Journal of Agronomy, 2018, 92: 141-152. DOI:10.1016/j.eja.2017.11.002 |
| [30] |
PIOVESAN A, VANCAUWENBERGHE V, VANDELOOVERBOSCH T, VERBOVEN P, NICOLAI B. X-ray computed tomography for 3D plant imaging[J]. Trends in Plant Science, 2021, 26(11): 1171-1185. DOI:10.1016/j.tplants.2021.07.010 |
| [31] |
TAN J, DE ZUTTER N, DESAEGER S, DEBOEVRE M, TRAN T M, VANDERLEE T, WAALWIJK C, WILLEMS A, VANDAMME P, AMEYE M, AUDENAERT K. Presence of the weakly pathogenic fusarium poae in the fusarium head blight disease complex hampers biocontrol and chemical control of the virulent fusarium graminearum pathogen[J]. Frontiers in Plant Science, 2021, 12: 641890. DOI:10.3389/fpls.2021.641890 |
| [32] |
JIN X L, ZARCO-TEJADA P J, SCHMIDHALTER U, REYNOLDS M P, HAWKESFORD M J, VARSHNEY R K, YANG T, NIE C, LI Z, MING, B XIAO Y, XIE Y, LI S. High-throughput estimation of crop traits: a review of ground and aerial phenotyping platforms[J]. IEEE Geoscience and Remote Sensing Magazine, 2021, 9(1): 200-231. DOI:10.1109/mgrs.2020.2998816 |
| [33] |
HUGHES A, ASKEW K, SCOTSON C P, WILLIAMS K, SAUZE C, CORKE F, DOONAN J H, NIBAU C. Non-destructive, high-content analysis of wheat grain traits using X-ray micro computed tomography[J]. Plant Methods, 2017, 13: 76. DOI:10.1186/s13007-017-0229-8 |
| [34] |
SHI R, JUNKER A, SEILER C, ALTMANN T. Phenotyping roots in darkness: disturbance-free root imaging with near infrared illumination[J]. Functional Plant Biology, 2018, 45(4): 400-411. DOI:10.1071/FP17262 |
| [35] |
梁丽秀, 叶军立, 吴丹, 杨万能. 水稻表层根系图像分割算法研究[J]. 中国农业科技导报, 2019, 21(1): 70-79. DOI:10.13304/j.nykjdb.2018.0079 LIANG L X, YE J L, WU D, YANG W N. Research on image segmentation algorithm of rice surface root system[J]. Journal of Agricultural Science and Technology, 2019, 21(1): 70-79. DOI:10.13304/j.nykjdb.2018.0079 |
| [36] |
BODNER G, NAKHFOROOSH A, ARNOLD T, LEITNER D. Hyperspectral imaging: a novel approach for plant root phenotyping[J]. Plant Methods, 2018, 14: 84. DOI:10.1186/s13007-018-0352-1 |
| [37] |
TARDIEU F, CABRERA-BOSQUET L, PRIDMORE T, BENNETT M. Plant phenomics, from sensors to knowledge[J]. Current Biology, 2017, 27(15): 770-783. DOI:10.1016/j.cub.2017.05.055 |
| [38] |
SKELTON R P, BRODRIBB T J, CHOAT B. Casting light on xylem vulnerability in an herbaceous species reveals a lack of segmentation[J]. New Phytologist, 2017, 214(2): 561-569. DOI:10.1111/nph.14450 |
| [39] |
WANG Z, VERBOVEN P, NICOLAI B. Contrast-enhanced 3D micro-CT of plant tissues using different impregnation techniques[J]. Plant Methods, 2017, 13: 105. DOI:10.1186/s13007-017-0256-5 |
| [40] |
EARLES J M, BUCKLEY T N, BRODERSEN C R, BUSCH F A, CANO F J, CHOAT B, EVANS J R, FARQUHAR G D, HARWOOD R, HUYNH M, JOHN G P, MILLER M L, ROCKWELL F E, SACK L, SCOFFONI C, STRUIK P C, WU A, YIN X, BARBOUR M M. Embracing 3D complexity in leaf carbon-water exchange[J]. Trends in Plant Science, 2019, 24(1): 15-24. DOI:10.1016/j.tplants.2018.09.005 |
| [41] |
GARGIULO L, LEONARDUZZI C, MELE G. Micro-CT imaging of tomato seeds: predictive potential of 3D morphometry on germination[J]. Biosystems Engineering, 2020, 200: 112-122. DOI:10.1016/j.biosystemseng.2020.09.003 |
| [42] |
DAWES I W, CALVERT G R. Initiation of sporulation in saccharomyces cerevisiae. moutations causing derepressed sporulation and G1 arrest in the cell division cycle[J]. Journal of General Microbiology, 1984, 130(3): 605-613. DOI:10.1099/00221287-130-3-605 |
| [43] |
唐延林, 王纪华, 黄敬峰, 王人潮. 利用水稻成熟期冠层高光谱数据进行估产研究[J]. 作物学报, 2004(8): 780-785. DOI:10.3321/j.issn:0496-3490.2004.08.008 TANG Y L, WANG J H, HUANG J F, WANG R C. Yield estimation using canopy hyperspectral data of rice at maturity[J]. Acta Agronomica Sinica, 2004(8): 780-785. DOI:10.3321/j.issn:0496-3490.2004.08.008 |
| [44] |
ZHANG Y, HUI J, QIN Q, SUN Y, ZHANG T, SUN H, LI M. Transfer-learning-based approach for leaf chlorophyll content estimation of winter wheat from hyperspectral data[J]. Remote Sensing of Environment, 2021, 267: 112724. DOI:10.1016/j.rse.2021.112724 |
| [45] |
LIANG T, DUAN B, LUO X, MA Y, YUAN Z, ZHU R, PENG Y, GONG Y, FANG S, WU X. Identification of high nitrogen use efficiency phenotype in rice (Oryza sativa L.) through entire growth duration by unmanned aerial vehicle multispectral imagery[J]. Frontiers in Plant Science, 2021, 12: 740414. DOI:10.3389/fpls.2021.740414 |
| [46] |
JI Y, CHEN Z, CHENG Q, LIU R, LI M, YAN X, LI G, WANG D, FU L, MA Y, JIN X, ZONG X, YANG T. Estimation of plant height and yield based on UAV imagery in faba bean[J]. Plant Methods, 2022, 18(1): 26. DOI:10.1186/s13007-022-00861-7 |
| [47] |
OGAWA D, SAKAMOTO T, TSUNEMATSU H, KANNO N, NONOUE Y, YONEMARUJ I. Remote-sensing-combined haplotype analysis using multi-parental advanced generation inter-cross lines reveals phenology QTLs for canopy height in rice[J]. Frontiers in Plant Science, 2021, 12: 715184. DOI:10.3389/fpls.2021.715184 |
| [48] |
HEIN N T, CIAMPITTI I A, JAGADISH S K. Bottlenecks and opportunities in field-based high-throughput phenotyping for heat and drought stress[J]. Journal of Experimental Botany, 2021, 72(14): 5102-5116. DOI:10.1093/jxb/erab021 |
| [49] |
KLEIN I, DANZI S. Thyroid disease and the heart[J]. Circulation, 2007, 116(15): 1725-1735. DOI:10.1161/CIRCULATIONAHA.106.678326 |
| [50] |
ZHOU J, ZHOU J, YE H, ALI M L, NGUYEN H T, CHEN P. Classification of soybean leaf wilting due to drought stress using UAV-based imagery[J]. Computers and Electronics in Agriculture, 2020, 175. DOI:10.1016/j.compag.2020.105576 |
| [51] |
LARASWATI A A, PADJUNG R, FARID M, NASARUDDIN N, ANSHORI M F, NUR A, SAKINAH A I. Image based-phenotyping and selection index based on multivariate analysis for rice hydroponic screening under drought stress[J]. Plant Breeding and Biotechnology, 2021, 9(4): 272-286. DOI:10.9787/pbb.2021.9.4.272 |
| [52] |
BHAGWAT R, DANDAWATE Y. A review on advances in automated plant disease detection[J]. International Journal of Engineering and Technology Innovation, 2021, 11(4): 251-264. DOI:10.46604/ijeti.2021.8244 |
| [53] |
BARBEDO J. A review on the use of unmanned aerial vehicles and imaging sensors for monitoring and assessing plant stresses[J]. Drones, 2019, 3(2): 40. DOI:10.3390/drones3020040 |
| [54] |
ZHANG J, FENG X, WU Q, YANG G, TAO M, YANG Y, HE Y. Rice bacterial blight resistant cultivar selection based on visible/near-infrared spectrum and deep learning[J]. Plant Methods, 2022, 18(1): 49. DOI:10.1186/s13007-022-00882-2 |
| [55] |
GUO A, HUANG W J, DONG Y Y, YE H C, MA H Q, LIU H, WU W B, REN Y, RUAN C, GENG Y. Wheat yellow rust detection using UAV-based hyperspectral technology[J]. Remote Sensing, 2021, 13(1): 123. DOI:10.3390/rs13010123 |
| [56] |
NGUGI L C, ABDELWAHAB M, ABO-ZAHHAD M. A new approach to learning and recognizing leaf diseases from individual lesions using convolutional neural networks[J]. Information Processing in Agriculture, 2021, S2214317321000822. DOI:10.1016/j.inpa.2021.10.004 |
| [57] |
陈美伶, 姜玉松. 生姜转录因子基因ZoNAC17的克隆与表达分析[J]. 广东农业科学, 2018, 45(6): 30-35. DOI:10.16768/j.issn.1004-874X.2018.06.006 CHEN M L, JIANG Y S. Cloning and expression analysis of transcription factor gene ZoNAC17 in ginger[J]. Guangdong Agriculture Sciences, 2018, 45(6): 30-35. DOI:10.16768/j.issn.1004-874X.2018.06.006 |
| [58] |
万亮, 杜晓月, 陈硕博, 于丰华, 朱姜蓬, 许童羽, 何勇, 岑海燕. 基于无人机多源图谱融合的水稻稻穗表型监测[J]. 农业工程学报, 2022, 38(9): 162-170. DOI:10.11975/j.issn.1002-6819.2022.09.017 WAN L, DU X Y, CHEN SH B, YU F H, ZHU G P, XU T Y, HE Y, CEN H Y. Rice spike phenotype monitoring based on UAV multi-source map fusion[J]. Transacions of the Chinese Society of Agricultural Engineering, 2022, 38(9): 162-170. DOI:10.11975/j.issn.1002-6819.2022.09.017 |
(责任编辑 张辉玲)
 2022, Vol. 49
2022, Vol. 49