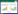文章信息
基金项目
- 广东省重点领域研发计划(2020B020222001)
作者简介
- 马凌遥(1998—),女,在读硕士生,研究方向为预防兽医,E-mail:1004573838@qq.com.
通讯作者
- 常爽(1981—),女,博士,副教授,研究方向为家禽免疫抑制性疾病,E-mail:changshuang81@126.com; 蔡曼珊(1980—),女,硕士,兽医师,研究方向为家禽疾病控制与净化,E-mail:shan296@163.com.
文章历史
- 收稿日期:2023-06-27
2. 广东省农业科学院动物科学研究所/猪禽种业全国重点实验室,广东 广州 510640
2. Institute of Animal Science, Guangdong Academy of Agricultural Sciences/State Key Laboratory of Livestock and Poultry Breeding, Guangzhou 510640, China
【研究意义】禽白血病病毒(Avian leukosis virus,ALV)是鸡群中一种常见的致肿瘤病毒,根据病毒的宿主范围和不同毒株间的相互干扰作用,以及病毒囊膜糖蛋白的抗原构造,可以将ALV分为A~K共11种亚群[1-2],其中J亚群ALV(ALV-J)具有极强的致病性和传播能力,危害极大,可导致鸡群产生免疫抑制、生产性能下降,甚至可发生血管瘤、骨髓瘤等特征性肿瘤而死亡[3-4]。禽网状内皮组织增殖病毒(Reticuloendotheliosis virus,REV)也是鸡群中常见的致肿瘤病毒,与ALV-J均属于逆转录病毒,可导致病禽发生急性网状细胞增生、肿瘤形成、生长迟缓、矮小综合征和免疫抑制,ALV-J和REV两者均可诱导鸡群发生肿瘤[5-6],并且都能通过鸡胚垂直传播,但两者共同经鸡胚垂直传播的致病性缺乏系统观察,建立ALV-J和REV共感染的垂直传播模型可进一步评估ALV-J和REV共感染的危害。
【前人研究进展】已有的流行病学调查结果显示,ALV-J和REV共感染在我国鸡群中非常普遍[7-8]。张志等[9]从自然发生ALV-J的病料中检测出REV;林汉卿等[10]在贵州土鸡中发现了ALV-J、REV和MDV 3种病毒混合感染的现象。研究证实,ALV-J和REV共感染比单感染能显著增加感染的致病性[10-11],Dong等[12-13]将ALV-J和REV两种病毒单独感染或共感染1日龄商品代肉鸡和SPF鸡,在不同时间对死亡率、体重、免疫器官发育指数和对疫苗的抗体反应等方面进行研究,结果表明ALV-J和REV共感染对商品代肉鸡和SPF鸡具有协同致病作用。Cui等[14]证实ALV-J和REV在鸡胚中的共感染,经鸡胚垂直传播是ALV-J和REV的主要感染途径。【本研究切入点】鸡群中多种免疫抑制病毒的混合感染非常普遍,并且容易继发各种细菌病和病毒病,严重危害养鸡业的发展。虽然ALV-J和REV共感染及其协同致病性已有报道,但REV与ALV-J通过垂直传播形成共感染后对雏鸡的致病性尚缺乏观察数据。【拟解决的关键问题】本研究选择ALV-J NX0101株和REV LN1201株进行扩增定量,通过鸡胚接种病毒,孵化后构建REV、ALV-J单感染及REV+ALV-J共感染的雏鸡模型,分析孵化率、雏鸡死亡率、体重、胎粪ALV-p27抗原检出率、病毒血症阳性率[15-16]等指标,探究REV在垂直传播中与ALV-J共感染对雏鸡的协同致病性,以及对禽白血病净化检测的影响。
1 材料与方法 1.1 试验材料供试ALV-J野毒株NX0101株(GenBank No:DQ115805)分离鉴定于宁夏(2001年)REV野毒株LN1201株(GenBank No:KU641115.1)分离鉴定于辽宁(2012年),均保存于山东农业大学家禽肿瘤病与免疫抑制病实验室。DF-1细胞购自美国模式培养物集存库(American type culture collection,ATCC),两种病毒在DF-1细胞上增殖后,按照Reed-Muench法测定其细胞半数感染量(TCID50)。SPF种蛋购自济南赛斯家禽科技有限公司。
1.2 试验设计试验于2022年10—12月在山东农业大学进行。将140枚SPF种蛋孵化至7胚龄时,按照表 1进行分组处理,每组35枚。ALV-J单感染组经卵黄囊接种1 000 TCID50 NX0101株病毒液100 μL,REV单感染组接种含有1 500 TCID50 LN1201株病毒液100 μL,两种病毒共感染组(ALV-J+REV)接种含有上述1 000 TCID50 NX0101和1 500 TCID50 LN1201的混合病毒液100 μL,以接种100 μL无菌生理盐水为对照(CK)。待鸡胚孵化出壳后,将各组雏鸡饲养于带有负压过滤空气的隔离罩内。
|
1.3 致病指标分析
全程记录各组鸡胚死胚率,出壳后每天观察鸡只精神状态、腹泻等临床症状,并记录各组SPF鸡死亡情况,绘制生存曲线。分别在1、3、5、7、10、14日龄对各组鸡只称重,计算不同日龄各组鸡只体重均值并绘制体重增长曲线,观察不同感染组对鸡的生长抑制作用。采集1、7、14日龄时的脾脏、胸腺、法氏囊进行称重,按照器官质量(g)/体重(g)×1 000的公式计算免疫器官发育指数。
1.4 共感染对ALV-J病毒血症与排毒的影响分别在1、3、7、14日龄对各组鸡只进行无菌采血,将抗凝血以3 000 r/min离心3 min后,取100 μL血浆样品接种于已长成单层的DF-1细胞,37 ℃继续孵育2 h后弃上清液,以无菌PBS清洗2遍,换为1% FBS的DMEM培养基,在37 ℃、5% CO2条件下继续培养7 d;取100 μL细胞培养上清以ALV-p27抗原ELISA检测试剂盒(哈尔滨国生生物科技股份有限公司)进行检测,操作按试剂盒使用说明进行。同时采集上述时间点的肛拭子,使用ALV-p27抗原ELISA检测试剂盒(爱德士生物科技有限公司)进行检测,分别比较ALV-J单感染组与共感染组的病毒血症阳性率、肛拭子阳性率等。
1.5 共感染对ALV-J和REV病毒在脏器中复制的影响采集1、3、7、14日龄鸡的胸腺、脾脏、法氏囊等器官,提取RNA后反转录,以Real-time RT-PCR检测ALV-J和REV的病毒复制量。荧光定量引物为ALV-F:5'-CAGAGAAGATACGGGTGG AAG-3',ALV-R:5'-CTATGACAAGCAATGCAAA CAG-3'[13];REV-F:5'-TTGTTGAAGGCAAGCATC AG-3',REV-R:5'-GAGGATAGCATCTGCCCTTT-3'[16],扩增体系和扩增条件参照大连宝生物工程有限公司SYBR Green Ⅰ荧光定量试剂盒的说明书。
1.6 数据统计试验数据采用SPSS(Version 20.0)、ANOVA方法进行显著性分析。
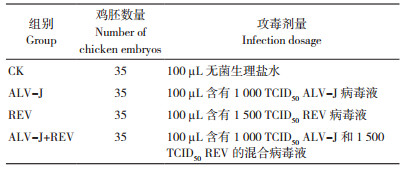
2 结果与分析 2.1 ALV-J、REV单感染与共感染对鸡胚孵化率的影响对ALV-J、REV单感染组与共感染组的鸡胚死胚率和孵化率进行统计,结果(表 2)显示,ALV-J单感染和REV单感染均能导致死胚率上升和孵化率下降,而且共感染进一步加重了鸡胚的致死率。
|
2.2 ALV-J、REV单感染与共感染对雏鸡死亡率的影响
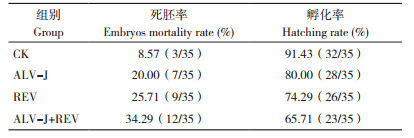
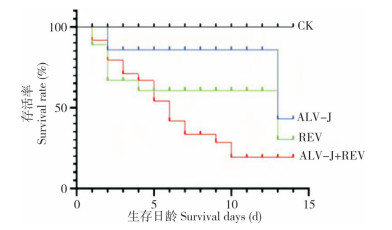
从ALV-J、REV单感染组与共感染组的生存曲线(图 1)可知,与CK相比,ALV-J或REV单感染均导致SPF鸡死亡率上升,两者共感染显著增加了雏鸡的死亡率。特别是在10日龄内鸡只死亡比较集中,表明ALV-J+REV共感染加重了雏鸡致死率,日龄越小,死亡率越高。
|
| 图 1 不同感染处理雏鸡的生存曲线 Fig. 1 Survival curves of chicks with different infection treatments |
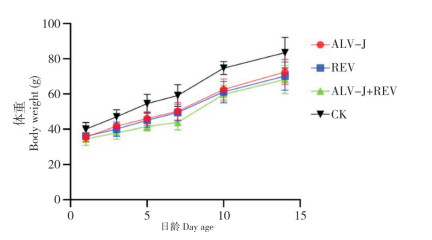
2.3 ALV-J、REV单感染与共感染对雏鸡体重的影响
通过体重增长曲线(图 2)可以看出,各日龄共感染组体重均低于单感染组和CK,7日龄时CK、ALV-J组、REV组、ALV-J+REV组分别为59.25、50.83、49.67、43.78 g,表明ALV-J或REV单感染均对SPF鸡的体重起到一定抑制作用,ALV-J+REV共感染对鸡只增重的抑制作用更明显。
|
| 图 2 不同感染处理雏鸡的体重增长曲线 Fig. 2 Weight gain curves of chicks with different infection treatments |
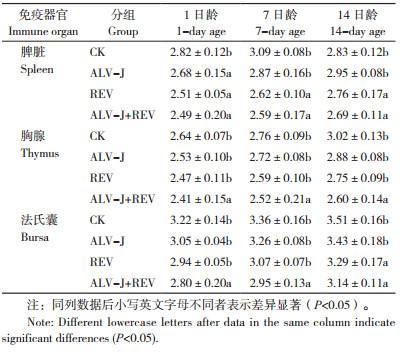
2.4 ALV-J、REV单感染与共感染对雏鸡免疫器官发育的影响
脾脏、胸腺和法氏囊3种免疫器官的发育指数如表 3所示,与CK相比,ALV-J、REV单感染均导致3种免疫器官萎缩,而ALV-J+REV共感染有进一步加重免疫器官萎缩的趋势。对脾脏发育指数进行分析,1日龄时与CK相比,共感染组显著降低,与ALV-J、REV单感染组相比,共感染组差异不显著;7、14日龄时分别与CK、ALV-J单感染组相比,共感染组均显著降低,与REV单感染组相比,共感染组差异均不显著。对胸腺发育指数进行分析,1、7、14日龄时分别与CK、ALV-J、REV单感染组相比,共感染组均显著降低。对法氏囊发育指数进行分析,1、7日龄时分别与CK、ALV-J、REV单感染组相比,共感染组均显著降低;14日龄时与CK、ALV-J相比,共感染组显著降低,与REV单感染组相比,共感染组差异不显著。
|
2.5 ALV-J、REV单感染与共感染对雏鸡ALV-J复制及排毒的影响
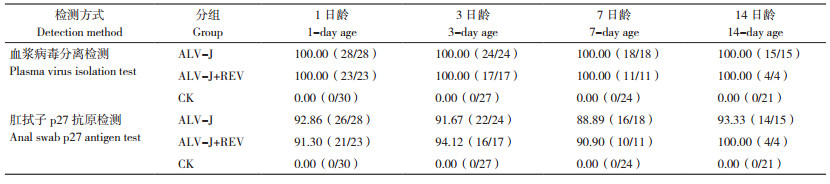
分别在1、3、7、14日龄对各组鸡只无菌采血接种DF-1细胞进行ALV-J病毒分离鉴定,CK始终保持阴性,ALV-J单感染组与ALV-J+REV共感染组雏鸡的ALV-J病毒分离阳性率均为100%(表 4)。肛拭子ALV-p27抗原ELISA检测结果显示,上述4个检测时间点的CK阳性率始终为0%,ALV-J单感染组与ALV-J+REV共感染组的阳性率为88.89%~100%,略低于血浆病毒分离阳性率;3日龄起,共感染组雏鸡的ALV-J阳性率高于ALV-J单感染组。
|
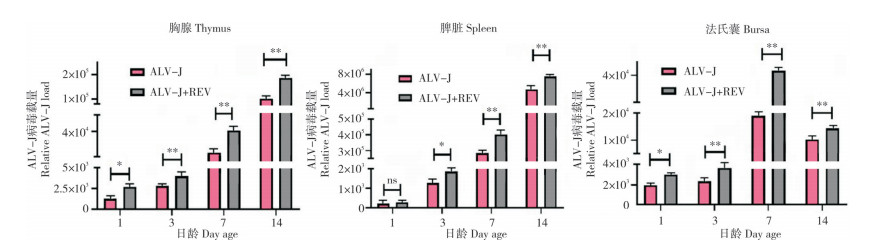
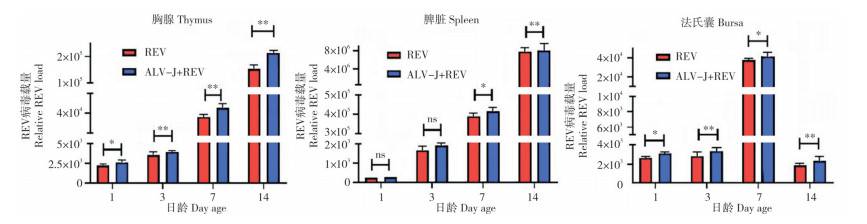
Real-time RT-PCR检测胸腺、脾脏、法氏囊中ALV-J的复制量,结果(图 3)显示,ALV-J单感染组与ALV-J+REV共感染组雏鸡胸腺和脾脏的ALV-J病毒载量均随日龄逐渐上升,而法氏囊中ALV-J病毒载量于7日龄时均达到最大值,分别为1.89×104和4.37×104。与ALV-J单感染组相比,共感染组雏鸡胸腺和法氏囊中的ALV-J病毒载量在1日龄时均显著升高,在3、7、14日龄时均极显著升高;脾脏中ALV-J病毒载量在3日龄时显著升高,在7、14日龄极显著升高,说明REV的共感染促进了ALV-J在雏鸡胸腺、脾脏、法氏囊中的复制。
|
| “*”表示差异显著“**”,表示差异极显著 "*" represents significant difference, "**" represents extremely significant difference 图 3 REV共感染促进ALV-J在3种免疫器官中的复制 Fig. 3 Replication of ALV-J in three immune organs promoted by co-infection of REV |
2.6 ALV-J、REV单感染与共感染对除鸡REV复制的影响
分别在1、3、7、14日龄对REV单感染组与ALV-J+REV共感染组各剖杀3只鸡,提取法氏囊、脾脏、胸腺的总RNA,以Real-time PCR检测REV的复制情况。由图 4可知,两组雏鸡胸腺和脾脏的REV病毒载量均随日龄增加而上升,法氏囊REV病毒载量均在7日龄时达到最大值,分别为3.82×104和4.28×104。与REV单感染组相比,共感染组雏鸡胸腺中REV病毒载量在3、7、14日龄极显著升高;脾脏中REV病毒载量在7日龄显著升高,在14日龄极显著升高;法氏囊中REV病毒载量在1、7日龄显著升高,在3、14日龄极显著升高,表明ALV-J促进了REV在雏鸡胸腺、脾脏、法氏囊中的复制。
|
| 图 4 ALV-J共感染促进REV在3种免疫器官中的复制 Fig. 4 Replication of REV in three immune organs promoted by co-infection of ALV-J |
3 讨论
ALV-J主要诱发禽髓细胞性白血病,同时也可以诱发多类型的肿瘤。近年来一些地区虽然已经通过较完善的检测净化方案使ALV-J得到净化,但仍有报道证实ALV-J导致多个商品代、祖代蛋鸡和部分地方品种鸡发生严重感染的病例。REV会导致禽类肿瘤病变、生长迟缓和免疫抑制,被感染的家禽胸腺、法氏囊、脾脏等免疫器官均会受到不同程度损害,从而使免疫功能受到损伤。多种家禽免疫抑制性病毒在鸡体内混合感染是一种较为普遍的流行病学现象[17-18],已经有多个流行病学报道证实ALV-J、REV和CIAV等多种禽免疫抑制病毒在鸡群中共感染[4, 19],这些病毒在共感染过程中常通过复杂的相互作用改变病毒的致病特点和危害。ALV-J易与其他免疫抑制病毒造成混合感染,导致鸡只发病更加严重、潜伏期缩短、死亡率升高。此前已有ALV-J和REV在我国鸡群中共感染的报道,包括从鸡胚中检出ALV-J和REV共感染[14-15]。Dong等[12-13]通过人工致病性试验研究发现,与ALV-J或REV单感染相比,两者共感染造成的免疫抑制和致病性显著增加,但是这些攻毒模型均以1日龄攻毒方式感染,还缺乏经过垂直传播感染的致病性观察数据。鉴于ALV-J和REV主要通过垂直传播而感染鸡群,建立两者经垂直传播共感染的实验模型进而观察两者的协同致病性,更能代表临床实际情况。
为进一步探讨REV与ALV-J共感染垂直传播的协同致病作用,本研究选取ALV-J NX0101株和REV LN1201株,采用卵黄囊接毒的方式将病毒液接种至7胚龄的SPF鸡胚上,待鸡胚孵化出壳后测定分析孵化率、雏鸡致死率、体重、胎粪ALV-p27抗原检出率、病毒血症阳性率等多项指标,这些指标均表明,ALV-J与REV经垂直传播共感染的致病性相对于各自单感染均显著增强[20]。首先,与CK、ALV-J单感染组和REV单感染组相比,二者经鸡胚垂直传播共感染会造成鸡胚孵化率降低、死胚率升高,表明两者共感染加重了对鸡胚的致死率,很好地解释了在很多种鸡群实施净化后鸡胚孵化率会显著增加的情况。此外,共感染对雏鸡体重增长形成了更显著的抑制作用,这与此前报道基本一致。在临床上很多存在ALV-J与REV共感染的黄羽肉鸡群中,在实施禽白血病净化后发现整个鸡群的生产性能得到大幅提升,多数鸡群平均增重达到10% 以上,推测实施ALV净化的同时可以将REV等其他病原检出淘汰,进而降低两种病毒共感染对鸡群生产性能的不良影响。
ALV-J与REV共感染的致病性增强,两者在复制过程中存在相互促进作用是原因之一。免疫器官中两种病毒载量的分析结果均显示,ALV-J与REV共感染组雏鸡脾脏、胸腺、法氏囊中的REV病毒载量显著高于REV单感染组,共感染组中ALV-J病毒载量也显著高于ALV-J单感染组,表明ALV-J与REV共感染会促进ALV-J和REV的病毒复制,这无疑会增强两者共感染对免疫器官等的损伤,很好地解释两者协同致病的部分机制[21]。ALV-J与REV共感染对诱导胸腺、脾脏和法氏囊等免疫器官萎缩的危害更加显著,这使鸡群处于长期免疫抑制状态,导致对其他病毒或者细菌继发感染的风险增加。
4 结论本研究建立了ALV-J与REV共感染垂直传播动物试验模型,分析结果显示,垂直传播共感染造成鸡胚孵化率降低,雏鸡死亡率升高,共感染组雏鸡体重低于单感染组和CK。ALV血浆病毒分离结果显示,ALV-J组、ALV-J+REV共感染组阳性率在各日龄均为100%,CK均为0%。肛拭子检测ALV-p27抗原结果显示,共感染组阳性率各日龄分别为91.30%、93.75%、90.90% 和100%,肛拭子的ALV-J p27阳性检出率低于血浆病毒分离。免疫器官发育指数结果显示,ALV-J和REV单感染均导致雏鸡免疫器官萎缩,共感染有进一步加重免疫器官萎缩的趋势。免疫器官病毒载量结果显示,共感染促进了ALV-J在雏鸡免疫器官中的增殖,同时ALV-J也促进了REV在免疫器官中的增殖。通过比较多种指标证实,ALV-J与REV经垂直传播共感染会加重对鸡胚和雏鸡的致死率、对雏鸡生长抑制,形成协同致病作用,提示在对ALV-J进行种源净化的同时,也要加强对REV等垂直传播性免疫抑制病的检测,进行多病原协同净化。
| [1] |
朱玮钰, 李敏, 杨耀炎, 郭金晗, 付福梅, 邓乔木, 韦平. Clade 1.3 J亚群禽白血病病毒与Ⅱ型禽网状内皮组织增殖病病毒共感染的病原分离鉴定及其囊膜基因分析[J]. 中国家禽, 2023, 45(3): 45-51. DOI:10.16372/j.issn.1004-6364.2023.03.007 ZHU W Y, LI M, YANG Y Y, GUO J H, FU F M, DNEG Q M, WEI P. Pathogen isolation and identification of co-infection between Clade 1.3 J subgroup avian leukemia virus and avian reticuloendothelial tissue proliferative disease type Ⅱ. virus and its capsule gene analysis[J]. China Poultry, 2023, 45(3): 45-51. DOI:10.16372/j.issn.1004-6364.2023.03.007 |
| [2] |
DENG Q M, LI M, HE C W, LU Q E, GAO Y L, LI Q H, SHI M Y, WANG P K, WEI P. Genetic diversity of avian leukosis virus subgroup J (ALV-J): Toward a unified phylogenetic classification and nomenclature system[J]. Virus Evolution, 2021, 7(1): 37. DOI:10.1093/ve/veab037 |
| [3] |
陈伟国, 李广伟, 严专强, 谢青梅. J亚群禽白血病病毒受体基因NHE1的遗传多态性分析[J]. 广东农业科学, 2016, 43(7): 145-150. DOI:10.16768/j.issn.1004-874X.2016.07.022 CHEN G W, LI G W, YAN Z Q, XIE Q M. Analysis of genetic poly mor phisms of t he vir us receptor gene NHE1 in t he J subpopulation of avian leukemia[J]. Guangdong Agricultural Sciences, 2016, 43(7): 145-150. DOI:10.16768/j.issn.1004-874X.2016.07.022 |
| [4] |
WANG P K, LIN L L, SHI M Y, LI H J, GU Z M, LI M, GAO Y L, TENG H, MO M L, WEI T C, WEI P. Vertical transmission of ALV from ALV-J positive parents caused severe immunosuppression and significantly reduced marek's disease vaccine efficacy in three-yellow chickens[J]. Veterinary Microbiology, 2020, 244: 108683. DOI:10.1016/j.vetmic.2020.108683 |
| [5] |
DU X S, ZHOU D F, ZHOU J, XUE J W, CHENG Z Q. Marek's disease virus and reticuloendotheliosis virus coinfection enhances viral replication and alters cellular protein profiles[J]. Frontiers in Veter inar y S cience, 2022(9): 854007. DOI:10.3389/fvets.2022.854007 |
| [6] |
GIOVANA C, CRISTINA N, PAULO U, KARIN K, JANSEN A, EDISON D, LUCIANO T, BRITTANY S, DUSTIN C, CAMILA R. Detection of reticuloendotheliosis virus in muscovy ducks, wild turkeys, and chickens in Brazil[J]. Journal of Wildlife Diseases, 2020, 56(3): 631-635. DOI:10.7589/2019-04-088 |
| [7] |
张振杰, 刘绍琼, 王波, 崔治中, 张永光, 孙淑红. 地方品种皖南黄肉种鸡ALV-J与REV的共感染及其分子变异分析[J]. 中国农业科学, 2011, 44(11): 2379-2386. DOI:10.3864/j.issn.0578-1752.2011.11.022 ZAHNG Z J, LIU S Q, WANG B, CUI Z Z, ZHANG Y G, SUN S H. Co-infection and molecular variation analysis of ALV-J and REV in local breed southern Anhui yellow broiler breeder[J]. Scientia Agricultura Sinica, 2011, 44(11): 2379-2386. DOI:10.3864/j.issn.0578-1752.2011.11.022 |
| [8] |
李宏梅, 成子强, 刘建柱, 刘法孝, 郭慧君, 崔治中. REV与ALV-J共感染对肉鸡T淋巴细胞免疫功能与组织病理学的影响[J]. 中国农业科学, 2009, 42(9): 3296-3304. DOI:10.3864/j.issn.0578-1752.2009.09.036 LI H M, CHENG Z Q, LIU J Z, LIU F X, GUO H J, CUI Z Z. Effect of co-infection with REV and ALV-J on T lymphocytes bioactivities and histopathology in broiler chickens[J]. Scientia Agricultura Sinica, 2009, 42(9): 3296-3304. DOI:10.3864/j.issn.0578-1752.2009.09.036 |
| [9] |
张志, 崔治中, 姜世金. 从J亚群禽白血病肿瘤中检测出禽网状内皮组织增生症病毒[J]. 中国兽医学报, 2004(1): 10-13. DOI:10.16303/j.cnki.1005-4545.2004.01.006 ZHANG Z, CUI Z Z, JIANG S J. Detection of avian reticuloendothelial tissue hyperplasia virus from subgroup J avian leukaemia tumours[J]. Chinese Journal of Veterinary Science, 2004(1): 10-13. DOI:10.16303/j.cnki.1005-4545.2004.01.006 |
| [10] |
林汉卿, 温贵兰, 汪德生, 张升波, 徐丽, 李昌红. 贵州土鸡中ALV-J、REV和MDV的混合感染[J]. 中国兽医杂志, 2019, 55(3): 45-47. LIN H Q, WEN G L, WANG D S, ZHANG S B, XU L, LI C H. Co-infection of ALV-J, REV and MDV in native chickens in Guizhou[J]. Chinese Journal of Veterinary Medicine, 2019, 55(3): 45-47. |
| [11] |
盖小君, 王晓玲, 郭龙宗, 陈静. 山东省烟台地区J亚型禽白血病与禽网状内皮组织增生症血清流行病学调查[J]. 家禽科学, 2020(3): 53-56. GAI X J, WANG X L, GUO L Z, CHEN J. Seroepidemiological investigation of subtype J avian leukemia and avian reticuloendothelial tissue hyperplasia in Yantai area, Shandong Province[J]. China Poultry Science, 2020(3): 53-56. |
| [12] |
DONG X, JU S D, ZHAO P, LI Y, MENG F F, SUN P, CUI Z Z. Synergetic effects of subgroup J avian leukosis virus and reticuloendotheliosis virus co-infection on growth retardation and immunosuppression in SPF chickens[J]. Veterinary Microbiology, 2014, 172(3/4): 425-431. DOI:10.1016/j.vetmic.2014.06.025 |
| [13] |
DONG X, ZHAO P, CHANG S, JU S D, LI Y, MENG F F, SUN P, CUI Z Z. Synergistic pathogenic effects of co-infection of subgroup J avian leukosis virus and reticuloendotheliosis virus in broiler chickens[J]. Avian Pathology, 2015(1): 43-49. DOI:10.1080/03079457.2014.993359 |
| [14] |
CUI Z Z, SUN S H, ZHANG Z, MENG S S. Simultaneous endemic infections with subgroup J avian leukosis virus and reticuloendotheliosis virus in commercial and local breeds of chickens[J]. Avian Pathology, 2009(38): 443-448. DOI:10.1080/03079450903349188 |
| [15] |
马奎. 安徽省部分地区蛋鸡肿瘤病的临床诊断与病理组织学观察[D]. 合肥: 安徽农业大学, 2019. DOI: 10.26919/d.cnki.gannu.2019.000359. MA K. Clinical diagnosis and histopathological observation of laying hen tumor disease in some areas of Anhui Province[D]. Hefei: Anhui Agricultural University, 2019. DOI: 10.26919/d.cnki.gannu.2019.000359.gannu.2019.000359. |
| [16] |
侯力丹, 刘丹, 翟天舒, 毛娅卿, 王嘉, 孔冬妮, 黄小洁, 杨汉春, 张亚文, 赵鹏, 李俊平. 禽网状内皮组织增生病毒和A亚群禽白血病病毒共感染SPF雏鸡诱导的免疫学反应[J]. 中国动物传染病学报, 2022, 30(6): 68-76. DOI:10.19958/j.cnki.cn31-2031/s.2022.06.006 HOU L D, LIU D, ZHAI T S, MAO Y Q, WANG J, KONG D N, HUANG X J, YANG H C, ZHANG Y W, ZAHO P, LI J P. Immune response induced by co-infection of SPF chicks with avian reticuloendothelial tissue hyperplasia virus and subgroup A avian leukemia virus[J]. Chinese Journal of Animal Infectious Diseases, 2022, 30(6): 68-76. DOI:10.19958/j.cnki.cn31-2031/s.2022.06.006 |
| [17] |
黄小洁, 刘丹, 孔冬妮, 张兵, 吴华伟, 薛麒, 杨飞, 侯力丹, 薛青红, 李俊平. 禽网状内皮组织增生症病毒和A亚群禽白血病病毒共感染对疫苗免疫鸡生长性能和免疫器官的影响[J]. 中国兽药杂志, 2022, 56(2): 9-18. DOI:10.11751/ISSN.1002-1280.2022.02.02 HUANG X J, LIU D, KONG D N, ZAHNG B, WU H W, XUE Q, YANG F, HOU L D, XUE Q H, LI J P. Effects of co-infection of avian reticuloendothelial tissue hyperplasia virus and avian leukemia virus of subgroup A on growth performance and immune organs of vaccine-immunized chickens[J]. Chinese Journal of Veterinary Drug, 2022, 56(2): 9-18. DOI:10.11751/ISSN.1002-1280.2022.02.02 |
| [18] |
李丹阳, 杨恒达, 王新卫. 海兰商品蛋鸡白血病与马立克氏病混合感染案例分析[J]. 养殖与饲料, 2020(6): 100-103. DOI:10.13300/j.cnki.cn42-1648/s.2020.06.045 LI D Y, YANG H D, WANG X W. Case study of co-infection of Leukemia and Marek's disease in Hailan commercial laying hens[J]. Animals Breeding and Feed, 2020(6): 100-103. DOI:10.13300/j.cnki.cn42-1648/s.2020.06.045 |
| [19] |
王玥, 姜艳萍, 于琳琳, 王峰, 陈洪博, 王晓伟, 成子强. 蛋种鸡ALV-J与REV共感染病变新特点[J]. 畜牧兽医学报, 2011, 42(11): 1643-1648. WANG Y, JIANG Y P, YU L L, WANG F, CHEN H B, WANG X W, CHENG Z Q. New characteristics of co-infected lesions between ALV-J and REV in egg breeders[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(11): 1643-1648. |
| [20] |
CUI X, ZHANG X, XUE J W, YAO Y, ZHOU D, CHENG Z Q. TMT-based proteomic analysis reveals integrins involved in the synergistic infection of reticuloendotheliosis virus and avian leukosis virus subgroup J[J]. BMC Veterinary Research, 2022, 18(1): 131. DOI:10.1186/s12917-022-03207-6 |
| [21] |
ZHANG Z J, LIU S Q, WANG B, CUI Z Z, ZAHNG Y G, SUN S H. Identification of co-infection of ALV-J and REV and molecular characterization of the two viruses isolated from Wannan yellow feather broilers[J]. Scientia Agricultura Sinica, 2011(44): 2379-2386. DOI:10.3864/j.issn.0578-1752.2011.11.022 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50