文章信息
基金项目
- 广东省现代农业产业技术体系创新团队项目(2023KJ137);“十四五”广东省农业科技创新十大主攻方向“揭榜挂帅”项目(2022SDZG02);广东省重点领域研发计划项目(2020B0202090004);云南省科技人才与平台计划项目“廖明专家工作站”(202105AF150077)
作者简介
- 陈玫婷(1999—),女,在读硕士生,研究方向为禽传染病,E-mail:2112159161@stu.fosu.edu.cn.
通讯作者
- 李林林(1981—),女,博士,副研究员,研究方向为禽传染病,E-mail:lingdang1000@163.com.
文章历史
- 收稿日期:2023-07-10
2. 佛山科学技术学院生命科学与工程学院,广东 佛山 528225
2. School of Life Sciences and Engineering, Foshan University, Foshan 528231, China
鹅星状病毒(Goose astrovirus, GAstV)病自2017年开始迅速蔓延[1],我国多个重要鹅养殖省份,如江苏、安徽、广东、湖南、河南、福建、浙江、四川等省份均有GAstV检测阳性的报道,给鹅养殖业造成严重的经济损失。GAstV感染导致鹅精神沉郁、饲料转化率降低、排白色粪便,病鹅关节肿大、行动迟缓甚至瘫痪[2]。全身广泛性尿酸盐沉积是GAstV病的典型症状,尿酸盐沉积部位可包括颈部皮下、胸部、腿部、关节腔、气管、气囊、心脏、肝脏、脾脏、腺胃、胆囊、肠系膜、肾脏和输尿管[3-4]。部分病例在眼睛角膜或瞬膜表面形成一层白色尿酸盐沉积膜或出现脑膜出血症状[5]。GAstV导致鹅多组织损伤,其中肾脏的病理损伤最为严重,呈现出血和肿胀现象。利用组织切片技术能观察到病鹅肾小管上皮细胞坏死脱落及肾组织炎性细胞浸润,肝细胞空泡变性,脾淋巴细胞崩解坏死,部分病死鹅出现脑炎病变,大脑皮层小胶质细胞增生,其包裹的神经细胞死亡[5]。
星状病毒(Astrovirus, AstV)可感染多种动物,包括哺乳动物和禽类。1975年首次报道AstV引起儿童腹泻[6]。1995年国际病毒分类委员会(Interonational Cmmittee on Taxonomy of Viruses, ICTV)(https://talk.ictvonline.org/taxonomy/)正式建立星状病毒科,并在2002年根据宿主范围将AstV分为2个属,即哺乳动物星状病毒属(Mamastrovirus, MAstV)和禽星状病毒属(Avastroviruses, AAstV)。哺乳动物星状病毒主要感染人类、猪、牛、羊、猫、犬、鼠等哺乳动物,禽类星状病毒主要感染鸡、火鸡、鸭等禽类。2011年ICTV将MAstV属划分为19种MAstV(MAstV 1~19),将AAstV属划分为3种AAstV(AAstV 1~3)。火鸡星状病毒1型(TAstV-1)归类为AAstV 1,禽肾炎病毒1型(ANV-1)和禽肾炎病毒2型(ANV-2)归类于AAstV 2,火鸡星状病毒2型(TAstV-2)和鸭星状病毒1型(DAstV-1)归类于AAstV 3。后续越来越多研究表明,AstV家族成员众多,具有复杂的遗传多样性,至2014年AstV已被发现至少感染30种哺乳动物和14种禽类[7]。GAstV尚未参与官方的AstV分类系统,GAstV SDXT株(MN399857)等曾被归类至禽星状病毒属AAstV3[8],但随着越来越多GAstV毒株的分离鉴定,GAstV被证实与其他AstV之间存在较大遗传差异,应作为独立群体参与分类[9]。
1 GAst V病原学AstV是小型无包膜的单链RNA病毒,在透射电子显微镜下多呈现具有光滑边缘的球形粒子形态,仅10% 的病毒粒子具有独特的五角星或六角星结构。GAstV目前主要通过透射电子显微镜进行病毒形态观察,尚未进行晶体结构分析。Yuan等[10]在感染GAstV的鹅肝组织切片中观察到直径约30 nm的病毒颗粒;Wang等[11]通过蔗糖密度梯度离心法纯化经胚胎尿囊液增殖的GAstV,在透射电子显微镜下观察到直径为22 nm的球形病毒颗粒;Zhu等[12]利用透射电子显微镜从感染GAstV的鸡肝癌细胞(Leghorn male hepatoma cell, LMH)中观察到直径30 nm的球形病毒颗粒。
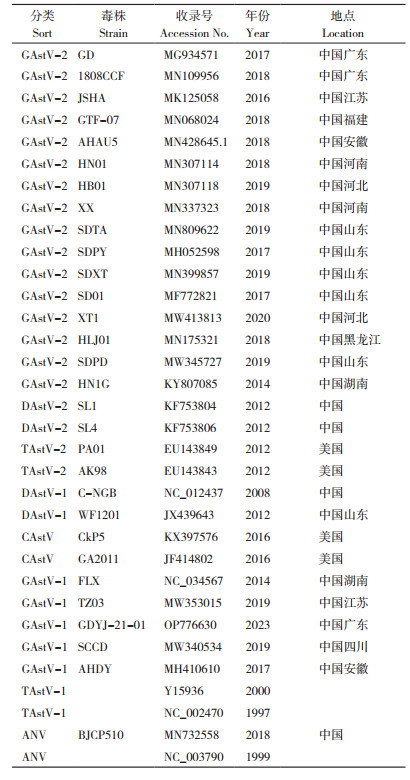
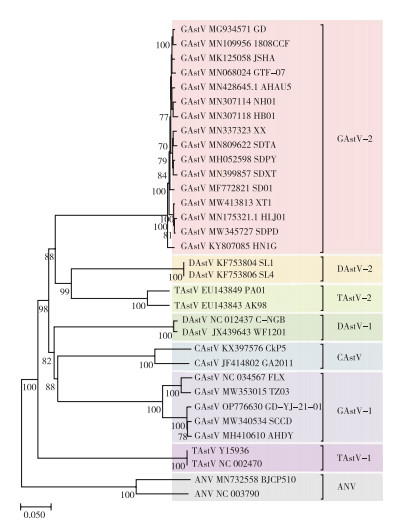
GAstV基因组长度为7.1~7.3 kb,由5'UTR、ORF1a、ORF1b、ORF2、3'UTR和一个poly(A)尾组成[13]。学者们根据GAstV的基因同源性及遗传距离将其划分为2个基因型群组,即鹅星状病毒1型(GAstV-1)和鹅星状病毒2型(GAstV-2),GAstV-1以AHDY株(MH410610)和FLX株(NC_034567)等毒株为代表,GAstV-2以GD株(MG934571)为代表,使用MEGA7软件构建禽类星状病毒进化树(图 1,参考序列信息见表 1)[2, 14]。2种基因型GAstV的ORF2相似性低于80%,且遗传进化树显示不同基因型GAstV的遗传距离较远。动物回归实验中,2种基因型GAstV联合攻毒比单一基因型GAstV感染雏鹅引起痛风症状的比率更大,症状更加严重,提示GAstV-1与GAstV-2可能具有协同致病能力;临床病例显示,部分地区GAstV-1与GAstV-2混合感染程度较深,其样品的混合感染率可达94.03%[2]。
|
| 图 1 禽类星状病毒遗传进化树 Fig. 1 Phylogenetic tree of avian astrovirus |
1.1 非结构蛋白
ORF1a和ORF1b编码非结构蛋白,包括跨膜螺旋结构、丝氨酸蛋白酶(Serine proteinase, Pro)、核定位信号(Nuclear localization signal, NLS)和RNA依赖RNA聚合酶(RNA-dependent RNA polymerase, RdRp)[15]。其ORF1b的基因突变率低,其编码的RdRp蛋白在AstV各蛋白中最为保守[1, 16]。ORF1a和ORF1b间的核苷酸重叠区域包含1个高度保守的5'-AAAAAAC-3' 核糖体移帧信号(Ribosomal frameshifting signal, RFS),RFS指导ORF1a和ORF1b融合蛋白的合成,是影响RdRp正常翻译的重要因素。
1.2 结构蛋白ORF2编码结构蛋白(Cap蛋白)包含S、P1、P2和酸性C端4个功能结构域,其编码的病毒衣壳是病毒组成不可或缺的部分[17]。该区域具有良好的局部亲水性,没有跨膜区域和信号肽序列[18]。ORF2在GAstV基因组中具有显著的多样性,ORF2氨基酸序列的同源性已被用作星状病毒物种进一步分类的判断标准。
ORF2编码的VP90前体蛋白大小约90 kD,VP90蛋白可在细胞内组装成未成熟的病毒粒子。VP90蛋白被半胱天冬酶加工产生VP70蛋白,之后VP70蛋白在细胞外经过胰蛋白酶切割产生VP34、VP27/29和VP25/26蛋白,这3种蛋白分布于病毒衣壳表面,形成成熟的GAstV病毒颗粒。VP34位于Cap蛋白高度保守的N端,由S结构域编码,参与组成病毒的衣壳结构[19];VP27/29和VP25/26位于Cap蛋白易于变异的C端,由P1和P2结构域编码,以二聚体形式组成衣壳表面突起的病毒粒子纤突。研究表明,纤突上存在GAstV的受体结合结构域,参与细胞表面相关受体的识别和宿主免疫应答过程[20]。纤突与病毒入侵机制密切相关,负责病毒入侵、触发中和抗体的产生[21]。
2 GAst V流行病学 2.1 GAstV传播能力强GAstV水平传播的主要途径是粪口传播。雏鹅感染GAstV后,最早在泄殖腔拭子中检出病毒,可监测时间长达20 d[22]。我国部分鹅养殖场共饮一池水的养殖环境为病毒的水平传播提供了便利条件。GAstV可能通过垂直传播方式感染下一代。Wei等[23]使用SDPY株感染产蛋鹅,从产蛋鹅的卵巢和卵黄膜分离出的GAstV,与从鹅胚的胚胎、尿囊液和孵化雏鹅中分离出的GAstV具有高达99.9% 的核苷酸同源性;同时,在检测鹅的生殖道拭子和死鹅胚的GAstV阳性率时发现,生殖道拭子和死鹅胚中GAstV阳性率分别为29.6% (81/274) 和42.1% (32/76),推测GAstV可以通过种鹅垂直感染鹅胚和雏鹅。Zhang等[9]在我国中部2个不同的鹅场分离到2株GAstV,溯源发现其与孵化场分离到的胚源病毒密切相关,共享多个特殊的氨基酸突变,推测2个鹅场的病毒源自受垂直感染的病鹅胚胎。GAstV对外界环境的强抵抗力,为病毒传播提供了有利条件。AstV在外界环境中极其稳定,对苯扎溴铵、酚类、季铵盐类等常用消毒剂具有很强的抵抗力,对热、酸具有一定的抵抗能力,因此病毒可长时间在外界环境中存活。一旦养殖场出现GAstV感染,带毒种蛋、污染的运输工具和饲料等均可成为病毒的传播媒介[4, 9],造成区域性快速传播,甚至通过贸易实现GAstV的跨省份长距离传播,加大了病毒防治工作的难度。
2.2 GAstV宿主范围广阔鹅是GAstV的天然宿主,多种鹅品种均可感染GAstV,且临床发病率高达80%。临床样品检测过程中发现,鹅胚、GAstV感染耐过鹅、临床表现正常种鹅或活禽市场中的鹅体内也可检测到GAstV[23-25]。日龄1~15 d雏鹅比日龄25~35 d幼鹅更易感GAstV,其组织中病毒拷贝数较高,表现出更加严重的临床症状。最新的研究显示,日龄70 d成年鹅也可感染GAstV,病鹅消瘦、痛风,死亡率为40%[12],表明GAstV或可感染多年龄段的鹅。
GAstV除了感染鹅之外,还可感染多种鸡和鸭,对家禽养殖业造成更大威胁。Li等[18]从湖南病鹅组织中分离出LYG3株(MT934437),其感染雏鸡后能引起与雏鹅痛风一致的临床症状,即雏鸡腹泻、关节肿大和内脏尿酸盐沉积。HNNY0620株(MZ367612)[26]、SDTA株(MN809622)[27]和SDTX株(MN399857)[8]分别引起河南番鸭、山东鸭养殖场和山东樱桃谷小鸭发生相似痛风病症,表明GAstV具有跨物种传播的能力。目前尚未有AstV对不同物种的易感性研究,但AstV家族成员的跨种传播使其具有能在人类和动物之间传播,引起人畜共患传染病的潜在风险。屠宰场工人、火鸡养殖人员等与火鸡密切接触的人群血清中能检测到火鸡星状病毒2型(TAstV-2)抗体[28]。因此后续研究仍需持续关注GAstV的致病性与传播特性,及时评估和预防该病对养殖业甚至公共卫生安全的危害。
2.3 GAstV流行情况使用贝叶斯分析法预估GAstV的发散时间和演化历史,结果显示GAstV-1出现的时间较早,估计为1985年,而GAstV-2出现的时间为2010年,GAstV的平均进化速度约为每年每个位点发生1.42×103个氨基酸替换[14]。位于基因特殊区域的变异位点,尤其是参与组成抗原表位的氨基酸发生突变,可能影响病毒的传染性或受体结合能力。2019—2021年在中国广东省和福建省分离到6株GAstV毒株,分别为JYF6株、QY1株、NH2株、DBN1株、DBN30株和LWY5株(ON049467~ON049473),在ORF2蛋白氨基酸中均含有Y36H突变,且QY1株、JYF6株、DBN30株和LWY5株在Cap蛋白的刺突部分具有E456D突变,QY1株和JYF6株在RdRP蛋白部分发现2个氨基酸突变,分别位于K357R和N454S[14];2020年在我国中部地区分离到2株高毒力的HNKF-1株(MW592377)和HNSQ-6株(MW592378)在不同区域也存在几个氨基酸突变位点,如ORF1a蛋白氨基酸中的A520T、S535R、V555I和A782T,以及ORF2蛋白氨基酸中的Q229P[9];2021年河南分离到HNZZ-4株(ON376722),其衣壳蛋白结构域的高可变C末端区存在3个氨基酸突变位点(E456D、A464N和L540Q)[29];2021—2022年从中国江西分离出的JXGZ(OL762471)株,其Cap蛋白C末端出现多处氨基酸突变,如G595S、V610I、L642F和S651V[30]。
2017年以来,流行病学调查结果显示GAstV-1的检出率及分离率均低于GAstV-2,GAstV-2在我国广泛流行,对养殖业的影响更为深远。Wang等[4]基于GAstV-2的全基因序列构建遗传进化树,将GAstV-2细分为1a、1b、1c、1d、2a、2b、2c和2d等8个亚群,结合GAstV的传播时间和地理信息后,判断当前流行的优势毒株为GAstV-2 1a亚群;Fai等[31]将GAstV-2分为Ⅰ、Ⅱ-a、Ⅱ-b和Ⅱ-c 4个亚群,数据显示2019年后分离的多数GAstV属于GAstV-2 Ⅱ-c亚群,GAstV-2Ⅱ-c亚群可能是目前主要的GAstV-2流行亚群。这些发现丰富了GAstV的分子信息,为细化GAstV的亚群分类提供依据,同时流行优势菌株的判别为加速建立有效的疾病防控程序提供数据支持。
3 GAst V宿主免疫应答GAstV与宿主相互作用刺激宿主产生先天性免疫应答和适应性免疫应答,先天免疫系统是抵御病原体入侵的第一道防线。研究表明,AstV感染会诱导机体产生诱导型一氧化氮合酶(Inducible nitric oxide synthase, iNOS),iNOS在脾脏和肾脏中的表达水平较高,能限制病毒复制[32]。ORF2可以有效地激活先天免疫反应,并在体外和体内诱导表达高水平的2', 5'-寡腺苷酸合成酶样蛋白(Oligoadenylate synthase-like, OASL)。当OASL过表达时限制GAstV的病毒复制,OASL被敲低后GAstV的病毒复制可得到有效促进。ORF2的截断试验进一步表明,ORF2的P2结构域和酸性C末端分别具有增加或减弱OASL的能力[33]。
GAstV可通过诱导模式识别受体等方式调节先天免疫。感染GAstV后,宿主先天免疫反应被激活,膜结合的Toll样受体3(Toll-like receptor 3, TLR3)、视黄酸诱导基因I(Retinoic acid-inducible gene I, RIG-I)和黑色素瘤分化相关基因5(Melanoma differentiation-associated gene 5, MDA-5)表达量上调[34]。胞质RIG-I样受体是识别病毒RNA重要的模式识别受体,识别病毒RNA后可激活特定信号通路,发挥抗病毒作用。此外,GAstV感染可使键衔接分子〔髓样分化因子(Myeloid differentiation factor 88, MyD88)和干扰素调节因子7(Interferon regulatory factor 7, IRF7)〕上调。雏鹅感染GAstV后体内的促炎细胞因子〔白介素(Interleukin, IL)-1β、IL-6)〕和与抗原呈递相关的主要组织相容性复合体(Major histocompatibility complex,MHC)-II的表达在感染后3 d受到抑制,而I型干扰素〔(Interferon, IFN)-α、IFN-β〕、炎性细胞因子〔IL-8、IL-10、肿瘤坏死因子(Tumor necrosis factor, TNF)-α〕、抗病毒蛋白〔黏病毒抗性蛋白A(Myxovirus resistance protein, MX)、OASL、蛋白激酶R(Protein kinases R, PKR)〕和MHC-I在病毒感染期间表达上调,可能在抑制病毒入侵中发挥重要作用。GAstV感染诱导脾肾模式识别受体(RIG-I、MDA-3和TLR3)和关键衔接分子〔MyD88、线粒体抗病毒信号蛋白(Mitochondrial antiviral signaling protein, MAVS)和IRF7〕的激活,并上调脾脏干扰素α和脾肾抗病毒蛋白〔MX1、OASL和干扰素诱导跨膜蛋白3(Interferon inducible transmembrane protein 3, IFITM3〕的基因表达[32]。深入了解GAstV的先天免疫机制可以为研究和预防GAstV提供帮助。
4 GAstV与痛风的关联 4.1 家禽痛风的原因体内尿酸过多或机体尿酸排泄障碍是导致家禽痛风的主要原因。家禽缺乏精氨酸酶,导致蛋白质的代谢产物氨无法形成尿素。当尿酸盐产生速度超过泌尿系统的排泄能力时,尿酸长期过多积聚在血液中,并随着血液循环转移至机体各组织器官,导致关节内或内脏表面出现尿酸盐结晶沉积。多种因素均可导致家禽痛风。研究显示,鹅痛风的常见因素是高蛋白质饮食,鹅过量采食动物内脏、鱼粉、大豆等富含核蛋白或嘌呤的高蛋白饲料后,鹅体内脂质代谢紊乱,尿酸水平显著升高,从而引起高尿酸血症,在体内形成尿酸盐结晶[35]。部分导致肾脏损伤的病原如肾型传染性支气管病毒、家禽腺病毒等也可阻碍尿酸在禽类体内的正常代谢。此外,维生素A或维生素D缺乏、药物滥用和管理不善(如饲养环境阴暗潮湿、饲养密度过高)等原因也是影响禽类尿酸代谢的重要因素[17]。2017年我国多地发生大规模鹅痛风病症,改用低蛋白饮食并不能使病情得到改善,经过检测和病原分离鉴定后确定病原为GAstV,但其致病机制尚未完全明晰。赵光伟等[36]的研究显示,GAstV感染存在抗体依赖性增强作用(Antibody dependent enhancement, ADE),表现为低中和效价的GAstV卵黄抗体能增强GAstV在雏鹅和鹅胚体内的复制能力,导致发病率和病死率增加。
4.2 GAstV感染导致组织损伤高尿酸血症与肾脏的排泄能力息息相关。组织病理学结果显示,GAstV感染可侵袭破坏鹅的肾脏,导致肾脏排泄能力降低,这可能是GAstV感染引发鹅体内形成尿酸盐沉积物的重要原因[37]。GAstV感染使鹅肾上皮细胞通透性增加甚至出现细胞变性坏死、刷状缘结构破坏、糖原沉积在肾小球中、纤维结缔组织增生、足细胞损伤、肾间质炎性细胞浸润[38]。采用透射电子显微镜观察肾脏组织的超微结构时可发现,GAstV感染使肾小管上皮细胞中的线粒体肿胀,线粒体脊断裂和核膜增厚,细胞间出现自噬体和自噬溶酶体[38]。
4.3 GAstV感染影响机体代谢肝和肾功能异常导致生化参数改变,对GAstV的发病机制至关重要。GAstV感染鹅后,血清中的肝损伤特定标准物〔天冬氨酸转氨酶(Aspartate aminotransferase, AST)和丙氨酸转氨酶(Alanine aminotransferase, ALT)〕、肾功能相关指标〔尿素氮(Urea nitrogen, UN)和尿酸(Uric acid, UA)〕显著升高,GAstV感染影响肝脏的尿酸生成相关酶的表达或活性[3]。研究表明,鹅感染GAstV影响肝脏中黄嘌呤氧化酶(Xanthine oxidase, XOD)和腺苷脱氨酶(Adenosine deaminase, ADA)活性,导致黄嘌呤脱氢酶、ADA、磷酸核糖焦磷酸酰胺转移酶和磷酸核糖焦磷酸合成酶1的mRNA水平升高[39]。人们认为多药耐药相关蛋白4(MRP4)和鸟氨酸转氨酶蛋白(OAT)是禽类的2种重要尿酸转运相关蛋白。鹅感染GAstV后,MRP4的mRNA转录水平和Na-K-ATP酶活性均显著降低,使肾脏的分泌能力下降[38]。这些研究表明GAstV感染可引起肝肾病变,进而影响肝脏中与尿酸产生相关的酶的表达或活性,降低肾脏排泄功能,导致高尿酸血症和痛风的形成。Liu等[40]使用STRING数据库进行蛋白质相互作用分析以确定GAstV感染后的分子网络调节中心,结果显示Toll样受体2(Toll-like receptor 2, TLR2)和过氧化氢酶(Catalase, CAT)基因是参与GAstV感染介导的痛风症状的关键基因, TLR2和CAT可能参与免疫调节与代谢调节之间的相互作用。在代谢调节方面,GAstV可以调节宿主代谢途径中重要的酶,促进病毒复制所需原料的产生;可以通过调节线粒体中关键酶的表达来调节宿主的新陈代谢;还可以促进乳酸脱氢酶(Lactate dehydrogenase, LDHA)和丙酮酸激酶M1型和M2型(Pyruvate kinase M1/2, PKM)在宿主中的高表达,以产生过量的乳酸,抑制宿主的抗病毒反应,从而促进病毒本身的复制。
4.4 GAstV可能与其他病原协同致病GAstV被认为是引起鹅痛风的重要病原,但动物回归实验中GAstV感染并不能完全重现与临床自然感染病例一致的痛风病症。不少学者提出是否存在其他感染因子与GAstV一起协同促进痛风发展的科学问题。研究显示,GAstV可导致淋巴细胞和巨噬细胞凋亡,可能引起机体的免疫抑制,更易受到其他病原的感染[41]。临床上GAstV与多种病毒混合感染的复杂局面逐渐呈现。已有多篇文章报道GAstV和鹅细小病毒(Goose parvovirus, GPV)自然混合感染的病例[42-45]。姚鑫炎等[46]和Yu等[47]发现存在GAstV、GPV、鹅圆环病毒(Goose circovirus, GCiV)和坦布苏病毒(Tembusu virus, TMUV)的双重或三重感染。Fei等[31]在临床样品检测中发现,感染GAstV的样本均存在其他病毒共同感染,其中包括新城疫病毒(Newcastle disease virus, NDV)、禽流感病毒(Avian influenza virus, AIV)、TMUV、GCiV和鹅呼肠孤病毒(Goose reovirus, GRV)。鹅杯状病毒(Goose calicivirus, GCaV)常在表现腹泻、抑郁,发育迟缓或在关节及内脏具有尿酸盐沉积等与GAstV相似病症的雏鹅中检测到[48]。Zheng等[49]在福建省2018—2019年的临床检测中发现,GCaV与GAstV的混合感染率高达91.50%(86/94)。GAstV感染鹅可能增加疾病混合感染的风险,加大疾病防控难度,同时不能排除GAstV与其他病原体的合并感染可能是导致鹅痛风症状加剧的重要原因,后续需要进一步阐明CAstV诱导痛风病的机制。
5 结语及展望目前关于GAstV的研究仍处于初级阶段,GAstV的培养体系众多,不同GAstV毒株对各种胚胎或细胞的适应机制尚未研究透彻,无法建立统一、高效的GAstV体外分离体系。鹅胚[5]、鸡胚[37]、鸭胚[8]、鹅胚肾细胞[50]、LMH细胞[3]、鸡胚成纤维细胞[18]、鸭胚肝细胞和鸭胚肾细胞[8]均可作为分离培养GAstV的载体。朱寅初等[51]分离2株不同基因型GAstV时发现,GAstV-1 ZJC14株(MZ819185)能在鹅胚和鸭胚中稳定传代,不能适应LMH细胞;GAstV-2 ZJLD20株(MZ819184)则无法适应胚胎,感染LMH细胞后,在细胞沉淀及上清中均可检测到稳定增殖的ZJLD20株病毒,但受感染的LMH细胞没有出现细胞病变效应(Cytopathic effect, CPE)。GAstV-2 GD株(MG934571)可以在含有胰蛋白酶培养条件的LMH细胞中繁殖,但并不产生CPE[3]。GAstV-2 ZJCX株(ON745304)能在鹅胚中正常繁殖,且感染LMH细胞72 h后能使LMH细胞形态发生改变,产生CPE [12]。GAstV-1 TZ03株(MW353015)能在鹅胚中繁殖,但既无法适应鸡胚、鸭胚,也无法适应LMH细胞[11]。
与大多数RNA病毒一样,GAstV复制过程缺乏校对能力,不同地区的流行毒株在病毒流行过程中可发生同源重组,致使新毒株出现。Zhu等[52]使用RDP27重组检测程序检测发现,江苏TZ03株(MW353015)存在潜在重组,其主要亲本菌株和次要亲本菌株分别为四川SCCD株(MW340534)和湖南FLX株(NC_034567)。Wang等[53]采用RDP 4.50和SimPlot软件进行重组检测发现,江苏JSHA株(MK125058)存在潜在重组,其亲本分别为安徽AHAU1株(MN428641)和山东SD01株(MF772821)。基因突变或重组为病原的抗原反应或致病力变化创造了条件,这些发现提示我们后续仍需密切关注GAstV的基因进化方向。
近年来GAstV在鹅群中广泛流行,对养殖业的发展造成重大经济损失。目前尚未研发出商品化疫苗或特效药用于防治GAstV,严格的生物安全措施仍是主要的预防和控制策略。做好引种检疫工作,避免在种蛋及活鹅交易的过程中引入病原;实行全进全出模式,及时进行笼舍打扫、设备消毒,同时注重工作人员及运输工具的日常清洁消毒工作是切断病原传播途径的关键。对存在病原的禽场应严格执行隔离制度,及时淘汰病鹅,严防病毒向外扩散。此外,饲料营养配比、禽舍饲养管理以及其他损伤肾脏的病原微生物等也是影响痛风的重要因素。根据鹅不同生长阶段提供合理营养的饲料并提供充足的干净饮水,保证合理的饲养密度和适当强度的运动。严格控制鹅的饲养环境,做好防潮、通风工作,保证笼舍卫生,避免粪便污染饲料及饮水。同时需严格执行合理的疫苗防控流程,密切监测养殖场病原流行情况。
鉴于GAstV造成的严重经济损失和潜在的公共卫生威胁,加快疫苗研究的步伐、制定有效的疾病控制措施,加大对GAstV的流行病学调查,解析GAstV诱导鹅痛风的致病机制以及多病原混合感染对致病性的影响等具有重要意义。
| [1] |
ZHANG Y X, WANG F M, LIU N, YANG L, ZHANG D B. Complete genome sequence of a novel avastrovirus in goose[J]. Archives of Virology, 2017, 162(7): 2135-2139. DOI:10.1007/s00705-017-3297-1 |
| [2] |
张玉杰, 孙宁, 刘东, 于静, 刘红祥, 于可超, 任衍倍, 高天佐, 杨少燕, 宫晓, 邹敏, 张宇龙, 王玉超, 钟声, 马冬, 杜元钊. 鹅星状病毒的分离鉴定及全基因组序列分析[J]. 畜牧兽医学报, 2020, 51(11): 2765-2777. DOI:10.11843/j.issn.0366-6964.2020.11.015 ZHANG Y J, SUN N, LIU D, YU J, LIU H X, YU K C, REN Y B, GAO T Z, YANG S Y, GONG X, ZOU M, ZHANG Y L, WANG Y C, ZHONG S, MA D, DU Y Z. Isolation, identification and complete genomic sequence analysis of goose astrovitus[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(11): 2765-2777. DOI:10.11843/j.issn.0366-6964.2020.11.015 |
| [3] |
ZHANG X Y, REN D, LI T F, ZHOU H Y, LIU X Y, WANG X B, LU H, CAO W, WANG Y J, ZOU X Y, SUN H C, YE J Q. An emerging novel goose astrovirus associated with gosling gout disease, China[J]. Emerging Microbes & Infections, 2018, 7(1): 152. DOI:10.1038/s41426-018-0153-7 |
| [4] |
WANG H Y, ZHU Y C, YE W C, HUA J G, CHEN L, NI Z, YUN T, BAO E D, ZHANG C. Genomic and epidemiological characteristics provide insights into the phylogeographic spread of goose astrovirus in China[J]. Transboundary and Emerging Diseases, 2022, 69(5): 1865-1876. DOI:10.1111/tbed.14522 |
| [5] |
ZHANG Q S, CAO Y X, WANG J, FU G H, SUN M X, ZHANG L J, MENG L, GUI G L, HUANG Y, HU X Y, SU J L. Isolation and characterization of an astrovirus causing fatal visceral gout in domestic goslings[J]. Emerging Microbes & Infections, 2018, 7(1): 71. DOI:10.1038/s41426-018-0074-5 |
| [6] |
APPLETON H, HIGGINS P G. Letter: Viruses and gastroenteritis in infants[J]. Lancet, 1975, 1: 1297. DOI:10.1016/s0140-6736(75)92581-7 |
| [7] |
BOSCH A, PINTO R M, GUIX S. Human astroviruses[J]. Clinical Microbiology Reviews, 2014, 27(4): 1048-1074. DOI:10.1128/CMR.00013-14 |
| [8] |
CHEN H, ZHANG B, YAN M, DIAO Y X, TANG Y. First report of a novel goose astrovirus outbreak in Cherry Valley ducklings in China[J]. Transboundary and Emerging Diseases, 2020, 67(2): 1019-1024. DOI:10.1111/tbed.13418 |
| [9] |
ZHANG X Z, DENG T W, SONG Y Z, LIU J, JIANG Z H, PENG Z F, GUO Y W, YANG L, QIAO H X, XIA Y X, LI X Z, WANG Z, BIAN C Z. Identification and genomic characterization of emerging goose astrovirus in central China, 2020[J]. Transboundary and Emerging Diseases, 2022, 69(3): 1046-1055. DOI:10.1111/tbed.14060 |
| [10] |
YUAN X Y, MENG K, ZHANG Y X, YU Z J, AI W, WANG Y L. Genome analysis of newly emerging goose-origin nephrotic astrovirus in China reveals it belongs to a novel genetically distinct astrovirus[J]. Infection, Genetics and Evolution, 2019, 67: 1-6. DOI:10.1016/j.meegid.2018.10.014 |
| [11] |
WANG A P, ZHANG S, XIE J, GU L L, WU S, WU Z, LIU L, FENG Q, DONG H Y, ZHU S Y. Isolation and characterization of a goose astrovirus 1 strain causing fatal gout in goslings, China[J]. Poultry Science, 2021, 100(11): 101432. DOI:10.1016/j.psj.2021.101432 |
| [12] |
ZHU Y C, WANG H Y, HUA J G, YE W C, CHEN L, N Z, YUN T, MA J L, YAO H C, BAO E D, ZHANG C. Isolation and pathogenicity of a novel goose astrovirus from overfed adult landaise Geese in China[J]. Viruses, 2022, 14(12): 2806. DOI:10.3390/v14122806 |
| [13] |
PANTIN-JACKWOOD M J, STROTHER K O, MUNDT E, ZSAK L, DAY J M, SPACKMAN E. Molecular characterization of avian astroviruses[J]. Archives of Virology, 2011, 156(2): 235-244. DOI:10.1007/s00705-010-0849-z |
| [14] |
FU X L, HOU Z P, LIU W J, CAO N, LIANG Y, LI B X, JIANG D L, LI W Y, XU D N, TIAN Y B, HUANG Y M. Insight into the epidemiology and evolutionary history of novel goose astrovirus-associated gout in goslings in Southern China[J]. Viruses, 2022, 14(6): 1306. DOI:10.3390/v14061306 |
| [15] |
CARLOS F A, REBECCA M D. The astrovirus capsid: A review[J]. Viruses, 2017, 9(1): 15. DOI:10.3390/v9010015 |
| [16] |
VICTORIA J S. A review of the strain diversity and pathogenesis of chicken astrovirus[J]. Viruses, 2017, 9(2): 29. DOI:10.3390/v9020029 |
| [17] |
CHEN Q X, XU X, YU Z L, SUI C G, ZUO K J, ZHI G L, JI J, YAO L G, KAN Y C, BI Y Z, XIE Q M. Characterization and genomic analysis of emerging astroviruses causing fatal gout in goslings[J]. Transboundary and Emerging Diseases, 2020, 67(2): 865-876. DOI:10.1111/tbed.13410 |
| [18] |
LI J Y, HU W Q, LIU T N, ZHANG H H, OPRIESSNING T, XIAO C T. Isolation and evolutionary analyses of gout-associated goose astrovirus causing disease in experimentally infected chickens[J]. Poultry Science, 2021, 100(2): 543-552. DOI:10.1016/j.psj.2020.11.003 |
| [19] |
CORTEZ V, MELIOPOULOS V A, KARLSSON E A, HARLSSON E A, HARGEST V, JOHNSON C, SCHULTZ-CHERRY S. Astrovirus biology and pathogenesis[J]. Annual Review of Virology, 2017, 4(1): 327-348. DOI:10.1146/annurev-virology-101416-041742 |
| [20] |
DUBOIS R M D, FREIDEN P, MARVIN S, REDDIVARI M, HEATH R J, WHITLE S W, SCHULTZ-CHERRY S. Crystal structure of the avian astrovirus capsid spike[J]. Journal of Virology, 2013, 87(14): 7853-7863. DOI:10.1128/JVI.03139-12 |
| [21] |
KRISHNA N K. Identification of structural domains involved in astrovirus capsid biology[J]. Viral Immunology, 2005, 18(1): 17-26. DOI:10.1089/vim.2005.18.17 |
| [22] |
YIN D, TIAN J J, YANG J, TANG Y, DIAO Y X. Pathogenicity of novel goose-origin astrovirus causing gout in goslings[J]. BMC Veterinary Research, 2021, 17(1): 40. DOI:10.1186/s12917-020-02739-z |
| [23] |
WEI F, YANG J, HE D L, DIAO Y X, TANG Y. Evidence of vertical transmission of novel astrovirus virus in goose[J]. Veterinary Microbiology, 2020, 244: 108657. DOI:10.1016/j.vetmic.2020.108657 |
| [24] |
WAN C H, CHEN C T, CHENG L F, FU G H, SHI S H, LIU R C, CHEN H M, FU Q L, HUANG Y. Specific detection of the novel goose astrovirus using a TaqMan real-time RT-PCR technology[J]. Microbial Pathogenesis, 2019, 137: 103766. DOI:10.1016/j.micpath.2019.103766 |
| [25] |
YIN D, YANG J, TIAN J J, HE D L, TANG Y, DIAO Y X. Establishment and application of a TaqMan-based one-step real-time RT-PCR for the detection of novel goose-origin astrovirus[J]. Journal of Virological Methods, 2020, 275: 113757. DOI:10.1016/j.jviromet.2019.113757 |
| [26] |
CHEN Q X, YU Z L, XU X, JI J, YAO L G, KAN Y C, BI Y Z, XIE Q M. First report of a novel goose astrovirus outbreak in Muscovy ducklings in China[J]. Poultry Science, 2021, 100(10): 101407. DOI:10.1016/j.psj.2021.101407 |
| [27] |
WEI F, YANG J, WANG Y M, CHEN H, DIAO Y X, TANG Y. Isolation and characterization of a duck-origin goose astrovirus in China[J]. Emerging Microbes & Infections, 2020, 9(1): 1046-1054. DOI:10.1080/22221751.2020.1765704 |
| [28] |
MELIOPOULOS V A, KAYALI G, BURNHAM A, OSHANSKY C M, THOMAS P G, GRAY G C, BACK M A, SCHULTZ-CHERRY S. Detection of antibodies against Turkey astrovirus in humans[J]. Public Library of Science one, 2014, 9(5): e96934. DOI:10.1371/journal.pone.0096934 |
| [29] |
PENG Z F, GAO D S, SONG X H, HUANG H M, ZHANG X Z, JIANG Z H, QIAO H X, BIAN C Z. Isolation and genomic characterization of one novel goose astrovirus causing acute gosling gout in China[J]. Scientific Reports, 2023, 13(1): 10565. DOI:10.1038/s41598-023-37784-9 |
| [30] |
ZHANG F F, LI H Q, WEI Q P, XIE Q, ZENG Y B, WU C C, YANG Q, TAN J, TAN M F, KANG Z F. Isolation and phylogenetic analysis of goose astrovirus type 1 from goslings with gout in Jiangxi province, China[J]. Poultry Science, 2022, 101(7): 101800. DOI:10.1016/j.psj.2022.101800 |
| [31] |
FEI Z G, JIAO A Q, XU M L, WU J Q, WANG Y, YU J, LU L, JIANG W C, ZHU G W, SUN W B, CHEN Z, ZHANG Y Y, REN S F, LIU F, ZHANG L. Genetic diversity and evolution of goose astrovirus in the east of China[J]. Transboundary and Emerging Diseases, 2022, 69(5): 2059-2072. DOI:10.1111/tbed.14542 |
| [32] |
WU W K, QIU S Y, HUANG H, XU R, BAO E D, LV Y J. Immune-related gene expression in the kidneys and spleens of goslings infected with goose nephritic astrovirus[J]. Poultry Science, 2021, 100(4): 100990. DOI:10.1016/j.psj.2021.01.013 |
| [33] |
REN D, LI T F, ZHANG X Y, YAO X H, GAO W, XIE Q, ZHANG J J, SHAO H X, WAN Z M, QIN A J, YE J Q. OASL triggered by novel goose astrovirus via ORF2 restricts its replication[J]. Journal of Virology, 2020, 94(24). DOI:10.1128/JVI.01767-20 |
| [34] |
WANG Z, LI L, LIU P, WANG C, LU Q, LIU Q N, YANG Y Y, LUO Q P, SHAO H B. Host innate immune responses of geese infected with goose origin nephrotic astrovirus[J]. Microbial Pathogenesis, 2021, 152: 104753. DOI:10.1016/j.micpath.2021.104753 |
| [35] |
XI Y M, YAN J S, LI M Y, YING S J, SHI Z D. Gut microbiota dysbiosis increases the risk of visceral gout in goslings through translocation of gut-derived lipopolysaccharide[J]. Poultry Science, 2019, 98(11): 5361-5373. DOI:10.3382/ps/pez357 |
| [36] |
赵光伟, 邵骜骏, 曹瑞兵, 曹蓝云, 冯昊南, 曹礼静, 谭昌藩, 杨晓伟, 魏思远, 张天奇, 李军, 崔晓焓, 张立武. 鹅星状病毒感染抗体依赖性增强作用[J]. 中国兽医学报, 2023, 43(6): 1181-1186. DOI:10.16303/j.cnki.1005-4545.2023.06.10 ZHAO G W, SHAO A J, CAO R B, CAO L Y, FENG H N, CAO L J, TAN C F, YANG X W, WEI S Y, ZHANG T Q, LI J, CUI X H, ZHANG L W. Study on antibody-dependent enhancement during goose astrovirus infection[J]. Chinese Journal of Veterinary Science, 2023, 43(6): 1181-1186. DOI:10.16303/j.cnki.1005-4545.2023.06.10 |
| [37] |
YANG J, TIAN J J, TANG Y, DIAO Y X. Isolation and genomic characterization of gosling gout caused by a novel goose astrovirus[J]. Transboundary and Emerging Diseases, 2018, 65(6): 1689-1696. DOI:10.1111/tbed.12928 |
| [38] |
HUANG H, DING R, CHEN Z Y, YI Z W, WANG H Y, LV Y J, BAO E D. Goose nephritic astrovirus infection increases autophagy, destroys intercellular junctions in renal tubular epithelial cells, and damages podocytes in the kidneys of infected goslings[J]. Veterinary Microbiology, 2021, 263: 109244. DOI:10.1016/j.vetmic.2021.109244 |
| [39] |
WU W K, XU R, LV Y J, BAO E D. Goose astrovirus infection affects uric acid production and excretion in goslings[J]. Poultry Science, 2020, 99(4): 1967-1974. DOI:10.1016/j.psj.2019.11.064 |
| [40] |
LIU C G, LI L L, DONG J W, ZHANG J Q, HUANG Y Z, ZHAI Q, XIANG Y, JIN J, HUANG X S, WANG G, SUN M H, LIAO M. Global analysis of gene expression profiles and gout symptoms in goslings infected with goose astrovirus[J]. Veterinary Microbiology, 2023, 279: 109677. DOI:10.1016/j.vetmic.2023.109677 |
| [41] |
DING R, HUANG H, WANG H Y, YI Z W, QIU S Y, LV Y J, BAO E D. Goose nephritic astrovirus infection of goslings induces lymphocyte apoptosis, reticular fiber destruction, and CD8 T-cell depletion in spleen tissue[J]. Viruses, 2021, 13(6): 1108. DOI:10.3390/v13061108 |
| [42] |
苗艳, 朱庆贺, 陈亮, 钟鹏, 兰世捷, 冯万宇, 李丹, 张蕾, 沈思思, 江波涛, 金振华, 田秋丰, 于晨龙, 张国华, 罗天瑶. GPV、GoAstV和GPMV三重Nano-PCR检测方法的建立及应用[J/OL]. 中国动物传染病学报, 2022: 1-7. DOI: 10.19958/j.cnki.cn31-2031/s.20220707.003. MIAO Y, ZHU Q H, CHEN L, ZHONG P, LAN S J, FENG W Y, LI D, ZHANG L, SHEN S S, JIANG B T, JIN Z H, TIAN Q F, YU C L, ZHANG G H, LUO T X, Y. Establishment and primary application of a nanoparticle-assisted PCR assay for detction of GPV, GoAstV and GPMV[J/OL]. Chinese Journal of Animal Infectious Diseases, 2022: 1-7. DOI: 10.19958/j.cnki.cn31-2031/s.20220707.003. |
| [43] |
YANG K K, XU L, LIANG Y Q, YIN D D, TU J, SONG X J, SHAO Y, LIU H M, QI K Z. Simultaneous differentiation and diagnosis of goose parvovirus and astrovirus in clinical samples with duplex SYBR Green Ⅰ real-time PCR[J]. Molecular and Cellular Probes, 2020, 52: 101561. DOI:10.1016/j.mcp.2020.101561 |
| [44] |
张红, 田秋丰, 王志强, 黄宇翔, 邹跃, 李鑫, 吕明哲, 杨昊天, 马志刚, 霍明东, 董佳强, 杨坤, 魏念冬, 苗艳, 钟鹏, 陈志峰. 鹅星状病毒鹅细小病毒和鹅坦布苏病毒三重PCR检测方法的建立与应用[J]. 中国兽医科学, 2023, 53(02): 163-169. DOI:10.16656/j.issn.1673-4696.2023.0015 ZHANG H, TIAN Q F, WANG Z Q, HUANG Y X, ZUO Y, LI X, LYU M Z, YANG H T, MA Z G, HUO M D, DONG J Q, WANG K, WEI N D, MIAO Y, ZHON P, CHEN Z F. Establishment and application of a triple PCR method for detection of astrovirus, parvovirus and tembusu virus in goose[J]. Chinese Veterinary Science, 2023, 53(02): 163-169. DOI:10.16656/j.issn.1673-4696.2023.0015 |
| [45] |
LIU H M, HU D M, ZHU Y Q, XIONG H F, LV X, WEI C Q, LIU M M, YIN D D, HE C S, QI K Z, WANG G J. Coinfection of parvovirus and astrovirus in gout-affected goslings[J]. Transboundary and Emerging Diseases, 2020, 67(6): 2830-2838. DOI:10.1111/tbed.13652 |
| [46] |
姚鑫炎, 孙静, 刘宏, 吕志航, 车艺俊, 黄淑坚, 袁生, 张雪莲. 鹅4种常见病毒多重PCR检测方法的建立及初步应用[J]. 中国兽医学报, 2022, 42(11): 2190-2194. DOI:10.16303/j.cnki.1005-4545.2022.11.10 YAO X Y, SUN J, LIU H, LYU Z H, CHE Y J, HUANG S J, YUAN S, ZHANG X L. Establishment and preliminary application of multiplex PCR for detection of four common goose viruses[J]. Chinese Journal of Veterinary Science, 2022, 42(11): 2190-2194. DOI:10.16303/j.cnki.1005-4545.2022.11.10 |
| [47] |
YU J, ZOU J W, LIU X, PAN Y, MU Y Y, LI S Y, WANG J H, XU F Z, WANG Y. TaqMan-probe-based multiplex real-time RT-qPCR for simultaneous detection of GoAstV, GPV, and GoCV[J]. Poultry Science, 2023, 102(2): 102396. DOI:10.1016/j.psj.2022.102396 |
| [48] |
LIN S, ZHANG S Z, WANG S, XIE K C, JIANG D D, XIAO S F, CHEN X Q, CHEN S Y. Development of an EvaGreen based real-time RT-PCR assay for rapid detection, quantitation and diagnosis of goose calicivirus[J]. Molecular and Cellular Probes, 2020, 49: 101489. DOI:10.1016/j.mcp.2019.101489 |
| [49] |
ZHENG M, LIN S, ZHANG S Z, CHEN X Q, JIANG D D, CHEN S Y, WANG S, CHEN S L. Rapid detection of H146-like goose calicivirus using a TaqMan-based real-time PCR assay[J]. Poultry Science, 2021, 100(2): 482-487. DOI:10.1016/j.psj.2020.11.016 |
| [50] |
NIU X Y, TIAN J J, YANG J, JIANG X N, WANG H Z, CHEN H, YI T, DIAO Y X. Novel goose astrovirus associated gout in gosling, China[J]. Veterinary Microbiology, 2018, 220: 53-56. DOI:10.1016/j.vetmic.2018.05.006 |
| [51] |
朱寅初, 王宏宇, 云涛, 华炯钢, 叶伟成, 倪征, 陈柳, 张存. 浙江地区鹅星状病毒分离鉴定及其衣壳蛋白多克隆抗体的制备[J]. 浙江农业学报, 2022, 34(10): 2149-2159. DOI:10.3969/j.issn.1004-1524.2022.10.09 ZHU Y C, WANG H Y, YUN T, HUA J G, YE W C, NI Z, CHEN L, ZHANG C. Isolation and identification of goose astrovirus in Zhejiang Province, China, and preparation of polyclone antibodies against capside protein[J]. Acta Agriculturae Zhejiangensis, 2022, 34(10): 2149-2159. DOI:10.3969/j.issn.1004-1524.2022.10.09 |
| [52] |
ZHU Q H, SUN D B. Goose Astrovirus in China: A Comprehensive Review[J]. Viruses, 2022, 14(8). DOI:10.3390/v14081759 |
| [53] |
WANG Y, BAI C X, ZHANG D, YANG K K, YU Z R, JIANG S D, GE K, LI Y D. Genomic and phylogenetic characteristics of a novel goose astrovirus in Anhui Province, Central-Eastern China[J]. Gene, 2020, 756: 144898. DOI:10.1016/j.gene.2020.144898 |
(责任编辑 邹移光)
 2023, Vol. 50
2023, Vol. 50