文章信息
基金项目
- 岭南现代农业科学与技术广东省实验室茂名分中心基金资助课题(2022KF003);广东省普通高校创新团队项目(2021KCXTD029)
作者简介
- 梁雪雨(1995—),女,在读博士生,研究方向为作物遗传育种,E-mail:964315904@qq.com.
通讯作者
- 杨瑰丽(1977—),女,博士,助理研究员,研究方向为作物遗传育种,E-mail:yanggl@scau.edu.cn.
文章历史
- 收稿日期:2023-09-11
2. 华南农业大学国家植物航天育种工程技术研究中心,广东 广州 510642
2. National Engineering Research Center of Plant Space Breeding, South China Agricultural University, Guangzhou 510642, China
【研究意义】水稻(Oryza sativa L.)是世界三大粮食作物之一,亚洲水稻产量占世界总产量的90%,而我国作为水稻的起源地和最大生产国,其产量占世界总产量的37%[1]。随着经济的快速发展和生活水平的提高,人们对水稻品种的要求也越来越高。优良的水稻品种不仅要求高产,而且要有外观好看、口感和食味适口等特点[2]。水稻香味是水稻重要的品质性状之一[3],直接影响人们对稻米的感官评价。南方稻区是我国重要的水稻主产区域之一[4],水稻种植以籼稻为主,优质稻育种在全国处于领先地位[5]。在国际市场上,香米的价格是普通非香稻米价格的2~3倍。香味性状是优质稻育种中的重要目标性状,更是被列为广东丝苗米品种的一项硬性评价指标,这也为南方稻区优质香稻的选育提出了更高要求。培育符合市场需求的优质香稻品种,可有效提升优质特色水稻产业的生产效益。【前人研究进展】香稻是栽培稻中除了根部以外,茎、叶、花及稻谷均有香味的自然群体,稻米产生香味的物质成分相当复杂[6]。随着气相色谱技术和质谱技术的发展及其在香稻物质成分检测中的普遍应用,已经在香稻品种中检测到500多种挥发性芳香化合物[7]。目前,多数研究认为,2- 乙酰基-1- 吡咯啉(2-acetyl-1-pyrroline,2-AP)是稻米产生香味的主要化合物[8],并且香稻米中的2-AP含量是非香普通稻米的10倍[9]。已有研究表明,水稻香味的产生是由第8号染色体上编码甜菜碱醛脱氢酶(BADH)的Badh2基因突变导致。当Badh2基因在编码区或者调控区域发生突变,BADH酶活性丧失,导致γ- 氨基丁醛积累,进而使γ- 氨基丁醛转化为1- 吡咯啉,最终合成并积累大量的2-AP,从而使水稻产生香味[10]。Badh2基因序列全长6 264 bp,CDS全长1 512 bp,包含15个外显子和14个内含子,编码503个氨基酸[11]。该基因的突变或敲除可导致BADH2蛋白功能缺失,也会引发Badh2的新等位变异产生[12]。研究发现,Badh2基因上至少有27个单倍型[13],超过12个等位基因已被鉴定出来,以小片段序列插入或删除(Indel)和单核苷酸变异(SNP)为主[14]。传统的水稻香味性状的鉴定方法主要有热水法、咀嚼法等,这些方法主观影响大、重复性差、效率低[3]。与传统的方法相比,分子标记鉴定技术具有操作简单、特异性高、稳定性强、分析结果可靠等优点,近年来得到了更多的关注及应用[15]。研究者们针对Badh2功能性等位基因变异位点设计了一系列特异引物用于香味基因的筛选[16],利用与Badh2基因紧密连锁的分子标记能够区分香稻和非香水稻[17]。【本研究切入点】香稻种质资源鉴定的方法复杂且准确性较低,将分子标记应用到香稻种质资源鉴定过程中至关重要,目前已发现了20多种Badh2的等位基因型,但对不同基因型在南方稻区香稻育种中的真正应用情况仍缺乏较全面的了解,分析育种实践中香稻品种的香味基因Badh2等位基因型的分布与利用频率,可以更好地服务于香稻选育实践。本研究收集南方稻区种植的香稻品种共30份,分析其Badh2基因突变类型的分布,同时对其进行香味性状定性鉴定,为未来香稻种质资源的利用和育种实践提供依据和参考。【拟解决的关键问题】利用KASP新型分子标记技术对南方稻区香稻主栽品种的香味基因Badh2进行基因分型,了解目前南方香稻品种香味基因Badh2的遗传背景,为分子标记辅助选择优质香稻新品种的选育提供理论基础依据。
1 材料与方法 1.1 试验材料以南方稻区30份香稻主栽品种、20份非香稻品种为试验材料,于2021年7月种植在华南农业大学国家航天育种工程技术研究中心实验基地,由农场管理人员种植并管理。在水稻生长旺盛期剪取水稻倒二叶置于-20 ℃保存,在成熟期收获稻谷并置于-80 ℃保存。
1.2 试验方法1.2.1 KOH浸泡法鉴定水稻香味 将稻谷用砻谷机磨成糙米,取2 g糙米置于容量为15 mL顶空瓶中,加入10 mL 1.7% KOH溶液加盖密封,放于50 ℃烘箱中10~15 min,之后开盖闻其气味,有香味记为“1”,无香味则记为“0”。注意打开盖子时要立即闻其香味有无,否则香味物质会很快挥发,影响试验结果。
1.2.2 咀嚼法 随机选取3~10粒精米,放入口中咀嚼,通过将气体吸入鼻腔中,有明显的刺激性香味记为有香,咀嚼后判定香味有无,重复验证3次,以防出错。
1.2.3 2-AP定量检测 2-AP萃取的方法通过顶空固相微萃取方法(HS-SPME)结合GC-MS检测技术提取并检测水稻中香味物质2-AP,具体步骤参照刘洪等[18]的检测方法。
1.2.4 水稻全基因DNA提取 采用CTAB法提取水稻叶片全基因组DNA,利用NANODROP1000紫外分光光度计检测DNA浓度,确保所提DNA质量好且浓度高,之后放于冰箱-20 ℃保存备用。
1.2.5 KASP基因分型 KASP引物共3条,其中2条为与等位基因特异性结合的带有FAM或HEX荧光标记的正反向引物、1条为通用引物。引物设计参照陈思平[19],序列信息如表 1所示,由生工生物工程有限公司合成。
1.2.6 序列验证 水稻材料Badh2-E7突变位点测序验证,Badh2引物序列参照Shi等[20]报道的Badh2-P6引物序列,扩增引物由生工生物工程有限公司合成。测序结果由北京擎科生物科技有限公司提供。以野生型非香稻日本晴OsBadh2的基因序列(来源于国家水稻数据中心,www.ricedata.com)为参考,利用Snap Gene软件对测序结果进行序列比对分析。
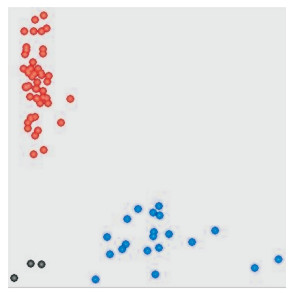
2 结果与分析 2.1 Badh2-E7等位基因型分型结果利用KASP分子标记技术进行香稻品种与非香稻对照材料进行基因分型,结果(图 1)发现,所有测试样品被分成2类,30份香稻资源均为Badh2-E7突变类型(红色线框内红点为携带Badh2-E7基因型的材料),即Badh2基因在第7外显子上存在8个碱基的缺失和3个碱基多态性,且这30份种质中包含已知Badh2-E7基因型材料玉针香;20份非香稻对照材料均为非Badh2-E7基因型(蓝色线框内蓝点代表该材料)。
|
| 红色为Badh2-E7类型;蓝色为非Badh2-E7类型;黑色为空白对照 Red represents the Badh2-E7 type; Blue represents non Badh2-E7 type; Black represents blank control 图 1 Badh2基因分型检测结果 Fig. 1 Genotyping results of Badh2 |
2.2 携带Badh2-E7基因型的水稻品种香味性状鉴定
利用KOH浸泡法和咀嚼法对KASP分子标记鉴定为携带Badh2-E7基因型的30份水稻品种进行水稻香味性状定性鉴定,结果(表 2)表明30份水稻种质均具有香味。

|
2.3 2-AP定量检测结果
为进一步验证香稻中具体2-AP的含量,选取香稻品种美香占2号、玉针香、Basmati 370进行香味物质2-AP定量检测,结果分别含有2-AP 130、156、144 μg/kg。
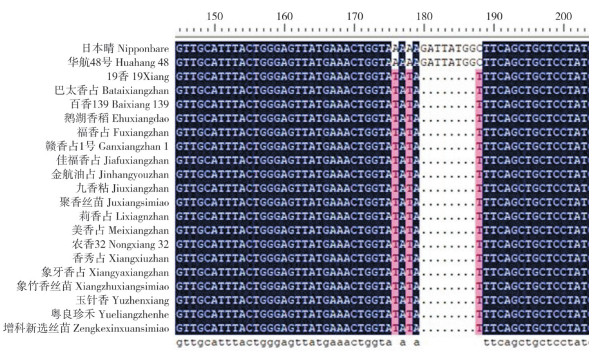
2.4 基因分型结果验证随机抽取19份Badh2-E7基因型的种质资源和2份非香对照材料日本晴和华航48号,扩增Badh2第7外显子序列进行Sanger测序。测序比对结果(图 2)显示,19香、巴太香占、百香139、鹅湖香稻(赣晚籼40号)、福香占、赣香占1号、佳福香占、金航油占、九香粘、聚香丝苗、莉香占、美香占、农香32、香秀占、象牙香占、象竹香丝苗、玉针香、粤良珍禾、增科新选丝苗1号的测序结果与KASP分型结果一致,表明KASP基因分型结果的准确率达100%。
|
| 图 2 Badh2-E7目标片段测序验证结果 Fig. 2 Sequencing verification result of target fragment Badh2-E7 |
2.5 香源亲本系谱分析
为更好地利用这些香稻种质资源,本研究对所收集的南方稻区香稻主栽品种的原始香源亲本进行溯源分析。根据国家水稻数据中心(https://www.ricedata.cn/)提供的品种谱系信息,分析其香源亲本来源和背景,并统计原始香源亲本的在香稻育种中的利用频次,最终发现所鉴定香稻材料中,除Basmati 370、赣香占1号外,其他品种均在数据库中成功溯源。分析结果(表 3)显示,现象牙香占、Basmati 370、粤香占、农香16等作为香源亲本利用度较高。其中象牙香占被作为香源亲本利用频次最高,本研究中约30% 的香稻品种以象牙香占为香源亲本;13% 的品种以Basmati 370为香源亲本;以农香16、粤香占为香源亲本的品种均占10%;其他香源亲本占比约37%。
3 讨论
目前,香稻的鉴定方法主要包括定性和定量检测2种方法。其中,定性检测可以通过咀嚼或KOH浸泡后进行香味鉴定,而定量检测法则包括气相色谱- 质谱(GC-MS)、气相色谱- 嗅觉测定(GC-O)和电子鼻(E-nose)等。定性检测法在大批量样品检测中容易对气味敏感性降低而产生误判,导致香稻材料丢失,定量检测法利用GC-MS大型仪器检测样品昂贵[21]。随着测序技术的发展,分子标记技术越来越广泛地被应用到作物育种实践中,随着大量与水稻产量、抗病、品质相关的功能基因的成功克隆,分子标记在作物改良和种质资源筛选过程中发挥的作用也愈来愈明显[22]。KASP作为第三代单苷酸多态性(SNP)分子标记,是基于测序技术的高通量标记,由于其具有数量巨大、基因组分布广泛、遗传稳定等特点,近年来在大规模基因分型与种质资源鉴定筛选中发挥着越来越重要的作用[23]。本研究利用KASP功能性分子标记基因分型技术对南方稻区30份香稻推广种质资源进行香味基因Badh2的基因型分析,检测快速,且结果准确性可达到100%。香味表型检测结果也验证了该标记与香味表型间的高度一致,这也表明KASP分子标记可以高效且准确地应用到香稻Badh2-E7基因分型和种质筛选中。随着分子生物学的迅速发展,在不久的将来会有越来越多高效、便捷的分子标记应用在香稻种质资源的筛选和育种上。
在香稻种质资源筛选的过程中,具有不同Badh2突变类型的材料被陆续发现,丰富了香稻种质资源的遗传背景。南方稻区作为在水稻重要产区,香稻品种培育过程中香型育种亲本的选择依据及其香味基因Badh2的背景等仍缺乏较全面的研究。本研究中所搜集的香稻品种所携带的Badh2基因型均为Badh2-E7类型,香味基因背景较为单一。目前,在水稻材料中已经鉴定出其他多种Badh2等位基因型,例如南方稻区中江苏省的“南粳”系列、“武运粳”系列等位基因型为Badh2-E2.1(第二外显子缺失7 bp),“香粳糯”系列等位基因型为Badh2-E2.2(第二外显子缺失75 bp);浙江和广西地区的“香糯稻”等位基因型为Badh2-E4-5(第4、5外显子806 bp缺失);福建省的“一支香”等位基因型为Badh2-E10.4(第10号外显子G/A突变);中国台湾的台农72号、香宝1号等位基因型为Badh2-E13.2(第13号外显子C/T突变)等[14],但是这些等位基因型在南方稻区香稻育种中利用频率不高。在香稻栽培过程中,香稻多数存在生长周期长、光周期敏感,产量低易倒伏等问题,导致香稻的推广生产面积较低,目前香稻面临着既要保证产量的同时又要保证稻米品质的挑战,这就更加需要大量的高产质优的种质资源作为杂交育种的亲本来源,提供丰富的香稻亲本资源,为育成优良香稻品种提供可能性。通过对本研究中香稻主栽香稻品种的亲本溯源,我们发现这些香稻品种的香源亲本较为单一,主要以象牙香占、Basmati 370等为香源亲本杂交选育而来。因此,香源亲本的单一性也在一定程度上导致南方稻区大部分香稻品种的香源基因遗传背景狭窄。中国是亚洲栽培稻多样性中心之一,水稻的遗传资源具有品种多样性、丰富度高和类型复杂等特点,香稻种质资源也非常丰富并且分布广泛[24-25]。在香稻育种中可供利用的香稻种质资源有限,大量有价值的等位基因变异未被我们挖掘,在遗传育种中未被充分应用[26]。香稻遗传育种不仅需要精准且高效的香味性状鉴定技术,也更加需要来源广泛的香稻种质资源。在未来香稻育种实践中,可以考虑引入更多的优质香源亲本,丰富香稻品种材料的遗传背景,并结合分子标记辅助选择育种等新育种策略和方法,提高香稻筛选与鉴定效率,加快香稻新品种培育工作。
4 结论本研究利用KASP分子标记分析了30份南方稻区香稻主栽品种香味基因Badh2的基因型,并结合香味表型检测结果及基因测序技术,验证了KASP分子标记可高效且准确地进行香稻Badh2基因分型和香稻种质筛选;同时,本研究发现30份香稻品种的香味基因Badh2均为Badh2-E7型,香稻资源的遗传背景较为单一,在未来香稻育种实践中应加大对其他香味基因类型的香稻种质资源的挖掘与利用,适当引入新的香味基因,以丰富香稻育种的遗传背景,培育更多香味类型的香稻品种。
| [1] |
赵凌, 赵春芳, 周丽慧, 王才林. 中国水稻生产现状与发展趋势[J]. 江苏农业科学, 2015, 43(10): 105-107. DOI:10.15889/j.issn.1002-1302.2015.10.032 ZHAO L, ZHAO C F, ZHOU L H, WANG C L. Current situation and development trend of rice production in china[J]. Jiangsu Agricultural Sciences, 2015, 43(10): 105-107. DOI:10.15889/j.issn.1002-1302.2015.10.032 |
| [2] |
于梅梅. 利用CRISPR/Cas9技术改良稻米外观和食味品质的研究[D]. 扬州: 扬州大学, 2019. YU M M. Improvement of rice grain quality by using CRISPR/Cas9 System[D]. Yangzhou: Yangzhou University, 2019. |
| [3] |
CHAN-IN P, JAMJOD S, YIMYAM N, RERKASEM B, PUSADEE T. Grain quality and allelic variation of the Badh2 gene in Thai fragrant rice landraces[J]. Agronomy, 2020, 10(6): 779. DOI:10.3390/agronomy10060779 |
| [4] |
潘阳阳, 周德贵, 黄道强, 王重荣, 李宏, 王志东, 陈宜波, 赵雷, 龚蓉, 周少川. 香稻不同发育时期香味物质的变化分析[J]. 广东农业科学, 2021, 48(10): 42-51. DOI:10.16768/j.issn.1004-874X.2021.10.005 PAN Y Y, ZHOU D G, HUANG D Q, WANG Z R, LI H, WANG Z D, CHEN Y B, ZHAO L, GONG R, ZHOU S C. Analysis on the changes of aroma compounds in aromatic rice at various developmental stages[J]. Guangdong Agricultural Sciences, 2021, 48(10): 42-51. DOI:10.16768/j.issn.1004-874X.2021.10.005 |
| [5] |
何秀英, 周少川, 刘志霞, 刘传光. 广东省农业科学院常规水稻育种60年: 成就与展望[J]. 广东农业科学, 2020, 47(11): 1-8. DOI:10.16768/j.issn.1004-874x.2020.11.001 HE X Y, ZHOU S C, LIU Z X, LIU C G. Sixty years conventional rice breeding of Guangdong Academy of Agricultural Sciences: Achievements and prospects[J]. Guangdong Agricultural Sciences, 2020, 47(11): 1-8. DOI:10.16768/j.issn.1004-874x.2020.11.001 |
| [6] |
OKPALA N E, MO Z, DUAN M, TANG X. The genetics and biosynthesis of 2-acetyl-1-pyrroline in fragrant rice[J]. Plant Physiology and Biochemistry, 2019, 135: 272-276. DOI:10.1016/j.plaphy.2018.12.012 |
| [7] |
魏晓东, 张亚东, 赵凌, 路凯, 宋雪梅, 王才林. 稻米香味物质2-乙酰-1-吡咯啉的形成及其影响因素[J]. 中国水稻科学, 2022, 36(2): 131-138. DOI:10.16768/j.issn.1004-874x.2020.11.001 WEI X D, ZHANG Y D, ZHAO L, LU K, SONG X M, WANG C L. Research progress in biosynthesis and influencing factors of 2-acetyl-1-pyrroline in fragrant rice[J]. Chinese Journal of Rice Science, 2022, 36(2): 131-138. DOI:10.16768/j.issn.1004-874x.2020.11.001 |
| [8] |
LORIEUX M, PETROV M, HUANG N, GUIDERDONI E, GHESQUIERE A. Aroma in rice: Genetic analysis of a quantitative trait[J]. Theoretical and Applied Genetics, 1996, 93(7): 1145-1151. DOI:10.1007/BF00230138 |
| [9] |
徐善斌. 利用CRISPR/Cas9技术高效创制长粒香型粳稻新种质[D]. 哈尔滨: 东北农业大学, 2021. DOI: 10.27010/d.cnki.gdbnu.2021.000390. XU S B. Improvement of grain shape and aroma in japonica rice by using CRISPR/Cas9 system[D]. Harbin: Northeast Agricultural University, 2021. DOI: 10.27010/d.cnki.gdbnu.2021.000390. |
| [10] |
BRADBURY L M, FITZGERALD T L, HENRY R J, JIN Q, WATERS D L. The gene for aroma in rice[J]. Plant Biotechnology Journal, 2005, 3(3): 363-370. DOI:10.1111/j.1467-7652.2005.00131.x |
| [11] |
祁永斌, 张礼霞, 王林友, 宋建, 王建军. 利用CRISPR/Cas9技术编辑水稻香味基因Badh2[J]. 中国农业科学, 2020, 53(8): 1501-1509. DOI:10.16819/j.1001-7216.2022.201214 QI Y B, ZHANG L X, WANG L Y, SONG J, WANG J J. CRISPR/Cas9 targeted editing for the fragrant gene Badh2 in rice[J]. Scientia Agricultura Sinica, 2020, 53(8): 1501-1509. DOI:10.16819/j.1001-7216.2022.201214 |
| [12] |
SHAN Q W, WANG Y P, CHEN K L, LIANG Z, LIA J, ZHANG Y, ZHANG K, LIU J X, DANIEL F, VOYTASB, ZHENG X L, ZHANG Y, GAO C X. Rapid and efficient gene modification in rice and Brachypodium using TALENs[J]. Molecular Plant, 2013, 6(4): 1365-1368. DOI:10.1093/mp/sss162 |
| [13] |
SHAO G N, TANG S, CHEN M L, WEI X J, HE J W, LUO J L, JIAO G A, HU Y C, XIE L H, HU P S. Haplotype variation at Badh2, the gene determining aroma in rice[J]. Genomics, 2013, 101(2): 157-162. DOI:10.1016/j.ygeno.2012.11.010 |
| [14] |
潘阳阳, 黄道强, 王重荣, 李宏, 周德贵, 王志东, 陈宜波, 赵雷, 龚蓉, 周少川. 香稻Badh2基因单倍型及香气成分2-乙酰-1-吡咯啉代谢通路的研究进展[J]. 广东农业科学, 2021, 48(7): 9-16. DOI:10.16768/j.issn.1004-874X.2021.07.002 PAN Y Y, HUANG D Q, WANG Z R, LI H, ZHOU D G, WANG Z D, CHEN Y B, ZHAO L, GONG R, ZHOU S C. Research advances of haplotype variation at Badh2 gene and 2-Acetyl-1-pyrroline biosynthetic pathway in aromatic rice[J]. Guangdong Agricultural Sciences, 2021, 48(7): 9-16. DOI:10.16768/j.issn.1004-874X.2021.07.002 |
| [15] |
李袁杰. 基于DNA条形码和ISSR分子标记技术的葛属植物遗传多样性研究[D]. 南昌:江西中医药大学, 2022. DOI: 10.27180/d.cnki.gjxzc.2022.000292. LI Y J. Study of genetic diversity of pueraria based on DNA barcoding and ISSR molecular marker technology[D]. Nanchang:Jiangxi University of Chinese Medicine, 2022. DOI: 10.27180/d.cnki.gjxzc.2022.000292. |
| [16] |
王丰, 李金华, 柳武革, 廖亦龙, 朱满山, 刘振荣, 黄慧君, 黄德娟. 一种水稻香味基因功能标记的开发[J]. 中国水稻科学, 2008(4): 347-352. DOI:10.16819/j.1001-7216.2008.04.003 WANG F, LI J H, LIU W G, LIAO Y L, ZHU M S, LIU Z R, HUANG H J, HUANG D J. Development of a functional marker for fragrance gene in rice[J]. Chinese Journal of Rice Science, 2008(4): 347-352. DOI:10.16819/j.1001-7216.2008.04.003 |
| [17] |
彭波, 孙艳芳, 陈报阳, 孙瑞萌, 孔冬艳, 庞瑞华, 李先文, 宋晓华, 李慧龙, 李金涛, 周棋赢, 柳琳, 段斌, 宋世枝. 水稻香味基因及其在育种中的应用研究进展[J]. 植物学报, 2017, 52(6): 797-807. DOI:10.11983/CBB16197 PENG B, SUN Y F, CHEN B Y, SUN R M, KONG D Y, PANG R H, LI X W, SONG X H, LI H L, LI J T, ZHOU Q Y, LIU L, DUAN B, SONG S Z. Advances in rice aroma gene and its application in breeding[J]. Chinese Bulletin of Botany, 2017, 52(6): 797-807. DOI:10.11983/CBB16197 |
| [18] |
刘洪, 饶得花, 任永浩, 邱友媚, 陈兴林, 徐振江. 香稻香气特征化合物2-乙酰基-1-吡咯啉测定方法的建立[J]. 湖南农业大学学报(自然科学版), 2015, 41(3): 234-238. DOI:10.13331/j.cnki.jhau.2015.03.002 LIU H, RAO D H, REN Y H, QIU Y M, CHEN X L, XU Z J. A method on determination the 2-acetyl-1-pyrroline of aromatic rice[J]. Journal of Hunan Agricultural University (Natural Sciences), 2015, 41(3): 234-238. DOI:10.13331/j.cnki.jhau.2015.03.002 |
| [19] |
陈思平. 基于KASP的水稻基因组SNP标记开发及其育种应用[D]. 广州: 华南农业大学, 2017. CHEN S P. Development of rice SNP marker based on KASP technology and its application in breeding[D]. Guangzhou: South China Agricultural University, 2017. |
| [20] |
SHI W, YANG Y, CHEN S, XU M. Discovery of a new fragrance allele and the development of functional markers for the breeding of fragrant rice varieties[J]. Molecular Breeding, 2008, 22(2): 185-192. DOI:10.1007/s11032-008-9165-7 |
| [21] |
PERIS M, ESCUDER-GILABERT L. A 21st century technique for food control: electronic noses[J]. Analytica Chimica Acta, 2009, 638(1): 1-15. DOI:10.1016/j.aca.2009.02.009 |
| [22] |
LIU W, LIU J, TRIPLETT L, LEACH J E, WANG G L. Novel insights into rice innate immunity against bacterial and fungal pathogens[J]. Annual Review of Phytopathology, 2014, 52: 213-241. DOI:10.1146/annurev-phyto-102313-045926 |
| [23] |
GANAL M W, POLLEY A, GRANER E M, PLIESKE J, WIESEKE R, LUERSSEN H, DURSTEWITZ G. Large SNP arrays for genotyping in crop plants[J]. Journal of Bioscience and Bioengineering, 2012, 37(5): 821-828. DOI:10.1007/s12038-012-9225-3 |
| [24] |
WU Z G, TANG D, LIU K, MIAO C B, ZHOU X X, LI Y F, TAN X L, SUN M F, LUO Q, CHEN Z K. Characterization of a new semidominant dwarfallele of SLR1 and its potential application in hybrid rice breeding[J]. Journal of Experimental Botany, 2018, 69(20): 4703-4713. DOI:10.1093/jxb/ery243 |
| [25] |
SHAN Q W, CHEN K L, ZHANG Y, GAO C X, ZHANG K. Creation of fragrant rice by targeted knockout of the OsBADH2 gene using TALEN technology[J]. Plant Biotechnology Journal, 2015, 13(6): 791-800. DOI:10.1111/pbi.12312 |
| [26] |
MCCOUCH S R, TEYTELMAN L, XU Y B, LOBOS K B, CLARE K, WALTON M, FU B Y, MAGHIRANG R, LI Z K, XING Y Z, ZHANG Q F, KONO I, YANO M, FJELLSTROM R, DECLERCK G, SCHNEIDER D, CARTINHOUR S, WARE D, STEIN L. Development and mapping of 2240 new SSR markers for rice (Oryza sativa L.) (supplement)[J]. DNA Research, 2002, 9(6): 257-279. DOI:10.1093/dnares/9.6.257 |
(责任编辑 马春敏)
 2023, Vol. 50
2023, Vol. 50