文章信息
基金项目
- 国家自然科学基金(31970154)
作者简介
- 张乐(1997―),男,在读硕士生,研究方向为兽医公共卫生,E-mail:zhangle20@mails.jlu.edu.cn.
通讯作者
- 段铭(1975―),男,博士,教授,研究方向为兽医公共卫生,E-mail:duan_ming@jlu.edu.cn.
文章历史
- 收稿日期:2022-10-25
【研究意义】犬瘟热病毒(Canine Distemper Virus,CDV)于1905年首次被分离[1],其引起的犬瘟热(Canine Distemper,CD)最初被认为是一种严重威胁家养犬生命的疾病,并常与犬细小病毒共同感染,但后来发现CDV还可感染一些非人灵长类动物和许多哺乳动物[2-6],严重威胁动物的生命健康,并可造成重大的经济和生态损失[7]。我国于1980年第一次分离到CDV。调查CD的流行特点和发病规律,可为CD的防控提供理论依据。
【前人研究进展】CDV是一种较大的ssRNA病毒,直径为100~250 nm,属于副粘病毒科麻疹病毒属(Morbillivirus)。CDV有一个脂蛋白包膜,基因组长度约16 000 nt。与其他副粘病毒类似,CDV包含6种结构蛋白,分别为基质蛋白(Matrix,M)、血凝素(Haemagglutinin,H)、融合蛋白(Fusion protein,F)、磷蛋白(Phosphoprotein,P)、大蛋白(Large protein,L)、核衣壳蛋白(Nucleocapsid protein,N),按3'-5' 端顺序依次为前导序列-N-P-M-F-H-L-引导序列[8-9]。根据其H蛋白的变异类型[10-12],CDV可分为Rockborn-like型、美国1型、美国2型、亚洲1型和2型、南美1型、南美2型、南美3型、欧洲野生型、非洲1型和2型[13-14]。
CDV H蛋白作为重要的病毒囊膜糖蛋白,可与宿主细胞膜上的信号淋巴细胞活化分子(Signaling Lymphocytic Activation Molecule,SLAM)和细胞黏附分子(Nectin-4)结合,两种受体在病毒的吸附和侵入宿主细胞过程中起发挥重要功能[15-16]。Bieringer等[17]研究发现,CDV H蛋白的540位残基Asp到Gly(D540G)的替换可以使CDV适应人的SLAM受体。Feng等[18]研究发现,大熊猫/SX/2014毒株H基因编码蛋白发生了5处特有的氨基酸替换,这些变化未曾在CDV亚洲1型毒株中观察到,并且从受感染的大熊猫CDV H蛋白上发现549位的酪氨酸发生取代。越来越多的研究显示,H蛋白上某些氨基酸的替换可导致其与受体结合能力的改变,是CDV跨宿主传播的原因之一[19]。因此H基因的扩增、克隆和测序,是鉴定CDV毒株基因型和研究CDV遗传演化的有力手段。
【本研究切入点】近几年CDV在河南省、河北省内犬和毛皮养殖动物中的流行情况尚不明确,不利于地区CDV防控策略的选择。【拟解决的关键问题】为进一步探究CD在河南与河北的流行情况,本研究于2019—2020年期间从两省部分地区随机采集犬、水貂、貉和狐狸样品459份,通过RT-PCR检测、毒株分离鉴定并基于病毒H基因的遗传进化分析等技术方法,分析了该地区犬和几种毛皮养殖动物中的CDV流行概况,成功分离了1株犬源毒株,并明确了该毒株的基因型。研究结果可为该地区的CDV预防、疫苗选择与使用提供参考依据。
1 材料与方法 1.1 试验材料1.1.1 病料采集 2019—2020年期间在河南和河北部分地区的宠物医院及毛皮动物养殖场,随机采集了459份犬、水貂、貉、狐狸的样品,包括动物的口鼻拭子、血液、粪便,以及用于病毒分离鉴定的9只死亡动物的新鲜组织。采集的样品速冻后保存于-80 ℃冰箱中备用。
1.1.2 主要试剂 Vero-SLAM细胞由吉林大学人兽共患病研究所病毒病实验室构建;CD抗原检测试纸条购自韩国京畿道BioNote股份有限公司;病毒基因组RNA提取试剂盒购自凯杰生物技术(上海)有限公司;反转录试剂盒购自诺唯赞(南京)生物科技股份有限公司;PCR试剂盒、胶回收试剂盒均购自莫纳生物科技有限公司;大肠杆菌DH5α感受态细胞、pEASY-Blunt载体均购自北京全式金生物技术有限公司;小鼠抗CDV-F单克隆抗体(IG5)购自安诺伦(北京)生物科技有限公司;FITC标记羊抗鼠IgG购自上海碧云天生物技术有限公司;DMEM培养基购买自赛默飞生物化学制品(北京)有限公司;胎牛血清购自Biological Industries公司。
1.2 试验方法1.2.1 病毒的RT-PCR检测 对试纸条检测为CD阳性的样品进行RT-PCR检测。按照试剂盒说明书进行操作,依次完成RNA提取、反转录、病毒NP基因的PCR扩增。引物为NP-F:5'-CAGAGGATCATAGACGACCCTGA-3',NP-R:5'-GGTGCTGTTTCACCCATCTGYTG-3'。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s、54 ℃退火30 s、72 ℃延伸30 s,共35个循环;72 ℃终延伸5 min。将PCR产物用1.5% 琼脂糖凝胶电泳进行鉴定。
1.2.2 病毒分离及鉴定 无菌操作下取CD阳性动物组织样放入灭菌的研钵中充分研磨,然后加入预冷的PBS制成10%(W/V)的匀浆,整个过程均在冰上进行。阳性组织匀浆经0.22 μm滤器过滤后,病毒按1 ︰ 10的比例接种Vero-SLAM细胞,37 ℃下吸附1 h,弃掉上清液,PBS冲洗1次,补加含2% 胎牛血清的DMEM细胞培养液,再置于37 ℃、5% CO2的培养箱中培养,同时以未接毒的正常细胞为对照。当80%~90% 以上的细胞出现多核巨细胞、融合等CD典型的致细胞病变效应(Cytopathic Effect,CPE)时收毒,-80 ℃冻存备用[20]。
1.2.3 间接免疫荧光鉴定 将病毒分离株接种至Vero-SLAM细胞,出现典型的CPE时加多聚甲醛进行固定,以1 ︰ 1 000稀释小鼠抗CDV-F单克隆抗体IG5,并以1 ︰ 500稀释FITC标记的羊抗鼠IgG为二抗,对分离毒株进行间接免疫荧光鉴定,同时设立对照。
1.2.4 H基因遗传进化分析 利用软件Primer Premier 5.0设计引物对CDV-H-F(5'-TTAGGGCTCAGGTAGTCCA-3')和CDVH-R(5'-CTAAGKCCAATTGARATGTGT-3'),对分离毒株进行目的片段扩增。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s、54 ℃退火30 s、72 ℃延伸1 min 30 s,共35个循环;72 ℃终延伸5 min。反应结束后,取10 μL PCR产物用1.5% 琼脂糖凝胶电泳进行检测,并用胶回收试剂盒纯化目的片段,使用pEASY-Blunt载体连接目的片段,转入大肠杆菌DH5α感受态细胞中,经蓝白斑筛选和PCR检测后,对阳性克隆进行测序。应用DNAStar V7.1软件对测序所获H基因序列进行比对分析。采用MEGA 7.0软件,选取邻接法(Neighbor-joining method,NJ)构建系统发育树。
2 结果与分析 2.1 疑似犬瘟热样品的RT-PCR检测以反转录得到的cDNA为模板,使用设计的NP引物对,经PCR扩增后得到大小约为668 bp的特异性条带,与预期结果相符(图 1),证明为犬瘟热阳性。

|
| M:DNA分子量标准 Trans Plus 2K;1~14:RT-PCR扩增产物;15:阳性对照;16:阴性对照 M: DNA Marker Trans Plus 2K; 1-14: RT-PCR amplification products; 15: Positive control; 16: Negative control 图 1 CDV RT-PCR鉴定结果 Fig. 1 Results of CDV RT-PCR identification |
2.2 犬瘟热阳性病例调查分析
本研究采集了459份样品,经RT-PCR检测鉴定的阳性样品有87份,阳性率为18.96%(图 2A),且河南、河北两省部分地区均有发病(图 2B)。分析结果表明,流调所涉地区CD一年四季均有发病。犬于秋季(9—11月)阳性率最高、为37.77%,冬季(12—2月)阳性率最低、为11.10%(图 2C)。由于养殖周期的原因,水貂、貉、狐狸的样品只在6—9月进行采集,以7月CDV阳性率最高,分别为33.33%、36.36% 和36.84%(图 2D)。流调所涉动物均表现出幼龄动物更易感CDV,犬中12月龄以下的阳性率为75.56%(图 2E),水貂、貉、狐狸中2岁龄以下阳性率分别为75%、81.82% 和73.68%(图 2F)。
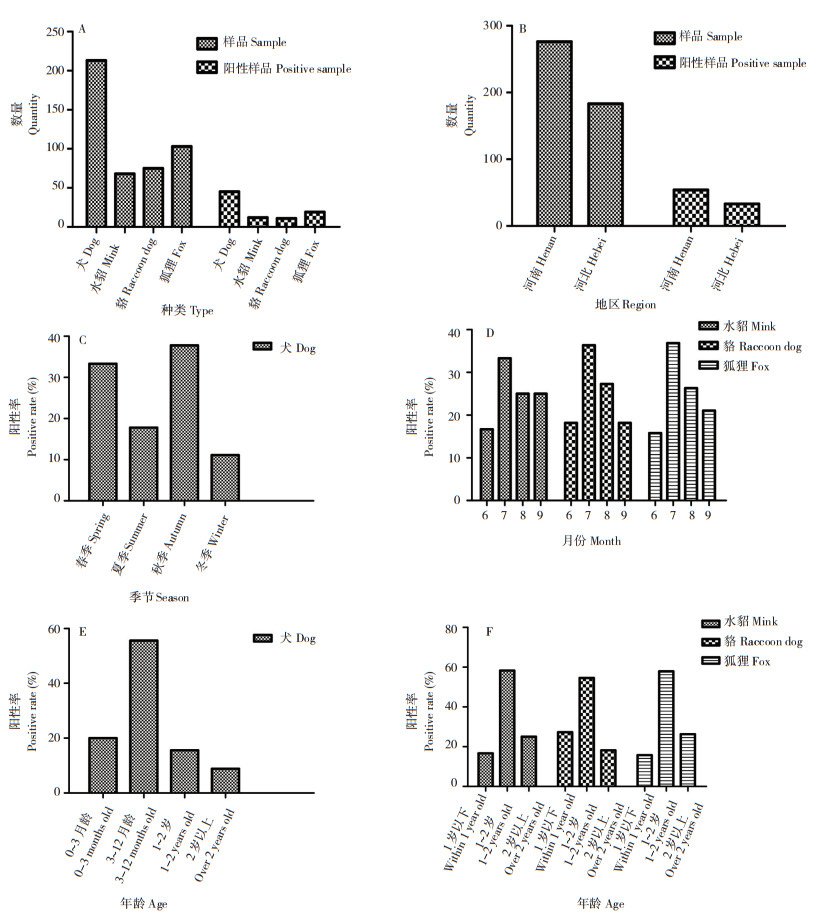
|
| 图 2 犬瘟热阳性样本在种类(A)、地区(B)、季节(C、D)和年龄(E、F)上的分布 Fig. 2 Distribution of canine distemper positive samples in different species (A), regions (B), seasons (C, D) and ages (E, F) |
2.3 病毒分离及鉴定
将CD阳性样品接种至Vero-SLAM细胞,盲传3代后,发现有1份病犬样品出现合胞体、拉网和细胞脱落等CD典型的致细胞病变效应(图 3),阴性对照未出现。随后应用免疫荧光进一步鉴定,结果(图 4)可见绿色特异性荧光,说明该分离株为CDV,命名为HB19-1株。

|
| A:正常Vero-SLAM细胞;B:感染CDV的Vero-SLAM细胞 A: Normal Vero-SLAM cells; B: Vero-SLAM cells infected with CDV 图 3 分离毒株感染Vero-SLAM细胞的病变分析 Fig. 3 Cytopathic analysis of Vero-SLAM cell infected with CDV |
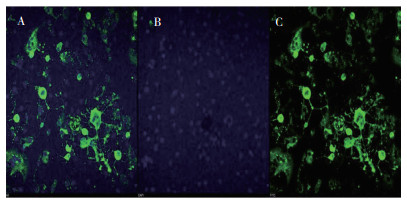
|
| A: Merge; B: DAPI; C: FITC 图 4 分离毒株的间接免疫荧光鉴定结果 Fig. 4 Indentification results of indirect immunofluorescence of isolated virus strain |
2.4 CDV H基因的遗传进化分析
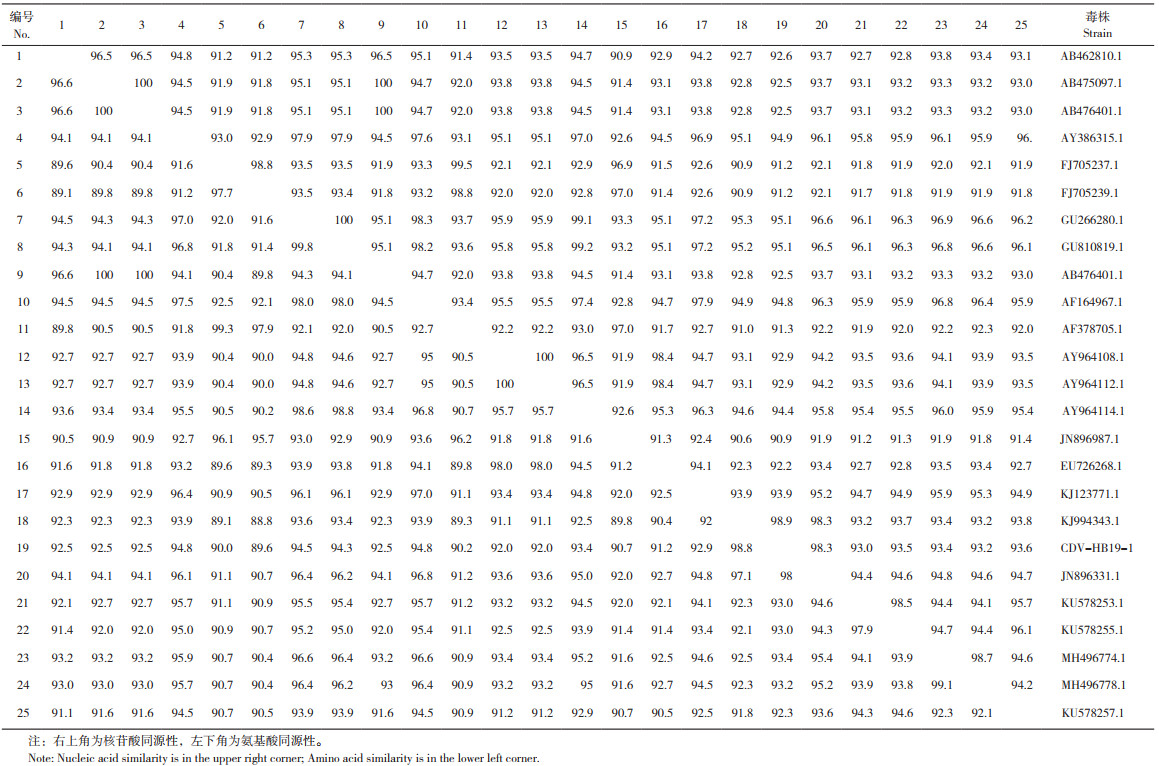
使用MEGA7软件,对HB19-1毒株进行遗传进化分析。基于CDV H基因序列的系统发育分析和多序列比对表明,HB19-1毒株属于亚洲1型毒株(图 5),与来源于山东貉分离的犬瘟热病毒株(GenBank登录号:KJ994343)同源性最高,亲缘关系最近,核苷酸和氨基酸同源性分别为98.9% 和98.8%;与疫苗株Onderstepoort(GenBank登录号:AF378705)的核苷酸及氨基酸同源性相对较低,核苷酸同源性为91.3%,氨基酸同源性为90.2%(表 1)。
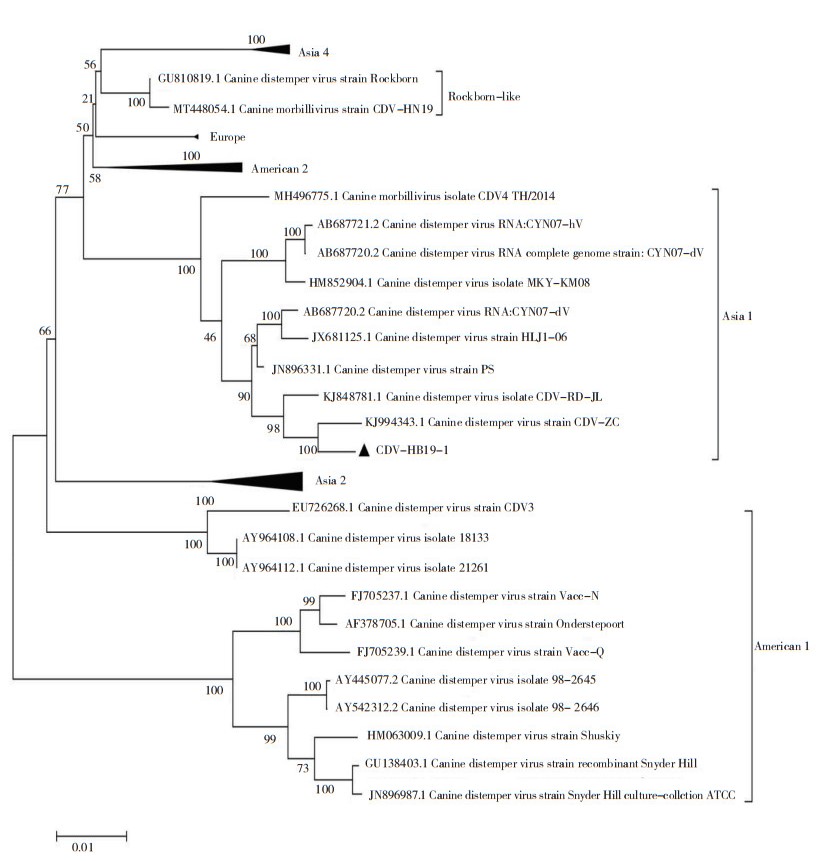
|
| 图 5 基于CDV H基因序列的系统进化分析 Fig. 5 Phylogenetic analysis of CDV based on H gene sequence |
|
3 讨论
CDV存在于被感染动物呼吸道、消化道、泌尿生殖道等的分泌物中,主要通过空气和飞沫传播,易感动物也能通过接触患病动物的排泄物而被感染[21]。CDV主要感染犬,可以侵入中枢神经系统,导致急性脱髓鞘,一般在感染后2~4周死亡,犬类感染CD的死亡率为30%~80%,仅次于狂犬病[22-23]。因为毛皮动物对CDV也较为易感,且具有较强的致病性(对雪貂的致死率可高达100%)[24-25],因此,CDV对我国毛皮动物养殖业造成极大危害,可导致严重的经济损失。因此,做好CDV的追踪调查和防控,不但对动物的健康意义重大,而且对动物生态、经济安全同样具有重要意义。
CD在我国宠物犬和养殖毛皮动物中的流行情况一直为动物医学工作者所关注。近几年先后报道了北京、广西和山东等地域犬、水貂、狐狸、貉等动物中的CDV流行情况[24-27]。河南、河北是我国毛皮动物养殖大省,本研究对两省部分地区2019—2020年的CD流行情况进行调查,随机采集459份源自犬、水貂、貉和狐狸的样品,以分析CD的发病特点和流行规律。结果表明,CD在几种不同年龄的动物中一年四季均有发病。其中犬在秋季(9—11月)发病率最高,更多集中在1周岁以下,阳性率为75.56%。而水貂、貉和狐狸更多在7、8月发病,更集中于2周岁以下,阳性率均大于70%,而且CD发病率随着年龄增加出现先上升后降低的趋势。黄罄等[25]研究发现,广西地区的CD发病率为19.96%,冬季时发病率较高,2~12月龄的幼犬发病率最高且不同年龄、性别、品种和体型的犬均可发病。而李超等[26]从山东省毛皮动物养殖场死亡的16只毛皮动物中检测到11只呈CDV阳性,检出率为68.8%。不同地区流调显示CDV阳性率的差异可能与物种的圈养特性及采样时间和样品选择有关。
通过对病毒的某个高变异基因进行遗传进化分析可以对病毒进行基因分型,并在此基础上监测病毒的遗传进化轨迹[28]。因此,对CDV H基因变异情况进行监测,有助于研究CDV各分离株的相关性,并深入解析流行病学调查的结果[29-30]。本研究针对分离株HB19-1的H基因序列构建系统进化树并进行同源性分析,结果发现,分离株HB19-1属于亚洲1型,与14年前从山东一只貉分离的CD毒株同源性最高,亲缘关系最近。推测可能随着城乡活动日益频繁以及人口长途迁徙,这些变异株在不同地区的动物之间流行,同时由于河北和山东都是毛皮动物养殖大省,毛皮动物引种或者交易也会导致犬瘟热的扩散,因此应进一步加强监测。
由于没有CDV的特效药,接种疫苗成为预防CD的唯一有效途径。本研究分离得到的犬源HB19-1毒株与疫苗株Onderstepoort(Genbank登录号:AF378705)同源性较远,H基因核苷酸、氨基酸同源性分别为91.3%、90.2%。王召阳等[31]从CDV阳性犬中分离出7个野毒株,对H基因的遗传进化分析结果表明,毒株均为亚洲1型,且与疫苗株差异较大,核苷酸、氨基酸同源性分别为90.0%~90.9% 和88.8%~91.4%。李超等[26]基于H基因遗传进化分析发现,从水貂、狐狸、貉中分离的11株毒株中有9株属于亚洲1型、2株属于America-1疫苗型,核苷酸同源性为90.1%~91.1%。这些研究结果均提示,应有针对性地研制适合当前流行毒株的CDV疫苗。
4 结论本研究随机采集河南与河北两省部分地区犬、水貂、貉和狐狸样品459份,经RT-PCR检测发现CDV阳性样品87份,阳性率为18.96%。犬在秋季发病率较高,而水貂、貉和狐狸则多于夏季7月患病;不同年龄的动物均可发病,幼龄动物更为易感。从病犬样本中成功分离到1株CDV,经鉴定后命名为HB19-1株;基于H基因进行测序和遗传进化分析发现,该毒株属于亚洲1型且与疫苗株同源性较低。研究结果可为河南与河北两省的CD预防、疫苗选择与使用提供参考。
| [1] |
UHL E W, KELDERHOUSE C, BUIKSTRA J, BLICK J P, BOLON B, HOGAN R J. New world origin of canine distemper: Interdisciplinary insights[J]. International Journal of Paleopathology, 2019, 24: 266-278. DOI:10.1016/j.ijpp.2018.12.007 |
| [2] |
DONG B, ZHANG X, WANG J, ZHANG G, LI C, WEI L, LIN W. A meta-analysis of cross-sectional studies on the frequency and risk factors associated with canine morbillivirus infection in China[J]. Microbial Pathogenesis, 2021, 161(Pt A): 105258. DOI:10.1016/j.micpath.2021.105258 |
| [3] |
DUQUE-VALENCIA J, SARUTE N, OLARTE-CASTILLO X A, RUIZ-SAENZ J. Evolution and interspecies transmission of canine distemper virus-an outlook of the diverse evolutionary landscapes of a multi-host virus[J]. Viruses, 2019, 11(7): 582. DOI:10.3390/v11070582 |
| [4] |
RENDON-MARIN S, DA F B R, CANAL C W, RUIZ-SAENZ J. Tropism and molecular pathogenesis of canine distemper virus[J]. Virology Journal, 2019, 16(1): 30. DOI:10.1186/s12985-019-1136-6 |
| [5] |
LOOTS A K, MOKGOKONG P S, MITCHELL E, VENTER E H, KOTZE A, DALTON D L. Phylogenetic analysis of canine distemper virus in South African wildlife[J]. PLoS One, 2018, 13(7): e199993. DOI:10.1371/journal.pone.0199993 |
| [6] |
陈卫红, 陈永忠. 犬细小病毒病的综合治疗[J]. 广东农业科学, 2009(8): 185-187. DOI:10.16768/j.issn.1004-874X.2009.08.071 CHEN W D, CHEN Y Z. Comprehensive treatment of canine parvovirus disease[J]. Guangdong Agricultural Sciences, 2009(8): 185-187. DOI:10.16768/j.issn.1004-874X.2009.08.071 |
| [7] |
PATEL J R, HELDENS J G, BAKONYI T, RUSVAI M. Important mammalian veterinary viral immunodiseases and their control[J]. Vaccine, 2012, 30(10): 1767-1781. DOI:10.1016/j.vaccine.2012.01.014 |
| [8] |
CAI C, WANG X, ZHAO Y, YI C, JIN Z, ZHANG A, HAN L. Construction of a mavs-inactivated MDCK cell line for facilitating the propagation of canine distemper virus (CDV)[J]. Molecular Immunology, 2019, 114: 133-138. DOI:10.1016/j.molimm.2019.06.013 |
| [9] |
MUNOZ-ALIA M A, RUSSELL S J. Probing morbillivirus antisera neutralization using functional chimerism between measles virus and canine distemper virus envelope glycoproteins[J]. Viruses, 2019, 11(8): 688. DOI:10.3390/v11080688 |
| [10] |
林希, 刘若寒, 郝香琪, 郑清栩, 陶攀, 周沛, 李守军. 广东地区犬瘟热病毒血凝素基因的克隆与序列分析[J]. 华南农业大学学报, 2019, 40(6): 22-28. DOI:10.7671/j.issn.1001-411X.201812044 LIN X, LIU R H, HAO X Q, ZHEN Q Y, TAO P, ZHOU P, LI S J. Cloning and sequence analysis of haemagglutinin gene of canine distemper virus inGuangdong area[J]. Journal of South China Agricultural University, 2019, 40(6): 22-28. DOI:10.7671/j.issn.1001-411X.201812044 |
| [11] |
MOLENAAR R J, BUTER R. Outbreaks of canine distemper in Dutch and Belgian mink farms[J]. Veterinary Ophthalmol, 2018, 38(1): 112-117. DOI:10.1080/01652176.2018.1544427 |
| [12] |
LIU Y, HAO L, LI X, WANG L, ZHANG J, DENG J, TIAN K. Development and characterization of canine distemper virus monoclonal antibodies[J]. Monoclon Antib Immunodiagn Immunother, 2017, 36(3): 119-123. DOI:10.1089/mab.2017.0012 |
| [13] |
SHI N, ZHANG L, YU X, ZHU X, ZHANG S, ZHANG D, DUAN M. Insight into an outbreak of canine distemper virus infection in masked palm civets in China[J]. Frontiers in Veterinary Science, 2021, 8: 728238. DOI:10.3389/fvets.2021.728238 |
| [14] |
CHEN M, XIN T, HOU S, LIN W, SONG W, ZHU H, HUANG K, JIA H. Genotyping and pathogenic characterization of canine distemper virus based on mutations in the hemagglutinin gene in Chinese domestic dogs[J]. Polish Journal of Veterinary Sciences, 2018, 21(3): 623-629. DOI:10.24425/124301 |
| [15] |
NOYCE R S, DELPEUT S, RICHARDSON C D. Dog nectin-4 is an epithelial cell receptor for canine distemper virus that facilitates virus entry and syncytia formation[J]. Virology, 2013, 436(1): 210-220. DOI:10.1016/j.virol.2012.11.011 |
| [16] |
TATSUO H, ONO N, YANAGI Y. Morbilliviruses use signaling lymphocyte activation molecules (CD150) as cellular receptors[J]. Journal of Virology, 2001, 75(13): 5842-5850. DOI:10.1128/JVI.75.13.5842-5850.2001 |
| [17] |
BIERINGER M, HAN J W, KENDL S, KHOSRAVI M, PLATTET P, SCHNEIDER-SCHAULIES J. Experimental adaptation of wild-type canine distemper virus (CDV) to the human entry receptor CD150[J]. PLoS One, 2013, 8(3): e57488. DOI:10.1371/journal.pone.0057488 |
| [18] |
FENG N, YU Y, WANG T, WILKER P, WANG J, LI Y, SUN Z, GAO Y, XIA X. Fatal canine distemper virus infection of giant pandas in China[J]. Scientific Reports, 2016, 6: 27518. DOI:10.1038/srep27518 |
| [19] |
KENNEDY J M, EARLE J, OMAR S, ABDULLAH H, NIELSEN O, ROELKE-PARKER M E, COSBY S L. Canine and phocine distemper viruses: Global spread and genetic basis of jumping species barriers[J]. Viruses, 2019, 11(10): 944. DOI:10.3390/v11100944 |
| [20] |
宋若楠, 刘春草, 王真真, 贾楠楠, 朱杰, 李传峰, 刘光清, 孟春春. 犬瘟热病毒NT株分离鉴定、全基因测序与分析[J/OL]. 中国动物传染病学报[2022-01-07]. https://doi.org/10.19958/j.cnki.cn31-2031/s.20220106.001. SONG R N, LIU C C, WANG Z Z, JIA N N, ZHU J, LI C F, LIU G Q, MENG C C. Isolation, identification, whole gene sequencing and analysis of canine distemper virus NT strain[J/OL]. Chinese Journal of Animal Infectious Diseases[2022-01-07]. https://doi.org/10.19958/j.cnki.cn31-2031/s.20220106.001. |
| [21] |
KARKI M, RAJAK K K, SINGH R P. Canine morbillivirus (CDV): A review on current status, emergence and the diagnostics[J]. Virusdisease, 2022, 33(3): 309-321. DOI:10.1007/s13337-022-00779-7 |
| [22] |
赵维荣, 赵铭昕, 徐婧, 张丹玮, 郭艺迪, 关振宏, 段铭, 张茂林. 狂犬病病毒M蛋白胞内合成和分布初步研究[J]. 广东农业科学, 2021, 48(4): 111-118. DOI:10.16768/j.issn.1004-874X.2021.04.016 ZHAO W R, ZHAO M X, XU J, ZHANG D W, GUO Y D, GUAN Z H, DUAN M, ZHANG M L. Preliminary study on intracellular synthesis and translocation of rabies virus M protein[J]. Guangdong Agricultural Sciences, 2021, 48(4): 111-118. DOI:10.16768/j.issn.1004-874X.2021.04.016 |
| [23] |
AMUDE A M, ALFIERI A A, ALFIERI A F. Antemortem diagnosis of CDV infection by RT-PCR in distemper dogs with neurological deficits without the typical clinical presentation[J]. Veterinary Research Communications, 2006, 30(6): 679-687. DOI:10.1007/s11259-006-3308-2 |
| [24] |
ENKIRCH T, VON MESSLING V. Ferret models of viral pathogenesis[J]. Virology, 2015, 79/480: 259--270. DOI:10.1016/j.virol.2015.03.017 |
| [25] |
黄馨, 唐盈, 戚永乐, 周华波, 龙剑明, 劳月琪, 魏知非, 石瀚瑜, 韦祖樟, 欧阳康, 黄伟坚, 陈樱. 2016—2019年间广西部分地区犬瘟热流行病学调查及遗传演化分析[J/OL]. 中国动物传染病学报[2021-08-27]. https://doi.org/10.19958/j.cnki.cn31-2031/s.20210826.001. HUANG X, TANG Y, QI Y L, ZHOU H B, LONG J M, LAO Y Q, WEI Z F, SHI H Y, WEI Z Z, OU Y K, HUANG W J, CHEN Y. Epidemiological investigation and phylogenetic analysis of canine distemper virus in partial regions of Guangxi from 2016 to 2019[J/OL]. Chinese Journal of Animal Infectious Diseases[2021-08-27]. https://doi.org/10.19958/j.cnki.cn31-2031/s.20210826.001. |
| [26] |
李超, 陈金凤, 宋彩玲, 庞巍建, 张博文, 刘刚. 山东省部分地区毛皮动物犬瘟热病毒与细菌混合感染的检测[J]. 中国动物检疫, 2018, 35(12): 91-96. DOI:10.3969/j.issn.1005-944X.2018.12.022 LI C, CHEN J F, SONG C L, PANG W J, ZHANG B W, LIU G. Detection on mixed infection of canine distemper virus and other bacteria in fur-bearing animals in part of Shandong province[J]. China Animal Health Inspection, 2018, 35(12): 91-96. DOI:10.3969/j.issn.1005-944X.2018.12.022 |
| [27] |
肖园, 吕艳丽, 孙艳争. 北京地区犬呼吸道冠状病毒感染状况的监测与分析[J]. 畜牧兽医学报, 2022, 53(10): 3522-3529. DOI:10.11843/j.issn.0366-6964.2022.10.024 XIAO Y, LYU Y L, SUN Y Z. Surveillance and analysis of canine respiratory coronavirus infection in Beijing[J]. Chinese Journal of Animal and Veterinary Sciences, 2022, 53(10): 3522-3529. DOI:10.11843/j.issn.0366-6964.2022.10.024 |
| [28] |
蒋智勇, 楚品品, 陈天宝, 李春玲, 蔡汝健. 广东省猪繁殖与呼吸综合征病毒ORF5基因遗传变异分析[J]. 广东农业科学, 2022, 49(4): 97-105. DOI:10.16768/j.issn.1004-874X.2022.04.012 JIANG Z Y, CHU P P, CHEN T B, LI C L, CAI R J. Genetic variation analysis of ORF5 genes of porcine reproductive and respiratory syndrome virus in Guangdong province[J]. Guangdong Agricultural Sciences, 2022, 49(4): 97-105. DOI:10.16768/j.issn.1004-874X.2022.04.012 |
| [29] |
SAWATSKY B, CATTANEO R, VON MESSLING V. Canine distemper virus spread and transmission to naive ferrets: selective pressure on signaling lymphocyte activation molecule-dependent entry[J]. Journal of Virology, 2018, 92(15). DOI:10.1128/JVI.00669-18 |
| [30] |
LOOTS A K, MITCHELL E, DALTON D L, KOTZE A, VENTER E H. Advances in canine distemper virus pathogenesis research: A wildlife perspective[J]. Journal of General Virology, 2017, 98(3): 311-321. DOI:10.1099/jgv.0.000666 |
| [31] |
王召阳, 蒋亚君, 刘雪婷, 侯绍华, 郭晓宇, 鑫婷, 朱鸿飞, 贾红. 济南市犬瘟热病毒H基因遗传进化分析[J]. 动物医学进展, 2021, 42(1): 6-12. DOI:10.16437/j.cnki.1007-5038.2021.01.002 WANG Z Y, JIANG Y J, LIU X T, HOU S H, GUO X Y, XIN T, ZHU H F, JIA H. Genetic evolution of canine distemper virus H gene in Jinan[J]. Progress in Veterinary Medicine, 2021, 42(1): 6-12. DOI:10.16437/j.cnki.1007-5038.2021.01.002 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50




