文章信息
基金项目
- 广东省自然科学基金(2020A1515011112);广东省科技应急防控专题项目(20190211)
作者简介
- 康溥(1994—),男,在读硕士生,研究方向为蓝耳病检测诊断,E-mail:1056787389@qq.com.
通讯作者
- 王晓虎(1979—),男,博士,研究员,研究方向为人兽共患病,E-mail:13662380490@163.com.
文章历史
- 收稿日期:2022-11-15
2. 广东省农业科学院动物卫生研究所,广东 广州 510640;
3. 东莞市动物疫病预防控制中心,广东 东莞 523128
2. Institute of Animal Health, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China;
3. Dongguan Animal Disease Prevention and Control Center, Dongguan 523128, China
猪繁殖与呼吸综合征(Porcine Reproductive and Respiratory Syndrome,PRRS)是由PRRSV引起的一种高度接触性传染病,主要表现为妊娠母猪流产以及各年龄猪只患呼吸道疾病。PRRS于1987年首次在美国北卡罗莱纳州发现,1992年成功分离出欧洲型毒株LV和美洲型毒株VR-2332,这两种毒株核苷酸同源性约60%,抗原性差异大,免疫学上无交叉保护[1]。PRRS一直广泛流行于欧洲、亚洲、北美等地的养猪国家,给全球养猪业造成了巨大的经济损失。目前,我国流行的美洲型毒株可分为4个谱系[2],分别为谱系1(NADC30、JL580等中等毒力毒株)、谱系3(QYYZ、GM2等低致病毒株)、谱系5(VR2332-like毒株)、谱系8(JXA1、TJ、TA-12等高致病毒株以及CH-1a为代表的经典毒株)。其中处于谱系8.7的HP-PRRSV和谱系1的NADC30-like毒株是我国流行的优势毒株[3]。欧洲型毒株在我国较为少见。ORF5基因编码GP5蛋白。Stadejek等[4]使用邻接法构建ORF5系统发育树,将欧洲型PRRSV分为4个亚型。近年来,在黑龙江、辽宁、河北、山东等地部分猪场已检测出欧洲型PRRS[5]。
不同PRRSV毒株的全基因组存在遗传变异,以NSP2和ORFS为主[6]。因此,GP5经常作为分子流行病学的研究对象。作为PRRSV一种重要的囊膜蛋白,GP5被证明与病毒感染、毒力、中和相关。近年来一些生物信息学分析也聚焦于GP5。通过对GP5的结构预测发现,GP5包含1个N端信号肽、2个高变区、3个跨膜区和11个表位[7]。其中表位包括诱饵表位、初级中和表位(Primary Neutralizing Epitopes,PNE)、T细胞表位和B细胞表位。这些表位由特定的氨基酸序列决定,一些氨基酸的突变和替换会导致不同亚系或者同一亚系的不同个体之间产生抗原差异。由于GP5含有多个中和表位,因此基于GP5的基因工程疫苗一直以来是PRRSV疫苗研究的热点。与传统的灭活苗或者减毒活疫苗相比,基因工程疫苗在免疫效果与安全性等方面具有一定优势。近年来,研究者构建了DNA疫苗、亚单位疫苗、活载体疫苗等新型疫苗。但这些疫苗距离商品化应用还有一段距离。
1 GP5生物信息学分析 1.1 GP5外域结构预测由于缺乏PRRSV包膜蛋白的晶体结构信息,使得这些蛋白对病毒感染、复制、中和的影响机制尚不明确。对于GP5和M蛋白,一般认为GP5/M二聚体在PRRSV复制和逃逸免疫中起重要作用,但目前并没有GP5/M二聚体三维结构的准确预测。原因是PRRSV病毒颗粒的多形性,导致目前无法使用高分辨率冷冻电镜重建其结构;此外,GP5和M蛋白的疏水特性,导致其难以纯化和结晶,因此目前成熟的X射线晶体学方法也不适用。这使得生物信息学预测GP5/M结构成为当前的主要手段。Veit等[8]使用alphafold2(基于人工智能的系统)预测GP5/M的可靠结构,描述了二聚体的各个结构域,并将氨基酸残基的变化与结构特征的改变联系起来。
对于单体M蛋白的模型,其一级结构已有相对准确的预测[9]。M蛋白由1个短的外域、3个假定的跨膜区域和1个长的亲水性细胞质尾(Long hydrophilic cytoplasmic tail)组成。M蛋白没有信号肽,少数PRRSV毒株的M蛋白含有N-连接聚糖(N-linked glycans)的共识序列,但并未起作用。对于单体GP5蛋白的模型,Veit等[8]将其划分为外域结构、内域结构和跨膜区域结构3部分。由于中和表位在GP5/M蛋白的外域结构中,因此本文主要介绍该部分。
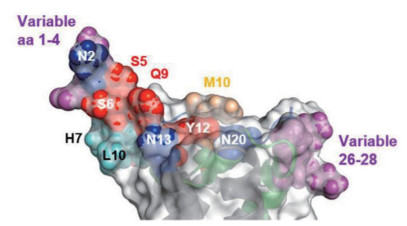
在GP5/M的外域结构中,GP5的中和表位包括残基5~12(图 1),它们位于N端螺旋的C端部分(残基编号从成熟蛋白的第1个氨基酸算起)。预测结果表明,GP5只有3个残基(7、8、10)在毒株之间可变,其他残基(5、6、9、11、12)几乎完全保守。许多保守的表位残基(红色球体)暴露在螺旋的上侧,而可变残基(青色球体)位于其下侧。GP5外域序列的中心部位完全保守,包括两个N-糖基化位点。GP5外域有两个高变区,一个由残基26~28构成(目前尚未有该区域功能的报道),另一个由残基1~4构成。病毒在进化过程中,残基1~4的突变可以减少或增加额外的碳水化合物附着到GP5上。在α螺旋开端,碳水化合物的附着可能会阻止抗体进入中和表位(残基5-12)[8]。
在GP5/M的较长外域结构中,只有当信号肽切割发生在残基31、32之间时,VR-2332的成熟GP5中才存在非中和诱饵表位。诱饵表位包括Val、Leu、Ala、Asn,并且表面暴露。其序列在美洲型PRRSV菌株之间变化很大,且主要疏水氨基酸存在于这些位置。
Veit等[8]预测了4个美洲型PRRSV谱系毒株的GP5/M二聚体结构。GP5和M的外域均为螺旋形,但螺旋的方向相对于跨膜区域不同。可见,alphafold2可正确预测外域的二级结构,但3级结构的空间排列不一定准确。外域的方向由GP5的跨膜螺旋1和α螺旋之间的角度决定。由于该预测的不确定性,因此无法从这些模型中推断病毒进化过程中发生的GP5抗原漂移是否会导致外域的构象变化。
1.2 基于ORF5的分型PRRSV目前主要的分型方法仍然基于高度可变的ORF5[10]。对于美洲型PRRSV,分型多参照Shi等[2]的分类系统。丢弃10% 老化(burnin)样本后按以下程序进行分类:第一,手动确定拓扑上不同的单系簇(后验概率>90% 为标准)作为初始分类;第二,将整个数据集按照初始分类划分为子数据集;第三,计算每个子数据集的集内多样性(即平均成对遗传距离),对多样性水平>11% 的子数据集进一步分为较小的单系簇;最后,将9个单系谱系(通常谱系内多样性 < 11%)建立为最终分类。使用相同的程序鉴定谱系中的亚谱系,临界值为7%。通过这种方式,整个数据集被划分为9个谱系和37个亚谱系。
近年来,Lambert等[11]构建了一种基于最大似然树与最大成对遗传距离的自动分类系统。该方法被证明可用于大型ORF5数据集。在研究中,3 661个序列被分为29(第1次运算)和33(第2次运算)个集群。但该系统旨在对大型数据集内的遗传多样性进行初步评估,应被视为系统发育分析的第一步。事实上,应该进行进一步的贝叶斯分析,以更好地确定特定集群随时间推移的进化速率。
尽管ORF5是PRRSV分型和系统发育分析最常见的靶标,但ORF5序列仅占整个PRRSV基因组的5%。因此,基于完整基因组或多个蛋白质编码区域的分型可以更全面地了解PRRSV毒株的遗传相关性。Stadejek等[4]认为ORF7可作为欧洲型PRRSV分型的替代标记,但并无确切的分型方法。
1.3 GP5遗传变异分析GP5是变异最大的结构蛋白之一,在同一基因型中具有最高的遗传多样性。一些GP5中已知的功能域,如中和表位和诱饵表位,一直以来是GP5遗传变异分析的重点。近年来,研究者更倾向于揭示特定地区流行毒株的特征性氨基酸突变[12-15]。
Xie等[16]调查了我国2017—2018年流行的PRRSV美洲株的遗传特征。结果表明,PRRSV毒株之间的核苷酸序列同源性范围为61.6%~100%,氨基酸序列同源性范围为51.8%~100%。与经典PRRSV毒株、NADC30-like毒株和GM2-like毒株相比,HP-PRRSV毒株的GP5蛋白在氨基酸位点9(G → C)、24(C → Y)、47(L → I)和161(L → V)处有突变;与HPPRRSV毒株、NADC30-like毒株和GM2-like毒株相比,经典PRRSV毒株的GP5蛋白在氨基酸位点11(V → A)和185(A → V)处有突变;与经典PRRSV毒株、HP-PRRSV毒株和GM2-like毒株相比,NADC30-like毒株的GP5蛋白在氨基酸位点10(C → Y)和168(E → D)处有突变;与GM2毒株的GP5蛋白相比,经典PRRSV株、HP-PRRSV毒株和NADC30-like株的GP5蛋白在氨基酸位点6(L → S)处有突变。Guo等[17]调查了我国流行的PRRSV欧洲株的遗传特征,结果表明,检测到的PRRSV毒株与Lelystad毒株的全基因组核苷酸同源性范围为85.9%~92.7%,GP5核苷酸同源性范围为83.5%~94.6%;氨基酸比对发现,氨基酸位点8、60、63、106高度可变,且具有3~7种不同的氨基酸突变。与Lelystad毒株相比,中国毒株在氨基酸氨基酸位点37(D → N)、100(T → V)、101(A → T)、112(C → S)、123(F → L)、155(V → I)、173(D → G)、175(N → D) 处有非常保守的突变。综合来说,GP5蛋白的氨基酸极少见删除和添加,但经常发生替换[12]。替换位点常见于GP5蛋白的信号肽编码区(氨基酸位点1~26)、非中和表位(氨基酸位点27~30)、中和表位(氨基酸位点37~45)和跨膜区(氨基酸位点66~83,氨基酸位点95~104,氨基酸位点112~128),这些变化可能是导致病毒加速进化的原因[18]。
2 GP5对PRRSV感染复制的影响 2.1 GP5与细胞嗜性的关系PRRSV具有严格的细胞嗜性,仅在PAM、MA-104和MARC-145细胞中增殖。一般认为,PRRSV对PAM细胞的嗜性是病毒感染的先决条件。一些包膜蛋白上的氨基酸突变可能会对PRRSV的细胞嗜性产生一定影响。Xie等[19]发现欧洲型PRRSV减毒株与传代毒株在GP2a的3个氨基酸位点具有相同的氨基酸突变,分别为88(V → F)、94(M → I)、95(F → L)。在随后的研究中,研究者构建了具有上述氨基酸替换的突变体,并对PAM和MARC-145细胞进行感染。结果表明,该突变促进了欧洲型PRRSV适应MARC-145细胞系,但对适应PAM细胞系没有明显影响。Zhang等[20]佐证了该观点,即PRRSV对MARC-145的适应由次要包膜蛋白GP2a和GP3决定。
近年来,有研究认为包膜蛋白GP5的氨基酸位点78(异亮氨酸)可能影响PRRSV对PAM细胞系的适应,而且GP5/M二聚体通过与唾液酸粘附素相互作用参与了PRRSV进入PAM细胞的过程[21]。虽然有证据表明GP5与细胞嗜性有一定联系,但有研究用GP5和M蛋白的外域替换EAV的相应区域,得到的嵌合EAV并未改变其细胞嗜性。因此,GP5和M蛋白并非PRRSV细胞嗜性的决定因素。
2.2 GP5与病毒感染复制的关系病毒受体位于宿主细胞表面,多为蛋白质(也有糖类和脂类),在细胞信息传递中发挥重要作用。研究表明,GP5通过与受体的结合参与PRRSV感染细胞的过程[22]。
硫酸乙酰肝素(HepS)是一种蛋白聚糖,PAM细胞表面存在的HepS可作为PRRSV受体。研究表明,将HepS类似物与PRRSV混合后,美洲型PRRSV的PAM感染率降低到92%,欧洲型PRRSV的PAM感染率则降低到88%[23]。这表明HepS可能参与PRRSV感染的过程。感染动力学分析表明,PRRSV附着于HepS在感染早期发生。非还原性SDS-PAGE显示,GP5/M二聚体可与PAM上的HepS结合。随后在一些受体的参与下,病毒粒子内化形成胞内体,最后释放病毒RNA到细胞质。
唾液酸黏附素(Sn) 也被称为CD169, 主要参与细胞间或细胞与病毒间的相互作用。CD169表达于PAM细胞表面,在其他的PRRSV易感细胞系(MA104和MARC-145)和非易感细胞系中都没有发现。Xia等[24]发现GP5/M二聚体与CD169以唾液酸依赖性方式结合,随后通过吸附与内吞作用参与病毒感染宿主细胞的过程。但一般认为CD169对病毒的吸附作用较弱,主要介导的是病毒的内吞过程,且CD169并不能单独导致PRRSV的感染。
波形蛋白(Vimentin)是一种具有中心α螺旋结构域的环状二聚体单体分子,主要存在于非洲绿猴肾细胞内(MA104及其衍生细胞系)。Kim等[25]发现波形蛋白是PRRSV受体复合物的组分,在介导PRRSV的细胞内转运中发挥重要作用,且波形蛋白的单克隆抗体能够阻断PRRSV感染。有研究表明[26],波形蛋白与GP5结合从而完成识别过程,但王伟伟等[27]用ELISA方法证明波形蛋白与N蛋白结合而非GP5。
非肌球蛋白重链9(Non-muscle myosin heavy chain 9,MYH9)是大肌球蛋白超家族成员之一。Xue等[28]证实了PRRSV进入细胞的过程受到GP5和MYH9的共同调节。GP5的第一个胞外域(GP5-ecto-1)与MYH9的C端结构域(PRA)相互作用,可诱导MYH9的聚集,这是肌球蛋白组装的必要步骤,有助于PRRSV病毒粒子进入细胞。这与Guo等[29]的研究结果一致。这些研究表明GP5与MYH9相互作用,参与PRRSV向邻近细胞传播(通过纳米管)。还有研究表明,通过重组表达的PRA会中断PRA与MYH9的相互作用,从而在体外阻断PRRSV的感染[30]。
3-磷酸甘油醛脱氢酶(GAPDH)是一种含有335个氨基酸的细胞质蛋白,在物种间高度保守,可与多种蛋白相互作用,进而执行多种生物学功能。Liu等[31]研究表明,GAPDH是GP5蛋白的靶标,具有糖酵解活性,且只有细胞质中的GAPDH可以促进PRRSV的复制。进一步研究证实,GP5的氨基酸位点93~105与GAPDH的Lys227结合,可竞争性破坏GAPDH与Siah1(E3泛素连接酶)的相互作用,阻碍GAPDH进入细胞核,而留在细胞质中的GAPDH通过其糖酵解活性促进PRRSV的复制。
细胞蛋白Snapin参与SNARE(soluble N-ethylmaleimide-sensitive fusion protein attachment protein receptor)所介导的膜融合过程,也是溶酶体相关细胞器复合物1(BLOC-1)的成员。Hicks等[32]设计了酵母双杂交试验证实,GP5的氨基酸位点31~60和M蛋白的氨基酸位点1~22与Snapin相互作用,降低了Snapin水平,从而导致病毒复制减少。
CD151与CD163、CD209也是近年研究比较多的细胞受体,它们均在PRRSV的感染中起作用[33],但并未有证据显示其与GP5相互作用。研究认为,在病毒进入宿主细胞的过程中,即PRRSV感染PAM细胞初期,HepS首先与GP5/M异二聚体结合,黏附PRRSV;随后CD169参与病毒内化;接着在CD163的作用下,HepS与PRRSV的GP2a/GP3/GP4异三聚体结合,PRRSV脱衣壳并释放基因组RNA到细胞中。在这个过程中还有其他受体参与[22]。
目前GP5的大多数结构数据仍然依赖于生物信息学分析,或者参照EAV等相关病毒来预测。因此,GP5与受体作用的结构基础一直不够明确[34]。此外,大多数研究使用合成肽或者细菌表达的蛋白质来替代PRRSV的包膜蛋白(如GP5),但模拟的蛋白在膜关联或肽链折叠方面的真实性有待商榷。例如一些构象表位或翻译后需要修饰的表位(如糖基化),可能存在于异质分离株中,并不能靠常规方法来可靠重建。因此,必须开发可信度更高的生物信息学预测手段才能推动相关的基础研究。
3 GP5对病毒中和与毒力的影响 3.1 GP5对PRRSV病毒中和的影响研究发现,基于ORF3~ORF6的重组蛋白以及质粒DNA具有诱导中和抗体产生的能力[35]。在PRRSV的所有糖基化蛋白中,GP5的免疫原性最强,含有很多中和表位。因此,GP5在PRRSV不同毒株之间的交叉保护方面起关键作用。有研究将GP5蛋白中的一些氨基酸突变与病毒的中和性能进行关联分析,这使得大量分子流行病学调查的数据具有更重要的意义。
GP5有至少3个B细胞表位(氨基酸位点27~30、37~45、187~200),至少2个T细胞表位(氨基酸位点117~131、149~163)[36]。Kim等[35]证实GP5的5个候选位点与病毒中和密切相关,氨基酸位点分别为32~34、38~39、57~59、137和151。其中用N取代34位残基会导致在该区域添加1个新的N-糖基化位点,这可能掩盖中和抗体对保守线性中和表位的识别。Rowland等[37]推测第34位氨基酸变化可能是病毒逃逸中和抗体的标志物,目前这种假设尚未被证实。氨基酸位点38~39位于GP5的N末端外区,并且在PRRSV的保守线性中和表位区域内[38]。许多对VR2332中和抗体具有抗性的分离株发生了氨基酸位点38(H → K或N)和39(L → F或I)的替换。氨基酸位点57~59位于GP5高变区(氨基酸位点57~61位)中,根据计算机辅助预测,该序列的替换可能导致抗原表位发生构象改变,从而降低中和抗体对分离株的识别[39]。氨基酸位点137、151位最初是用于RFLP分析以区分疫苗毒株与野毒株[40],两位点处在2个跨膜区域(氨基酸位点65~130、170~190)之间,可能属于GP5的额外胞外域。因此,137、151氨基酸位点的替换可以显著改变GP5的抗原性[41],然而研究表明该替换对病毒中和并没有显著影响[40]。
GP5共有5个N-糖基化位点(N30、N32/33/34、N35、N44、N51)[42]。Wei等[43]证实,GP5的N34、N44、N51突变会提高病毒对抗体的敏感性,使机体产生更高水平的抗体,同时也会抑制PRRSV的增殖。GP5外域的高变区(氨基酸位点32~35)具有潜在的N-糖基化位点,且添加新的糖基化位点可能会掩盖中和抗体对保守线性中和表位的识别。这表明GP5胞外结构域糖基化的缺失会增强病毒的中和效果以及中和表位B的免疫原性。目前研究者还不清楚GP5或其他包膜蛋白(如GP2、GP3、GP4)中的糖基化位点具体如何影响抗体识别,而且尚无有关猪或小鼠的PRRSV抗体在病毒粒子包膜上识别肽聚糖的报道。大多数研究认为,GP5蛋白的糖基化位点在中和反应的阻断或病毒逃逸中起作用[44],而非直接作为潜在的中和抗体靶标[45]。
3.2 GP5对PRRSV毒力的影响PRRSV不同毒株在毒力、抗原和遗传特性方面都有不同,一些氨基酸位点的突变被认为与PRRSV的毒力相关。
Allende等[46]发现,PRRSV的9个氨基酸位点替换可能导致其毒力减弱,包含结构蛋白编码区的5个氨基酸位点与非结构蛋白编码区的4个氨基酸位点。GP5蛋白上有2个可替换位点,分别为氨基酸位点13(R → Q) 和151(R → G)。氨基酸位点13(R → Q) 是一个保守的突变,位于GP5的信号肽区域,翻译后被删除。这种突变会改变信号肽的净电荷,干扰GP5向内质网膜的转运。氨基酸位点151(R → G) 突变改变位于糖蛋白的亲水部分,可能导致PRRSV毒力减弱[46]。
Zhang等[47]研究发现,5种同时具有氨基酸位点13R和151R的分离株具有高毒性,可导致仔猪抑郁、厌食、体温过高、呼吸困难,并造成母猪流产;而具有13R或151R的3株分离株具有中等毒力,并导致中度临床体征(高热、厌食、呼吸道症状);其余分离株引起较轻的临床症状(体温升高伴食欲不振)。Ostrowski等[38]发现GP5的初级中和表位(氨基酸位点37~45)和诱导表位(氨基酸位点27~31)在抑制免疫反应中起重要作用。这些位置上一些关键氨基酸的取代可能导致病毒逃逸中和抗体的识别。
Wesley等[48]通过分析90多株PRRSV毒株,发现弱毒疫苗株GP5蛋白的第137个氨基酸一般为137A,野毒株一般为137S,但并未有报道称该位点影响PRRSV毒力。Khatun等[49]将PRRSV突变株和MLV毒株在猪体内以及细胞中传代致弱,根据不同代次病毒中稳定存在的减毒序列来推断导致毒力减弱的氨基酸突变,其中与GP5相关的氨基酸突变为151G,但ORF2(10F)以及ORF6(16E)才是导致病毒毒力减弱的主要序列。由于GP5可能参与PRRSV与细胞受体的结合过程,并包含诱导体液免疫和细胞免疫的主要表位。因此,这些氨基酸位点的变化可能会影响细胞的趋向性,从而影响毒力强弱。当前研究认为,GP5在确定PRRSV的毒力相关位点以及诱导免疫反应中起关键作用[45]。
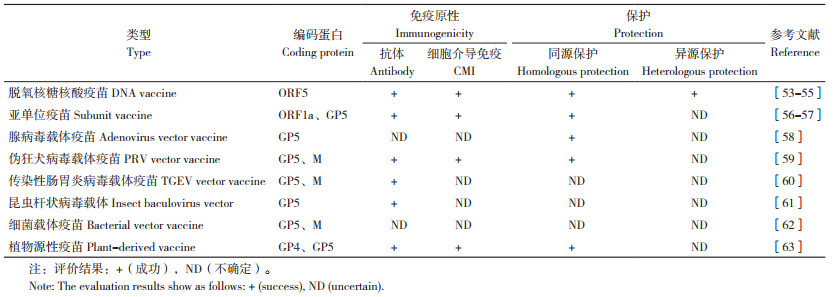
4 GP5在疫苗研究中的应用PRRSV弱毒疫苗对异源毒株只能提供部分保护作用[50],且有毒力返强的风险。而PRRSV灭活疫苗虽然具有更好的安全性,但2005年以来的灭活疫苗效果一直表现不佳,目前大多数国家已经停止使用[51]。而将PRRSV弱毒疫苗与灭活疫苗联用可产生更好的免疫效果[52],但免疫成本偏高,较难在临床中推广。基于以上问题,研究人员利用现代生物技术开展了基于ORF5/GP5的PRRS基因工程疫苗研究(表 1),以期为我国养猪业提供优质的候选PRRS疫苗。
当前研究认为,宿主针对PRRSV的免疫分为先天免疫与特异性免疫[53]。特异性免疫主要包括细胞介导免疫(CMI)与特异性体液免疫(中和反应等)。在CMI中,辅助T细胞(CD4+)和细胞毒性T细胞(CD8+)均能在PRRSV感染后8周内检测到。由于GP5以及其他的一些结构蛋白(GP4、M、N)是CMI的强诱导物,因此CD4+、CD8+ T细胞水平常用于评价基于GP5的基因工程疫苗效果。此外,GP5/M二聚体被认为是诱导PRRSV中和反应的关键,且中和抗体主要指向GP5,因此CD4+、CD8+以及中和抗体水平的升高都属于宿主针对GP5的免疫反应。
4.1 DNA疫苗DNA疫苗即通过基因工程技术,将编码抗原的外源基因注入动物体内,使其在动物体内表达,从而产生中和抗体,达到预防疾病的目的。近年来,通过DNA改组技术将不同的抗原基因进行体外重组,可以筛选出综合性能更加优秀的DNA疫苗。PRRSV GP5-Mosaic疫苗是近年来由Cui等[54]研发的一种DNA疫苗,该疫苗可以显著提升外周血单核细胞(PBMC)分泌的干扰素-γ(IFN-γ)mRNA表达,产生的特异性中和抗体水平高于对照,对不同毒株的交叉保护(主要指细胞反应)也得到了验证。魏春华等[55]利用DNA改组技术进行体外基因重组,去信号肽和非中和表位,筛选出2个重组突变体(ΔORF5-8和ΔORF5-46)。以此为基础进一步构建的重组DNA疫苗能刺激机体产生特异性的GP5蛋白抗体,与弱毒活疫苗组的免疫效果相近。血清中和试验证实,该重组DNA疫苗能产生针对3~4个不同谱系(尤其是谱系1和谱系3的代表毒株)的中和抗体。
可见,DNA疫苗目前最大的优势是能够对不同谱系的毒株产生交叉保护,但与弱毒活疫苗的缺点相似。DNA疫苗是否会与宿主基因整合,造成免疫耐受或其他不可控的影响还尚不可知。需要更多的动物实验来验证DNA疫苗的安全性。
4.2 亚单位疫苗亚单位疫苗一般选取病毒(杆状病毒、腺病毒等)或细菌(酵母菌等)表达体系,在体外正确表达抗原蛋白,注入动物体内从而诱导机体产生特异性免疫。近年来,关于PRRSV亚单位疫苗的研究增多。
GP5m-铁蛋白疫苗是近年来由Ma等[56]研发的一种亚单位疫苗。该疫苗用修饰的GP5和铁蛋白融合,并使用杆状病毒表达,可以产生较高的抗体滴度,并显著提升TH1介导的细胞免疫应答。在临床实验中可以引发猪的特异性保护反应,平均直肠温度、呼吸、病毒血症、宏观和微观肺部病变等各项评分均显著降低。Ad-NADC20-PP1和AD-NADC20-PP2是由Tian等[57]通过腺病毒载体表达多表位肽作为抗原构建的一种亚单位疫苗。一项对30头仔猪的免疫试验表明,与对照相比,疫苗组的肺部病变面积以及血清中病毒的RNA载量数值更低,但差异不显著,因此该疫苗的保护效果有待进一步验证。
亚单位疫苗副作用小、安全性高。由于亚单位疫苗不能在体内复制,因此面临免疫剂量大和费用昂贵等问题。目前已有的PRRSV亚单位疫苗尚未投入商品化应用。
4.3 病毒活载体疫苗与亚单位疫苗和DNA疫苗不同,使用病毒活载体疫苗免疫动物,效果与自然感染非常相似,能较长时间刺激机体产生特异性和非特异性免疫,而且病毒载体可插入多个外源基因从而预防多种疾病。rPRV-NC56是Zhao等[59]以CHSCDJY-2019为亲本构建的具有gE/gI/TK基因缺失且共表达PRRSV NADC30-like毒株GP5和M蛋白的伪狂犬病毒载体疫苗。该疫苗可诱导小鼠产生NADC30-like毒株特异性体液和细胞免疫,但在高致病PRRSV组中引发的中和抗体滴度显著降低,因此是一种用于控制NADC30-like毒株的候选疫苗。
Becares等[60]研制了一种用重组传染性胃肠炎病毒(rTGEV)作为载体共表达PRRSV GP5和M蛋白的疫苗,该疫苗对PRRSV的损伤有部分保护作用(减少临床体征和肺损伤),但目前最大的问题是rTGEV系统中GP5蛋白的不稳定性,在传代8~10次后会造成异源基因丢失。此外,rTGEV载体疫苗保护性不足可能与表达的蛋白存在诱导负调节T细胞(Treg)的表位有关。GP5蛋白或者M蛋白存在诱导Treg的负调节信号,因此可能会导致PRRSV免疫反应延迟[64]。华思红等[58]构建了表达GP5的重组腺病毒,根据动物实验,该疫苗能对PRRSV强毒产生一定保护作用;但ELISA试验结果显示,免疫后并不能检测到PRRSV特异性血清抗体。黄袁慧等[61]构建了表达重组GP5的昆虫杆状病毒载体,但未对其免疫原性作进一步研究。
病毒活载体疫苗安全性较高,特异性较好,可同时表达多种抗原,但多次传代后的稳定性还有待验证。此外,如果宿主本身存在载体病毒的中和抗体,则会降低免疫效果。但总的来看,病毒载体疫苗是目前相对成熟的一种疫苗。
4.4 细菌和植物载体疫苗细菌和植物载体疫苗近年来也备受研究者关注,这些疫苗可能对机体非特异性免疫(促炎细胞因子、干扰素等)具有更好的诱导效果。Wang等[62]将PRRSV的ORF5或ORF6基因整合到伊万诺维李斯特菌(Listeria Ivanovii,LI)的基因组中,对非分泌和分泌的细菌蛋白样品进行蛋白质免疫印迹分析,发现重组LI菌株中有GP5或M蛋白的表达和分泌。因此,这可能成为一种潜在的新型疫苗。An等[63]研发了一种转基因拟南芥植物,可以表达PRRSV重组糖蛋白GP4D和GP5D。猪采食表达GP4D和GP5D蛋白的转基因拟南芥叶,其肺部病变评分比对照显著降低,肺部病毒血症和病毒载量也降低;免疫猪的PRRSV特异性抗体滴度、促炎细胞因子(TNF-α和IL-12)、干扰素(IFN γ)的水平升高。因此,用植物来替代传统载体具有一定的应用前景。
以细菌为载体的活载体疫苗在免疫方式、菌株培养、递呈基因等方面有较多优势,但是减毒菌面临毒力返强的危险,而且细菌活载体疫苗免疫效率低,需要长期试验确定最佳免疫剂量和免疫周期[65]。此外,机体对细菌的耐受性也会影响疫苗效果。
5 展望PRRS给全球养猪业带来巨大的经济损失,对其防控至关重要。由于PRRSV变异极快,而且商业化弱毒活疫苗对不同谱系毒株的交叉保护较弱,因此,一直以来如何防控PRRSV是困扰世界养猪业的一大难题。多年来研究者从多方面多角度探究PRRSV的特性,生物信息学分析是重要内容之一。近年来的分子流行病学调查发现,在我国流行的PRRSV中,不同谱系GP5的氨基酸变异位点有一定的规律可循,且不同谱系ORF5具有其特征序列,可以用于分型。此外,人工智能的发展推动了生物信息学方法对GP5结构的可靠预测,但基于GP5新结构模型的机制研究尚未有报道。现有的研究认为,GP5对于细胞嗜性并不起决定作用,但其与多种病毒受体互作,形成的分子复合物可能对PRRSV的感染和复制产生影响。通过初级结构预测,GP5含有多个中和表位,因此部分研究围绕GP5如何影响病毒的中和与毒力展开。但由于之前对GP5结构的生物信息学预测并不统一,因此该部分的研究尚不完善。现有的证据表明,GP5具有良好的免疫原性,可用于基因工程疫苗的开发。近年GP5的相关DNA疫苗、亚单位疫苗、病毒细菌载体疫苗、植物载体疫苗相继问世。虽然一些疫苗的表现良好,经动物实验具有良好的免疫原性与交叉保护效果,但鉴于其稳定性、安全性和免疫效率等问题,这些疫苗尚未能商品化应用。2022年Veit等[8]使用alphafold2对GP5/M二聚体结构的可靠预测,将会促使GP5的相关机制研究成为PRRSV的研究热点,进而促进GP5相关疫苗研制。
| [1] |
唐紫燕, 高跃美, 张红云, 梁晶晶, 罗廷荣, 李晓宁. 广西三个猪繁殖与呼吸综合征病毒GP5及NSP2基因的克隆与分析[J]. 广西畜牧兽医, 2022, 38(5): 214-218. DOI:10.3969/j.jssn.1002-5235.2022.05.006 TANG Z Y, GAO Y M, ZHANG H Y, LIANG J J, LUO T R, LI X N. Cloning and analysis of GP5 and NSP2 genes of three porcine reproductive and respiratory syndrome viruses in Guangxi[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine, 2022, 38(5): 214-218. DOI:10.3969/j.jssn.1002-5235.2022.05.006 |
| [2] |
SHI M, LAM T T, HON C C, MURTAUGH M P, DAVIES P R, HUI R K, LI J, WONG L T, YIP C W, JIANG J W, LEUNG F C. Phylogeny-based evolutionary, demographical, and geographical dissection of North American type 2 porcine reproductive and respiratory syndrome viruses[J]. Journal of Virology, 2010, 84(17): 8700-8711. DOI:10.1128/JVI.02551-09 |
| [3] |
郭振华, 陈鑫鑫, 李睿, 乔松林, 郭军庆, 张改平. 中国猪繁殖与呼吸综合征病毒流行历史及现状[J]. 畜牧兽医学报, 2018, 49(1): 1-9. DOI:10.11843/j.issn.0366-6964.2018.01.001 GUO Z H, CHEN X X, LI R, QIAO S L, GUO J Q, ZHANG G P. The prevalent history and current status of porcine reproductive and respiratory syndrome in China[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(1): 1-9. DOI:10.11843/j.issn.0366-6964.2018.01.001 |
| [4] |
STADEJEK T, OLEKSIEWICZ M B, POTAPCHUK D, PODGORSKA K. porcine reproductive and respiratory syndrome virus strains of exceptional diversity in eastern Europe support the definition of new genetic subtypes[J]. Journal of General Virology, 2006, 87(7): 1835-1841. DOI:10.1099/vir.0.81782-0 |
| [5] |
许浒, 相丽润, 张文立, 汤艳东, 赵静, 李超, 龚邦俊, 李宛生, 付军, 彭金美, 王倩, 周国辉, 冷超粮, 安同庆, 蔡雪辉, 张洪亮, 田志军. 欧洲型PRRSV竞争ELISA抗体检测方法的建立及应用[J]. 中国预防兽医学报, 2022, 44(6): 617-623. DOI:10.3969/j.issn.1008-0589.202109037 XU H, XIANG L R, ZHANG W L, TANG Y D, ZHAO J, LI C, GONG B J, LI W S, FU J, PENG J M, WANG Q, ZHOU G H, LENG C L, AN T Q, CAI X H, ZHANG H L, TIAN Z J. Establishment and application of european PRRSV competitive ELISA antibody detection methods[J]. Chinese Journal of Preventive Veterinary Medicine, 2022, 44(6): 617-623. DOI:10.3969/j.issn.1008-0589.202109037 |
| [6] |
陈希文, 李莲, 尹苗, 赖守勋, 汪谦, 罗文涛, 叶兆美, 王雄清, 周杰珑. PRRSV SC-GY变异株Nsp2、ORF5、ORF3基因遗传变异分析[J]. 中国兽医学报, 2017, 37(8): 1433-1441. DOI:10.16303/j.cnki.1005-4545.2017.08.01 CHEN X W, LI L, YIN M, LAI S X, WANG Q, LUO W T, YE Z M, WANG X Q, ZHOU J L. Genetic variation analysis of PRRSV SC-GY variants Nsp2, ORF5 and ORF3 genes[J]. Chinese Journal of Veterinary Science, 2017, 37(8): 1433-1441. DOI:10.16303/j.cnki.1005-4545.2017.08.01 |
| [7] |
ZHOU L, KANG R, JI G, TIAN Y, GE M, XIE B, YANG X, WANG H. Molecular characterization and recombination analysis of porcine reproductive and respiratory syndrome virus emerged in southwestern China during 2012-2016[J]. Virus Genes, 2018, 54(1): 98-110. DOI:10.1007/s11262-017-1519-y |
| [8] |
VEIT M, GADALLA M R, ZHANG M. Using Alphafold2 to predict the structure of the Gp5/M dimer of porcine respiratory and reproductive syndrome virus[J]. International Journal of Molecular Sciences, 2022, 23(21): 13209. DOI:10.3390/ijms232113209 |
| [9] |
DE VRIES A A, CHIRNSIDE E D, HORZINEK M C, ROTTIER P J. Structural proteins of equine arteritis virus[J]. Journal of Virology, 1992, 66(11): 6294-6303. DOI:10.1128/jvi.66.11.6294-6303.1992 |
| [10] |
VANDENBUSSCHE F, MATHIJS E, TIGNON M, VANDERSMISSEN T, CAY A B. WGS-versus ORF5-based typing of PRRSV: A belgian case study[J]. Viruses, 2021, 13(12): 2419. DOI:10.3390/v13122419 |
| [11] |
LAMBERT M E, ARSENAULT J, AUDET P, DELISLE B, D'ALLAIRE S. Evaluating an automated clustering approach in a perspective of ongoing surveillance of porcine reproductive and respiratory syndrome virus(PRRSV) field strains[J]. Infection, Genetics and Evolution, 2019, 73: 295-305. DOI:10.1016/j.meegid.2019.04.014 |
| [12] |
ZHOU L, YANG Y, XIA Q, GUAN Z, ZHANG J, LI B, QIU Y, LIU K, SHAO D, MA Z, WANG X, WEI J. Genetic characterization of porcine reproductive and respiratory syndrome virus from Eastern China during 2017-2022[J]. Frontiers in Microbiology, 2022, 13: 971817. DOI:10.3389/fmicb.2022.971817 |
| [13] |
XIE C Z, TAO Y M, HA Z, ZHANG P, ZHANG Y, ZHANG H, JIN N Y, LU H J. Characterization of a new NSP2-deletion NADC34-like porcine reproductive and respiratory syndrome virus in China[J]. Research in Veterinary Science, 2022, 152: 212-218. DOI:10.1016/j.rvsc.2022.08.001 |
| [14] |
LI P, SHEN Y, WANG T, LI J, LI Y, ZHAO Y, LIU S, LI B, LIU M, MENG F. Epidemiological survey of PRRS and genetic variation analysis of the ORF5 gene in Shandong Province, 2020-2021[J]. Frontiers in Veterinary Science, 2022, 9: 987667. DOI:10.3389/fvets.2022.987667 |
| [15] |
蒋智勇, 楚品品, 陈天宝, 李春玲, 蔡汝健. 广东省猪繁殖与呼吸综合征病毒ORF5基因遗传变异分析[J]. 广东农业科学, 2022, 49(4): 97-105. DOI:10.16768/j.issn.1004-874X.2022.04.012 JIANG Z Y, CHU P P, CHEN T B, LI C L, CAI R J. Genetic variation analysis of ORF5 gene of porcine reproductive and respiratory syndrome virus in Guangdong province[J]. Guangdong Agricultural Sciences, 2022, 49(4): 97-105. DOI:10.16768/j.issn.1004-874X.2022.04.012 |
| [16] |
XIE S, LIANG W, WANG X, CHEN H, FAN J, SONG W, HUA L, TANG X, CHEN H, PENG Z, WU B. Epidemiological and genetic characteristics of porcine reproduction and respiratory syndrome virus 2 in mainland China, 2017-2018[J]. Archives of Virology, 2020, 165(7): 1621-1632. DOI:10.1007/s00705-020-04661-z |
| [17] |
GUO Z, CHEN X X, LI R, QIAO S, ZHANG G. The prevalent status and genetic diversity of porcine reproductive and respiratory syndrome virus in China: a molecular epidemiological perspective[J]. Virology Journal, 2018, 15(1): 2-16. DOI:10.1186/s12985-017-0910-6 |
| [18] |
LIANG W, ZHAO T, PENG Z, SUN Y, STRATTON C W, ZHOU D, TANG X, TIAN Y, CHEN H, WU B J A T. Epidemiological and genetic characteristics of porcine reproductive and respiratory syndrome virus circulating in central and South China in 2016[J]. Acta Tropica, 2019, 190: 83-91. DOI:10.1016/j.actatropica.2018.11.004 |
| [19] |
XIE J, TRUS I, OH D, KVISGAARD L K, RAPPE J C F, RUGGLI N, VANDERHEIJDEN N, LARSEN L E, LEFEVRE F, NAUWYNCK H J. A triple amino acid substitution at position 88/94/95 in glycoprotein GP2a of type 1 porcine reproductive and respiratory syndrome virus(PRRSV1) is responsible for adaptation to MARC-145 cells[J]. Viruses, 2019, 11(1): 36. DOI:10.3390/v11010036 |
| [20] |
ZHANG H L, TANG Y D, LIU C X, XIANG L R, ZHANG W L, LENG C L, WANG Q, AN T Q, PENG J M, TIAN Z J, CAI X H. Adaptions of field PRRSVs in Marc-145 cells were determined by variations in the minor envelope proteins GP2a-GP3[J]. Veterinary Microbiology, 2018, 222: 46-54. DOI:10.1016/j.vetmic.2018.06.021 |
| [21] |
VAN BREEDAM W, VAN GORP H, ZHANG J Q, CROCKER P R, DELPUTTE P L, NAUWYNCK H J. The M/GP(5) glycoprotein complex of porcine reproductive and respiratory syndrome virus binds the sialoadhesin receptor in a sialic acid-dependent manner[J]. PLoS Pathogens, 2010, 6(1): e1000730. DOI:10.1371/journal.ppat.1000730 |
| [22] |
叶梦雪, 朱建中, 陈南华. 猪繁殖与呼吸综合征病毒受体及其在病毒感染中的作用研究进展[J]. 动物医学进展, 2020, 41(12): 102-107. DOI:10.16437/j.cnki.1007-5038.2020.12.019 YE M X, ZHU J Z, CHEN N H. Progress in porcine reproductive and respiratory syndrome virus receptor and its role in viral infection[J]. Progress in Veterinary Medicine, 2020, 41(12): 102-107. DOI:10.16437/j.cnki.1007-5038.2020.12.019 |
| [23] |
STADEJEK T, STANKEVICIUS A, MURTAUGH M P, OLEKSIEWICZ M B. Molecular evolution of PRRSV in Europe: current state of play[J]. Veterinary Microbiology, 2013, 165(1/2): 21-28. DOI:10.1016/j.vetmic.2013.02.029 |
| [24] |
XIA W, WU Z, GUO C, ZHU S, ZHANG X, XIA X, SUN H. Recombinant adenovirus-delivered soluble CD163 and sialoadhesin receptors protected pigs from porcine reproductive and respiratory syndrome virus infection[J]. Veterinary Microbiology, 2018, 219: 1-7. DOI:10.1016/j.vetmic.2018.04.006 |
| [25] |
KIM J K, FAHAD A M, SHANMUKHAPPA K, KAPIL S. Defining the cellular target(s) of porcine reproductive and respiratory syndrome virus blocking monoclonal antibody 7G10[J]. Journal of Virology, 2006, 80(2): 689-696. DOI:10.1128/jvi.80.2.689-696.2006 |
| [26] |
马晓春. 波形蛋白对PRRSV感染细胞的作用研究[D]. 泰安: 山东农业大学, 2012. MA X C. Study on the effect of waveform protein on PRRSV-infected cells[D]. Taian: Shandong Agricultural University, 2012. |
| [27] |
王伟伟, 张璐, 马晓春, 高继明, 肖一红, 周恩民. 波形蛋白介导猪繁殖与呼吸综合征病毒感染Marc-145细胞作用的初步研究[J]. 病毒学报, 2011, 27(5): 456-461. DOI:10.13242/j.cnki.bingduxuebao.002205 WANG W W, ZHANG L, MA X C, GAO J M, XIAO Y H, ZHOU E M. Preliminary study on vimentin mediated porcine reproductive and respiratory syndrome virus infection of Marc-145 cells[J]. Chinese Journal of Virology, 2011, 27(5): 456-461. DOI:10.13242/j.cnki.bingduxuebao.002205 |
| [28] |
XUE B, HOU G, ZHANG G, HUANG J, LI L, NAN Y, MU Y, WANG L, ZHANG L, HAN X, REN X, ZHAO Q, WU C, WANG J, ZHOU E M. MYH9 Aggregation induced by direct interaction with PRRSV GP5 ectodomain facilitates viral internalization by permissive cells[J]. Frontiers in Microbiology, 2019, 10: 2313. DOI:10.3389/fmicb.2019.02313 |
| [29] |
GUO R, KATZ B B, TOMICH J M, GALLAGHER T, FANG Y. Porcine reproductive and respiratory syndrome virus utilizes nanotubes for intercellular spread[J]. Journal of Virology, 2016, 90(10): 5163-5175. DOI:10.1128/JVI.00036-16 |
| [30] |
LI L, XUE B, SUN W, GU G, HOU G, ZHANG L, WU C, ZHAO Q, ZHANG Y, ZHANG G, HISCOX J A, NAN Y, ZHOU E M. Recombinant MYH9 protein C-terminal domain blocks porcine reproductive and respiratory syndrome virus internalization by direct interaction with viral glycoprotein 5[J]. Antiviral Research, 2018, 156: 10-20. DOI:10.1016/j.antiviral.2018.06.001 |
| [31] |
LIU X, LIU X, BAI J, GAO Y, SONG Z, NAUWYNCK H, WANG X, YANG Y, JIANG P J J O V. Glyceraldehyde-3-phosphate dehydrogenase restricted in cytoplasmic location by viral GP5 facilitates porcine reproductive and respiratory syndrome virus replication via its glycolytic activity[J]. Journal of Virology, 2021, 95(18): e00210-21. DOI:10.1128/JVI.00210-21 |
| [32] |
HICKS J A, YOO D, LIU H C. Interaction of porcine reproductive and respiratory syndrome virus major envelope proteins GP5 and M with the cellular protein Snapin[J]. Virus Research, 2018, 249: 85-92. DOI:10.1016/j.virusres.2018.03.010 |
| [33] |
方满新. 猪繁殖与呼吸综合征病毒复制及感染影响因素的研究新进展[J]. 中国预防兽医学报, 2021, 43(6): 679-685. DOI:10.3969/j.issn.1008-0589.202007013 FANG M X. New progress in the study of porcine reproductive and respiratory syndrome virus replication and influencing factors of infection[J]. Chinese Journal of Preventive Veterinary Medicine, 2021, 43(6): 679-685. DOI:10.3969/j.issn.1008-0589.202007013 |
| [34] |
LUNNEY J K, FANG Y, LADINIG A, CHEN N, LI Y, ROWLAND B, RENUKARADHYA G J. porcine reproductive and respiratory syndrome virus(PRRSV): pathogenesis and interaction with the immune system[J]. Annu Rev Anim Biosci, 2016, 4: 129-154. DOI:10.1146/annurev-animal-022114-111025 |
| [35] |
KIM W I, KIM J J, CHA S H, WU W H, COOPER V, EVANS R, CHOI E J, YOON K J. Significance of genetic variation of PRRSV ORF5 in virus neutralization and molecular determinants corresponding to cross neutralization among PRRS viruses[J]. Veterinary Microbiology, 2013, 162(1): 10-22. DOI:10.1016/j.vetmic.2012.08.005 |
| [36] |
VASHISHT K, GOLDBERG T L, HUSMANN R J, SCHNITZLEIN W, ZUCKERMANN F A. Identification of immunodominant T-cell epitopes present in glycoprotein 5 of the North American genotype of porcine reproductive and respiratory syndrome virus[J]. Vaccine, 2008, 26(36): 4747-4753. DOI:10.1016/j.vaccine.2008.06.047 |
| [37] |
ROWLAND R R, STEFFEN M, ACKERMAN T, BENFIELD D A J V. The evolution of porcine reproductive and respiratory syndrome virus: quasispecies and emergence of a virus subpopulation during infection of pigs with VR-2332[J]. Virology, 1999, 259(2): 262-266. DOI:10.1006/viro.1999.9789 |
| [38] |
OSTROWSKI M, GALEOTA J A, JAR A M, PLATT K B, OSORIO F A, LOPEZ O J. Identification of neutralizing and nonneutralizing epitopes in the porcine reproductive and respiratory syndrome virus GP5 ectodomain[J]. Journal of Virology, 2002, 76(9): 4241-4250. DOI:10.1128/jvi.76.9.4241-4250.2002 |
| [39] |
LAROCHELLE R, D'ALLAIRE S, MAGAR R. Molecular epidemiology of porcine reproductive and respiratory syndrome virus(PRRSV) in Québec[J]. Virus Research, 2003, 96(1/2): 3-14. DOI:10.1016/s0168-1702(03)00168-0 |
| [40] |
RUPASINGHE R, LEE K, LIU X, GAUGER P C, ZHANG J, MARTINEZ-LOPEZ B. Molecular evolution of porcine reproductive and respiratory syndrome virus field strains from two swine production systems in the Midwestern United States from 2001 to 2020[J]. Microbiol Spectr, 2022, 10(3): e0263421. DOI:10.1128/spectrum.02634-21 |
| [41] |
WESLEY R D, MENGELING W L, LAGER K M, VORWALD A C, ROOF M B. Evidence for divergence of restriction fragment length polymorphism patterns following in vivo replication of porcine reproductive and respiratory syndrome virus[J]. American Journal of Veterinary Research, 1999, 60(4): 463-467. |
| [42] |
AKTER F, ROYCHOUDHURY P, DUTTA T K, SUBUDHI P K, KUMAR S, GALI J M, BEHERA P, SINGH Y D. Isolation and molecular characterization of GP5 glycoprotein gene of Betaarterivirus suid 2 from Mizoram, India[J]. Virusdisease, 2021, 32(4): 748-756. DOI:10.1007/s13337-021-00735-x |
| [43] |
WEI Z, LIN T, SUN L, LI Y, WANG X, GAO F, LIU R, CHEN C, TONG G, YUAN S J J O V. N-linked glycosylation of GP5 of porcine reproductive and respiratory syndrome virus is critically important for virus replication in vivo[J]. Journal of Virology, 2012, 86(18): 9941-9951. DOI:10.1128/JVI.07067-11 |
| [44] |
ZHU Z, YUAN L, HU D, LIAN Z, YAO X, LIU P, LI X. Isolation and genomic characterization of a Chinese NADC34-like PRRSV isolated from Jiangsu province[J]. Transboundary and Emerging Diseases, 2022, 69(4): e1015-e1027. DOI:10.1111/tbed.14392 |
| [45] |
NAN Y, WU C, GU G, SUN W, ZHANG Y J, ZHOU E M. Improved vaccine against PRRSV: current progress and future perspective[J]. Frontiers in Microbiology, 2017, 8: 1635. DOI:10.3389/fmicb.2017.01635 |
| [46] |
ALLENDE R, KUTISH G, LAEGREID W, LU Z, LEWIS T, ROCK D, FRIESEN J, GALEOTA J, DOSTER A R, OSORIO F A J A O V. Mutations in the genome of porcine reproductive and respiratory syndrome virus responsible for the attenuation phenotype[J]. 2000, 145(6): 1149-1161. DOI: 10.1007/s007050070115.
|
| [47] |
ZHANG L, FENG Y, MARTIN D P, CHEN J, MA S, XIA P, ZHANG G. Genetic diversity and phylogenetic analysis of the ORF5 gene of PRRSV from central China[J]. Research in Veterinary Science, 2017, 115: 226-234. DOI:10.1016/j.rvsc.2017.05.013 |
| [48] |
WESLEY R D, MENGELING W L, LAGER K M, CLOUSER D F, LANDGRAF J G, FREY M L J J O V D I. Differentiation of a porcine reproductive and respirator y syndrome vir us vaccine strain from North American field strains by restriction fragment length polymorphism analysis of ORF5[J]. Journal of Veterinary Diagnostic Investigation, 1998, 10(2): 140-144. DOI:10.1177/104063879801000204 |
| [49] |
KHATUN A, SHABIR N, SEO B-J, KIM B-S, YOON K-J, KIM W-I J J O V. The attenuation phenotype of a ribavirin-resistant porcine reproductive and respiratory syndrome virus is maintained during sequential passages in pigs[J]. Journal of Virology, 2016, 90(9): 4454-4468. DOI:10.1128/JVI.02836-15 |
| [50] |
CHARERNTANTANAKUL W. porcine reproductive and respiratory syndrome virus vaccines: Immunogenicity, efficacy and safety aspects[J]. World J Virol, 2012, 1(1): 23-30. DOI:10.5501/wjv.v1.i1.23 |
| [51] |
张璞, 陈建凯, 赖月辉, 林德锐, 李复坤, 周晓敏, 侯高伟, 齐冬梅. 猪瘟病毒检测和猪瘟疫苗研究进展[J]. 广东农业科学, 2022, 49(4): 106-115. DOI:10.16768/j.issn.1004-874X.2022.04.013 ZHANG P, CHEN J K, LAI Y H, LIN D R, LI F K, ZHOU X M, HOU G W, QI D M. Progress in swine fever virus detection and swine fever vaccine research[J]. Guangdong Agricultural Sciences, 2022, 49(4): 106-115. DOI:10.16768/j.issn.1004-874X.2022.04.013 |
| [52] |
蔡汝健, 蒋智勇, 勾红潮, 楚品品, 李艳, 宋帅, 徐志宏, 李春玲. 不同PRRS疫苗组合对仔猪免疫效果的研究[J]. 广东农业科学, 2019, 46(10): 93-98. DOI:10.16768/j.issn.1004-874X.2019.10.015 CAI R J, JIANG Z Y, GOU H C, CHU P P, LI Y, SONG S, XU Z H, LI C L. Study on the immune effect of different PRRS vaccine combinations on piglets[J]. Guangdong Agricultural Sciences, 2019, 46(10): 93-98. DOI:10.16768/j.issn.1004-874X.2019.10.015 |
| [53] |
程杰. PRRSV两种毒株GP5蛋白糖基化位点鉴定及其突变体核酸疫苗诱导免疫反应的研究[D]. 泰安: 山东农业大学, 2022. CHENG J. Identification of glycosylation sites of GP5 protein in two PRRSV strains and study on immune response induced by mutant nucleic acid vaccine[D]. Taian: Shandong Agricultural University, 2022. |
| [54] |
CUI J, O'CONNELL C M, COSTA A, PAN Y, SMYTH J A, VERARDI P H, BURGESS D J, VAN KRUININGEN H J, GARMENDIA A E. Correction: A PRRSV GP5-Mosaic vaccine: Protection of pigs from challenge and ex vivo detection of IFNgamma responses against several genotype 2 strains[J]. PloS One, 2019, 14(2): e0213091. DOI:10.1371/journal.pone.0213091 |
| [55] |
魏春华, 黄夏玲, 杨圆, 何乐, 林志锋, 徐叶, 黄文琳, 柳开隆, 戴爱玲, 杨小燕, 刘建奎. 猪繁殖与呼吸综合征病毒ORF5基因重组DNA疫苗的构建及其免疫效果评价[J]. 西北农林科技大学学报, 2022, 50(7): 17-25. DOI:10.13207/j.cnki.jnwafu.2022.07.003 WEI C H, HUANG X L, YANG Y, HE L, LIN Z F, XU Y, HUANG W L, LIU K L, DAI A L, YANG X Y, LIU J K. Construction of recombinant DNA vaccine of ORF5 gene of porcine reproductive and respiratory syndrome virus and evaluation of immune effect[J]. Journal of Northwest A & F University(Natural Science Edition), 2022, 50(7): 17-25. DOI:10.13207/j.cnki.jnwafu.2022.07.003 |
| [56] |
MA H, LI X, LI J, ZHAO Z, ZHANG H, HAO G, CHEN H, QIAN P. Immunization with a recombinant fusion of porcine reproductive and respiratory syndrome virus modified GP5 and ferritin elicits enhanced protective immunity in pigs[J]. Virology, 2021, 552: 112-120. DOI:10.1016/j.virol.2020.10.007 |
| [57] |
TIAN D, SUBRAMANIAM S, HEFFRON C L, MAHSOUB H M, SOORYANARAIN H, WANG B, CAO Q M, HASSEBROEK A, LEROITH T, FOSS D L, CALVERT J G, MENG X J. Construction and efficacy evaluation of novel swine leukocyte antigen(SLA) class I and class Ⅱ allele-specific poly-T cell epitope vaccines against porcine reproductive and respiratory syndrome virus[J]. Journal of General Virology, 2020, 101(11): 1191-1201. DOI:10.1099/jgv.0.001492 |
| [58] |
华思红, 熊贝佳, 樊钰莹, 孙永科, 杨玉艾. 表达猪瘟病毒E2和猪繁殖与呼吸综合征病毒GP5蛋白重组腺病毒动物免疫保护试验[J]. 动物医学进展, 2018, 39(11): 7-13. DOI:10.16437/j.cnki.1007-5038.20180517.001 HUA S H, XIONG B J, FAN Y Y, SUN Y K, YANG Y A. Animal immunoprotection test of recombinant adenovirus expressing classical swine fever virus E2 and porcine reproductive and respiratory syndrome virus GP5 protein[J]. Progress in Veterinary Medicine, 2018, 39(11): 7-13. DOI:10.16437/j.cnki.1007-5038.20180517.001 |
| [59] |
ZHAO J, ZHU L, XU L, LI F, DENG H, HUANG Y, GU S, SUN X, ZHOU Y, XU Z. The construction and immunogenicity analyses of recombinant pseudorabies virus with NADC30-Like porcine reproductive and respiratory syndrome virus-like particles Co-expression[J]. Frontiers in Microbiology, 2022, 13: 846079. DOI:10.3389/fmicb.2022.846079 |
| [60] |
BECARES M, SANCHEZ C M, SOLA I, ENJUANES L, ZUNIGA S. Antigenic structures stably expressed by recombinant TGEV-derived vectors[J]. Virology, 2014, 464-465: 274-286. DOI:10.1016/j.virol.2014.07.027 |
| [61] |
黄袁慧, 马静, 王乃迪, 张昕, 张莹, 兰冰洁, 刘玉良, 倪建强, 周智, 李义平, 王传彬. 猪繁殖与呼吸综合征病毒GP5蛋白在昆虫杆状病毒表达系统中的表达与鉴定[J/OL]. 中国动物传染病学报, 2022: 1-8[2023-03-08]. DOI: 10.19958/j.cnki.cn31-2031/s.20220513.002. HUANG Y H, MA J, WANG N D, ZHANG X, ZHANG Y, LAN B J, LIU Y L, NI J Q, ZHOU Z, LI Y P, WANG C B. Expression and identification of GP5 protein of porcine reproductive and respiratory syndrome virus in insect baculovirus expression system[J/OL]. Chinese Journal of Animal Infectious Diseases, 2022: 1-8[2023-03-08]. DOI: 10.19958/j.cnki.cn31-2031/s.20220513.002. |
| [62] |
WANG C, ZHANG F, YANG J, KHANNICHE A, SHEN H. Expression of porcine respiratory and reproductive syndrome virus membrane-associated proteins in Listeria ivanovii via a genome site-specific integration and expression system[J]. Journal of Molecular Microbiology and Biotechnology, 2014, 24(3): 191-195. DOI:10.1159/000363450 |
| [63] |
AN C H, NAZKI S, PARK S C, JEONG Y J, LEE J H, PARK S J, KHATUN A, KIM W I, PARK Y I, JEONG J C, KIM C Y. Plant synthetic GP4 and GP5 proteins from porcine reproductive and respiratory syndrome virus elicit immune responses in pigs[J]. Planta, 2018, 247(4): 973-985. DOI:10.1007/s00425-017-2836-z |
| [64] |
李国峰, 韩鹤, 翟宇. 预防PRRSV的载体疫苗的研究进展[J]. 畜牧兽医科技信息, 2014(3): 10-12. DOI:10.3969/j.issn.1671-6027.2014.03.005 LI G F, HAN H, ZHAI Y. Progress in vector vaccines for PRRSV prevention[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2014(3): 10-12. DOI:10.3969/j.issn.1671-6027.2014.03.005 |
| [65] |
陈妍卉, 刘军亭, 于潜, 刘久源, 裴翊峰, 庞富生, 高栋鹏, 董浩. 重组细菌活载体疫苗研究进展[J]. 中国预防兽医学报, 2022, 44(2): 219-224, 231. DOI:10.3969/j.issn.1008-0589.202104013 CHEN Y H, LIU J T, YU Q, LIU J Y, PEI Y F, PANG F S, GAO D P, DONG H. Progress in recombinant bacterial live-vector vaccines[J]. Chinese Journal of Preventive Veterinary Medicine, 2022, 44(2): 219-224, 231. DOI:10.3969/j.issn.1008-0589.202104013 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50