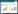文章信息
基金项目
- 国民核生化防护国家重点实验室基础科研基金(SKLNBC2019-21)
作者简介
- 张杰(1995—),男,在读硕士生,研究方向为土壤地膜污染防治,E-mail:1395868572@qq.com.
通讯作者
- 罗学刚(1957—),男,博士,教授,研究方向为环境污染控制与修复,E-mail:lxg@swust.edu.cn.
文章历史
- 收稿日期:2022-10-29
2. 西南科技大学生物质材料教育部工程研究中心,四川 绵阳 621010
2. Engineering Research Center, Ministry of Education, Southwest University of Science and Technology, Mianyang 621010, China
【研究意义】我国是农业大国,农用地膜的广泛应用,在促进粮食和经济作物产量增加的同时,也带来严重的环境污染问题。据中国农村统计年鉴最新数据显示,2020年我国农用塑料薄膜使用量已达240万t,其中地膜使用量达136万t,传统的农用地膜主要成分是聚乙烯,废弃的农用地膜降解极为困难。土壤中的农用地膜碎片可在理化因素的作用下分解成粒径小于5 mm的微塑料[1-4]。相关研究指出,微塑料会改变土壤的理化性质、影响土壤中微生物正常生理活动[5-8],此外还可作为载体吸附环境中的有机污染物[9-10]和重金属[11-12],造成复合污染。【前人研究进展】土壤环境组分复杂,从土壤中提取微塑料要比从水和沉积物中提取更困难,这是限制土壤中微塑料污染研究的重要原因。目前土壤中微塑料的提取方法主要有密度分离法[13-15]、油分离提取法[16-17]、加压流体萃取[18-19]等。密度分离法不适用于密度大、粒径小的微塑料,其工艺复杂容易造成交叉污染;油分离提取法利用微塑料的亲油性进行分离,具有简单、安全、廉价、省时等优点,但对非人工添加的环境微塑料样品的回收提取效果和对后续表征的影响有待进一步研究;加压流体萃取可以直接提取土壤中微塑料,自动化程度高、成本低、效率高,但是会低估微塑料的含量,改变微塑料的粒子形态,影响后续的物理表征,无法准确判断微塑料的生物毒性、来源和移动性[20-22]。Zhang等[23]研究发现,土壤中72% 的塑料颗粒与土壤团聚体结合,28% 的塑料颗粒分散,塑料纤维在微团聚体中的浓度显著高于大团聚体,表明塑料颗粒与土壤团聚体的结合,是造成土壤中微塑料分离困难的重要原因。
【本研究切入点】目前土壤中微塑料的提取方法均是将人工添加的微塑料和土壤混合后立即提取,忽略了土壤和微塑料会在理化因素的作用下相互结合,提取过程中也没有考虑对提取物微观表面特征的影响。从土壤中提取聚乙烯微塑料且不破坏提取物微观表面特征的提取方法鲜有报道。【拟解决的关键问题】本研究以3种聚乙烯为研究对象,探究改进后的筛分浮选法、密度分离法和索氏提取法对土壤中聚乙烯微塑料的提取率及提取物微观表面特征的影响,探讨一种简单且不破坏提取物微观表面特征的分离提取方法,以期为土壤中微塑料的分离提供理论参考和实践依据。
1 材料与方法 1.1 试验材料选用低密度聚乙烯(LDPE,粒径范围0.05~0.20 mm,平均粒径0.10 mm)、高密度聚乙烯(HDPE,粒径范围0.1~0.5 mm,平均粒径0.3 mm)和线性低密度聚乙烯(LDPE,粒径范围0.2~1.0 mm,平均粒径0.7 mm)3种聚乙烯粉末模拟土壤中残留聚乙烯微塑料,3种聚乙烯粉末均购自东莞市顺捷塑胶科技有限公司。
试验地点为西南科技大学(30°42′~ 33°03′N、主,沙土以细砂粒(20~200 μm)和粗砂粒(200~ 103°45′~105°43′E)。供试土壤质地分别为壤土、2 000 μm)为主,壤土粘粒、粉粒、砂粒适中,沙土、粘土、沙土,其基本理化性质如表 1所示。粘土壤土、粘土过孔径43 μm钢筛后剩余物质分别为以粘粒(0.01~2.00 μm)和粉砂粒(2~20 μm)为57.36%、23.12%、2.66%。
|
1.2 试验方法
1.2.1 聚乙烯微塑料处理 将3种质地供试土壤(壤土、粘土、沙土)放入烘箱中50 ℃烘干,用土壤粉碎机粉碎后过5 mm钢筛。于2021年12月30日将LDPE、HDPE和LLDPE 3种聚乙烯粉末分别添加在3种土壤中,根据2020年农业生产地膜覆盖使用量每年为90 kg/hm2,本研究模拟100年使用量,折算添加量为3.5 g/kg。每个处理3次重复,设置不添加聚乙烯粉末的壤土、粘土、沙土为对照;将聚乙烯粉末和土壤充分混匀,分别装入5号加仑盆中,浇透水后压实置于室内阴凉处,每周浇水1次,于2022年5月10日取出土壤,进行干燥、粉碎、过筛,用于提取土壤中聚乙烯微塑料。
1.2.2 聚乙烯微塑料提取 采用经过优化的筛分浮选法、密度分离法、索氏提取法3种方法提取土壤中聚乙烯微塑料,操作步骤如下:
筛分浮选法:称取50 g土壤,放入40 μm钢筛中,使用振动筛机筛至无泥土颗粒筛出,取下钢筛加蒸馏水冲洗至钢筛流出的水无色,用蒸馏水将钢筛上的剩余物冲洗入250 mL容量瓶中,加蒸馏水至瓶口,待容量瓶中水清澈后收集水面漂浮物,多次重复,至水面无漂浮物,将收集到的漂浮物放在滤纸上干燥。
密度分离法:称取50 g土壤放入容量瓶中,加适量蒸馏水充分混匀,然后加蒸馏水至瓶口,待容量瓶中水清澈后收集水面漂浮物,多次重复,至水面无漂浮物,将收集到的漂浮物置于滤纸上干燥。
索氏提取法:在密度分离法的基础上,将干燥后的漂浮物用滤纸包好,然后放入索氏提取器中,加入50 mL十氢萘,使用电热套加热至135 ℃后,加热25 min,趁热将溶液进行抽滤。转移抽滤瓶中的液体至培养皿,放入通风橱中,待十氢萘挥发完之后,用小刀刮下培养皿中的剩余物。

|
1.2.3 聚乙烯微塑料理化表征 热重(TG)分析:分别取3种聚乙烯粉末原样(未加入土壤中的聚乙烯粉末)、利用3种分离方法从3种土壤中提取的提取物5 mg,使用SDT Q600热重分析仪在N2氛围下,升温速率为10 ℃ /min,扫描温度范围25~800 ℃,分析提取物的热解情况。
傅里叶红外光谱(FT-IR)分析:分别取3种聚乙烯粉末原样(未加入土壤中的聚乙烯粉末)、3种分离方法从3种土壤中提取的提取物,与溴化钾粉末充分混合后,用压片机压成1 cm左右的薄片,在4 000~400 cm-1波谱下进行扫描分析。
扫描电镜(SEM)分析:使用TM-3000台式电子显微镜对3种聚乙烯粉末原样(未加入土壤中的聚乙烯粉末)、3种分离方法从3种土壤中提取的提取物表面形貌进行观察,拍照。
1.3 数据分析采用SPSS 20.0对数据进行统计分析,采用Origin 2019绘图,利用Adobe lllustrator CS6进行图片排版。
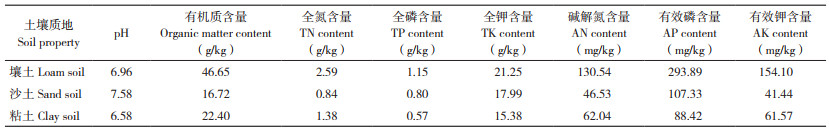
2 结果与分析 2.1 不同提取方法对微塑料提取率的影响筛分浮选法、密度分离法、索氏提取法提取土壤中聚乙烯微塑料的提取率如表 2所示。
|
由表 2可知,筛分浮选法的提取率可达74.08%~95.58%,密度分离法的提取率为58.91%~89.60%,索氏提取法的提取率仅为41.13%~86.10%,尤其是对LDPE粉末的提取率不到50%。整体上看,3种提取方法中,筛分浮选法的提取率显著高于索氏提取法,密度分离法的提取率与筛分浮选法、索氏提取法的提取率无显著性差异。其中在粘土中3种方法之间均呈显著性差异,表明在粘土中筛分浮选法明显优于其他两种方法,壤土次之,沙土中最差;在相同提取方法和土壤类型下,对不同聚乙烯种类的提取率进行显著性分析发现,HDPE和LLDPE的提取率显著性高于LDPE,说明聚乙烯粉末粒径越大,提取效果越好;在相同提取方法和相同聚乙烯种类下,对不同土壤类型的提取率进行显著性分析发现,3种土壤中提取率无显著性差异,推测3种方法均不受土壤类型影响,适用于不同土壤。综上,通过比较3种方法对3种土壤中聚乙烯粉末的提取率,发现筛分浮选法的提取率达到74.08% 以上,密度分离法的提取率达58.91% 以上,索氏提取法的提取率只有达41.13% 以上,表明在不同土壤中,筛分浮选法的提取率优于其他两种提取方法,且粒径越大,提取率越高。
2.2 不同提取方法对微塑料表面微观形貌的影响利用扫描电子显微镜对原样聚乙烯微塑料和3种不同提取方式提取的聚乙烯微塑料表面微观形貌进行观察发现,LDPE、HDPE和LLDPE 3种聚乙烯微塑料原样表面平整光滑,索氏提取法的提取物表面有细碎的鱼鳞纹(图 1J),从有机溶剂里面析出产生的片状表面(图 1H),或有机溶剂挥发后凹凸不平的沟壑(图 1K)。表明索氏提取法的提取物经过溶解于有机溶剂中再析出,微观表面形貌发生改变。

|
| 图 1 索氏提取法提取物和聚乙烯微塑料原样SEM图 Fig. 1 SEM images of extracts by Soxhlet extraction method and original polyethylene microplastics |
由图 2可知,密度分离法提取物表面附有大量颗粒物,这些颗粒物可能是在提取过程中,土壤中的泥土粒子附着于聚乙烯微塑料表面造成,也可能是浮选液中无机盐析出后形成的晶体(图 2F~图 2H)。表明密度分离法提取物表面会附着土壤中杂质,覆盖聚乙烯微塑料原有的微观表面形貌特征。

|
| 图 2 密度分离法提取物和聚乙烯微塑料原样SEM图 Fig. 2 SEM images of extracts by density separation method and original polyethylene microplastics |
如图 3所示,筛分浮选法提取物表面几乎没有杂质颗粒,表面大部分与原样相同(图 3H~图 3L),基本的表面微观形貌特征未被破坏,也没有被其他杂质覆盖。可见,筛分浮选法提取物能有效保留聚乙烯微塑料原有的微观表面形貌特征。

|
| 图 3 筛分浮选法提取物和聚乙烯微塑料原样SEM图 Fig. 3 SEM images of extracts by sieve flotation method and original polyethylene microplastics |
2.3 不同提取方法对微塑料热解特性参数的影响
由图 4可知,从土壤中提取的聚乙烯提取物和原样聚乙烯粉末的热重变化趋势相同,热解温度相近,其中LDPE原样热解温度为408 ℃,索氏提取法、密度浮选法、筛分浮选法的提取物热解温度分别为416、416、415.3 ℃;HDPE原样热解温度为413 ℃,索氏提取法、密度浮选法、筛分浮选法的提取物热解温度分别为417、414、415.3 ℃;LLDPE原样热解温度为408 ℃,索氏提取法、密度浮选法、筛分浮选法的提取物热解温度分别为415、413.3、411.6 ℃;因为聚乙烯是高分子混合物,无固定的热解温度,且提取物中聚乙烯和杂质的相互作用会使热解温度出现波动,上述提取物的热解温度在正常波动范围内。表明3种提取方法的提取物主要成分为聚乙烯。

|
| A~C:索氏提取法;D~F:密度分离法;G~I:筛分浮选法 A~C: Soxhlet extraction method; D~F: density separation method; G~I: sieve flotation method 图 4 3种提取方法提取物的热重比较 Fig. 4 Thermogravimetric comparison of extracts by three extraction methods |
2.4 不同提取方法对微塑料官能团的影响
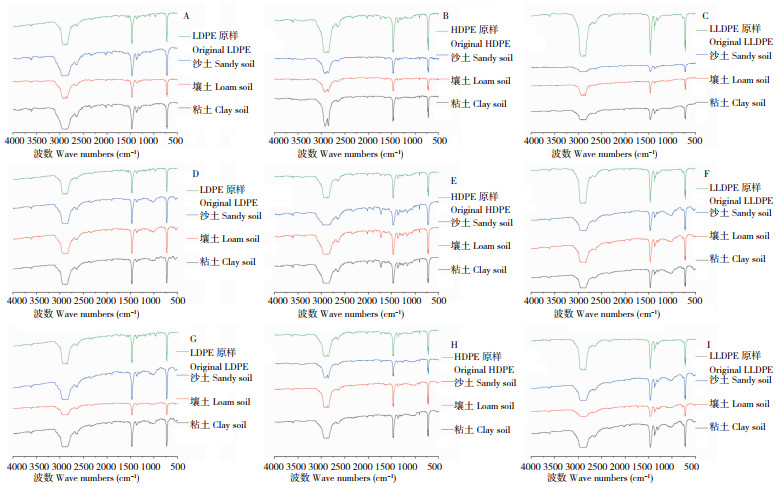
利用傅里叶红外光谱比较聚乙烯微塑料原样和处理后提取物结构变化发现,部分处理出现吸收峰强度不同的情况,如壤土处理(图 5G)、沙土处理(图 5C)等,这是由于制片时聚乙烯微塑料的浓度差别导致吸收峰强弱不同。但3种方法的提取物与聚乙烯微塑料原样相比,既没有出现新的吸收峰,也没有消失的吸收峰,表明提取物没有官能团的增加与减少,3种提取方法均没有破坏聚乙烯微塑料原结构。同时,提取物和原样聚乙烯粉末的红外光谱图类似,表明3种提取方法提取的提取物主要成分是聚乙烯。
|
| A~C:索氏提取法;D~F:密度分离法;G~I:筛分浮选法 A~C: Soxhlet extraction method; D~F: density separation method; G~I: sieve flotation method 图 5 3种提取方法提取物的红外光谱比较 Fig. 5 Comparison of infrared spectra of extracts by three extraction methods |
3 讨论
土壤中微塑料的提取是制约土壤微塑料污染研究的重要阻碍之一。微塑料在物理、化学、生物等因素作用下会与土壤形成聚乙烯 - 土壤杂质复合物,使复合物密度发生变化,且在提取过程中,土壤团聚体具有吸附效应,而微塑料具有较大的比表面积,使得土壤团聚体和微塑料发生不同限度的结合,从而增加土壤环境中微塑料的分离难度[23],降低密度分离法在土壤中的提取率。本研究结果显示,筛分浮选法的提取率高于密度分离法和索氏提取法的提取率,且显著高于索氏提取法的提取率。筛分浮选法通过减少分离体系中细小的土壤粒子、破坏土壤团聚体结构、降低浮选液吸附能力,以提高分离效果,因此筛分浮选法的提取率比密度分离法和索氏提取法的提取率高。同时发现HDPE和LLDPE的提取率显著高于LDPE,聚乙烯粉末粒径越大,比表面积越小,吸附力越小,提取效果越好,与韩娜等[24]研究结果相似,侧面证实了筛分浮选法的原理和方向是正确的。
扫描电镜分析是观察物体表观形貌特征的一种方法,可用于表面形态鉴定[25]。周倩等[26]使用密度分离法提取出的微塑料表面黏附有黏土矿物和铁氧化物等杂质,提取过程中微塑料粒子形态的变化和物理特征的改变,可能会对微塑料的来源和生态毒理效应的判断出现偏差[27],因此保证提取物微观表面特征完整性是有必要的。本研究发现,索氏提取法提取物表面有细碎的鱼鳞纹或者片状表面,密度分离法提取物表面附有大量杂质颗粒物,筛分浮选法提取物表面虽然仍有少量杂质颗粒,但基本的表面微观形貌特征未发生改变,也没有被其他杂质覆盖。以上结果表明,在保留提取物微观表面特征信息方面,筛分浮选法优于密度分离法和索氏提取法。因为索氏提取法利用聚乙烯溶解于有机溶剂的特性进行提取,在聚乙烯溶解和析出的过程中提取物微观表面特征信息完全被破坏;密度分离法因为土壤杂质附着于聚乙烯粉末表面,使提取物微观表面特征信息被覆盖;而筛分浮选法通过减少分离体系中细小的土壤粒子,破坏土壤团聚体,减少土壤杂质附着于聚乙烯粉末表面,从而保持提取物表观形貌信息的完整性。
傅里叶红外光谱法是当前鉴定材料分子结构变化的最佳技术之一,可以测得材料分子结构中特定的化学键,与标准图谱进行对比,可以识别特定微塑料,也可以判断微塑料分子结构是否发生变化[20]。熊小莉等[21]利用傅里叶红外光谱法检验聚乙烯微塑料分子结构的变化,刘梦婷等[22]利用傅里叶红外光谱法识别微塑料。本研究测定提取物红外光谱图,与聚乙烯微塑料原样相比,提取物红外光谱中既没有出现新的吸收峰,也没有消失的吸收峰,说明提取物没有官能团的改变,3种提取方法均没有破坏聚乙烯微塑料的原结构,同时,因为提取物和聚乙烯微塑料原样红外光谱类似,说明提取物主要成分是聚乙烯,佐证了热重分析的结果。
本研究发现,在提取率和保持提取物表观形貌信息的完整性上,改进后的筛分浮选法均优于密度分离法和索氏提取法。但该方法难以提取粒径较小的微塑料,应进一步探究其他的物理化学手段破坏土壤团聚体结构,降低浮选液吸附能力,提高提取效果。
4 结论本研究比较了筛分浮选法、密度分离法和索氏提取法对土壤中聚乙烯微塑料的提取效果,发现筛分浮选法提取率显著高于其他两种方法,其中筛分浮选法的提取率最高可达95.58%,密度分离法的提取率最高达89.60%,索氏提取法的提取率最高为86.10%;筛分浮选法提取物微观表面特征保存完整性优于其他两种方法;推测在土壤中提取聚乙烯微塑料,筛分浮选法比密度分离法和索氏提取法更好。后期可考虑采用不同的理化方法去破坏土壤与聚乙烯微塑料的结合,以达到更好的分离效果。
| [1] |
THOMPSON R C, OLSEN Y, MITCHELL R P. Lost at sea: where is all the plastic?[J]. Science, 2004, 304(5672): 838. DOI:10.1126/science.1094559 |
| [2] |
THOMPSON R C, MOORE C J, VOM SAAL F S. Plastics, the environment and human health: current consensus and future trends[J]. Philosophical Transactions of the Royal Society B. Biological Sciences, 2009, 364(1526): 2153-2166. DOI:10.1098/rstb.2009.0053 |
| [3] |
COLE M, LINDEQUE P, HALSBAND C. Microplastics as contaminants in the marine environment: a review[J]. Marine Pollution Bulletin, 2011, 62(12): 2588-2597. DOI:10.1016/j.marpolbul.2011.09.025 |
| [4] |
黄瑶珠, 高旭华, 陈明周, 谢东. 全生物降解除草地膜覆盖在冬种马铃薯的应用效果研究[J]. 广东农业科学, 2017, 44(8): 20-25. DOI:10.16768/j.issn.1004-874X.2017.08.004 HUANG Y Z, GAO X H, CHEN M Z, XIE D. Application effect of truly biodegradable herbicidal mulching film inwinter potato[J]. Guangdong Agricultural Sciences, 2017, 44(8): 20-25. DOI:10.16768/j.issn.1004-874X.2017.08.004 |
| [5] |
陶宗娅, 曹小卫, 罗学刚, 黎霞, 周志芳. 几种土壤酶活性对低分子量聚乙烯的响应[J]. 土壤通报, 2012, 43(5): 1104-1110. DOI:10.19336/j.cnki.trtb.2012.05.014 TAO Z Y, CAO X W, LUO X G, LI X, ZHOU Z F. Responses of three enzyme activities to lower molecular weight polyethylene added in pot-cultured horse bean soil[J]. Chinese Journal of Soil Science, 2012, 43(5): 1104-1110. DOI:10.19336/j.cnki.trtb.2012.05.014 |
| [6] |
樊有国, 罗学刚. 环境降解聚乙烯地膜残余组分对土壤酶活性的影响[J]. 环境科学与技术, 2014, 37(6): 1-6. FAN Y G, LUO X G. Effects of the residues of mulching films of environmental degradable polyethylene on soil enzyme activities[J]. Environmental Science & Technology, 2014, 37(6): 1-6. |
| [7] |
刘沙沙, 操江飞, 陈显宇, 梁绮彤. 微塑料 - 多环芳烃对农用地土壤微生物群落结构和功能的影响[J]. 广东农业科学, 2022, 49(8): 64-72. DOI:10.16768/j.issn.1004-874X.2022.08.008 LIU S S, CAO J F, CHEN X Y, LIANG Q T. Effects of microplastics-polycyclic aromatic hydrocarbons on microbial community structure and function in agricultural soil[J]. Guangdong Agricultural Sciences, 2022, 49(8): 64-72. DOI:10.16768/j.issn.1004-874X.2022.08.008 |
| [8] |
农淼明, 陶宗娅, 张尔亮, 赖金龙, 吴国, 罗学刚. LMWPE对土壤微生物活性及多样性的影响// 农业环境与生态安全——第五届全国农业环境科学学术研讨会论文集[C]. 2013. NONG M M, TAO Z Y, ZHANG E L, LAI J L, WU G, LUO X G. Effects of low molecular polyethylene (lmwpe)on microbial activity and diversity // Agricultural Environment and Ecological Security-proceedings of The Fifth National Symposium on Agricultural Environmental Science[C]. 2013. |
| [9] |
ANTUNES J C, FRIAS J G L, MICAELO A C. Resin pellets from beaches of the portuguese coast and adsorbed persistent organic pollutants[J]. Estuarine, Coastal and Shelf Science, 2013, 130: 62-69. DOI:10.1016/j.ecss.2013.06.016 |
| [10] |
OLIVEIRA M, RIBEIRO A, HYLLAND K. Single and combined effects of microplastics and pyrene on juveniles (0+ group) of the common goby Pomatoschistus microps (Teleostei, Gobiidae)[J]. Ecological Indicators, 2013, 34: 641-647. DOI:10.1016/j.ecolind.2013.06.019 |
| [11] |
范秀磊, 常卓恒, 邹晔锋, 刘加强, 李莹, 侯俊. 可降解微塑料对铜和锌离子的吸附解吸特性[J]. 中国环境科学, 2021, 41(5): 2141-2150. DOI:10.19674/j.cnki.issn1000-6923.2021.0226 FAN X L, CHANG Z H, ZOU Y F, LIU J Q, LI Y, HOU J. Adsorption and desorption properties of degradable microplastic for Cu2+ and Zn2+[J]. China Environmental Science, 2021, 41(5): 2141-2150. DOI:10.19674/j.cnki.issn1000-6923.2021.0226 |
| [12] |
BRENNECKE D, DUARTE B, PAIVA F. Microplastics as vector for heavy metal contamination from the marine environment[J]. Estuarine, Coastal and Shelf Science, 2016, 178: 189-195. DOI:10.1016/j.ecss.2015.12.003 |
| [13] |
FRERE L, PAUL-PONT I, RINNERT E. Influence of environmental and anthropogenic factors on the composition, concentration and spatial distribution of microplastics: a case study of the Bay of Brest (Brittany, France)[J]. Environmental Pollution, 2017, 225: 211-222. DOI:10.1016/j.envpol.2017.03.023 |
| [14] |
IMHOF H K, LAFORSCH C, WIESHEU A C. Pigments and plastic in limnetic ecosystems: A qualitative and quantitative study on microparticles of different size classes[J]. Water Research, 2016, 98: 64-74. DOI:10.1016/j.watres.2016.03.015 |
| [15] |
GRBIC J, NGUYEN B, GUO E. Magnetic extraction of microplastics from environmenta l sa mples[J]. Environmental Science & Technolog y Letters, 2019, 6(2): 68-72. DOI:10.1021/acs.estlett.8b00671 |
| [16] |
MISRA A, ZAMBRZYCKI C, KLOKER G. Water purification and microplastics removal using magnetic polyoxometalate‐supported ionic liquid phases (magPOM‐SILPs)[J]. Angewandte Chemie International Edition, 2020, 59(4): 1601-1605. DOI:10.1002/anie.201912111 |
| [17] |
RHEIN F, SCHOLL F, NIRSCHL H. Magnetic seeded filtration for the separation of fine polymer particles from dilute suspensions: Microplastics[J]. Chemical Engineering Science, 2019, 207: 1278-1287. DOI:10.1016/j.ces.2019.07.052 |
| [18] |
DIERKES G, LAUSCHKE T, BECHER S. Quantification of microplastics in environmental samples via pressurized liquid extraction and pyrolysis-gas chromatography[J]. Analytical and Bioanalytical Chemistry, 2019, 411(26): 6959-6968. DOI:10.1007/s00216-019-02066-9 |
| [19] |
OKOFFO E D, RIBEIRO F, O'BRIEN J W. Identification and quantification of selected plastics in biosolids by pressurized liquid extraction combined with double-shot pyrolysis gas chromatography– mass spectrometry[J]. Science of the Total Environment, 2020, 715: 136924. DOI:10.1016/j.scitotenv.2020.136924 |
| [20] |
李君薇. 水体中微塑料的采集、分离及检测技术研究进展[J]. 塑料科技, 2021, 49(8): 113-116. DOI:10.15925/j.cnki.issn1005-3360.2021.08.026 LI J W. Research progress on collection, separation and detection technology of microplastics in water[J]. Plastics Science and Technology, 2021, 49(8): 113-116. DOI:10.15925/j.cnki.issn1005-3360.2021.08.026 |
| [21] |
XIONG X L, LUO X G, CHEN C. Extraction and analysis of degradable polyethylene residues in soil[J]. Advanced Materials Research, 2012, 554: 157-160. DOI:10.4028/www.scientific.net/AMR.554-556.157 |
| [22] |
LIU M T, SONG Y, LU S. A method for extracting soil microplastics through circulation of sodium bromide solutions[J]. Science of The Total Environment, 2019, 691: 341-347. DOI:10.1016/j.scitotenv.2019.07.144 |
| [23] |
ZHANG G S, LIU Y F. The distribution of microplastics in soil aggregate fractions in southwestern China[J]. Science of the Total Environment, 2018, 642: 12-20. DOI:10.1016/j.scitotenv.2018.06.004 |
| [24] |
韩娜, 张春惠, 卢红. 土壤中低相对分子质量聚乙烯(L-PE)的提取及其降解特性研究[J]. 四川师范大学学报: 自然科学版, 2017, 40(2): 228-233. DOI:10.3969/j.issn.1001-8395.2017.02.015 HAN N, ZHANG C H, LU H. Study on extraction rates and degradation characteristics of low relative molecular weight polyethylene (L-PE) in potted-soil[J]. Journal of Sichuan Normal University(Natural Science), 2017, 40(2): 228-233. DOI:10.3969/j.issn.1001-8395.2017.02.015 |
| [25] |
VAN CAUWENBERGHE L, VANREUSEL A, MEES J. Microplastic pollution in deep-sea sediments[J]. Environmental Pollution, 2013, 182: 495-499. DOI:10.1016/j.envpol.2013.08.013 |
| [26] |
周倩, 章海波, 周阳, 李远, 薛勇, 付传城, 涂晨, 骆永明. 滨海潮滩土壤中微塑料的分离及其表面微观特征[J]. 科学通报, 2016, 61(14): 1604-1611. DOI:10.1360/N972015-01098 ZHOU Q, ZHANG H B, ZHOU Y, LI Y, XUE Y, FU C C, TU C, LUO Y M. Separation of microplastics from a coastal soil and their surface microscopic features[J]. Chinese Science Bulletin, 2016, 61(14): 1604-1611. DOI:10.1360/N972015-01098 |
| [27] |
冉泰山, 廖洪凯, 龙健, 李娟, 杨国梅, 赵雨鑫. 微塑料在土壤环境中的分离和检测方法研究进展[J]. 塑料科技, 2022, 50(7): 101-104. DOI:10.15925/j.cnki.issn1005-3360.2022.07.021 RAN T S, LIAO H K, LONG J, LI J, YANG G M, ZHAO Y X. Research progress on separation and detection methods of microplastics in soil environment[J]. Plastics Science and Technology, 2022, 50(7): 101-104. DOI:10.15925/j.cnki.issn1005-3360.2022.07.021 |
(责任编辑 白雪娜)
 2023, Vol. 50
2023, Vol. 50