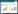文章信息
基金项目
- 国家自然科学基金(31860736);广西创新驱动发展专项(20171286);广西大学横向课题(20160284)
作者简介
- 莫超迪(1996—),男,壮族,在读硕士生,研究方向为水产动物免疫与病害防控,E-mail:422513622@qq.com.
通讯作者
- 韦友传(1971—),男,壮族,博士,副教授,研究方向为水产动物免疫与病害防控,E-mail:weiyc@gxu.edu.cn.
文章历史
- 收稿日期:2023-01-01
【研究意义】黄喉拟水龟(Mauremys mutica)属地龟科(Geoemydidae)拟水龟属(Mauremys),具有较高的食用、药用和观赏价值,从20世纪80年代以来已成为我国重要的养殖龟类。随着人们生活水平的提高以及对高质量食品蛋白需求的增加,黄喉拟水龟的养殖受到广泛关注,已成为广东、广西及海南等南方地区重要的龟类养殖品种[1]。但随着养殖规模不断扩大和养殖环境恶化,由肺炎克雷伯菌(Klebsiella pneumoniae)引起的白眼病和肺炎时有发生[2-3]。肺炎克雷伯菌通常分布于土壤和水生环境中,可感染人和动物,引起肺炎、肠炎、肝脓肿、脑膜炎及败血症等呼吸道和消化道疾病[4-5]。可见,肺炎克雷伯菌可对黄喉拟水龟养殖业造成严重的经济损失,而且存在传染给人的风险[6]。生产中常用抗菌药物和抗生素治疗黄喉拟水龟肺炎克雷伯菌病,但易产生耐药菌株或药物残留,引起肉龟食用安全等问题[7-9]。注射疫苗是防控动物疫病的有效手段[10-11]。开展肺炎克雷伯菌外膜蛋白A的原核表达与纯化,可为黄喉拟水龟肺炎克雷伯菌病的疫苗研发奠定基础。
【前人研究进展】目前针对肺炎克雷伯菌的疫苗种类主要有灭活疫苗、多糖疫苗以及蛋白疫苗等,均具有优良的保护力[5]。但灭活疫苗成分复杂,可能存在不良反应;荚膜多糖的血清型众多,制备的疫苗易出现无效保护。肺炎克雷伯菌表面的荚膜、脂多糖、菌毛蛋白、外膜蛋白(Outer membrane proteins, KpOmp)等具有一定的免疫原性,可用于疫苗研发[5]。其外膜蛋白或菌毛蛋白在各菌株之间非常保守,具备广谱保护潜力,用于制备蛋白疫苗成分单一,副作用小。肺炎克雷伯菌外膜蛋白为该菌细胞膜的主要成分,主要包括KpOmpA、KpOmpK17、KpOmpK35、KpOmpK36和KpOmpK37等,参与物质转运、信号传导、粘附、增强毒力和阻碍抗菌药物进入等生理活动,在感染宿主和诱导免疫反应中起重要作用[12-14]。其中,OmpA在肠杆菌科中高度保守,具有介导细菌对真核细胞的粘附和侵袭[15-16]以及抵抗血清补体的杀伤能力[17]。此外,KpOmpA作为病原相关分子模式(Pathogen-associated Molecular Patterns, PAMP),能被先天免疫系统识别从而清除肺炎克雷伯菌的感染[18]。研究表明,KpOmpA可增强肺炎链球菌(Streptococcus pneumoniae)多糖免疫原性,并保护小鼠抵御细菌的攻击[19]。Kurupati等[20]应用含有KpOmpA基因的DNA疫苗接种小鼠,可以诱导其产生抗体,并表现出良好的攻毒保护率。这些研究结果为应用KpOmpA作为疫苗的候选分子预防黄喉拟水龟肺炎克雷伯菌病提供借鉴。【本研究切入点】目前肺炎克雷伯菌疫苗的研究主要针对哺乳动物与人类,而黄喉拟水龟抗肺炎克雷伯菌的相关疫苗研究缺乏,表达纯化KpOmpA对研发肺炎克雷伯菌疫苗具有重要意义。【拟解决的关键问题】本研究克隆黄喉拟水龟肺炎克雷伯菌KpOmpA基因,构建重组质粒并诱导其表达,纯化获取重组蛋白KpOmpA,可为黄喉拟水龟抗肺炎克雷伯菌相关疫苗的研发提供依据。
1 材料与方法 1.1 试验材料黄喉拟水龟源肺炎克雷伯菌GXNN1菌株、大肠杆菌TOP10、BL21(DE3) 感受态细胞及pET-32a表达载体由广西大学动物科学技术学院水产免疫病害实验室保存。限制性内切酶(EcoR Ⅰ、Xho Ⅰ)和T4 DNA连接酶购自TaKaRa(宝日医生物技术有限公司);PCR产物胶回收试剂盒、质粒抽提试剂盒、蛋白分子量标准、SDS-PAGE凝胶制备试剂、Ni-IDA琼脂糖纯化树脂柱以及PVDF膜均购自生工生物工程(上海)股份有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、苯甲磺酰氟(PMSF)、脱脂奶粉以及ECL超敏发光液均购自北京索莱宝科技有限公司;小鼠抗His-tag单克隆抗体和辣根过氧化物酶标记的山羊抗小鼠IgG抗体购自上海碧云天生物技术有限公司。
1.2 试验方法1.2.1 KpOmpA基因扩增、序列分析与原核表达载体的构建 根据KpOmpA基因序列(NCBI登录号:KP728941.1),设计带酶切位点引物。上游引物(划线部分为EcoR Ⅰ酶切位点):5'-CCGGAATTCATGAAAAAGACAGCTATCGC-3',下游引物(划线部分为Xho Ⅰ酶切位点):5'-CCGCTCGAGTTAAGCCGCCGGCTGAGTTA-3'。以黄喉拟水龟源肺炎克雷伯菌DNA作为模板扩增KpOmpA基因,PCR扩增程序为:94 ℃ 4 min;94 ℃ 30 s、68 ℃ 30 s、72 ℃ 90 s,35个循环, ;72 ℃ 10 min。PCR产物按照胶回收试剂盒说明书进行目的片段纯化并由生工生物工程(上海)股份有限公司测序。应用SeqMan软件拼接测序序列,在线BLAST搜索同源氨基酸序列,运用MegAlign软件对氨基酸序列进行多重比对和同源性分析。
运用EcoR Ⅰ、Xho Ⅰ对pET-32a空载体和目的片段进行双酶切,将纯化后的双酶切产物用T4连接酶于16 ℃下连接8 h(目的片段︰载体的摩尔比为3 ︰ 1),连接产物转化到大肠杆菌TOP10感受态细胞中,于37 ℃下摇床(220 r/min)震荡培养3 h后将菌液涂板于含氨苄的固体培养基,37 ℃培养14~16 h。挑选单克隆进行阳性检测,引物选用通用引物(T7、T7ter),将阳性克隆菌液进行扩大培养后抽提重组质粒pET-32a-KpOmpA,双酶切鉴定后送去生工生物工程(上海)股份有限公司测序。
1.2.2 重组蛋白表达和可溶性鉴定 重组质粒pET-32a-KpOmpA转化至BL21(DE3) 感受态细胞中,挑选单克隆接种至含100 μg/mL氨苄的10 mL LB培养基中,37 ℃过夜培养。取过夜培养的菌液按照1 ︰ 100接种于含氨苄的10 mL LB培养基中,37 ℃振荡培养3 h。当菌液OD600约为0.6时,取出1 mL作为对照,剩余菌液加入IPTG使终浓度为1 mmol/L,37 ℃诱导4 h后取1 mL菌液进行SDS-PAGE检测。
为确定重组蛋白的可溶性,取8 mL诱导后的菌液以10 000 g离心3 min收集菌体并称重。每克湿重菌体加入10 mL pH为8.0的细菌裂解液(50 mmol/L Tris HCl、500 mmol/L NaCl、0.1 mmol/L PMSF、1 mg/mL溶菌酶、5 mmol/L EDTA)进行重悬,于冰上进行超声破碎细胞30 min(30 W,超声5 s,间歇8 s),4 ℃ 10 000 g离心收集上清和沉淀进行SDS-PAGE检测。
1.2.3 重组蛋白纯化 为纯化KpOmpA重组蛋白,扩大培养转化后的BL21重组菌,诱导表达、收集菌体、超声破碎及收集沉淀(包涵体)方法见1.2.2。收集沉淀后,为了去除少量脂类、核酸和其他杂蛋白等,应用10 mL洗涤液A(50 mmol/L Tris HCl、500 mmol/L NaCl、2% Tween-20和2 mol/L尿素)洗涤沉淀,涡旋震荡,4 ℃ 9 000 g离心10 min,收集沉淀并重复操作3次;应用10 mL洗涤液B(50 mmol/L Tris HCl和500 mmol/L NaCl)洗涤沉淀,去除样品中的EDTA,4 ℃ 9 000 g离心10 min,收集沉淀并重复操作3次;加入10 mL结合缓冲液(20 mmol/L Tris HCl、500 mmol/L NaCl、20 mmol/L咪唑、1 mmol/L β-巯基乙醇和8 mol/L尿素),应用磁力搅拌器于4 ℃下溶解包涵体8 h。将上述液体以4 ℃ 10 000 g离心10 min后收集上清,上清流经Ni-IDA琼脂糖纯化树脂柱,收集过柱液。分别用4 mL不同浓度(5、10、25、50 mmol/L)的咪唑溶液洗脱Ni-IDA琼脂糖纯化树脂柱,分别收集各过柱液,通过SDS-PAGE检测分析。
1.2.4 Western blot鉴定重组蛋白 纯化后的重组蛋白经SDS-PAGE电泳后,通过WIX迷你转印仪将样品转至经TBST漂洗的PVDF膜,室温下用5% 脱脂奶粉封闭2 h,加入小鼠抗His-tag单克隆抗体(1 ︰ 3 000),在4 ℃下孵育过夜。之后用TBST洗膜3次(8 min/次),再加入辣根过氧化物酶标记的山羊抗小鼠IgG抗体(1 ︰ 2 000),在室温下孵育1 h后再次用TBST洗膜3次(8 min/次),避光滴加8~10滴ECL超敏发光液于膜表面,用ImageQuant LAS 500成像仪拍照。
2 结果与分析 2.1 KpOmpA基因扩增、序列分析及原核表达质粒的构建与鉴定KpOmpA的PCR扩增产物经1% 琼脂糖凝胶电泳分析,在1 000 bp附近出现电泳条带,与预期结果相符(图 1)。测序结果表明,该基因CDS序列大小为1 071 bp,推定编码356个氨基酸。将本研究的龟源KpOmpA与牛源KpOmpA(GenBank登录号:AKN20218.1)、人源KpOmpA(GenBank登录号:MCM5720863.1)的氨基酸序列进行多重比对(图 2),结果表明KpOmpA氨基酸序列高度保守,同源性分别为99.4% 和99.7%。
|
| M:DNA Marker;1:PCR 扩增片段 M: DNA Marker; 1: PCR amplification fragment 图 1 KpOmpA基因的PCR扩增产物电泳结果 Fig. 1 Electrophoresis result of PCR amplification products of KpOmpA gene |

|
| 图 2 不同来源KpOmpA的氨基酸序列比对 Fig. 2 Alignment of amino acid sequences of KpOmpA from different sources |
重组质粒pET-32a-KpOmpA经EcoR Ⅰ和Xho Ⅰ双酶切,酶切产物电泳后出现两条电泳带(图 3)。DNA测序结果证实,pET-32a-KpOmpA包含KpOmpA基因,且基因序列和阅读框正确,表明重组质粒pET-32a-KpOmpA构建成功。

|
| M:DNA Marker;1:双酶切结果 M: DNA Marker; 1: Result of double enzyme digestion 图 3 双酶切鉴定重组质粒pET-32a-KpOmpA Fig. 3 Identification of recombinant plasmid pET-32a-KpOmpA by double enzyme digestion |
2.2 重组蛋白表达和可溶性鉴定
将构建好的质粒pET-32a-KpOmpA转化至大肠杆菌BL21感受态细胞,IPTG诱导蛋白表达,SDS-PAGE检测发现,经诱导的样品在57 kD处出现明显条带,与预期结果相符。诱导后经超声破碎,对上清和沉淀进行SDS-PAGE检测,结果显示,KpOmpA重组蛋白在沉淀中含量高,以包涵体的形式存在(图 4)。
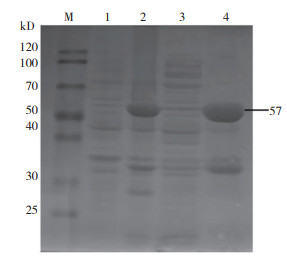
|
| M:蛋白 Marker;1:未诱导的 pET-32a-KpOmpA;2:IPTG诱导的 pET-32a-KpOmpA;3:上清;4:沉淀 M: Protein marker; 1: Uninduced pET-32a-KpOmpA; 2: pET-32a-KpOmpA induced by IPTG; 3: Supernatant; 4: Sediment 图 4 KpOmpA重组蛋白的诱导表达与可溶性分析 Fig. 4 Analysis of induced expression and dissolubility of KpOmpA recombinant protein |
2.3 重组蛋白纯化
目的蛋白在大肠杆菌BL21感受态细胞诱导表达后,利用Ni-IDA琼脂糖纯化树脂柱进行过柱,用不同浓度的咪唑洗脱缓冲液进行梯度洗脱,并将收集的样品进行SDS-PAGE检测。结果显示,用5、10 mmol/L咪唑洗脱缓冲液能洗脱大量杂蛋白并收集到较纯的重组蛋白KpOmpA(图 5)。

|
| M:蛋白 Marker;1~4:分别为5、10、25、50 mmol/L 咪唑洗脱液 M: Protein marker; 1-4: 5, 10, 25, 50 mmol/L imidazole eluate, respectivety 图 5 KpOmpA重组蛋白的纯化 Fig. 5 Purification of KpOmpA recombinant protein |
2.4 Western blot鉴定重组蛋白
纯化的蛋白样品经SDS-PAGE电泳后转至PVDF膜进行Western blot鉴定。结果(图 6)显示,57 kD处有明显的条带,与重组蛋白的大小一致,证明重组蛋白成功表达。

|
| M:蛋白 Marker;1:纯化的KpOmpA重组蛋白 M: Protein marker; 1: Purified KpOmpA recombinant protein 图 6 KpOmpA重组蛋白的Western blot鉴定 Fig. 6 Western blot identification of KpOmpA recombinant protein |
3 讨论
肺炎克雷伯菌隶属于肠杆菌科(Enterobacteria-ceae)克雷伯菌属,是一种具有包膜、兼性厌氧等特性的革兰氏阴性菌[21],主要感染人和动物的消化道、呼吸道和泌尿生殖道等。近年来主要以抗生素防治该菌引起的疫病[22],然而抗生素的滥用导致肺炎克雷伯菌耐药性加强,该菌逐渐威胁黄喉拟水龟养殖业的安全生产[23]。接种疫苗是控制疫病的有效措施,KpOmpA已被证实具有较好的免疫原性[20],且序列高度保守,可作为疫苗研制的候选靶标基因,因此本研究表达纯化KpOmpA蛋白为肺炎克雷伯菌疫苗制备提供参考。
3.1 原核表达系统与真核表达系统比较,大肠杆菌原核表达系统具有背景清晰、操作便捷和成本低廉等优点[24-25],因此被广泛用于蛋白表达。pET系统为大肠杆菌中克隆和表达重组蛋白最强大的系统之一,最初由Dubendorff等[26]利用该系统表达外源基因,随后许多研究也使用其表达外源目的基因[27-28]。pET-32a表达载体除具有pET系列高效表达重组蛋白的特性外,还具备His-Tag,便于重组蛋白的检测与纯化。本研究成功构建pET-32a-KpOmpA表达质粒,并转化大肠杆菌BL21感受态细胞,经IPTG诱导,重组蛋白KpOmpA高效表达,表明pET-32a适合表达KpOmpA。研究表明,用pET系列表达的重组蛋白免疫哺乳类[28]、鱼类[29]以及禽类[30],均表现出良好的免疫保护力,这些研究结果验证了pET系统可用于疫苗研制。
3.2 重组蛋白KpOmpA的存在形式重组蛋白在37℃、IPTG诱导的条件下高效表达,产物大量堆积,蛋白质因未能进行正确折叠与二硫键配对而形成包涵体沉淀[31]。包涵体为稳定的蛋白质聚集体,具有高密度、高纯度和蛋白不易降解的优点,但也存在一些局限性,如折叠错误、不具备生物活性、复性程序较复杂等。包涵体中的重组蛋白含量一般为50% 以上,其余成分主要为核酸、脂多糖、肽聚糖和其他杂蛋白等[32],纯化前通常需要洗涤分离去除杂质。本研究可溶性分析结果显示,重组蛋白KpOmpA主要存在于沉淀中,以包涵体形式存在,经Ni-IDA琼脂糖纯化树脂柱纯化后获得较高纯度的重组蛋白。由于重组蛋白错误折叠形成包涵体,其不具有天然结构而失去生物活性,为制备疫苗后续需进行复性实验以恢复其活性[33]。
4 结论本研究克隆黄喉拟水龟肺炎克雷伯菌外膜蛋白A基因KpOmpA,构建pET-32a-KpOmpA原核表达载体,经双酶切鉴定、测序确认基因序列,重组质粒成功构建,将其转化大肠杆菌BL21(DE3)感受态细胞,经IPTG诱导表达得到分子量约为57 kD的重组蛋白,并对该重组蛋白进行了可溶性分析,结果表明KpOmpA重组蛋白以包涵体形式存在。为去除其含有的少量脂类、核酸和其他杂蛋白等杂质,对其进行分离洗涤后使用Ni-IDA琼脂糖纯化树脂柱进行纯化,最终收集到较高纯度的KpOmpA重组蛋白。Western blot鉴定结果表明,该重组蛋白可被小鼠抗His-tag单克隆抗体识别,证实重组蛋白正确表达。
| [1] |
牟超盛, 齐旭明, 钱天宇, 周正彦, 莫燕妮, 李丕鹏. 黄喉拟水龟人工养殖技术现状及产业发展对策[J]. 水产养殖, 2021, 42(1): 1-4. DOI:10.3969/j.issn.1004-2091.2021.01.001 MOU C S, QI X M, QIAN T Y, ZHOU Z Y, MO Y N, LI P P. Current status and development countermeasures for culture industry of Asian Yellow Pond Turtle (Mauremys mutica)[J]. Journal of Aquaculture, 2021, 42(1): 1-4. DOI:10.3969/j.issn.1004-2091.2021.01.001 |
| [2] |
陆专灵, 钟一治, 赵忠添, 雷燕, 韦友传, 张益峰. 黄喉拟水龟白眼病病原菌分离鉴定及药敏试验[J]. 南方农业学报, 2016, 47(11): 1974-1978. DOI:10.3969/j:issn.2095-1191.2016.11.1974 LU Z L, ZHONG Y Z, ZHAO Z T, LEI Y, WEI Y C, ZHANG Y F. Isolation, identification and drug sensitivity test of pathogen causing withe eye disease of Mauremys mutica[J]. Journal of Southern Agriculture, 2016, 47(11): 1974-1978. DOI:10.3969/j:issn.2095-1191.2016.11.1974 |
| [3] |
胡舒, 黎江, 徐腾, 谢业扬, 雷坤, 王邦杰, 陆专灵, 韦友传. 黄喉拟水龟肺气肿病病原菌的分离鉴定及其药敏特性分析[J]. 南方农业学报, 2018, 49(12): 2566-2572. DOI:10.3969/j.issn.2095-1191.2018.12.31 HU S, LI J, XU T, XIE Y Y, LEI K, WANG B J, LU Z L, WEI Y C. Isolation, identification and antibiotic sensitivity of pathogenic bacteria causing pulmonary emphysema from Mauremys mutica[J]. Journal of Southern Agriculture, 2018, 49(12): 2566-2572. DOI:10.3969/j.issn.2095-1191.2018.12.31 |
| [4] |
CLEGG S, MURPHY C N. Epidemiology and virulence of Klebsiella pneumoniae[J]. Microbiology Spectrum, 2016, 4(1). DOI:10.1128/microbiolspec.UTI-0005-2012 |
| [5] |
吴广喜, 石学银, 何斌. 肺炎克雷伯菌疫苗的研制进展[J]. 上海交通大学学报(医学版), 2018, 38(4): 458-462. DOI:10.3969/j.issn.1674-8115.2018.04.020 WU G X, SHI X Y, HE B. Development of vaccines for prevention of Klebsiella pneumoniae[J]. Journal of Shanghai Jiaotong University (Medical Science), 2018, 38(4): 458-462. DOI:10.3969/j.issn.1674-8115.2018.04.020 |
| [6] |
程家海, 殷娟斌, 白珊泽, 田泽暘, 庞红红, 包世俊. 肺炎克雷伯菌榆中分离株OmpK17基因的克隆、生物信息学分析及免疫原性研究[J]. 中国畜牧兽医, 2019, 46(5): 1456-1465. DOI:10.16431/j.cnki.1671-7236.2019.05.024 CHENG J H, YIN J B, BAI S Z, TIAN Z Y, PANG H H, BAO S J. Cloning, bioinformatics and immunogenicity analysis of OmpK17 gene of Klebsiella pneumoniae YZ strain[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(5): 1456-1465. DOI:10.16431/j.cnki.1671-7236.2019.05.024 |
| [7] |
潘苑霞, 王文基, 陈庆涛, 呼高伟. 1株大黄鱼源肺炎克雷伯菌的分离鉴定与致病性分析[J]. 水产科学, 2023, 42(2): 268-278. DOI:10.16378/j.cnki.1003-1111.21041 PAN Y X, WANG W J, CHEN Q T, HU G W. Isolation, identification, and pathogenic analysis of Klebsiella pneumoniae from Large Yellow Croak[J]. Fisheries Science, 2023, 42(2): 268-278. DOI:10.16378/j.cnki.1003-1111.21041 |
| [8] |
付霞丽, 郑紫方, 肖书奇, 李爽. 一株猪源肺炎克雷伯菌的分离与鉴定[J]. 中国兽医科学, 2021, 51(8): 999-1006. DOI:10.16656/j.issn.1673-4696.2021.0140 FU X L, ZHENG Z F, XIAO S Q, LI S. Isolation and identification of Klebsiella pneumoniae from swine[J]. Chinese Veterinary Science, 2021, 51(8): 999-1006. DOI:10.16656/j.issn.1673-4696.2021.0140 |
| [9] |
孙国荣, 马少鸿, 韦光本, 张依琳, 谭慧明, 蔡双虎. 哈维氏弧菌glyA基因的克隆及原核表达分析[J]. 广东农业科学, 2020, 47(6): 84-90. DOI:10.16768/j.issn.1004-874X.2020.06.012 SUN G R, MA S H, WEI G B, ZHANG Y L, TAN H M, CAI S H. Cloning and prokaryotic expression analysis of glyA gene of Vibrio harveyi[J]. Guangdong Agricultural Sciences, 2020, 47(6): 84-90. DOI:10.16768/j.issn.1004-874X.2020.06.012 |
| [10] |
GHATTAS M, DWIVEDI G, LAVERTU M, ALAMEH M G. Vaccine technologies and platforms for infectious diseases: Current progress, challenges, and opportunities[J]. Vaccines (Basel), 2021, 9(12): 1490. DOI:10.3390/vaccines9121490 |
| [11] |
张璞, 陈建凯, 赖月辉, 林德锐, 李复坤, 周晓敏, 侯高伟, 齐冬梅. 猪瘟病毒检测和猪瘟疫苗研究进展[J]. 广东农业科学, 2022, 49(4): 106-115. DOI:10.16768/j.issn.1004-874X.2022.04.013 ZHANG P, CHEN J K, LAI Y H, LIN D R, LI F K, ZHOU X M, HOU G W, QI D M. Research progress in classical swine fever virus detection and classical swine fever vaccines[J]. Guangdong Agricultural Sciences, 2022, 49(4): 106-115. DOI:10.16768/j.issn.1004-874X.2022.04.013 |
| [12] |
ZHU J, WANG T, CHEN L, DU H. Virulence factors in Hypervirulent Klebsiella pneumoniae[J]. Fronties in Microbiology, 2021, 12: 642484. DOI:10.3389/fmicb.2021.642484 |
| [13] |
LI B, ZHAO Y L, LIU C T, CHEN Z H, ZHOU D S. Molecular pathogenesis of Klebsiella pneumoniae[J]. Future Microbiology, 2014, 9(9): 1071-1081. DOI:10.2217/fmb.14.48 |
| [14] |
鱼艳荣, 刘希成, 张彦明, 王晶钰. 革兰氏阴性菌外膜蛋白研究进展[J]. 动物医学进展, 2000(2): 35-39. DOI:10.16437/j.cnki.1007-5038.2000.02.009 YU Y R, LIU X C, ZHANG Y M, WANG J Y. Research progress of outer membrane protein vaccine of fish gram-negative pathogenic bacteria[J]. Progress in Veterinary Medicine, 2000(2): 35-39. DOI:10.16437/j.cnki.1007-5038.2000.02.009 |
| [15] |
GUAN Q, BHOWMICK B, UPADHYAY A, HAN Q. Structure and functions of bacterial outer membrane protein A, A potential therapeutic target for bacterial infection[J]. Current Topics in Medicinal Chemistry, 2021, 21(13): 1129-1138. DOI:10.2174/1568026621666210705164319 |
| [16] |
NIE D, HU Y, CHEN Z, LI M K, HOU Z, LUO X X, MAO X G, XUE X Y. Outer membrane protein A (OmpA) as a potential therapeutic target for Acinetobacter baumannii infection[J]. Journal of Biomedical Science, 2020, 27(1): 26. DOI:10.1186/s12929-020-0617-7 |
| [17] |
PRASADARAO N V, BLOM A M, VILLOUTREIX B O, LINSANGAN L C. A novel interaction of outer membrane protein A with C4b binding protein mediates serum resistance of Escherichia coli K1[J]. The Journal of Immunology, 2002, 169(11): 6352-6360. DOI:10.4049/jimmunol.169.11.6352 |
| [18] |
JEANNIN P, MAGISTRELLI G, GOETSCH L, HAEUW J F, THIEBLEMONT N, BONNEFOY J Y, DELNESTE Y. Outer membrane protein A (OmpA): a new pathogen-associated molecular pattern that interacts with antigen presenting cells-impact on vaccine strategies[J]. Vaccine, 2002, 20: A23-A27. DOI:10.1016/s0264-410x(2)00383-3 |
| [19] |
LIBON C, HAEUW J F, CROUZET F, MUGNIER C, BONNEFOY J Y, BECK A, CORVAIA N. Streptococcus pneumoniae polysaccharides conjugated to the outer membrane protein A from Klebsiella pneumoniae elicit protective antibodies[J]. Vaccine, 2002, 20(17/18): 2174-2180. DOI:10.1016/s0264-410x(2)00149-4 |
| [20] |
KURUPATI P, RAMACHANDRAN N P, POH C L. Protective efficacy of DNA vaccines encoding outer membrane protein A and OmpK36 of Klebsiella pneumoniae in mice[J]. Clinical and Vaccine Immunology, 2011, 18(1): 82-88. DOI:10.1128/CVI.00275-10 |
| [21] |
BENGOECHEA J A, PESSOA J S. Klebsiella pneumoniae infection biology: living to counteract host defences[J]. Fems Microbiology Reviews, 2019, 43(2): 123-144. DOI:10.1093/femsre/fuy043 |
| [22] |
马永驰. 肺炎克雷伯菌耐药研究进展[J]. 中国卫生标准管理, 2020, 11(19): 166-168. DOI:10.3969/j.issn.1674-9316.2020.19.066 MA Y C. Research progress on Klebsiella pneumoniae resistance[J]. China Health Standard Management, 2020, 11(19): 166-168. DOI:10.3969/j.issn.1674-9316.2020.19.066 |
| [23] |
陶锦华, 李康然, 韦平. 石龟肺炎克雷伯氏菌感染的诊断与防治[J]. 广西畜牧兽医, 2002(6): 20-21. DOI:10.3969/j.issn.1002-5235.2002.06.011 TAO J H, LI K R, WEI P. Diagnosis and prevention of Klebsiella pneumonia infection in stone turtle[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine, 2002(6): 20-21. DOI:10.3969/j.issn.1002-5235.2002.06.011 |
| [24] |
解庭波. 大肠杆菌表达系统的研究进展[J]. 长江大学学报(自科版)医学卷, 2008(3): 77-82. DOI:10.3969/j.issn.1673-1409-B.2008.03.034 XIE T B. Research progress of Escherichia coli expression system[J]. Journal of Yangtze University (Natural Science Edition), 2008(3): 77-82. DOI:10.3969/j.issn.1673-1409-B.2008.03.034 |
| [25] |
杨萌, 高爽爽, 谢业扬, 段家文, 陆专灵, 韦友传. 卵形鲳鲹JAK3蛋白的原核表达与纯化[J]. 广东农业科学, 2020, 47(1): 137-142. DOI:10.16768/j.issn.1004-874X.2020.01.019 YANG M, GAO S S, XIE Y Y, DUAN J W, LU Z L, WEI Y C. Prokaryotic expression and purification of JAK3 protein in golden pompano (Trachinotus ovatus)[J]. Guangdong Agricultural Sciences, 2020, 47(1): 137-142. DOI:10.16768/j.issn.1004-874X.2020.01.019 |
| [26] |
DUBENDORFF J W, STUDIER F W. Controlling basal expression in an inducible T7 expression system by blocking the target T7 promoter with lac repressor[J]. Journal of Molecular Biology, 1991, 219(1): 45-59. DOI:10.1016/0022-2836(91)90856-2 |
| [27] |
DOBRIJEVIC D, NEMATOLLAHI L A, HAILES H C, WARD J M. pET expression vector customized for efficient seamless cloning[J]. Biotechniques, 2020, 69(5): 384-387. DOI:10.2144/btn-2020-0101 |
| [28] |
LI G, WUBSHET A K, DING Y, LI Q, DAI J, WANG Y, HOU Q, CHEN J, MA B, SZCZOTKA-BOCHNIARZ A, SZATHMARY S, ZHANG Y, ZHANG J. Antigenicity and immunogenicity analysis of the E. coli expressed FMDV structural proteins: VP1, VP0, VP3 of the South African territories type 2 virus[J]. Viruses, 2021, 13(6). DOI:10.3390/v13061005 |
| [29] |
SILVARAJ S, MD YASIN I S, Karim M M A, SAAD M Z. Elucidating the efficacy of vaccination against vibriosis in lates calcarifer using two recombinant protein vaccines containing the outer membrane protein K (r-OmpK) of Vibrio alginolyticus and the DNA chaperone J (r-DnaJ) of Vibrio harveyi[J]. Vaccines (Basel), 2020, 8(4): 660. DOI:10.3390/vaccines8040660 |
| [30] |
GUO X, SUN W, WEI L, WANG X, ZOU Y, ZHANG Y, LI S, WANG N, JIANG M, ZHAO H, QU E, PANG Y, YIN J, REN G. Development and evaluation of a recombinant VP2 neutralizing epitope antigen vaccine candidate for infectious bursal disease virus[J]. Transbound and Emerging Diseases, 2021, 68(6): 3658-3675. DOI:10.1111/tbed.13974 |
| [31] |
包义风, 应莲芳, 蒋琳. 包涵体蛋白复性技术研究进展[J]. 微生物学免疫学进展, 2012, 40(2): 84-88. DOI:10.13309/j.cnki.pmi.2012.02.007 BAO Y F, YING L F, JIANG L. Research progress in renaturation of inclusion body protein[J]. Prog ress in Microbiology and Immunology, 2012, 40(2): 84-88. DOI:10.13309/j.cnki.pmi.2012.02.007 |
| [32] |
CARRIO M M, VILLAVERDE A. Construction and deconstruction of bacterial inclusion bodies[J]. Journal of Biotechnology, 2002, 96(1): 3-12. DOI:10.1016/s0168-1656(2)00032-9 |
| [33] |
郦钰超, 李佳萌, 沈万鹏, 吴帆, 王弼君, 李玉萍, 宗利强, 庄素素, 李越希. VZV外膜蛋白E胞外区的原核表达及其免疫特性研究[J]. 药物生物技术, 2020, 27(3): 189-194. DOI:10.19526/j.cnki.1005-8915.20200301 LI Y C, LI J M, SHEN W P, WU F, WANG B J, LI Y P, ZONG L Q, ZHUANG S S, LI Y X. Prokaryotic expression of VZV outer membrane protein E extracellular domain and study of immune characteristics[J]. Pharmaceutical Biotechnology, 2020, 27(3): 189-194. DOI:10.19526/j.cnki.1005-8915.20200301 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50