文章信息
基金项目
- 嘉应学院大学生创新创业训练项目(嘉院校办〔2021〕20号);广东省驻镇帮镇扶村农村科技特派员项目(KTP20210218);广东省重点建设学科科研能力提升项目(2022ZDJS088);湛江市科技计划项目(2020A04008)
作者简介
- 李威娜(1984—),女,硕士,实验师,研究方向为动物营养与资源保护,E-mail: tlwn712@jyu.edu.cn.
通讯作者
- 黄勋和(1982—),男,博士,副教授,研究方向为特色禽类资源保护与利用,E-mail:hxh826@jyu.edu.cn.
文章历史
- 收稿日期:2023-02-24
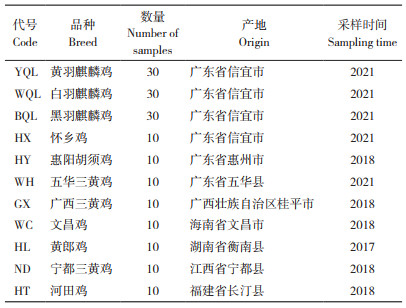
2. 广东省山区特色农业资源保护与精准利用重点实验室,广东 梅州 514015;
3. 广东省五华三黄鸡科技创新中心,广东 梅州 514015
2. Guangdong Key Laboratory of Conservation and Precision Utilization of Characteristic Agricultural Resources in Mountainous Areas, Meizhou 514015, China;
3. Guangdong Science and Technology Innovation Centre of Wuhua Yellow Chicken, Meizhou 514015, China
【研究意义】麒麟鸡,又称粤西卷羽鸡、翻毛鸡,是产于我国大陆最南端粤西一带的特色畜禽品种资源,具有悠久的饲养历史[1-3]。但麒麟鸡因长期没有受到必要的保护而几近灭绝。全面摸查麒麟鸡保种群体的遗传多样性水平和品种,对该品种资源的保护和利用具有重要的科学价值。【前人研究进展】线粒体DNA(mtDNA)D-loop因突变速率快、无重组、含量高等特点,被广泛应用于家鸡遗传资源评估和历史追溯[4]。基于mtDNA D-loop序列研究表明,五华三黄鸡保种群具有较高的遗传多样性水平,品种的形成可能受北方家鸡南迁的影响[5];广东省黄鸡保持较高的遗传多样性水平,品种的形成受到邻省、北方家鸡和东南亚红原鸡的影响[6]。对华东地区11个地方鸡品种的遗传多样性和母系起源进行研究,检测出欧美高产品系的遗传渗入信号[7]。黄勋和等[8]基于mtDNA D-loop序列评估了我国南方28个黄鸡地方品种的遗传多样性水平,结果表明黄鸡地方品种存在杂交现象,群体经历了历史扩张,提示东南亚和我国西南地区的家鸡对我国南方黄鸡地方品种的形成有一定的遗传贡献。麒麟鸡是粤西一带的特色品种,为保护这一珍稀地方品种资源,2011年起广东海洋大学对其开展了系统研究,全面摸清了麒麟鸡的生物学特性[9-11],阐明了麒麟鸡卷羽性状的发育规律[12]、遗传规律[13],并揭示了卷羽性状独立的分子形成机制[14-15]。
【本研究切入点】目前已形成了以黄羽麒麟鸡为主体、白羽麒麟鸡和黑羽麒麟鸡为特色的资源保护群体。这3个资源群的主要区别在于羽色,黄羽麒麟鸡的羽毛为黄色,白羽麒麟鸡属于隐性白羽类型,黑羽麒麟鸡的羽毛为黑色,少部分有乌骨性状。本研究团队前期已利用mtDNA D-loop部分序列研究了黄羽麒麟鸡的遗传多样性,并探讨其遗传起源[16]。但目前黄羽麒麟鸡未与周边地方鸡品种进行遗传比较分析,白羽麒麟鸡和黑羽麒麟鸡的遗传多样性及其与周边地方鸡品种的亲缘关系也尚未明确。【拟解决的关键问题】本研究利用mtDNA D-loop全序列研究麒麟鸡3个资源群体的遗传多样性,探讨麒麟鸡与周边地方鸡品种的遗传关系,以揭示麒麟鸡的品种形成历史。
1 材料与方法 1.1 试验材料试验于2022年在广东省山区特色农业资源保护与精准利用重点实验室开展。90份麒麟鸡(来自黄羽、白羽、黑羽群体各30份)血液样品采自广东盈富农业发展有限公司,其他地方鸡血液样品来自当地保种场,各10份(表 1),均为母鸡样品。血液样品的基因组DNA提取采用HiPure Blood DNA Mini Kit试剂盒(广州美基生物科技有限公司)。
1.2 PCR扩增与序列测定
mtDNA D-loop全序列PCR扩增引物:L16750,5'-AGGACTACGGCTTGAAAAGC-3'[17];H1374,5'-TTTCACTGGGATGCGGATACT-3'[18]。PCR反应体系(30 μL)包括Premix Taq〔宝生物工程(大连)有限公司〕15 μL,正反向引物(20 μmol/L)各0.3 μL,模板DNA 1 μL,灭菌ddH2O 13.4 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s、58 ℃退火50 s、72 ℃延伸80 s,35个循环;72 ℃延伸7 min。目标条带经1.5% 琼脂糖凝胶电泳确认后,送生工生物工程(上海)股份有限公司进行双向测序。
1.3 序列分析测序序列用软件Bioedit[19]进行人工校对,以红原鸡mtDNA D-loop全序列(GenBank登录号:NC_007235)作为参考序列,采用MEGA 7.0[20]进行序列比对后,使用DnaSP 6.12[21]定义单倍型,提取变异位点,计算单倍型多样性、核苷酸多样性以及进行中性检验(Tajima's D和Fu's Fs检验)。通过NCBI BLAST功能(https://blast.ncbi.nlm.nih.gov/Blast.cgi)搜索与麒麟鸡单倍型完全匹配的中国地方鸡D-loop全序列。碱基组成分析和群体间的遗传距离(Kimura 2-parameter模型K2P)计算应用MEGA 7.0[20]完成。应用软件MitoToolPy(http://mitotool.kiz.ac.cn/)获取序列变异信息,然后将序列划入特定的单倍型类群[18, 22]。采用软件PopART 1.7[23]绘制麒麟鸡及其他8个地方鸡品种的mtDNA D-loop全序列中介网络图。
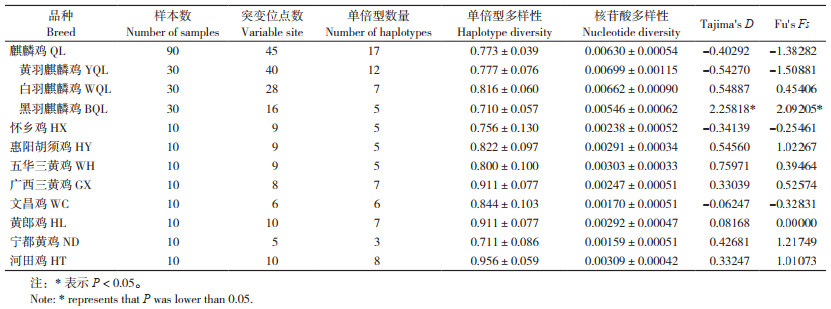
2 结果与分析 2.1 麒麟鸡遗传多样性分析麒麟鸡mtDNA D-loop全序列为1 231~1 232 bp,供试样本中有72个在核苷酸位置859处缺失碱基C。碱基T、C、G、A的平均含量分别为33.7%、26.5%、13.3%、26.5%,T+A的平均含量(60.2%)高于C+G的平均含量(39.8%)。通过90份麒麟鸡样品共检测到45个变异位点,占总分析位点的3.65%,其中多态位点43个、简约信息位点29个、单一位点突变14个。以红原鸡mtDNA序列NC_007235作为参考,在麒麟鸡45个变异位点中定义了17个单倍型,其中独享型单倍型9个、共享型单倍型8个(表 2)。黄羽麒麟鸡的单倍型数量最多(12个),白羽麒麟鸡次之(7个),黑羽麒麟鸡最少(5个)。在其他8个地方鸡品种中,共定义了19个单倍型,其中河田鸡的单倍型数量最多(8个),宁都黄鸡最少(3个),没有发现与麒麟鸡共享的单倍型。通过搜索中国家鸡D-loop全序列发现,与麒麟鸡单倍型2、3、8和14序列完全一致的地方鸡品种,主要有金湖乌骨鸡、竹乡鸡、略阳乌鸡、绿耳乌鸡、仙居鸡、崇仁麻鸡、白耳黄鸡、江边鸡、平铺麻黄鸡、藏鸡等(表 2)。

|
麒麟鸡总体单倍型多样性和核苷酸多样性分别为0.773±0.039和0.00630±0.00054(表 3)。3个麒麟鸡群体中,黄羽麒麟鸡遗传多样性最高,黑羽麒麟鸡最低。在麒麟鸡周边8个地方鸡品种中,河田鸡的遗传多样性最高,宁都黄鸡最低(表 3)。然而,麒麟鸡的核苷酸多样性明显高于其他8个地方鸡品种。中性检测结果显示,9个鸡种的检测值差异均不显著,但黑羽麒麟鸡的Fu's Fs和Tajima's D值均差异显著。
|
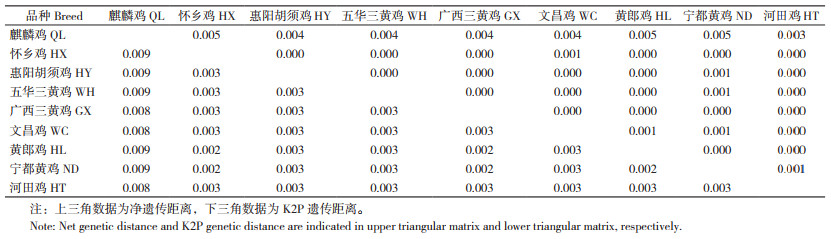
9个鸡品种间的K2P遗传距离介于0.002~0.009之间,麒麟鸡与其他8个地方鸡品种的遗传距离均大于其他8个地方鸡品种间的遗传距离;品种间的净遗传距离为0~0.005,麒麟鸡与8个地方鸡品种的净遗传距离均大于其他8个地方鸡品种间的净遗传距离(表 4)。
|
2.2 麒麟鸡遗传进化分析
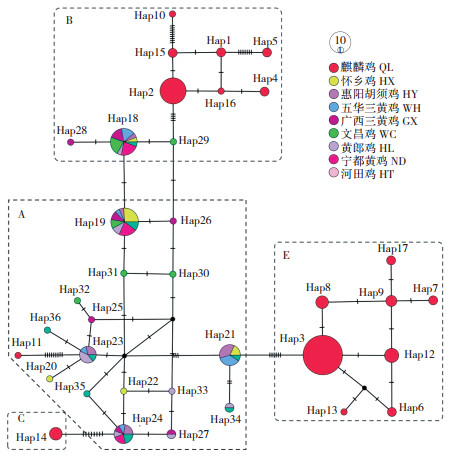
以麒麟鸡和8个地方鸡品种的mtDNA D-loop全序列构建中介网络图(图 1),36个单倍型可划分为单倍型类群A、B、C和E,其中A、B、E是优势单倍型类群,C只有1个单倍型。麒麟鸡独享17个单倍型,归属于单倍型类群A、B、C和E,频率分别为1.1%(1/90)、30.0%(27/90)、4.4%(4/90)和64.4%(58/90),B和E为优势单倍型类群;黄羽麒麟鸡和白羽麒麟鸡独享单倍型最多,各4个。其他8个地方鸡品种共有19个单倍型,归属于单倍型类群A和B,频率分别为75.0%(60/80)和25.0%(20/80),其中12个为单个品种的独享单倍型,文昌鸡占4个。
|
| 图 1 麒麟鸡和8个地方鸡品种mtDNA D-loop单倍型的中介网络图 Fig. 1 Median network of mtDNA D-loop haplotypes of Qilin chicken and 8 indigenous chicken breeds |
3 讨论
mtDNA D-loop全序列分析表明,总体上麒麟鸡保持相对较高的遗传多样性水平,核苷酸多态性明显高于本研究供试的其他8个地方鸡品种,也高于江西、浙江、山东等地方鸡的核苷酸多态性[7],这可能与其尚未开展系统选育有关。麒麟鸡有着1 000多年的饲养历史,但长期未受到足够重视,2011年起由广东海洋大学研究团队开始了较为系统的研究,同步开展了麒麟鸡提纯复壮和初步选育。在选育过程中,出现了部分白羽和黑羽的麒麟鸡后代,在此基础上逐步扩大白羽和黑羽麒麟鸡群体数量,形成了以黄羽麒麟鸡为主体、白羽麒麟鸡和黑羽麒麟鸡为特色的资源群体。麒麟鸡3个资源群体的遗传多样性与其群体数量呈正相关,黑羽麒麟鸡的群体数量最少,因此单倍型数量和核苷酸多态性均最低。与2016年有关麒麟鸡mtDNA D-loop部分核苷酸序列(1~524)遗传多样性[16]的研究结果相比较发现,黄羽麒麟鸡的单倍型多样性、核苷酸多样性分别为0.628±0.063和0.00859±0.00114,虽然单倍型多样性略有下降,但核苷酸多样性有所提高,说明黄羽麒麟鸡保种群体较为稳定。
地方品种的形成是自然环境和人文历史综合选择的结果[24]。虽然本研究供试的周边地方鸡品种样品较少,但麒麟鸡的17个单倍型全部为独享型,不与其他8个地方鸡品种共享,说明麒麟鸡具有相对独立的品种形成历史。麒麟鸡在粤西尤其在茂名一带备受民众喜爱,但在其他地区的销售量则有限。麒麟鸡的卷羽是不完全显性遗传性状[14-15],分为全卷和半卷两种类型,从外观上容易与片羽类型区分。从遗传距离可以看出,麒麟鸡与其他地方鸡的遗传交流较小,这可能是麒麟鸡保持独特性状和遗传特性的重要原因之一。在我国其他地区也有一些羽毛外翻的地方鸡,如贵州倒毛鸡[25]、湖南永顺倒毛鸡[26]、浙江开化翻毛鸡[27]、云南怒江翻毛鸡[28]等,均生长在我国南方地区,卷羽性状与其散热功能相吻合。这些卷毛鸡都是在本地鸡群体中发现少量卷羽个体后,经过扩群和本地选育而来,推测不同卷羽鸡品种的形成是独立事件。通过扩大比对范围发现,归属于单倍型类群B、C和E的4个麒麟鸡单倍型与国内部分地方鸡品种一致[18, 29],并且不少为乌骨鸡品种,这可能使部分麒麟鸡有乌骨性状,也说明了麒麟鸡是由本土品种选育而来。后续还需扩大样品收集范围,利用基因组重测序等分析技术以进一步研究麒麟鸡的品种形成历程。
根据线粒体基因组的划分方法,可将全球家鸡和原鸡划分为A~I和V~Z[18, 30-31]。特定的单倍型类群有特定的区域分布,如A、B和C在东亚家鸡是优势单倍型类群,D主要在东南亚和太平洋地区分布,E则全球广泛分布,G主要在我国西南家鸡中分布[8, 18, 31]。mtDNA D-loop全序列中介网络图将麒麟鸡划分为单倍型类群A、B、C和E,可认为麒麟鸡具有4个母系来源。我国地方鸡品种主要以B为优势单倍型类群[8],而麒麟鸡为E。值得注意的是,E在中快速型肉鸡以及高产蛋鸡中是绝对优势单倍型类群[32-33]。鉴于麒麟鸡体型明显大于其他地方鸡品种,麒麟鸡在品种形成过程中是否有外来血源渗入仍有待进一步研究。
4 结论本研究利用mtDNA D-loop控制区全序列对麒麟鸡进行遗传多样性分析,黄羽麒麟鸡、白羽麒麟鸡和黑羽麒麟鸡的单倍型多样性分别为0.777、0.816、0.710,核苷酸多样性分别为0.00699、0.00662、0.00546,其中黄羽麒麟鸡多样性最高,且核苷酸多态性明显高于周边8个地方鸡品种,表明保种效果良好。麒麟鸡有4个单倍型类群来源,且B和E是优势单倍型类群,而8个地方鸡品种单倍型类群主要为A和B,表明麒麟鸡保持相对较高的遗传多样性水平。麒麟鸡17个单倍型不与周边地方鸡品种共享,但4个单倍型与国内乌骨鸡等品种共享,这一发现佐证了该品种的遗传独特性,为麒麟鸡的品种形成研究提供了新视角。
| [1] |
齐豫生, 郭振海. 四库全书精编[M]. 北京: 中国文史出版社, 1999. QI Y S, GUO Z H. General catalogue of four repositories[M]. Beijing: Chinese Literature and History Publishing House, 1999. |
| [2] |
周去非, 杨武泉. 岭外校答代注[M]. 北京: 中华书局, 1999. ZHOU Q F, YANG W Q. Notes to the answers from beyond the mountains[M]. Beijing: Zhonghua Book Company, 1999. |
| [3] |
李时珍. 本草纲目[M]. 北京: 人民卫生出版社, 1982. LI S Z. Compendium of materia medica[M]. Beijing: People's Medical Publishing House, 1982. |
| [4] |
LAN D, HU Y D, ZHU Q, LIU Y P. Mitochondrial DNA study in domestic chicken[J]. Mitochondrial DNA Part A, 2017, 28: 25-29. DOI:10.3109/19401736.2015.1106526 |
| [5] |
黄勋和, 余哲琪, 翁茁先, 温金星, 李威娜, 钟鸣, 唐亚东, 钟福生. 基于线粒体DNA D-loop序列的五华三黄鸡遗传多样性及其品种起源研究[J]. 广东农业科学, 2017, 44(9): 106-113. DOI:10.16768/j.issn.1004-874X.2017.09.017 HUANG X H, YU Z Q, WENG Z X, WEN J X, LI W N, ZHONG M, TANG Y D, ZHONG F S. Genetic diversity and breed origin of Wuhua Yellow chicken inferred from mitochondrial DNA D-loop sequences[J]. Guangdong Agricultural Sciences, 2017, 44(9): 106-113. DOI:10.16768/j.issn.1004-874X.2017.09.017 |
| [6] |
黄勋和, 余哲琪, 翁茁先, 何丹林, 易振华, 李威娜, 陈洁波, 张细权, 杜炳旺, 钟福生. 广东省地方鸡线粒体遗传多样性与母系起源[J]. 生物多样性, 2018, 26(3): 238-247. DOI:10.17520/biods.2017259 HUANG X H, YU Z Q, WENG Z X, HE D L, YI Z H, LI W N, CHEN J B, ZHANG X Q, DU B W, ZHONG F S. Mitochondrial genetic diversity and maternal origin of Guangdong indigenous chickens[J]. Biodiversity Science, 2018, 26(3): 238-247. DOI:10.17520/biods.2017259 |
| [7] |
贾晓旭, 唐修君, 樊艳凤, 陆俊贤, 黄胜海, 葛庆联, 高玉时, 韩威. 华东地区地方鸡品种mtDNA控制区遗传多样性[J]. 生物多样性, 2017, 25(5): 540-548. DOI:10.17520/biods.2017012 JIA X X, TANG X J, FAN Y F, LU J X, HUANG S H, GE Q L, GAO Y S, HAN W. Genetic diversity of local chicken breeds in East China based on mitochondrial DNA D-loop region[J]. Biodiversity Science, 2017, 25(5): 540-548. DOI:10.17520/biods.2017012 |
| [8] |
黄勋和, 翁茁先, 李威娜, 王庆, 何丹林, 罗威, 张细权, 杜炳旺. 中国地方品种黄鸡线粒体DNA D-loop遗传多样性研究[J]. 中国农业科学, 2022, 55(22): 4526-4538. DOI:10.3864/j.issn.0578-1752.2022.22.016 HUANG X H, WENG Z X, LI W N, WANG Q, HE D L, LUO W, ZHANG X Q, DU B W. Genetic diversity of indigenous yellow-feathered chickens in southern China inferred from mitochondrial DNA D-loop region[J]. Scientia Agricultura Sinica, 2022, 55(22): 4526-4538. DOI:10.3864/j.issn.0578-1752.2022.22.016 |
| [9] |
陶林. 麒麟鸡(卷羽鸡)部分种质特性观察及其卷羽性状的分子机制初探[D]. 湛江: 广东海洋大学, 2014. TAO L. Parts of breed characters and molecular mechanism in frizzled feather of Kirin chicken[D]. Zhanjiang: Guangdong Ocean University, 2014. |
| [10] |
叶伟庆, 李东华, 宋春青, 胡咏琳, 魏阳, 杜炳旺. 黄羽麒麟鸡(卷羽鸡)体重与体尺性状指标主成分分析[J]. 广东农业科学, 2015, 42(3): 99-102. DOI:10.16768/j.issn.1004-874X.2015.03.030 YE W Q, LI D H, SONG C Q, HU Y L, WEI Y, DU B W. Principal component analysis of yellow-feathered Kirin chicken's body measurement traits and body weight[J]. Guangdong Agricultural Sciences, 2015, 42(3): 99-102. DOI:10.16768/j.issn.1004-874X.2015.03.030 |
| [11] |
曹长仁, 张丹明, 杜炳旺. 麒麟鸡与怀乡鸡0~16周龄生长曲线的拟合分析[J]. 广东农业科学, 2022, 49(8): 97-102. DOI:10.16768/j.issn.1004-874X.2022.08.012 CAO C R, ZHANG D M, DU B W. Fitting analysis of growth curves of frizzle chicken and Huaixiang chicken aged 0-16 weeks[J]. Guangdong Agricultural Sciences, 2022, 49(8): 97-102. DOI:10.16768/j.issn.1004-874X.2022.08.012 |
| [12] |
李艳青. 比较群体基因组学揭示家鸡卷羽性状的分子遗传机制[D]. 湛江: 广东海洋大学, 2017. LI Y Q. Comparative population genomics reveals the molecular genetic mechanism of frizzled feather traits in domestic chickens[D]. Zhanjiang: Guangdong 0cean University, 2017. |
| [13] |
董晶, 张权, 张丽, 李艳青, 李珊珊, 王章, 杜炳旺. 卷羽与半卷羽遗传特性分析及KRT75基因SNP位点检测[J]. 中国畜牧兽医, 2016, 43(11): 3003-3010. DOI:10.16431/j.cnki.1671-7236.2016.11.029 DONG J, ZHANG Q, ZHANG L, LI Y Q, LI S S, WANG Z, DU B W. Genetic characteristics of frizzled and imcomlete frizzled feather and SNP detection of KRT75 gene[J]. Chinese Animal Husbandry & Veterinary Medicine, 2016, 43(11): 3003-3010. DOI:10.16431/j.cnki.1671-7236.2016.11.029 |
| [14] |
GUO X, LI Y Q, WANG M S, WANG Z B, ZHANG Q, SHAO Y, JIANG R S, WANG S, MA C D, MURPHY R W, WANG G Q, DONG J, ZHANG L, WU D D, DU B W, PENG M S, ZHANG Y P. A parallel mechanism underlying frizzle in domestic chickens[J]. Journal of Molecular Cell Biology, 2018, 10(6): 589-591. DOI:10.1093/jmcb/mjy037 |
| [15] |
DONG J, HE C, WANG Z B, LI Y Q, LI S S, TAO L, CHEN J B, LI D H, YANG F X, LI N B, ZHANG Q, ZHANG L, WANG G Q, AKINYEMI F, MENG H, DU B W. A novel deletion in KRT75L4 mediates the frizzle trait in a Chinese indigenous chicken[J]. Genetics Selection Evolution, 2018, 50: 68. DOI:10.1186/s12711-018-0441-7 |
| [16] |
黄勋和, 梁慧敏, 龚珊珊, 陈洁波, 李威娜, 钟福生. 基于线粒体DNA D-loop序列的麒麟鸡遗传多样性与品种起源研究[J]. 嘉应学院学报, 2016, 34(8): 73-77. HUANG X H, LIANG H M, GONG S S, CHEN J B, LI W N, ZHONG F S. Genetic diversity and breed origin of frizzle chicken using mitochondrial DNA d-loop sequences[J]. Journal of Jiaying University, 2016, 34(8): 73-77. |
| [17] |
FUMIHITO A, MIYAKE T, SUMI S, TAKADA M, OHNO S, KONDO N. One subspecies of the red jungle fowl (Gallus gallus) suffices as the matriarchic ancestor of all domestic breeds[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(26): 12505-12509. DOI:10.1073/pnas.91.26.12505 |
| [18] |
MIAO Y W, PENG M S, WU G S, OUYANG Y N, YANG Z Y, YU N, LIANG J P, PIANCHOU G, BEJA-PEREIRA A, MITRA B, PALANICHAMY M G, BAIG M, CHAUDHURI T K, SHEN Y Y, KONG Q P, MURPHY R W, YAO Y G, ZHANG Y P. Chicken domestication: an updated perspective based on mitochondrial genomes[J]. Heredity, 2013, 110(3): 277-282. DOI:10.1038/hdy.2012.83 |
| [19] |
HALL T A. Bioedit: a user - friendly biological sequence alignment editor and analysis program for windows 95/98/NT[J]. Nucleic Acids Symposium Series, 1999, 41: 95-98. |
| [20] |
KUMAR S, ST ECHER G, TAMUR A K. MEGA7: Molecular evolutionary genetics analysis version 7[J]. Molecular Biology and Evolution, 2016, 33: 1870-1874. DOI:10.1093/molbev/msw054 |
| [21] |
ROZAS J, FERRER-MATA A, SÁNCHEZ-DELBARRIO J C, GUIRAO-RICO S, LIBRADO P, RAMOS-ONSINS S E, SÁNCHEZGRACIA A. DnaSP 6: DNA sequence polymorphism analysis of large datasets[J]. Molecular Biology and Evolution, 2017, 34: 3299-3302. DOI:10.1093/molbev/msx248 |
| [22] |
PENG M S, FAN L, SHI N N, NING T, YAO Y G, MURPHY R W, WANG W Z, ZHANG Y P. DomeTree: a canonical toolkit for mitochondrial DNA analyses in domesticated animals[J]. Molecular Ecology Resources, 2015, 15: 1238-1242. DOI:10.1111/1755-0998.12386 |
| [23] |
LEIGH J W, BRYANT D. PopART: Full-feature software for haplotype network construction[J]. Methods in Ecology and Evolution, 2015, 6(9): 1110-1116. DOI:10.1111/2041-210X.12410 |
| [24] |
国家畜禽遗传资源委员会. 中国畜禽遗传资源志: 家禽志[M]. 北京: 中国农业出版社, 2011. China National Commission of Animal Genetic Resources. Animal genetic resources in China: Poultry[M]. Beijing: Chinese Agriculture Press, 2011. |
| [25] |
王凡, 刘忠伟, 金志强, 文明, 欧德渊. 倒毛鸡生物学特性、屠宰性能及肉质性状研究[J]. 贵州畜牧兽医, 2016, 40(3): 1-6. WANG F, LIU Z W, JIN Z Q, WEN M, OU D Y. Study on the biological characteristics of chicken, slaughter performance and meat quality traits[J]. Guizhou Journal of Animal Husbandry & Veterinary Medicine, 2016, 40(3): 1-6. |
| [26] |
严佩卿, 杨崇斌, 田清兵, 周小明, 彭韬瑛, 姚勇. 永顺县"倒毛鸡" 种源保护及对策[J]. 中国畜禽种业, 2010, 6(4): 115-116, 162. YAN P Q, YANG C B, TIAN Q B, ZHOU X M, PENG T Y, YAO Y. Countermeasures of resources protection for frizzle fowl in Yongshun county[J]. The Chinese Livestock and Poultry Breeding, 2010, 6(4): 115-116, 162. |
| [27] |
李国强, 余北安, 李靖. 翻毛鸡种质性能的选育研究及其开发利用[J]. 中国畜禽种业, 2008, 4(4): 57-59. LI G Q, YU B A, LI J. Study on breeding characteris and utilization of Frizzle fowl[J]. The Chinese Livestock and Poultry Breeding, 2008, 4(4): 57-59. |
| [28] |
王坤, 豆腾飞, 李琦华, 柳明正, 李丰耘, 贾俊静, 葛长荣. 云南3个新发掘地方鸡品种mtDNA D-loop区序列遗传多样性分析[J]. 中国畜牧兽医, 2020, 47(10): 3232-3241. DOI:10.16431/j.cnki.1671-7236.2020.10.02 WANG K, DOU T F, LI Q H, LIU M Z, LI F Y, JIA J J, GE C R. Genetic diversity analysis of three newly discovered native chicken breeds in Yunnan using mtDNA D-loop region sequence[J]. Chinese Animal Husbandry & Veterinary Medicine, 2020, 47(10): 3232-3241. DOI:10.16431/j.cnki.1671-7236.2020.10.02 |
| [29] |
GAO Y S, JIA X X, TANG X J, FAN Y F, LU J X, HUANG S H, TANG M J. The genetic diversity of chicken breeds from Jiangxi, assessed with BCDO2 and the complete mitochondrial DNA D-loop region[J]. PLoS One, 2017, 12(3): e0173192. DOI:10.1371/journal.pone.0173192 |
| [30] |
LIU Y P, WU G S, YAO Y G, MIAO Y W, LUIKART G, BAIG M, BEJA-PEREIRA A, DING Z L, PALANICHAMY M G, ZHANG Y P. Multiple maternal origins of chickens: out of the Asian jungles[J]. Molecular Phylogenetics and Evolution, 2006, 38(1): 12-19. DOI:10.1016/j.ympev.2005.09.014 |
| [31] |
HUANG X H, WU Y J, MIAO Y W, PENG M S, CHEN X, HE D L, SUWANNAPOOM C, DU B W, LI X Y, WENG Z X, JIN S H, SONG J J, WANG M S, CHEN J B, LI W N, OTECKO N O, GENG Z Y, QU X Y, WU Y P, YANG X R, JIN J Q, HAN J L, ZHONG F S, ZHANG X Q, ZHANG Y P. Was chicken domesticated in northern China? New evidence from mitochondrial genomes[J]. Science Bulletin, 2018, 63(12): 743-746. DOI:10.1016/j.scib.2017.12.004 |
| [32] |
唐修君, 樊艳凤, 贾晓旭, 葛庆联, 陆俊贤, 唐梦君, 韩威, 高玉时. 基于线粒体DNA D-loop区的肉鸡品种遗传多样性和起源分析[J]. 中国农业科学, 2021, 54(24): 5302-5315. DOI:10.3864/j.issn.0578-1752.2021.24.012 TANG X J, FAN Y F, JIA X X, GE Q L, LU J X, TANG M J, HAN W, GAO Y S. Genetic diversity and origin characteristics of chicken species based on mitochondrial DNA D-loop region[J]. Scientia Agricultura Sinica, 2021, 54(24): 5302-5315. DOI:10.3864/j.issn.0578-1752.2021.24.012 |
| [33] |
TANG X J, FAN Y F, JIA X X, GE Q L, LU J X, HAN W, LIU H L, GAO Y S. Haplotype study of the mitochondrial control region of broiler breeds with different growth rates[J]. Animal Biotechnology, 2022. DOI:10.1080/10495398.2022.2138412 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50