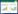文章信息
基金项目
- 黑龙江省省属高等学校基本科研业务费项目(2021KYYWF-FC06)
作者简介
- 孙莉莉(1983—),女,博士,副研究员,研究方向为分子遗传育种,E-mail:sunlilineau@163.com.
通讯作者
- 彭丽娜(1990—),女,博士,讲师,研究方向为分子生物学,E-mail:plina2012@163.com.
文章历史
- 收稿日期:2023-03-21
2. 黑龙江省农业科学院,黑龙江 哈尔滨 150086
2. Heilongjiang Academy of Agricultural Sciences, Harbin 150086, China
【研究意义】李(Prunus salicina L.)为蔷薇科(Rosaceae)李属(Prunus)植物,李在我国分布广泛,几乎所有省份都有栽培[1],位于我国东北地区的黑龙江省依托寒地优势,抗寒种质资源丰富,为抗寒新品种的选育提供了较好的种质来源。由于李富含糖、酸、维生素等多种营养物质,具有良好的抗氧化活性,其中提取出的活性肽能有效抵抗自由基[2],同时李可鲜食,也可进行深加工[3],深加工后的产品价值提升,能有效带动当地经济,具有较高的经济价值。【前人研究进展】数量性状位点(Quantitative Trait Locus,QTL)定位是研究数量性状的一种有效方法,构建高密度遗传图谱是QTL定位的基础,果树受童期长、纯合与杂合位点共存、遗传背景复杂等因素的影响,获得高密度遗传图谱较难,容易影响果树QTL定位的准确性[4]。随着分子生物学技术的不断发展,果树果实性状QTL定位研究也有一定的进展。果实品质是新品种选育的重要依据,果实品质包括内在品质和外观品质,内在品质体现在果实可溶性固形物、维生素C、可滴定酸及酚类化合物等含量。针对桃﹝Prunus persica(L.)Batsch﹞果实品质性状的研究比较深入,Shi等[5]基于SLAF-Seq构建了桃高密度遗传图谱,对果实质量、果实横径等12个果实性状进行QTL定位,获得90个位点,同时筛选和鉴定了果实性状的候选基因;张瑞萍等[6]对梨(Pyrus L.)的单果质量、果实横径、果实纵径和纵径横径比等果实性状进行了研究,结果共获得QTL位点8个,定位在不同的连锁群上,LOD值在2.50~4.14之间,可解释11.4%~36.4% 的表型变异。研究发现,在连锁群3上有3个柑橘(Citrus L.)果实横径QTL位点,在连锁群8上有4个果实纵径QTL位点[7]。近年,唐海霞等[8]对枣(Ziziphus jujuba Mill.)果实性状的QTL定位进行了报道,共检测到156个枣果实相关的QTL位点,分布在10个连锁群中。郭栋梁等[9]报道了龙眼(Dimocarpus longan Lour.)种质资源果实性状的多样性及相关性分析,结果发现单果质量与总糖含量呈极显著负相关。徐豆等[10]对欧李﹝Cerasus humilis(Bge.)Sok. ﹞亲本及正反交F1后代果实性状的遗传变异进行分析,研究表明杂交后代单果质量、可溶性固形物含量、果形指数等属于数量性状,由多基因控制。孙海龙等[11]对35份李种质的果实性状进行18个指标的相关性分析,为李种质资源品质性状的评价提供理论基础。然而,国内关于寒地李果实性状QTL定位研究较少。【本研究切入点】鉴于李具有的营养价值和经济价值,本试验以东北地区李吉林6号(P. salicina cv. jilin6)和龙园秋李(P. salicina cv. longyuanqiuli)的F1子代为研究群体,在已构建遗传图谱基础上[12],对单果质量、果实横径、果实纵径、果形指数、果肉厚度和总糖含量6个果实性状进行相关性分析和QTL的初步定位。【拟解决的关键问题】通过本研究,对李部分果实性状进行QTL初步定位,为寒地李分子标记辅助育种提供理论基础。
1 材料与方法 1.1 试验材料供试材料为吉林6号和龙园秋李的72株F1子代植株,亲本在2009年进行杂交授粉,杂交种子于2010年播种、2012年定植于黑龙江省农业科学院园艺分院核果试验园,长势较好,按照常规田间管理模式进行管理,子代没有进行剔选。2017年秋季部分植株果实成熟后,采集果实进行果实相关性状的统计和测量,果实采集时选择树龄、株型、生长势、载果量一致的正常株,从每株的全部收获物中选取大中小和向阳和背阴的果实组成平均样品。测试地点在黑龙江省农业科学院园艺分院实验室。
1.2 试验方法1.2.1 测量方法 通过电子天平(精度为0.01 g,浙江托普仪器有限公司)对单果质量(Weight of single fruit,WSF)进行称量;使用游标卡尺(精度为0.01 mm)对果实横径(Transverse diameter of fruit,TDF)、果实纵径(Vertical diameter of fruit,VDF)、果肉厚度(Thickness of pulp,TP)等指标进行测量,测量标准参考郁香荷等[13]方法;通过棱镜折射仪(精度为0.2%,广州铭睿电子LB32T糖度计)对总糖含量(Content of total sugar,CTS)进行测定;每个F1子代选择3~5个果实对各项指标进行测量,同时计算果形指数(Fruit shape index,FI),果形指数=果实纵径/果实横径。
1.2.2 统计方法 利用SPSS 23.0软件对果实性状测量数据进行统计分析,获得各项指标的平均值、方差、标准偏差、偏度和峰度,计算变异系数(变异系数=标准偏差/平均值),根据正态性检验输出结果分析各项指标是否属于正态分布。通过SPSS 23.0绘制果实性状各项指标的频率分布直方图,同时对各指标的相关性进行分析。
1.2.3 QTL定位分析 本研究基于已经构建的李遗传连锁图谱[12],通过Map QTL 5.0软件将正态性分布的性状进行QTL分析,在Map QTL 5.0软件中,依据置换检验(Permutation test)(次数>1 000)计算LOD阈值,根据区间作图法进行QTL定位,最后利用Map Chart 2.3软件对获得的QTL所在连锁群进行绘图。采用“果实性状+数字”的方式命名QTL,如“TDF-1”表示“果实横径在连锁群上的第1个QTL”,若该果实性状有多个位点,则数字顺延。
2 结果与分析 2.1 李F1群体果实性状的表型分析李F1群体果实性状表型分析结果如表 1所示。果实单果质量标准偏差为9.537、方差为90.951,数值均较大,偏度和峰度均大于1,表明单果质量的数据分布不对称,果实个体之间存在较大差异。果实性状的变异系数在6.09%~35.98%,各果实性状变异较大,表明分离比较明显。本研究测量果实总数量大于50个,根据K-S检验所得数据,若P>0.05,表明该指标呈正态分布。如表 1中,果实横径、果实纵径和果肉厚度的K-S检验结果均为P>0.05,表明其均呈正态分布,单果质量、果形指数和总糖含量的K-S检验值均小于0.05,表明数据呈非正态分布。各果实性状分布情况见图 1,该图同时显示了各指标的频率分布直方图,直方图中正态分布曲线也显示了各指标的正态分布情况。
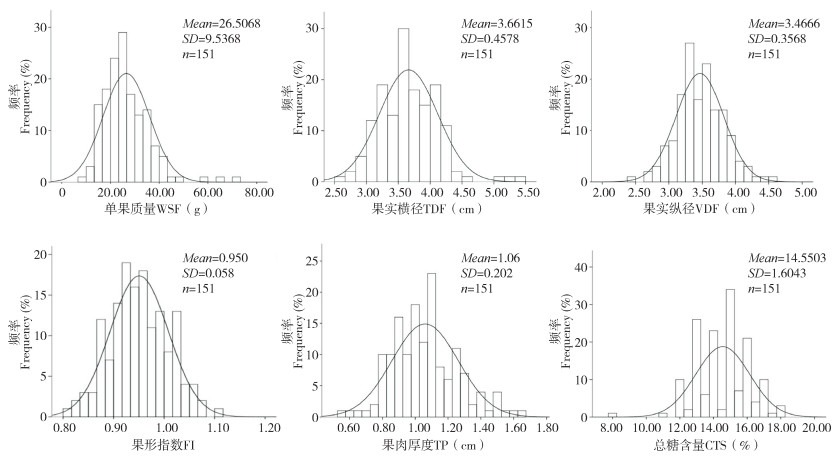
|
| 图 1 李F1群体果实性状的频率分布 Fig. 1 Frequency distribution of fruit traits in F1 population of plum |
2.2 李F1群体果实性状的相关性分析
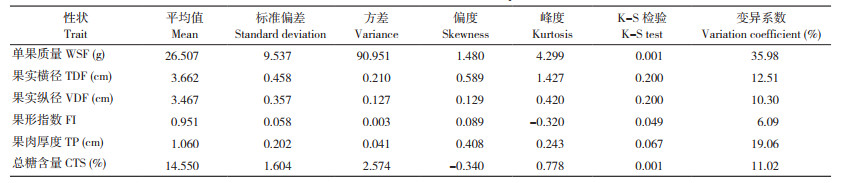
利用SPSS 23.0软件对李F1群体果实性状的相关性进行分析,结果如表 2所示,果实单果质量与果实横径、果实纵径和果肉厚度均具有极显著的正相关性,相关系数最大的是单果质量与果实横径,r为0.959,表明单果质量与果实横径关系最密切,筛选较大单果质量果实的同时,果实横径也会随之升高;单果质量与果形指数呈极显著负相关,而与总糖含量具有显著负相关关系,表明单果质量越大,果形指数和总糖含量越小,选择单果质量大、同时果形指数大和总糖含量高的品种比较难。果实横径与果实纵径、果肉厚度呈极显著正相关关系,表明果实横径与果实纵径、果肉厚度关系最密切,在连锁群上的QTL分布可能也较近;果实横径与果形指数、总糖含量呈极显著负相关关系,r分别为-0.548和-0.233,这一变化趋势和单果质量与果形指数、总糖含量的关系相似,更进一步说明单果质量与果实横径的关系最密切。果实总糖含量与其他指标间存在显著或极显著负相关,表明果实总糖含量在驯化过程中过分注重果实的大小,从而可能导致与果实总糖含量相关基因的丢失。
2.3 李F1群体果实性状的QTL定位
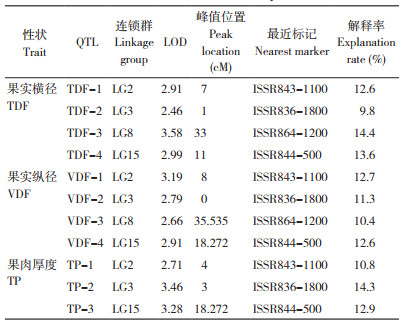
利用吉林6号和龙园秋李的F1子代构建李的遗传连锁图谱[12],选用Map QTL 5.0软件对呈正态性分布的李果实性状进行QTL分析,依据置换检验确定各个性状的LOD阈值(0.95和0.99水平),最终获得果实性状相关11个QTL位点(图 2、表 3)。
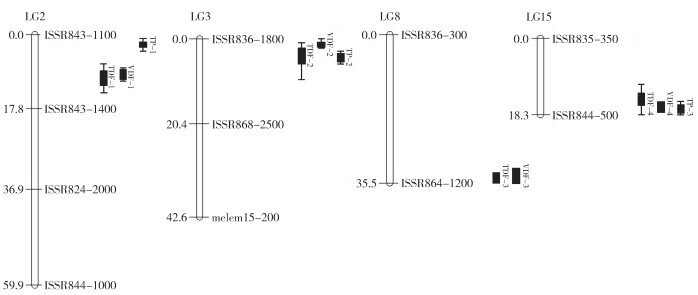
|
| TDF-1~TDF-4:果实横径位点1~4;VDF-1~VDF-4:果实纵径位点1~4;TP-1~TP-3:果肉厚度位点1~3 TDF-1~TDF-4: Transverse diameter of fruit-1~4; VDF-1~VDF-4: Vertical diameter of fruit-1~4; TP-1~TP-3: Thickness of pulp-1~3 图 2 李F1群体果实性状QTL在连锁图谱上的分布 Fig. 2 Distribution of QTL for fruit traits in F1 population of plum on linkage map |
果实横径共获得4个QTL位点,位点TDF-1位于第2连锁群7 cM区域,LOD值为2.91,表型变异解释率为12.6%;位点TDF-2位于第3连锁群1 cM区域,LOD值为2.46,表型变异解释率为9.8%;位点TDF-3位于第8连锁群33 cM区域,LOD值为3.58,表型变异解释率为14.4%;位点TDF-4位于第15连锁群11 cM区域,LOD值为2.99,表型变异解释率为13.6%。
果实纵径共获得4个QTL位点,分别为VDF-1、VDF-2、VDF-3和VDF-4,位点位置与果实横径连锁群一致,分别位于第2、第3、第8和第15连锁群,在连锁群上的区域分别为8 cM、0 cM、35.535 cM和18.272 cM,LOD值分别为3.19、2.79、2.66和2.91,能分别解释12.7%、11.3%、10.4% 和12.6% 的表型变异。
果肉厚度共获得3个QTL位点,分别为TP-1、TP-2和TP-3,分别位于第2、第3和第15连锁群,在连锁群上的区域分别为4 cM、3 cM和18.272 cM,LOD值分别为2.71、3.46和3.28,能分别解释10.8%、14.3% 和12.9% 的表型变异。
3 讨论果树具有基因高度杂合、自交不亲和及育种周期长等特点,致使果树遗传图谱构建比较困难,这也制约了果树QTL定位研究的进程。关于果树果实性状的QTL研究主要集中在桃、樱桃(Prunus avium L.)等物种上,关于李的研究较少。本研究中,李果实性状变异系数在6.09%~35.98%,个体间变异较大,表明各果实性状分离得比较明显,其中单果质量与果肉厚度之间的变异系数均大于19%。唐海霞等[8]以冬枣×金丝4号的103株F1群体为试验材料,采用GBS简化基因组测序技术开发SNP分子标记,参考冬枣全基因组筛选标记,构建枣高密度遗传图谱,对F1群体进行果实性状的相关性分析和QTL定位,结果发现单果质量的变异系数为19.49%;徐豆等[10]在欧李果实性状遗传变异研究中发现,单果质量的变异系数大于20%。以上研究结果与本研究相似,表明单果质量的个体差异在果实子代中普遍较大,出现广泛分离。单果质量属于数量性状,通常由多个基因控制,且易受外界环境影响,可能是群体中出现广泛分离的原因[14]。
本研究中,李果实的单果质量和总糖含量指标呈非正态分布,所以没有对其进行QTL定位分析,仅对果实横径、果实纵径和果肉厚度进行了分析。根据已有研究结果,并未发现果实横径和果实纵径的QTL定位与连锁群之间有很强的关联。如Quilot等[15]在LG1、LG4、LG5、LG6和LG7上定位了不同的桃果核横径QTL,而Cantín等[16]在LG4上定位了不同的桃果实横径QTL。在樱桃中,Zhang等[17]在LG2和LG6中发现了果实横径QTL位点;Rosyara等[18]在LG1、LG3和LG6中确定了6个影响果实横径和纵径的QTL。Campoy等[19]定位了LG5中与甜樱桃果实横径和纵径控制相关的主要QTL,并沿着QTL区间鉴定了不同的候选基因。本研究共获得11个QTLs位点,其中果实横径和果实纵径主要集中在LG2、LG3、LG8和LG15上,这与上述研究结果既有相似之处、也有不同结果,具体原因有待进一步深入研究。
本研究中,果实横径、果实纵径和果肉厚度定位在4个连锁群上,平均每个连锁群定位2~3个位点,且各位点间距离较近,这与赵慧[20]关于甜樱桃相关QTL位点的结果相似,其甜樱桃的单果质量、细胞数目和细胞体积定位在同一条染色体上,且距离较近。QTL在连锁群上普遍存在成簇聚集的现象,这可能与果实性状之间的相关性呈显著水平有关,也可能与同一基因同时控制不同果实性状有关。
本研究仍存在不足之处,首先,由于果树具有自交不亲和的特点,遗传图谱构建只能以F1群体为作图群体,这制约了高质量遗传图谱的构建,直接影响QTL定位的准确度。其次,黑龙江省位于我国东北部,春季倒春寒和冬季严寒气候,导致F1群体数量过少,可能使QTL定位出现偏差。第三,由于数量性状受多基因的调控,且基因之间还存在着互作效应,遗传机制比较复杂,同时还受环境因素、群体大小及遗传图谱饱和度的影响,容易造成QTL定位存在误差。在将来应考虑构建多种标记整合的图谱,提高图谱的饱和性和通用性,进而提高QTL定位的准确度,为挖掘李优质果实品质基因奠定基础,为培育李优质抗寒新品种提供理论基础。
4 结论本研究以东北地区李吉林6号和龙园秋李F1群体为试验材料,对果实的单果质量、果实横径、果实纵径、果形指数、果肉厚度和总糖含量等6个果实性状进行研究。表型分析结果显示,单果质量的变异系数为35.98%,表明F1群体间单果质量分离得比较明显;K-S检验结果显示,果实横径、果实纵径和果肉厚度的表型数据均呈现正态分布;通过各指标的相关性分析,单果质量与果实横径呈极显著正相关、相关系数为0.959,果实横径与果实纵径、果肉厚度之间亦具有极显著正相关关系;QTL定位共检测到11个QTL相关位点,分别位于LG2、LG3、LG8和LG15连锁群上,各位点在连锁群上成簇分布,这可能与果实横径、果实纵径和果肉厚度间存在极显著正相关有关,LOD值介于2.46~3.58,可解释9.8%~14.4% 的表型变异。
| [1] |
曲霜. 我国抗寒李果实性状的研究[D]. 长春: 吉林农业大学, 2019. QU S. Study on fruit characters of Hardy Prunus salicina in China[D]. Changchun: Jilin Agricultural University, 2019. |
| [2] |
GONZÁLEZ-GARCÍA E, MARINA M L, GARCÍA M C. Plum (Prunus Domestica L.) by-product as a new and cheap source of bioactive peptides: Extraction method and peptides characterization[J]. Journal of Functional Foods, 2014, 11: 428-437. DOI:10.1016/j.jff.2014.10.020 |
| [3] |
成策, 陆俊, 韩文琪, 黄晖, 李忠海. 李果粒果汁饮料加工工艺研究[J]. 食品与机械, 2015, 31(6): 215-218. DOI:10.13652/j.issn.1003-5788.2015.06.051 CHENG C, LU J, HAN W Q, HUANG H, LI Z H. Study on processing technology of plum juice beverage with pulp[J]. Food & Machinery, 2015, 31(6): 215-218. DOI:10.13652/j.issn.1003-5788.2015.06.051 |
| [4] |
李鹏, 刘锐涛, 谭西北, 张颖, 刘崇怀. 葡萄遗传图谱构建与抗病QTL定位研究进展[J/OL]. 果树学报, 2022, https://doi.org/10.13925/j.cnki.gsxb.20220031. LI P, LIU R T, TAN X B, ZHANG Y, LIU C H. Research progress on genetic map construction and QTL mapping for disease resistance in grapevine[J/OL]. Journal of Fruit Science, 2022, https://doi.org/10.13925/j.cnki.gsxb.20220031. |
| [5] |
SHI P, XU Z, ZHANG S Y, WANG X J, MA X F, ZHENG J C, XING L B, ZHANG D, MA J J, HAN M Y, ZHAO C P. Construction of a highdensity SNP-based genetic map and identification of fruitrelated QTLs and candidate genes in peach ﹝Prunus persica (L.) Batsch﹞[J]. BMC Plant Biology, 2020(20): 438-454. DOI:10.1186/s12870-020-02557-3 |
| [6] |
张瑞萍, 吴俊, 李秀根, 杨健, 王龙, 王苏珂, 张绍铃. 梨AFLP标记遗传图谱构建及果实相关性状的QTL定位[J]. 园艺学报, 2011, 38(10): 1991-1998. DOI:10.16420/j.issn.0513-353x.2011.10.021 ZHANG R P, WU J, LI X G, YANG J, WANG L, WANG S K, ZHANG S L. Construction of AFLP genetic linkage map and analysis of QTLs related to fruit traits in pear[J]. Acta Horticulturae Sinica, 2011, 38(10): 1991-1998. DOI:10.16420/j.issn.0513-353x.2011.10.021 |
| [7] |
罗艾, 龚桂芝, 彭祝春, 杨程, 常珍珍, 洪棋斌. 柑橘果实大小与质量的遗传分析和数量性状位点定位[J]. 浙江大学学报(农业与生命科学版), 2021, 47(6): 719-728. DOI:10.3785/j.issn.1008-9209.2021.04.121 LUO A, GONG G Z, PENG Z C, YANG C, CHANG Z Z, HONG Q B. Genetic analysis and quantitative trait locus mapping of citrus fruit size and mass[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2021, 47(6): 719-728. DOI:10.3785/j.issn.1008-9209.2021.04.121 |
| [8] |
唐海霞, 裴广营, 张琼, 王中堂. 枣果实相关性状QTL定位分析[J/OL]. 园艺学报, 2023, https://doi.org/10.16420/j.issn.0513-353x.2022-0056. TANG H X, PEI G Y, ZHANG Q, WANG Z T. Location and analysis of quantitative trait loci in Chinese Jujube fruit[J/OL]. Acta Horticulturae Sinica, 2023, https://doi.org/10.16420/j.issn.0513-353x.2022-0056. |
| [9] |
郭栋梁, 王静, 黄石连, 韩冬梅, 李建光. 龙眼种质资源果实性状多样性分析[J]. 广东农业科学, 2022, 49(1): 30-41. DOI:10.16768/j.issn.1004-874X.2022.01.004 GUO D L, WANG J, HUANG S L, HAN D M, LI J G. Analysis on fruit character diversity of Longan (Dimocarps longan Lour.) germplasm resources[J]. Guangdong Agricultural Sciences, 2022, 49(1): 30-41. DOI:10.16768/j.issn.1004-874X.2022.01.004 |
| [10] |
徐豆, 付鸿博, 杜灵敏, 郭晋鸣, 杜俊杰, 王鹏飞, 穆霄鹏, 张建成. 欧李正反交F1果实性状的遗传变异分析[J]. 山西农业科学, 2020, 48(5): 696-699, 714. DOI:10.3969/j.issn.1002-2481.2020.05.10 XU D, FU H B, DU L M, GUO J M, DU J J, WANG P F, MU X P, ZHANG J C. Genetic variation analysis of fruit traits in positive and negative cross F1 generation of Chinese Dwarf Cherry[J]. Journal of Shanxi Agricultural Sciences, 2020, 48(5): 696-699, 714. DOI:10.3969/j.issn.1002-2481.2020.05.10 |
| [11] |
孙海龙, 鲁晓峰, 邵静, 徐树广. 不同李种质果实性状分析及综合评价[J]. 中国果树, 2021(12): 53-59. DOI:10.16626/j.cnki.issn1000-8047.2021.12.010 SUN H L, LU X F, SHAO J, XU S G. Analysis and comprehensive evaluation of fruit traits of different plum germplasm[J]. China Fruits, 2021(12): 53-59. DOI:10.16626/j.cnki.issn1000-8047.2021.12.010 |
| [12] |
孙莉莉, 彭丽娜, 李铮, 侯睿宁, 牟蕴慧. 应用ISSR和SRAP标记构建李遗传连锁图谱[J]. 广东农业科学, 2022, 49(3): 40-48. DOI:10.16768/j.issn.1004-874X.2022.03.005 SUN L L, PENG L N, LI Z, HOU R N, MU Y H. Construction of genetic linkage map of plum (Prunus salicina L.) with ISSR and SRAP markers[J]. Guangdong Agricultural Sciences, 2022, 49(3): 40-48. DOI:10.16768/j.issn.1004-874X.2022.03.005 |
| [13] |
郁香荷, 刘威生. 李种质资源描述规范和数据标准[M]. 北京: 中国农业出版社, 2006. YU X H, LIU W S. Descriptive specification and data standard of plum germplasm resources[M]. Beijing: China Agriculture Press, 2006. |
| [14] |
王学征, 刘阳萍, 陈克农, 赵正翔, 孙蕾, 高忠琦, 朱子成, 韩文灏, 栾非时. 栽培西瓜单果重主基因+ 多基因遗传分析[J]. 东北农业大学学报, 2022, 53(7): 9-15. DOI:10.19720/j.cnki.issn.1005-9369.2022.07.002 WANG X Z, LIU Y P, CHEN K N, ZHAO Z X, SUN L, GAO Z Q, ZHU Z C, HAN W H, LUAN F S. Mixed major gene and polygene inheritance analysis of single fruit weight in watermelon[J]. Journal of Northeast Agricultural University, 2022, 53(7): 9-15. DOI:10.19720/j.cnki.issn.1005-9369.2022.07.002 |
| [15] |
QUILOT B, WU B H, KERVELLA J, GÉNARD M, FOULONGNE M, MOREAU K. QTL analysis of quality traits in an advanced backcross between Prunus persica cultivars and the wild relative species P. davidiana[J]. Theoretical and Applied Genetics, 2004, 109: 884-897. DOI:10.1007/s00122-004-1703-z |
| [16] |
CANTÍN C M, CRISOSTO C H, OGUNDIWIN E A, GRADZIEL T, TORRENTS J, MORENO M A, GOGORCENA Y. Chilling injury susceptibility in an intra-specific peach ﹝Prunus persica (L.) Batsc﹞ progeny[J]. Postharvest Biology and Technology, 2010, 58(2): 79-87. DOI:10.1016/j.postharvbio.2010.06.002 |
| [17] |
ZHANG G, SEBOLT A M, SOORIYAPATHIRANA S S, WANG D, BINK M C, OLMSTEAD J W, LEZZONI A F. Fruit size QTL analysis of an F1 population derived from a cross between a domesticated sweet cherry cultivar and a wild forest sweet cherry[J]. Tree Genetics & Genomes, 2010(6): 25-36. DOI:10.1007/s11295-009-0225-x |
| [18] |
ROSYARA U R, BINK M C A M, VAN DE WEG E, ZHANG G, WANG D, SEBOLT A, DIRLEWANGER E, QUERO-GARCIA J, SCHUSTER M, LEZZONI A F. Fruit size QTL identification and the prediction of parental QTL genotypes and breeding values in multiple pedigreed populations of sweet cherry[J]. Molecular Breeding, 2013(32): 875-887. DOI:10.1007/s11032-013-9916-y |
| [19] |
CAMPOY J A, LE DANTEC L, BARRENECHE T, DIRLEWANGER E, QUERO-GARCÍA J. New insights into fruit firmness and weight control in sweet cherry[J]. Plant Molecular Biology Reporter, 2015(33): 783-796. DOI:10.1007/s11105-014-0773-6 |
| [20] |
赵慧. 甜樱桃果实大小性状的遗传分析与QTL定位[D]. 沈阳: 沈阳农业大学, 2018. ZHAO H. Inheritance and QTL mapping for fruit size in sweet cherry[D]. Shenyang: Shenyang Agricultural University, 2018. |
(责任编辑 张辉玲)
 2023, Vol. 50
2023, Vol. 50