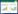文章信息
基金项目
- 国家重点研发计划“蓝色粮仓科技创新”重点专项(2018YFD0900200);中国水产科学研究院基本科研业务费资助项目(2020TD55);岭南现代农业科学与技术广东省实验室茂名分中心自主科研项目(2022ZD009);广东省省级乡村振兴战略专项资金种业振兴项目(2022-440000-4301030302-9582)
作者简介
- 徐淑玉(1996—),女,在读硕士生,研究方向为鱼类生物学,E-mail:shuyuirene@163.com.
通讯作者
- 区又君(1964—),女,研究员,研究方向为鱼类生物学、发育生物学与水产养殖技术,E-mail: ouyoujun@126.com.
文章历史
- 收稿日期:2023-02-18
2. 上海海洋大学水产与生命学院,上海 201306;
3. 岭南现代农业科学与技术广东省实验室茂名分中心,广东 茂名 525000;
4. 大连海洋大学水产与生命学院,辽宁 大连 116000
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Maoming Branch, Guangdong Laboratory for Lingnan Modern Agriculture, Maoming 525000, China;
4. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116000, China
【研究意义】四指马鲅(Eleutheronema tetradactylum)具有肉嫩味美、生长速度快、适应范围广等特点[1],且其生长周期短,经济回报高,因此深受渔民喜爱。四指马鲅是一种广盐性鱼类,当水体渗透压变低时,机体会产生一系列应激反应来适应环境变化,当盐度超过其耐受范围时就会造成死亡,从而导致养殖效益下降。鱼类的鳃组织不仅是主要的呼吸器官[2],还参与渗透压调节、离子平衡及体液pH调节等[3],在盐度适应过程中发挥至关重要的作用。心脏是最重要的能量供应器官,与物质的运输、内部环境的稳定和鱼类的防御功能密切相关[4]。脾脏是最大的周围淋巴器官,有过滤血液和对侵入血内的抗原产生免疫应答等重要功能。肝脏是人体最大的消化腺,除分泌胆汁参与消化机能外,还有贮藏养分、代谢和解毒等作用。因此,研究四指马鲅幼鱼鳃、心脏、脾脏和肝脏在急性淡水胁迫下的变化,对探讨四指马鲅低盐度养殖具有积极意义。【前人研究进展】目前已有盐度胁迫相关养殖研究,如盐度胁迫对斑点叉尾鮰(Ictalurus punctatus)应答基因的分析[5]、盐度胁迫对细鳞鲑幼鱼酶活的影响[6]、盐度骤降对大黄鱼的影响[7]等。王雯等[8]研究显示,斜带石斑鱼幼鱼在急性淡水胁迫下不能长期存活。牛莹月等[9]研究发现,四指马鲅幼鱼在不同盐度条件下的存活率和鳃组织形态有较大差异。急性淡水胁迫对四指马鲅幼鱼的影响研究较少,尤其是急性淡水胁迫对鱼类心脏影响的研究鲜有报道,Morgenroth等[10]指出盐度胁迫对黄尾鰤(Seriola lalandi)的心肺功能和生长性能无实质影响。【本研究切入点】鱼类的渗透压调节通过水和离子的运输来实现[11],是鳃、肾脏和肠道等水和离子运输的结果[12]。不同海洋生物对盐度变化的适应机制不相同。本研究以四指马鲅幼鱼为研究对象,分析四指马鲅幼鱼鳃、心脏、脾脏和肝脏在盐度0和9下的反应。【拟解决的关键问题】利用扫描电子显微镜技术和组织石蜡切片,分析四指马鲅幼鱼鳃、心脏、脾脏和肝脏对急性淡水胁迫的适应性,为四指马鲅的低盐度养殖及良种选育提供参考。
1 材料与方法 1.1 试验材料四指马鲅为中国水产科学研究院南海水产研究所中山科技成果转化基地自繁自育,14日龄,平均全长2.31 cm,平均体质量3.81 g。试验所用水族箱长58 cm、宽48 cm、高45 cm,水位28 cm。试验开始日期为2021年7月,开始前于室内暂养7 d,暂养盐度为9.0±0.5,水温28(±1)℃,期间每天换水1次,每次换水1/3并连续24 h充气增氧。暂养期结束时随机挑选体色正常、体格均匀且健康的鱼进行正式试验。
1.2 试验方法1.2.1 试验设计 试验共设淡水胁迫(盐度为0)2、6、12、24、48、72 h共6个处理,未受淡水胁迫的正常盐度(盐度为9)处理为对照,每个处理设3个平行,每个平行30尾鱼。将暂养于盐度9水体中的四指马鲅幼鱼放入盐度0的水体中。试验期间水温控制在26~28 ℃之间,连续充气增氧,每天换水1次,每次换水1/3,调节盐度,误差不超过0.5。每天9:00和17:00各投喂1次,喂食1 h后将残饵及粪便用虹吸法吸出。
1.2.2 样品采集与处理 在2、6、12、24、48、72 h时,从相应处理中随机选取3尾鱼,活体取鱼鳃、心脏、脾脏和肝脏组织,分别切成小块,用4%多聚甲醛溶液固定。固定后将样品在流水中冲洗12 h,在50%~100%的乙醇梯度中脱水(50%乙醇2 h,70%乙醇4 h,80%乙醇2 h,85%乙醇2 h,95%乙醇45 min×2次,100%乙醇45 min×2次);用二甲苯进行透明处理(1/2无水乙醇+1/2二甲苯混合物1 h,二甲苯15 min×2次);浸蜡(石蜡2 h×2次),石蜡包埋、切片(厚度5~6 μm),苏木精-曙红(HE)染色,用中性树脂密封;在光学显微镜(MZDR0850)下观察和拍照。
2 结果与分析 2.1 急性淡水胁迫对四指马鲅幼鱼鳃组织结构的影响由表 1可知,淡水胁迫2~72 h对四指马鲅幼鱼鳃小片长度、宽度和间距的影响不同,鳃小片长度出现逐渐增长的趋势,宽度先缩小后逐渐增大,鳃小片间距则先增大后有回落。由图 1可见,对照(图 1a)四指马鲅幼鱼未受到胁迫,细胞具有正常的生理形态,鳃丝整齐致密,两侧鳃小片对称完整,上皮细胞排列有序,线粒体细胞呈椭圆形。淡水胁迫2 h时(图 1b),线粒体丰富细胞数量增加,血细胞数量变多,鳃小片的表皮轻微剥落,鳃细胞末端轻微肿胀。淡水胁迫6 h时(图 1c),线粒体丰富细胞数量明显增多,血细胞数量增多,表皮脱落明显增多。淡水胁迫12 h时(图 1d),线粒体丰富细胞数量与淡水胁迫6 h相比没有明显变化,但体积增大,并出现向上蔓延的趋势;血细胞数量减少,表皮脱落情况与淡水胁迫6 h没有明显差别,鳃小片末端变小。淡水胁迫24 h时(图 1e),鳃丝和鳃小片基部线粒体丰富细胞数量变多,体积变大,继续呈向上蔓延趋势;血细胞数量增多,表皮脱落情况与淡水胁迫6 h没有明显差别,鳃小片末端明显变小。淡水胁迫48 h时(图 1f),鳃小片上(非基部)的线粒体丰富细胞数量增多,鳃小片末端表皮出现小范围脱落,红细胞吸水涨破。淡水胁迫72 h时(图 1g),鳃小片上(非基部)线粒体丰富细胞数量明显增多,位置进一步上升;鳃小片末端的表皮大量脱落,血细胞数量比淡水胁迫48 h时减少,鳃小片形状不规则。
|

|
| a:对照;b~g:分别为淡水胁迫2、6、12、24、48、72 h PVC:扁平上皮细胞;BC:血细胞;MRC:线粒体丰富细胞;S:血窦;BL:鳃小片 a: Control; b~g: Freshwater stress for 2, 6, 12, 24, 48, and 72 h, respectively PVC: Pavement cell; BC: Blood cell; MRC: Mitonchondria-rich cell; S: Blood sinus; BL: Gill lamella 图 1 急性淡水胁迫对四指马鲅幼鱼鳃组织结构的影响 Fig. 1 Effect of acute freshwater stress on the tissue structure of the gill of juvenile Eleutheronema tetradactylum |
2.2 急性淡水胁迫对四指马鲅幼鱼心脏组织结构的影响
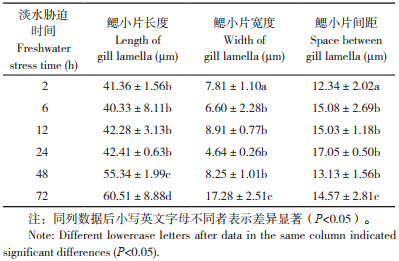
由图 2a可见,对照四指马鲅幼鱼未受到胁迫,心肌横纹肌明显,细胞核清晰,间质血管大小适中,肌细胞束间界限明显。淡水胁迫2 h时(图 2b),心肌横纹肌、心肌细胞间隙略有变大,间质血管也稍微变大。淡水胁迫6 h时(图 2c),心肌横纹肌逐渐膨胀,心肌细胞间隙、间质血管逐渐变大。淡水胁迫12 h时(图 2d),心肌横纹肌达到最大值,心肌细胞间隙和间质血管大小明显变大。淡水胁迫24 h时(图 2e),心肌横纹肌开始缩小,心肌细胞间隙和间质血管达到最大值。淡水胁迫48 h后(图 2f),心肌细胞间隙逐渐变小,并且心肌间质血管也逐渐变小,心肌横纹肌较为明显。淡水胁迫72 h时(图 2g),心肌横纹肌略模糊,心肌细胞间隙、间质血管变得更小,肌细胞束间界限不明显,细胞核没有之前清晰。总体来说,心肌横纹肌大小、心肌细胞间隙大小和间质血管大小均呈现先增后减的趋势。心肌横纹肌大小的峰值出现在淡水胁迫12 h时,心肌细胞间隙和间质血管大小的峰值则出现在淡水胁迫24 h时。
|
| a:对照;b~g:分别为淡水胁迫2、6、12、24、48、72 h SL:海绵层(黑色线条内部,箭头所指全区域);CL:致密层(黑色线条外部);CM:心肌细胞;G:间质血管 a: Control; b~g: Freshwater stress for 2, 6, 12, 24, 48, and 72 h, respectively; SL: Sponge layer (inside the black line, the arrow points to the entire area); CL: Compact layer(black line outside); CM: Cardiomyocyte; G: Interstitial blood vessel 图 2 急性淡水胁迫对四指马鲅幼鱼心脏组织结构的影响 Fig. 2 Effect of acute freshwater stress on the tissue structure of the heart of juvenile Eleutheronema tetradactylum |
2.3 急性淡水胁迫对四指马鲅幼鱼脾脏组织结构的影响
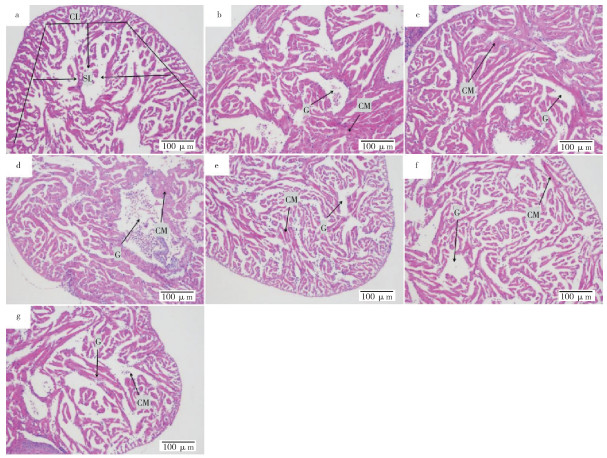
由图 3a可见,对照四指马鲅幼鱼脾脏最外层被膜较厚,表面覆有间皮,被膜结缔组织伸入脾内形成许多小梁,小梁和被膜内的平滑肌细胞较为规整。被膜以下由红髓、边缘区和白髓组成,白髓区域面积相对红髓区域明显小很多,黑色素巨噬细胞颜色较浅。与对照相比较,淡水胁迫2 h时(图 3b),白髓面积和边缘区面积增加,黑色素巨噬细胞颜色也略有加深。淡水胁迫6 h时(图 3c),白髓和边缘区面积进一步扩大,黑色素巨噬细胞的颜色进一步加深。淡水胁迫12 h时(图 3d),白髓面积增大,组织中红细胞数量增多,边缘区面积增大,黑色素巨噬细胞颜色变深。淡水胁迫24 h时(图 3e),白髓和边缘区面积达到峰值,黑色素巨噬细胞颜色也达到峰值。淡水胁迫48 h时(图 3f),白髓和边缘区面积减小,黑色素巨噬细胞颜色变浅。淡水胁迫72 h时(图 3g),红髓、边缘区、白髓和黑色素巨噬细胞基本恢复至对照水平。
|
| a:对照;b~g:分别为淡水胁迫2、6、12、24、48、72 h WP:白髓;RP:红髓;MZ:边缘区;MMCs:黑色素巨噬细胞中心 a: Control; b~g: Freshwater stress for 2, 6, 12, 24, 48, and 72 h, respectively WP: White pulp; RP: Red pulp; MZ: Marginal zone; MMCs: Melano-macrophage centers 图 3 急性淡水胁迫对四指马鲅幼鱼脾脏组织结构的影响 Fig. 3 Effect of acute freshwater stress on the tissue structure of the spleen of juvenile Eleutheronema tetradactylum |
2.4 急性淡水胁迫对四指马鲅幼鱼肝脏组织结构的影响
由图 4a可见,未受到胁迫的对照肝细胞体积较大,呈多面体,细胞核呈圆球形且位于中央,部分肝细胞具有2~3个核;肝板结构清晰;肝血窦形态正常,分布于肝细胞之间。淡水胁迫2 h时(图 4b),肝板结构变得模糊,肝小叶空泡相对增大,肝血窦间隙增宽,部分细胞核向肝外侧迁移。淡水胁迫6 h时(图 4c),肝板结构更模糊,肝小叶空泡继续增大,肝血窦间隙增宽,更多细胞核向肝外侧迁移。淡水胁迫12 h时(图 4d),肝板结构进一步模糊,肝小叶空泡继续增大,肝血窦间隙增宽,绝大部分细胞核位于细胞边缘,同时血管形状变得不规则。淡水胁迫24 h时(图 4e),肝板结构的模糊程度达到顶峰,肝血窦间隙宽度也达到顶峰,肝小叶空泡继续增大;大部分肝细胞核失去原有形态,多数细胞核变形呈纺锤形或圆形。淡水胁迫48 h时(图 4f),细胞空泡持续增大,细胞着色较浅,肝小板结构变得清晰,肝血窦间隙宽度缩小,一些细胞核失去固有形态。淡水胁迫72 h时(图 4g),细胞空泡继续增大,肝小板结构清晰,肝血窦间隙宽度继续缩小,大部分细胞核失去固有形态且位于细胞边缘。
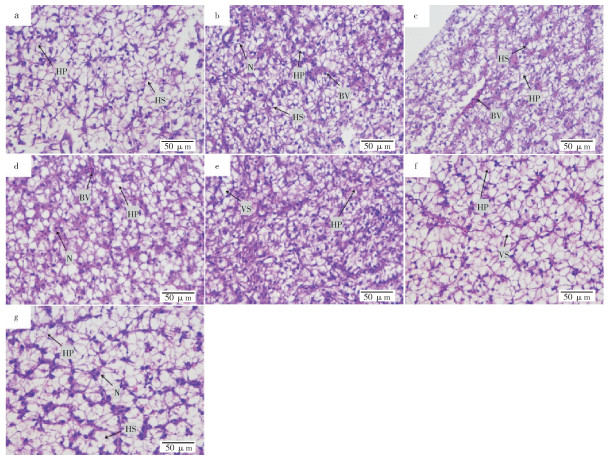
|
| a:对照;b~g:分别为淡水胁迫2、6、12、24、48、72 h BV:血管;HP:肝板;HS:肝血窦;VS:细胞空泡;N:细胞核 a: Control; b~g: Freshwater stress for 2, 6, 12, 24, 48, and 72 h, respectively BV: Blood vessel; HP: Hepatic plate; HS: Hepatic sinusoid; VS: Cellular vacuoles; N: Nucleus 图 4 急性淡水胁迫对四指马鲅幼鱼肝脏组织结构的影响 Fig. 4 Effect of acute freshwater stress on the tissue structure of the liver of juvenile Eleutheronema tetradactylum |
3 讨论 3.1 急性淡水胁迫对四指马鲅幼鱼鳃组织结构的影响
鳃是多数水生动物的呼吸器官,用来吸收溶解在水中的氧。急性盐度胁迫可以影响鱼类的渗透压平衡及细胞膜的通透性[13]。鱼类鳃组织的线粒体丰富细胞主要负责离子的摄取和分泌[14-16]。牛莹月等[17]研究发现,与对照盐度10处理相比,生活在盐度5低盐度水体中的四指马鲅幼鱼的鳃小片变细变长,向外延伸。本研究也发现随着淡水胁迫时间的延长,鳃小片长度呈现逐渐增长的趋势。鳃小片通过增加长度的方式以增加与水体的接触面,从而摄取水环境中的无机离子以适应在低渗环境中生存。研究发现,不同鱼类还可以通过改变鳃丝上皮结构来适应环境中的盐度变化。当对幼年鲈鱼(Lateolabrax japonicus)[18]施加不同的盐度压力时,淡水处理鲈鱼的鳃片排列紧密,只有少量的氯细胞(即线粒体丰富细胞)分布,而暴露在盐度15的幼年鲈鱼,其鳃片上的氯细胞增加并含有大量的粘液细胞。本研究渗透压的突变使得淡水胁迫2 h时四指马鲅幼鱼鳃的扁平上皮细胞出现轻微脱落,并在48 h时出现大量脱落,这可能是由于长期淡水胁迫导致鳃的渗透压紊乱。维持渗透压和剧烈运动都会导致细胞呼吸增加,从而导致耗氧量增加,这就需要更多的红细胞来运输氧气,从而使鳃片中出现更多红细胞,但低水温导致鳃血管收缩,导致红细胞分布不均,局部出现大量血细胞堆积。这与陈彩芳等[19]对泥蚶(Tegillarca granosa)的研究结果相似。本研究中,淡水胁迫72 h时四指马鲅幼鱼鳃血细胞数量出现回落,推测四指马鲅幼鱼已经适应了淡水环境。
增加尿液排泄也是维持鱼体内渗透压的一种方式,多余的水通过尿液从体内排出,从而使渗透压恢复稳定。鳃小片末端变细可能与鱼体大量排水有关。郭印等[20]将美洲鲥(Alosa sapidissims)幼鱼投入淡水及盐度5、10、20的环境下96 h,结果发现,24 h后各处理幼鱼的渗透压随时间变化均呈下降趋势并逐渐稳定。本研究中,四指马鲅幼鱼鳃丝的形态在淡水胁迫24 h内仍完整,此时它们可能处于积极恢复渗透调节的阶段;而淡水胁迫24 h后,鳃小片末端明显变细,表明四指马鲅幼鱼通过调节体内含水量来适应急性淡水胁迫。
鳃至少负责两个重要功能,摄取氧气和离子-水平衡[20]。维持温带海洋鱼类的离子平衡,主要取决于鳃上皮的线粒体丰富细胞水平[21]。大量的线粒体分布在线粒体丰富细胞内、核上和基底层[22-23]。线粒体丰富细胞适应外部水环境盐度的变化,主要通过细胞结构、形态和功能变化,以及结构变化导致亚型之间发生可逆的转变来维持其生存。线粒体丰富细胞通过主动运输来加强水氧的交换量,使其能更好地适应低盐环境[24]。线粒体丰富细胞主要分布在鳃小叶的基部,其顶端小窝开口于鳃的表面,与外界环境直接接触。线粒体丰富细胞在鳃上皮中所占比例虽然不高,仅约为8%,但在物质交换的过程中发挥主动运输功能[25]。
线粒体丰富细胞的形态结构、分布和数量适应环境中渗透条件的变化,但物种之间存在一些差异。一般来说,线粒体丰富细胞在广盐性硬骨鱼鳃上皮的分布有3种适应高渗或低渗环境的特点:(1)无论淡水或海水驯化时,线粒体丰富细胞仅分布在鳃丝上皮内;(2)海水高渗环境时,线粒体丰富细胞分布在鳃丝上皮内,但经淡水低渗环境驯化,线粒体丰富细胞在鳃小片上皮内也会有分布;(3)无论淡水或海水驯化,鳃丝和鳃小片上皮内均有线粒体丰富细胞分布[26]。本研究结果显示,低盐环境下四指马鲅幼鱼需要大量的能量来维持渗透压平衡,因此线粒体丰富细胞数量逐渐增加;而线粒体丰富细胞数量也随着应激时间的延迟而增加。当线粒体丰富细胞布满基部后,该细胞呈向鳃小片末端蔓延的趋势,表明线粒体丰富细胞在渗透压调节上发挥非常重要的作用。区又君等[27]也提出相似观点,线粒体丰富细胞结构和功能的适应性变化规律,是大多数广盐性鱼类能适应复杂多变水体盐度的主要原因之一。扁平上皮细胞是鳃组织结构的主要组成部分,主要以被动运输方式参与鳃的生理功能,其表面的微脊能进一步增加鳃组织与水体的接触面,起到增强气体交换的作用。庄青青等[28]研究发现,在低渗环境中,由于尼罗罗非鱼(Oreochromis niloticus)体内的离子浓度比环境高,鱼倾向于渗透性地吸收水,尽管多余的水会被肾脏排出体外,但尿液中损失的一些盐分通过鳃的主动吸收得到补偿。此时,活性离子吸收的压力增加,需要更多的线粒体丰富细胞参与盐离子的吸收,导致盐度为0时的线粒体丰富细胞数量比盐度为10时增加。
3.2 急性淡水胁迫对四指马鲅幼鱼心脏组织结构的影响心脏是鱼类最重要的能量供应器官,与物质的运输、内部环境的稳定和鱼类的防御功能密切相关[29]。环境胁迫会使得鱼类心脏受到损伤[30-31]。刘垚等[32]研究发现,高盐饮食会导致人的心室肥大,心腔扩大;随着时间推移,心室失代偿,心室肌肉肥大,心脏逐渐丧失代偿能力。本研究中,四指马鲅幼鱼心肌横纹肌随着淡水胁迫时间的延长逐渐变大,淡水胁迫12 h时达到峰值,随后逐渐缩小趋于胁迫前水平。这表明与高盐对人类心脏的影响相似,低盐胁迫对四指马鲅幼鱼心脏的损伤主要体现在心肌横纹肌增厚。但四指马鲅幼鱼与斑马鱼(Danio rerio)类似,心脏的修复能力较好[31],故随着时间的推移损伤逐渐消失。郭晓丽等[33]在热应激对大菱鲆(Scophthalmus maximus)心肌损伤及细胞凋亡的影响研究中指出,在24 ℃下热应激12 h内,心肌细胞出现增厚、肿胀、透明质变和染色质固缩,说明在热应激下心肌细胞的收缩能力增强,增加了机体的散热以维持生理活动。本研究中四指马鲅幼鱼心肌细胞在受到急性淡水胁迫后出现变粗的现象,这与前述研究相似,表明心肌细胞在急性淡水胁迫下扩张能力增强,以维持其正常生理活动。
Wang等[34]指出,高盐暴露会增加胚胎发育过程中雏鸡心血管异常循环和心腔内充血的风险,但心室细胞增殖和凋亡都增加。心室心肌细胞中高盐诱导的高渗透压导致的不完全分化与之类似。本研究中淡水胁迫的四指马鲅幼鱼心肌细胞和间质血管粗细的先增后减变化,表明急性淡水胁迫会对四指马鲅幼鱼的心脏组织产生损害,并导致流向心脏的血液减少,从而影响营养物质的摄取和吸收。经过48 h的恢复,间隙减小到压力前的水平,充血减少,表明心脏组织能够更好地修复淡水胁迫造成的损害。与之类似,许多脊椎动物可以使失去的组织和器官再生。如斑马鱼的心脏在受到严重伤害或组织损伤后可以再生,在斑马鱼心脏再生过程中,心肌细胞在7 dpa时开始进行DNA合成和细胞增殖;增殖活动在14 dpa达到高峰;新的心肌细胞取代了大部分失去的心室组织,心脏结构在30 dpa时完全恢复[31]。Morgenroth等[10]指出,广盐性鱼类在低盐度养殖条件下,体液与周围水体的渗透梯度降低,从而降低调节渗透压的能量成本,而能量可能被引导到生长等其他过程,其对黄尾鰤[10]的研究验证了这个结论。
3.3 急性淡水胁迫对四指马鲅幼鱼脾脏组织结构的影响脾脏是鱼体内最大的周围淋巴器官,位于血液循环的通路上,有过滤血液以及对侵入血内的抗原产生免疫应答等重要功能。脾分为白髓、边缘区和红髓3个部分,脾内有大量血窦。本研究中,淡水胁迫0~24 h的白髓面积逐渐增大,后逐渐回落,这与运输胁迫对四指马鲅幼鱼脾脏的影响研究结论[35]相似。脾脏免疫功能的强弱与脾脏白髓的面积密切相关,伍智等[36]研究发现,马来穿山甲(Manis javaniaca)脾脏白髓的面积远比其他哺乳动物小,也就是脾小体和动脉周围淋巴鞘的数量少,使得马来穿山甲的免疫能力较差。胡玲玲等[37]也提到,脾脏对条石鲷(Oplegnathus fasciatus)的免疫能力有重大影响。本研究中,白髓面积增大体现了四指马鲅幼鱼为了适应淡水胁迫,增加了脾小体和动脉周围淋巴鞘的数量,从而增强对环境突变的适应能力;淡水胁迫24~72 h白髓和红髓区域趋于正常,淋巴细胞数量恢复正常,表明四指马鲅幼鱼体内的有害物质减少,脾脏应答能力恢复正常。黑色素巨噬细胞在集中处理体内各种外源性和内源性物质降解和再循环中发挥重要作用。衰老、饥饿、感染疾病、毒物作用等均有可能导致黑色素巨噬细胞增多[38]。本研究中黑色素巨噬细胞在受到淡水胁迫24 h内逐渐增大、颜色加深、数量增多,可能与血液中可溶或颗粒物质先变多后变少有关,之后四指马鲅幼鱼适应了淡水环境,黑色素巨噬细胞的颜色逐渐恢复至胁迫前水平。
3.4 急性淡水胁迫对四指马鲅幼鱼肝脏组织结构的影响肝脏位于鱼腹腔前部,由许多角形肝细胞所形成的肝小叶集合而成,肝小叶中央静脉分布不整齐,肝细胞往往不规则地排列在中央静脉周围。肝细胞的大小随脂肪和糖原的贮藏量而变。在对泥鳅(Misgurnus anguillicaudatus)的急性氨氮胁迫研究中发现,随胁迫时间延长,肝细胞空泡逐渐增大,细胞核形状异常,内容物大量外泄[39]。本试验结果与其相类似,随着淡水胁迫时间的延长,细胞空泡逐渐增大,72 h时达到最大值。这可能是由于在盐度胁迫下,肝糖原被大量消耗以调节渗透压,也有可能是因为胁迫导致肝糖原代谢和合成平衡被打乱。刘恩光等[40]研究表明,急性热胁迫下的白梭吻鲈(Sander lucioperca)肝脏出现严重的空泡化,主要原因是高温胁迫增加了细胞脂质过氧化水平,降低了细胞抗氧化能力。陈世喜等[41]也观察到,随着急性低氧胁迫时间延长,卵形鲳鲹(Trachinotus ovatus)肝组织空泡体积变大(肝糖原分解所致);肝血窦间隙先逐渐扩大,24 h时达到顶峰,后逐渐缩小;胁迫前24 h,由于鱼体调节渗透压,耗氧量增大,血窦间隙随之增大;胁迫24~48 h后,鱼体适应了淡水环境,耗氧量减小,血窦间隙随之减小。这与本研究四指马鲅幼鱼在急性淡水胁迫下肝脏组织结构的恢复速度类似[42]。当时胁迫12 h后,四指马鲅幼鱼血管形状开始变得不规则,说明渗透压的变化导致肝脏收缩,进而导致血管收缩。也有可能是因胁迫时鱼体快速游动、撞击导致的机械损伤。细胞核形态在淡水胁迫24 h内较为正常,淡水胁迫48~72 h却出现了内容物流出的现象,说明鱼体会在淡水胁迫24 h后大致适应急性淡水胁迫,但胁迫并非完全不会对肝脏造成损伤,胁迫对细胞核的影响较大。区又君等[27]在急性低温胁迫对四指马鲅幼鱼肝脏组织结构的影响研究中也发现,长期暴露在低温环境下,鱼的肝脏逐渐失去自我调节能力,部分肝细胞严重损伤直至细胞核萎缩或消失。
4 结论本研究对急性淡水胁迫下四指马鲅幼鱼的鳃、心脏、脾脏和肝脏组织结构进行研究,结果发现,线粒体丰富细胞随着胁迫时间延长而逐渐增加,部分肝细胞核逐渐萎缩甚至消失。四指马鲅幼鱼的鳃小片,心肌细胞,脾脏红髓、白髓、边缘区、黑色素巨噬细胞,肝板和肝血窦等大部分结构在淡水胁迫24 h内有一定的应激反应,如鳃小片长度出现逐渐增长的趋势,宽度先缩小后又逐渐增大,鳃小片间距先增大后有回落;随着胁迫时间的延长,这些应激反应又逐渐恢复至胁迫前水平,表明四指马鲅幼鱼对短时间的急性淡水胁迫有一定的适应能力。
| [1] |
牛莹月. 四指马鲅(Eleutheronema tetradactylum)鳃结构发育以及应对盐度和低温胁迫的影响研究[D]. 上海: 上海海洋大学, 2021. DOI: 10.27314/d.cnki.gsscu.2021.000203. NIU Y Y. The organization structure and early development of gill and its adaptation mechanism to salinity and low temperature stress in Eleutheronema tetradactylum[D]. Shanghai: Shanghai Ocean University, 2021. DOI: 10.27314/d.cnki.gsscu.2021.000203. |
| [2] |
林欣, 区又君, 温久福, 徐淑玉, 李加儿. 急性低氧胁迫对四指马鲅幼鱼鳃和肝组织损伤影响[J]. 渔业研究, 2023, 45(1): 14-22. DOI:10.14012/j.cnkifjsc.2023.01.003 LIN X, OU Y J, WEN J F, XU S Y, LI J E. Effects of acute hypoxic stress on Eleutheronema tetradactylum gill organ and liver tissue damage[J]. Journal of Fisheries Research, 2023, 45(1): 14-22. DOI:10.14012/j.cnkifjsc.2023.01.003 |
| [3] |
LIU S, QI C, JIA Y, GU Z, LI E. Growth and intestinal health of the red claw crayfish, Cherax quadricarinatus, reared under different salinities[J]. Aquaculture, 2020, 527: 735420. DOI:10.1016/j.aquaculture.2020.735256 |
| [4] |
LAVERTY G, SKADHAUGE E. Adaptation of teleosts to very high salinity[J]. Comparative Biochemistry and Physiology (Part A: Molecular & Integrative Physiology), 2012, 163(1): 1-6. DOI:10.1016/j.cbpa.2012.05.203 |
| [5] |
段永强. 斑点叉尾鮰盐度胁迫应答基因的鉴定与分析[D]. 上海: 上海海洋大学, 2022. DOI: 10.27314/d.cnki.gsscu.2022.000409. DUAN Y Q. Identification and analysis of salinity stress response genes in channel catfish (Ictalurus punctatus)[D]. Shanghai: Shanghai Ocean University, 2022. DOI: 10.27314/d.cnki.gsscu.2022.000409. |
| [6] |
杜佳玉, 吴晗阅, 孟照勇, 李雪东, 文逊智, 王茂林. 盐度胁迫对细鳞鲑幼鱼呼吸代谢和抗氧化酶活性的影响[J]. 安徽农业科学, 2021, 49(22): 114-116, 121. DOI:10.3969/j.issn.0517-6611.2021.22.027 DU J Y, WU H Y, MENG Z Y, LI X D, WEN X Z, WANG M L. Effects of salinity stress on the respiratory metabolism and antioxidant enzyme activities of Brachymystax lenok tsinlingensis juvenile[J]. Journal of Anhui Agricultural Sciences, 2021, 49(22): 114-116, 121. DOI:10.3969/j.issn.0517-6611.2021.22.027 |
| [7] |
何亮银, 李进寿, 史晓丽, 周逢芳, 黄伟卿. 盐度骤降胁迫对大黄鱼血清生化组分的影响[J]. 海洋科学, 2022, 46(8): 32-38. DOI:10.11759/hykx20201028001 HE L Y, LI J S, SHI X L, ZHOU F F, HUANG W Q. Effects of a sudden drop in salinity on serum biochemical components in Larimichthys crocea[J]. Marine Sciences, 2022, 46(8): 32-38. DOI:10.11759/hykx20201028001 |
| [8] |
王雯, 温久福, 区又君, 李加儿, 王鹏飞, 陈世喜, 谢木娇. 急性淡水胁迫对斜带石斑鱼幼鱼鳃线粒体丰富细胞形态结构的影响[J]. 应用海洋学学报, 2016, 35(4): 544-549. DOI:10.3969/J.ISSN.2095-4972.2016.04.012 WANG W, WEN J F, OU Y J, LI J E, WANG P F, CHEN S X, XIE M J. Impacts of acute fresh water stress on morphology and structure of mitochondrion-rich cells of Epinephelus coioides juvenile[J]. Journal of Applied Oceanography, 2016, 35(4): 544-549. DOI:10.3969/J.ISSN.2095-4972.2016.04.012 |
| [9] |
牛莹月, 罗志平, 区又君, 蓝军南, 温久福, 李加儿, 周慧. 不同盐度对四指马鲅幼鱼存活及鳃组织形态变化的影响[J]. 南方农业学报, 2021, 52(6): 1719-1726. DOI:10.3969/j.issn.2095-1191.2021.06.033 NIU Y Y, LUO Z P, OU Y J, LAN J N, WEN J F, LI J E, ZHOU H. The survival and structural changes in gill of juvenile Eleutheronema tetradactylum under different salinities[J]. Journal of Southern Agriculture, 2021, 52(6): 1719-1726. DOI:10.3969/j.issn.2095-1191.2021.06.033 |
| [10] |
MORGENROTH D, MCARLEY T, DANIELO Q, HARFORD A, HICKEY A J R, KHAN J, SANDBLOM E. Kingfish (Seriola lalandi) adjust to low salinity with only subtle effects to cardiorespiratory and growth performance[J]. Aquaculture, 2022, 556: 738268. DOI:10.1016/j.aquaculture.2022.738268 |
| [11] |
MOORMAN B P, LERNER D T, GRAU E G, SEALE A P. The effects of acute salinity challenges on osmoregulation in Mozambique tilapia reared in a tidally changing salinity[J]. Journal of Experimental Biology, 2015, 218(5): 731-739. DOI:10.1242/jeb.112664 |
| [12] |
MAXIME V. The physiology of triploid fish: current knowledge and comparisons with diploid fish[J]. Fish and Fisheries, 2008, 9(1): 67-78. DOI:10.1111/j.1467-2979.2007.00269.x |
| [13] |
VELOTTA J P, MCCORMICK S D, WHITEHEAD A, DURSO C S, SCHULTZ E T. Repeated genetic targets of natural selection underlying adaptation of fishes to changing salinity[J]. Integrative and Comparative Biology, 2022, 62(2): 357-375. DOI:10.1093/icb/icac072 |
| [14] |
ZHOU B Z, QI D L, LIU S J, QI H, WANG Y, ZHAO K, TIAN F. Physiological, morphological and transcriptomic responses of tibetan naked carps (Gymnocypris przewalskii) to salinity variations[J]. Comparative Biochemistry and Physiology D-Genomics & Proteomics, 2022, 42. DOI:10.1016/j.cbd.2022.100982 |
| [15] |
ZHAO F, WU B B, YANG G, ZHANG T, ZHUANG P. Adaptive alterations on gill Na+, K+-ATPase activity and mitochondrion-rich cells of juvenile acipenser sinensis acclimated to brackish water[J]. Fish Physiology and Biochemistry, 2016, 42(2): 749-756. DOI:10.1007/s10695-015-0172-4 |
| [16] |
CHOI J H, LEE K M, INOKUCHI M, KANEKO T. Acute responses of gill mitochondria-rich cells in mozambique tilapia Oreochromis mossambicus following transfer from normal freshwater to deionized freshwater[J]. Fisheries Science, 2010, 76(1): 101-109. DOI:10.1007/s12562-009-0195-9 |
| [17] |
牛莹月, 罗志平, 区又君, 蓝军南, 温久福, 李加儿, 周慧. 不同盐度对四指马鲅幼鱼存活及鳃组织形态变化的影响[J]. 南方农业学报, 2021, 52(6): 1719-1726. DOI:10.3969/j.issn.2095-1191.2021.06.033 NIU Y Y, LUO Z P, OU Y J, LAN J N, WEN J F, LI J E, ZHOU H. The survival and structural changes in gill of juvenile Eleutheronema tetradactylum under different salinities[J]. Journal of Southern Agriculture, 2021, 52(6): 1719-1726. DOI:10.3969/j.issn.2095-1191.2021.06.033 |
| [18] |
王艳, 胡先成. 不同盐度下鲈鱼稚鱼鳃的显微结构观察[J]. 海洋科学, 2009, 33(12): 138-142. WANG Y, HU X C. Microscopical observation on the gill structure of juvenile Lateolabrax japonicus under different salinities[J]. Marine Sciences, 2009, 33(12): 138-142. |
| [19] |
陈彩芳, 沈伟良, 申屠基康, 林志华. Pb2+对泥蚶鳃、肝脏等组织结构的影响[J]. 水产学报, 2014, 38(7): 965-972. DOI:10.3724/SP.J.1231.2014.49080 CHEN C F, SHEN W L, SHEN T J K, LIN Z H. Effect of Pb2+ on the microstructure and ultrastructure of gill and hepatopancreas in Tegillarca granosa[J]. Journal of Fisheries of China, 2014, 38(7): 965-972. DOI:10.3724/SP.J.1231.2014.49080 |
| [20] |
郭印, 戴习林. 急性盐度胁迫对美洲鲥幼鱼渗透调节的影响[J]. 水产科学, 2022, 41(4): 676-681. DOI:10.16378/j.cnki.1003-1111.21013 GUO Y, DAI X L. Effects of Acute salinity stress on osmoregulation of juvenile American shad Alosa sapidissima[J]. Fisheries Science, 2022, 41(4): 676-681. DOI:10.16378/j.cnki.1003-1111.21013 |
| [21] |
ITOKI N, SAKAMOTO T, HAYASHI M, TAKEDA T, ISHIMATSU A. Morphological responses of mitochondria-rich cells to hypersaline environment in the Australian mudskipper, Periophthalmus minutus[J]. Zoological Science, 2012, 29(11): 794. DOI:10.2108/zsj.29.794 |
| [22] |
SAKAMOTO T, YOKOTA S, ANDO M. Rapid morphological oscillation of mitochondrion-rich cell in estuarine mudskipper following salinity changes[J]. Journal of Experimental Zoology, 2000, 286(6): 666-669. DOI:10.1002/(SICI)1097-010X(20000501)286:63.0.CO;2-G |
| [23] |
PISAM M. Membranous systems in the "chloride cell" of teleostean fish gill; their modifications in response to the salinity of the environment[J]. Anatomical Record-advances in Integrative Anatomy and Evolutionary Biology, 1981, 200(4): 401-414. DOI:10.1002/ar.1092000403 |
| [24] |
MASINI M A, STURLA M, PRATO P, UVA B. Mitochondria-rich cells in Antarctic fish gills[J]. Polar Biology, 2000, 23(4): 250-256. DOI:10.1007/s003000050441 |
| [25] |
DA COSTA O T F, RAMOS C A, DUNCAN W P, LAMEIRAS J L V, FERNANDES M N. Mitochondria-rich cells changes induced by nitrite exposure in tambaqui (Colossoma macropomum Cuvier, 1818)[J]. Anais Da Academia Brasileira De Ciencias, 2017, 89(2): 965-972. DOI:10.1590/0001-3765201720160648 |
| [26] |
GUAN Y, ZHANG G X, ZHANG S J, DOMANGUE B, GALVEZ F. The potential role of polyamines in gill epithelial remodeling during extreme hypoosmotic challenges in the Gulf killifish, Fundulus grandis[J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology, 2016, 194: 39-50. DOI:10.1016/j.cbpb.2016.01.003 |
| [27] |
区又君, 刘奇奇, 温久福, 李加儿, 李活. 急性低温胁迫对四指马鲅幼鱼肝脏、肌肉以及鳃组织结构的影响[J]. 生态科学, 2018, 37(5): 53-59. DOI:10.14108/j.cnki.1008-8873.2018.05.008 OU Y J, LIU Q Q, WEN J F, LI J E, LI H. The effects of acute low temperature stress on liver, muscle and gill tissues of juvenileEleutheronema tetradactylum[J]. Ecological Science, 2018, 37(5): 53-59. DOI:10.14108/j.cnki.1008-8873.2018.05.008 |
| [28] |
庄青青, 赵金良, 赵丽慧, 苌建菊. 盐度胁迫对尼罗罗非鱼鳃氯细胞调节变化的影响[J]. 生态学杂志, 2012, 31(10): 2619-2624. ZHUANG Q Q, ZHAO J L, ZHAO L H, CHANG J J. Effects of salinity stress on the adjustment of branchial chloride cells in Oreochromis niloticus[J]. Chinese Journal of Ecology, 2012, 31(10): 2619-2624. |
| [29] |
STEINBACH C, KROUPOVA H K, WAHLI T, KLICNAROVA J, SCHMIDT-POSTHAUS H. Histopathological alterations of the heart in fish: proposal for a standardized assessment[J]. Diseases of Aquatic Organisms, 2016, 118(3): 185-194. DOI:10.3354/dao02971 |
| [30] |
KAVALIAUSKIENE S, BECKER V, SUN B J, DALUM A S, VINDAS M A, LUND H, JOHANSEN I B, FRISK M. L-plastin levels are associated with mortality during cardiomyopathy syndrome in farmed Atlantic salmon (Salmo salar L.)[J]. Aquaculture, 2022, 560: 738546. DOI:10.1016/j.aquaculture.2022.738546 |
| [31] |
SUN J S, PETERSON E A, JIAO C, CHEN X, ZHAO Y, WANG J H. Zebrafish heart regeneration after coronary dysfunction-induced cardiac damage[J]. Developmental Biology, 2022, 487: 57-66. DOI:10.1016/j.ydbio.2022.04.008 |
| [32] |
刘垚, 薛腾, 王玺翔, 樊明瑞, 曹娜. 高盐饮食对非致死性创伤后心脏损伤的影响[J]. 山西医药杂志, 2019, 48(14): 1654-1657. DOI:10.3969/j.issn.0253-9926.2019.14.003 LIU Y, XUE T, WANG X X, FAN M R, CAO N. Effects of a high-salt diet on delayed cardiac injury after nonfatal trauma[J]. Shanxi Medical Journal, 2019, 48(14): 1654-1657. DOI:10.3969/j.issn.0253-9926.2019.14.003 |
| [33] |
郭晓丽, 黄智慧, 马爱军, 王庆敏, 徐荣静, 李明, 陈志信. 热应激对大菱鲆心肌损伤及细胞凋亡的影响[J]. 水产学报, 2022, 46(6): 1074-1084. DOI:10.11964/jfc.20201112492 GUO X L, HUANG Z H, MA A J, WANG Q M, XU R J, LI M, CHEN Z X. Effects of thermal stress on turbot (Scophthalmus maximus) myocardial injury and apoptosis[J]. Journal of Fisheries of China, 2022, 46(6): 1074-1084. DOI:10.11964/jfc.20201112492 |
| [34] |
WANG G, ZHANG N, WEI Y F. The impact of high-salt exposure on cardiovascular development in the early chick embryo[J]. Journal of Experimental Biology, 2015, 218: 3468-3477. DOI:10.1242/jeb.129486 |
| [35] |
刘奇奇, 温久福, 区又君, 李加儿, 周慧. 运输胁迫对四指马鲅幼鱼肝脏、鳃和脾脏组织结构的影响[J]. 南方农业学报, 2017, 48(9): 1708-1714. DOI:10.3969/j.issn.2095-1191.2017.09.27 LIU Q Q, WEN J F, OU Y J, LI J E, ZHOU H. Effects of transport stress on liver, gill and spleen tissue structure of juvenile Eleutheronema tetradactylum[J]. Journal of Southern Agriculture, 2017, 48(9): 1708-1714. DOI:10.3969/j.issn.2095-1191.2017.09.27 |
| [36] |
伍智, 刘进辉, 苏建明, 刘天龙, 姜卫星, 李立. 马来穿山甲的脾脏组织结构研究[J]. 经济动物学报, 2022(1): 26. DOI:10.13326/j.jea.2019.1440 WU Z, LIU J H, SU J M, LIU T L, JIANG W X, LI L. Histological structure of malay pangolin's spleen[J]. Journal of Economic Animal, 2022(1): 26. DOI:10.13326/j.jea.2019.1440 |
| [37] |
胡玲玲, 李加儿, 区又君, 于娜, 王刚. 条石鲷头肾和脾脏的显微结构观察[J]. 南方水产, 2010, 6(3): 41-45. DOI:10.3969/j.issn.1673-2227.2010.03.008 HU L L, LI J E, OU Y J, YU N, WANG G. Study on microstructure of head-kidney and spleen of Oplegnathus fasciatus[J]. South China Fisheries Science, 2010, 6(3): 41-45. DOI:10.3969/j.issn.1673-2227.2010.03.008 |
| [38] |
COUILLARD C M, WILLIAMS P J, COURTENAY S C. Histopathological evaluation of Atlantic tomcod (Microgadus tomcod) collected at estuarine sites receiving pulp and paper mill effluent[J]. Aquatic Toxicology, 1999, 44: 263-278. DOI:10.1016/S0166-445X(98)00085-X |
| [39] |
郝小凤, 刘洋, 凌去非. 氨氮对泥鳅的急性毒性及对其肝、鳃组织超微结构的影响[J]. 水生态学杂志, 2012, 33(5): 101-107. DOI:10.15928/j.1674-3075.2012.05.002 HAO X F, LIU Y, LING Q F. Acute toxicity test of ammonia nitrogen and effects of ammonia-N stress on the ultrastructure of gill and liver of Misgurnus anguillicaudatus[J]. Journal of Hydroecology, 2012, 33(5): 101-107. DOI:10.15928/j.1674-3075.2012.05.002 |
| [40] |
刘恩光. 急性热胁迫对白梭吻鲈肝脏和鳃组织损伤、细胞凋亡及免疫反应的影响[D]. 苏州: 苏州大学, 2021. DOI: 10.27351/d.cnki.gszhu.2021.000316. LIU E G. Effects of acute heat stress on liver and gill tissue damage, apoptosis and immune response of pikeperch (Sander lucioperca)[D]. Suzhou: Soochow University, 2021. DOI: 10.27351/d.cnki.gszhu.2021.000316. |
| [41] |
陈世喜. 卵形鲳鲹肝脏和鳃器官在急、慢性低氧胁迫下的生理组织及相关基因表达变化的研究[D]. 上海: 上海海洋大学, 2016. CHEN S X. Golden pompano (Trachinotus ovatus) liver, gills physiological and pathological changes and related gene expression under hypoxia stress[D]. Shanghai: Shanghai Ocean University, 2016. |
| [42] |
刘奇奇, 温久福, 区又君, 李加儿, 周慧, 汤清亮. 急性操作胁迫对四指马鲅幼鱼肝脏组织结构和氧化应激的影响[J]. 南方水产科学, 2017, 13(5): 103-109. DOI:10.3969/j.issn.2095-0780.2017.05.014 LIU Q Q, WEN J F, OU Y J, LI J E, ZHOU H, TANG Q L. Effects of acute handling stress on liver tissue and oxidative stress of juvenile Eleutheronema tetradactylum[J]. South China Fisheries Science, 2017, 13(5): 103-109. DOI:10.3969/j.issn.2095-0780.2017.05.014 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50