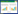文章信息
基金项目
- 广东省林业科技计划项目(2018KJCX054)
作者简介
- 毕可可(1981—),男,硕士,高级工程师,研究方向为古树名木保护与复壮、林业园林植物保护和生物防治,E-mail:53584150@qq.com.
文章历史
- 收稿日期:2023-04-05
【研究意义】扶桑绵粉蚧(Phenacoccus solenoposis) 起源于北美洲,是一种扩繁速度快、寄主范围广、适应能力强的世界性入侵昆虫[1]。截至2021年,它已蔓延至除南极洲外其他各大洲超过43个国家和地区[2],并且还在不断扩张。我国自2008年[3]首次发现扶桑绵粉蚧至2022年07月,已有14个省的125个县(区、市)记录了扶桑绵粉蚧的出现[4],共有166种寄主植物被报道[5],对我国棉花产业、蔬菜和园林植物种植均带来较大的经济损失[6-8]。目前,针对扶桑绵粉蚧的防治,仍以化学防治为主,常用的化学药剂主要有毒死蜱、吡虫啉、啶虫脒、呋虫胺和螺虫乙酯等[9-12]。由于扶桑绵粉蚧具有繁殖力强、世代重叠、抗药性强及体背具有蜡壳等特点[13],使其生态优势明显,在化学防治上难以取得突破,甚至引起的环境问题也日益凸显。虫生真菌是一类可以主动穿透昆虫蜡泌层和角质层进入昆虫体腔的真菌[14],其具有生产成本较低、产孢量大且对环境友好等特点,是具有较好应用前景的生物防治手段之一[15]。因此,挖掘具有应用前景的扶桑绵粉蚧虫生真菌资源,对扶桑绵粉蚧绿色防治发展具有重要意义。【前人研究进展】目前世界上记载的虫生真菌约100属1 000多种,我国已发现的虫生真菌涉及40多属400多种[16]。国内外针对扶桑绵粉蚧虫生真菌的研究仍较少,主要集中在早期开发真菌的致病力测定及资源挖掘等。Ujjan[17]测定了从野外采集和机构购买的共36个菌株对扶桑绵粉蚧不同虫龄的致病力,筛选出7个毒力较强的菌株,种类分别有金龟子绿僵菌(Metarrhizium anisopliae)、淡紫紫孢霉(Purpureocillium lilacinum)、玫烟棒束孢(Isaria farinosa)、球孢白僵菌(Beauvaria bassiana)和蜡蚧轮枝菌(Lecanicillium lecani);Ujjan等[18]在室内筛选出对扶桑绵粉蚧致病力最强的金龟子绿僵菌菌株PDRL526,且发现其与化学农药吡虫啉联合杀虫时的兼容效果最好。Khanzada等[19]在室内对比评估了5种常见虫生真菌对扶桑绵粉蚧的致病效果,发现玫烟棒束孢的致病效果最好。Nawaz等[20]在室内测定了球孢白僵菌(Bb-01、Bb-08)、金龟子绿僵菌(Ma-11.1、Ma-2.1)和玫烟棒束孢(If-2.3、If-02)对扶桑绵粉蚧2龄若虫的致病力,发现球孢白僵菌Bb-08的毒力最强。王震杰等[21]从扶桑绵粉蚧中分离得到了5种真菌,回接后的最高侵染率为66.7%,其中4种属于子囊菌门(Ascomycota)真菌,它们与扶桑绵粉蚧的关系可能为寄生或共生关系,而另外一种是担子菌门(Basidiomycota)真菌。袁盛勇等[22-23]在室内分别测定了球孢白僵菌Bb1287和蜡蚧轮枝菌MZ041024对扶桑绵粉蚧不同虫龄的致病力,发现该两种菌株对扶桑绵粉蚧若虫和成长均有较强的毒力。昆虫表皮是虫生真菌侵染过程的第一道屏障,由于虫生真菌接触至寄主昆虫体表后,需要在一定的温度和湿度下,经过一定的时间才能侵入,因此,虫生真菌是否侵染成功,与分生孢子在宿主体表的侵染过程密切相关[24]。虫生真菌侵染过程包含孢子附着在宿主体表、孢子萌发形成芽管、形成膨大附着胞穿透体壁和菌丝在宿主体内增殖4个阶段[25]。利用扫描电镜技术可以清晰地观察到分生孢子的侵染方式,是判断虫生真菌侵染能力的常用手段[26-27]。【本研究切入点】目前,可用于防控扶桑绵粉蚧的虫生真菌资源较少,具有生防潜力的菌株不足。因此,从扶桑绵粉蚧中挖掘致病力强病的虫生真菌资源,可为扶桑绵粉蚧的生物防控提供指导。【拟解决的关键问题】本研究于2018年9月,在上海普陀区采集到扶桑绵粉蚧僵虫,分离到一株虫生真菌菌株,结合形态学和分子系统学分析明确该菌株的分类地位。利用扫描电镜技术,观察菌株对扶桑绵粉蚧的侵染方式,明确其侵染能力。通过毒力测定,研究该菌株的生防潜力和应用前景,为挖掘更加安全、有效、持久控制的生物防治方法提供研究材料。
1 材料与方法 1.1 试验材料供试材料为2018年9月采集自上海普陀区扶桑树枝上的扶桑绵粉蚧僵虫。
供试虫源:毒力测定所需健康的扶桑绵粉蚧来自广州市林业和园林科学研究院植物保护研究所,在温室大棚马铃薯叶片上常年继代饲养。
供试培养基:马铃薯葡萄糖琼脂(PDA)培养基购自环凯微生物科技有限公司,按照使用说明配制,置于高压灭菌锅121℃灭菌15 min,备用。
主要试剂:dNTP、Phanta Max Super-Fidelity DNA聚合酶等PCR反应相关试剂购自南京诺唯赞生物技术有限公司;其余试剂均为国产分析纯。pEASY-T1载体,购自北京全式金生物技术有限公司;所用引物由擎科新业生物技术有限公司(北京)合成。
1.2 菌株分离纯化将扶桑绵粉蚧僵虫置于75% 乙醇中浸泡30 s,再经0.02% 次氯酸钠浸泡1 min后,用无菌水冲洗3次,无菌滤纸吸干虫体表面水分,置于PDA平板上28℃培养。待长出菌丝或菌落后,挑取具有真菌菌落特征的单菌落进行PDA平板续代培养获得真菌纯培养物。然后进行单胞分离得到纯化菌株,记为FE-1,并接种于斜面试管,4℃保存备用。
1.3 菌株鉴定1.3.1 形态鉴定 从纯化FE-1菌株的单菌落中取直径为5 mm的菌饼接在PDA平板中央,同时将灭菌后的盖玻片平放于菌饼,28 ℃培养7 d,每日观察菌落生长情况,记录菌落颜色和形态;待菌丝覆盖1/2盖玻片面积后,取盖玻片置于光学显微镜下观察菌丝和孢子形态。参照《真菌鉴定手册》[28]进行形态学鉴定。
1.3.2 分子鉴定 利用SDS法提取菌株基因组DNA,参照White等[28]设计的通用引物ITS4(5'-TCCTCCGCTTATTGATATGC-3')和ITS5(5'- GGAAGTAAAAGTCGTAACAAGG-3')进行rDNA ITS序列的扩增与测定。50 μL PCR反应体系,dNTP混合物1 μL、Phanta Max Super-Fidelity DNA聚合酶1 μL、上下游引物各1 μL,2×Phanta Max Buffer 25 μL和DNA模板1 μL,ddH2O补足至50 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃下变性15 s,55℃退火30 s,72 ℃延伸1 min;34个循环,最后72 ℃延伸5 min。扩增产物用2% 的琼脂凝胶电泳检测DNA片段。用胶回收试剂盒对PCR产物进行回收,并将PCR产物连接克隆在pEASY-T1载体上,将阳性克隆产物送至擎科新业生物技术有限公司测序。利用NCBI BLAST对所测序列进行比对分析,用Mega 7.0软件Clustal X方法进行多序列比对,以邻接法(Neighbor joining method)构建分子系统发育树。
1.4 菌株侵染方式1.4.1 菌株前处理 采用浸虫法[30],将含0.02% 吐温-80的孢子悬浮液(浓度为1×107 CFU/ mL)接种到扶桑绵粉蚧雌成虫,共接种5头,晾干后,置于1% 水琼脂板上,用无菌蒸馏水处理扶桑绵粉蚧作为对照。样品培养2~3 d后可见清晰的菌丝侵染虫体表面即可用2.5% 戊二醛4 ℃过夜固定,待脱水干燥。
1.4.2 SEM扫描电镜观察 将已过夜固定的扶桑绵粉蚧按以下方式进行脱水干燥:0.1 mol/L的磷酸缓冲液冲洗3次,每次10 min,蒸馏水冲洗3次后,再依次用70%、80%、90%、100% 乙醇脱水(每次5 min),然后用液态二氧化碳代替乙醇,利用EMS 850临界点干燥仪(美国Electron Microscopy Sciences公司)将样品干燥。最后将样品安装在短柱上,喷金后,即可在SEM(S-3000N扫描电子显微镜,日本日立公司)上观察。
1.5 毒力测定采用邓嘉茹等[30]浸虫法进行回接试验和生物学测定。将供试菌株接种于PDA平板上培养,待平板长满分生孢子后,用含0.02% 吐温-80的无菌水洗脱分生孢子,摇匀后用双层纱布过滤,用血球计数板在生物显微镜下计数,统计初始浓度,再用含0.05% 吐温-80的无菌水稀释至终浓度分别为1×104、1×105、1×106、1×107、1×108 CFU/mL,待用。
各取30头健康的扶桑绵粉蚧雌成虫置于直径9 cm的培养皿内,分别用小型喷雾器将上述提前配制的不同浓度的1 mL孢子悬浮液喷至虫体,浸泡20 s,使孢子液与雌成虫充分接触,然后将其挑至扶桑叶片背面,晾干。带有扶桑叶片的枝条用浸水花泥保湿,置于28 ℃人工气候培养箱(RH 90% 以上,12 L∶12 D)培养,以喷施0.02% 吐温-80无菌水为空白对照。每组设3次重复,每个重复30头虫。在菌株接种后2 d开始观察并统计菌株对扶桑绵粉蚧雌成虫的侵染和致死情况,计算校正死亡率。
校正死亡率=(处理组死亡率- 对照组死亡率)/(1- 对照组死亡率)×100%。
1.6 数据处理与分析试验所得数据采用SPSS 22.0软件进行Probit回归分析,得到回归方程,得出致死中浓度(LC50)和致死中时间(LT50)。
2 结果与分析 2.1 菌株FE-1的分离纯化从上海市普陀区一株扶桑枝条上采集获得扶桑绵粉蚧僵虫,置于体式显微镜观察(图 1A)。采用组织分离法,从扶桑绵粉蚧僵虫组织中分离出一个真菌菌落,经PDA平板传代培养,得到一株真菌纯培养物。进一步对真菌纯培养物进行单胞分离,纯化获得菌株FE-1(图 1B)。菌株FE-1菌落正面呈橙白色,菌丝棉絮状,菌落背面后期呈橙黄色。

|
| 图 1 扶桑绵粉蚧僵虫(A)和纯化的FE-1菌株菌落(B)形态 Fig. 1 The diseased P.solenoposis (A)and colony morphology of the purified strain FE-1(B) |
2.2 菌株FE-1的鉴定
2.2.1 菌株FE-1的形态学特征 将菌株FE-1置于PDA培养基28 ℃条件下,培养5 d后,菌落直径50~60 mm之间。经光学显微镜观察发现孢子形态呈两种类型,小型孢子卵形或长圆形,1~2个横隔(图 2A);大型孢子长柱形或镰刀形,微弯,有较多横隔(图 2B);分生孢子梗单生或丛生,菌丝无色有隔,细长分枝(图 2C)。结合上述菌落形态和孢子形状,发现其与镰刀菌属(Fusarium)形态特征一致。
|
| A:小型孢子;B:大型孢子;C:分生孢子梗 A: Small spores; B: Large spores; C: Conidiophore 图 2 菌株FE-1的形态学特征 Fig. 2 Morphological traits of strain FE-1 |
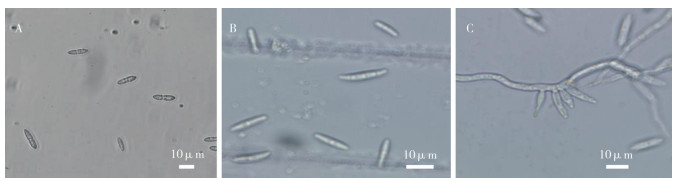
2.2.2 菌株FE-1的系统发育树分析 以ITS4和ITS5为引物,FE-1菌株基因组DNA为模板进行PCR扩增,获得大小约600 bp的目的片段。将PCR产物克隆到pEASY-T1载体后送去测序,在NCBI BLAST对测序结果进行比对,发现其与镰刀菌属的木贼镰刀菌(Fusarium equiseti)的rDNA ITS序列相似性达99%;系统发育树显示,菌株FE-1的rDNA ITS序列与镰刀菌属的木贼镰刀菌(序列编号为MH581383、MH581300、MH574897、MH567074等)聚在同一分枝上(图 3)。因此,结合上述培养特征、形态特征以及rDNA ITS序列分析结果,鉴定菌株FE-1为木贼镰刀菌。
|
| 图 3 基于rDNA ITS序列构建的菌株FE-1系统发育树 Fig. 3 Phylogenetic tree of strain FE-1 constructed based on rDNA-ITS sequences |
2.3 菌株FE-1的侵染方式
通过SEM扫描电镜,探究菌株FE-1对扶桑绵粉蚧的侵染方式,结果显示菌株FE-1的分生孢子先在扶桑绵粉蚧表皮处萌发形成芽管后水平生长,在适合的接触表皮处形成膨大的附着孢,进一步侵染进入昆虫体腔(图 4)。表明菌株FE-1对扶桑绵粉蚧具有侵染能力。

|
| A:菌丝在扶桑绵粉蚧表皮处水平生长;B:菌株芽管在扶桑绵粉蚧体壁形成附着孢进入体腔 A: Horizontal growth of the strain FE-1 on the epidermis of P.solenopsis; B: The expanded appressorium formation of the strain FE-1 图 4 菌株FE-1在扶桑绵粉蚧表皮上的侵染模式 Fig. 4 Infection mode of strain FE-1 on the epidermis of P.solenoposis |
2.4 菌株FE-1的毒力测定
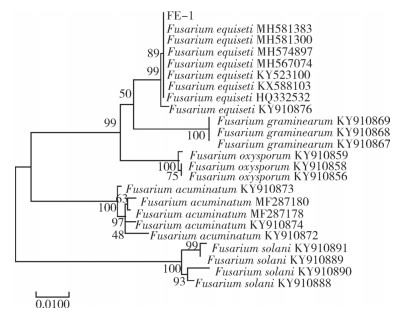
2.4.1 菌株FE-1回接扶桑绵粉蚧 回接试验结果表明,扶桑绵粉蚧可被菌株FE-1侵染。在侵染初期,接种后1 d,扶桑绵粉蚧的取食行为、虫体外部形态与健康扶桑绵粉蚧无差别。接种后2 d,扶桑绵粉蚧爬行逐渐缓慢,足部各关节以及背板等处长出少量白色菌丝(图 5A);接种后3 d,扶桑绵粉蚧虫体表面出现大量菌丝,开始出现僵虫(图 5B);接种后4 d,扶桑绵粉蚧被菌丝包裹死亡,虫体干瘪(图 5C),并产生大量分生孢子。以上结果表明菌株FE-1对扶桑绵粉蚧具有致死性。
|
| A:接种后2 d,扶桑绵粉蚧表面出现少量菌丝;B:接种后3 d,开始出现僵虫;C;接种后4 d,扶桑绵粉蚧表面产生大量分生孢子 A: A small amount mycelium appeared on the surface of the P.solenoposis two days after inoculation; B: The diseased P.solenoposis appeared three days after inoculation; C: The P.solenoposis produced a large numbers of conidia on the surface four days after inoculation. 图 5 扶桑绵粉蚧感染菌株FE-1后的动态症状 Fig. 5 Dynamic symptom of P.solenopsis infected with strain FE-1 |
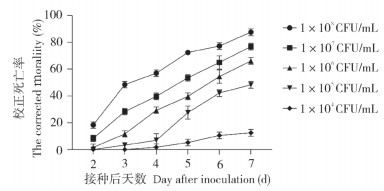
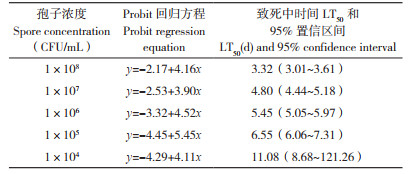
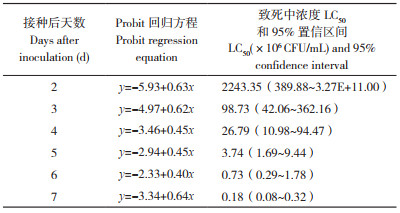
2.4.2 菌株FE-1对扶桑绵粉蚧室内毒力测定 不同浓度的菌株FE-1孢子悬浮液对扶桑绵粉蚧雌成虫的致病力如图 6所示。随着浓度的增大,致病力逐渐增强,当孢子浓度为1×108 CFU/mL时,接种7 d后扶桑绵粉蚧雌成虫的校正死亡率为87.50(±1.79)%。从菌株FE-1对扶桑绵粉蚧雌成虫的致死中时间LT50的结果看,随着分生孢子浓度的增加,致死中时间逐渐递减(表 1);当孢子浓度为1×108 CFU/mL时,致死中时间LT50最短、为3.32 d。从菌株FE-1对扶桑绵粉蚧雌成虫的致死中浓度LC50的结果看,随着接种时间的延长,菌株FE-1对扶桑绵粉蚧雌成虫的致死中浓度LC50递减(表 2);接种7 d后的致死中浓度LC50最低、为1.8×105 CFU/mL。以上结果表明菌株FE-1对扶桑绵粉蚧雌成虫具有一定的室内毒力。
|
| 图 6 不同浓度菌株FE-1孢子悬浮液对扶桑绵粉蚧雌成虫的校正死亡率 Fig. 6 Corrected morality of P.solenopsis female adults infected with strain FE-1 under different concentrations of spore suspension |
|
|
3 讨论
通常,来自原寄主的病原真菌比来自其他寄主的病原真菌对防治对象具有更高的毒力或更加专一的作用[31],这对于挖掘扶桑绵粉蚧高致病力虫生真菌资源起到关键的作用。本研究从扶桑绵粉蚧僵虫中分离得到一株虫生真菌,综合培养形状、形态学和系统发育树分析,确定该真菌为木贼镰刀菌。镰刀菌属真菌多为植物病原、昆虫病原以及人类致病菌。近年来,学者们发现部分镰刀菌属真菌对昆虫具有强致病性,而对寄主植物不致病[32];Sharma等[33]讨论了昆虫与镰刀菌之间的致病与互惠关系,重点是在野外条件下证明昆虫自然致病的研究;Santos等[34]发现至少有30种273株镰刀菌为昆虫致病菌。因此,镰刀菌是虫生真菌的重要组成部分[35],且寄主非常广泛,包括鞘翅目(Coleoptera)、双翅目(Diptera)、半翅目(Hemiptera)、膜翅目(Hymenoptera)和鳞翅目(Lepidoptera)[36]。而木贼镰刀菌是一种常见的镰刀菌类,目前国内外针对木贼镰刀菌作为虫生真菌对害虫的致病作用研究已有不少报道,如柳毒蛾(Leuccma cancliae)[37]、小麦茎叶蜂(Cephus cinctus)[38]、褐飞虱(Nilaparvata lugens)[33]、桃蚜(Myzus persicae)[39],但未见对扶桑绵粉蚧致病性研究的报道。菌株在环境中的持久性是选择其作为候选菌株制备微生物制剂的重要因素[40],而昆虫病原性镰刀菌类作为兼性病原体,在野外可能具有良好的生存潜力;此外,在自然中观察到镰刀菌类具高遗传变异的特点[41-42],扩大了菌株使用范围,有利于挖掘更多毒力强的菌株;还有一些镰刀菌种类是菌株复合体,例如赤霉病菌- 木贼种复合体(Fusarium incarnatum-equiseti)[43]、茄腐皮镰孢(F.solani)[44]、因其在昆虫致病相互作用中表现出高致病力,近年来也受到越来越多的关注。由此可见,镰刀菌因其生防潜力而备受青睐。
昆虫表皮是抵御病原真菌侵染的第一道屏障,判断虫生真菌是否对宿主有侵染能力,需要观察其是否能够形成膨大的附着孢穿透寄主体壁[25]。本研究通过扫描电镜技术,观察菌株FE-1对扶桑绵粉蚧的侵染方式,发现菌株FE-1可以在扶桑绵粉蚧特定接触表皮处形成膨大的附着孢,进一步进入昆虫体腔。Leger等[45]研究发现虫生真菌是依靠附着孢的膨压所产生的机械压力和所分泌的体壁降解酶的共同作用,进一步穿透扶桑绵粉蚧体壁,这与本研究观察到菌株FE-1的侵染方式是相一致的。因此,本研究从微观上验证了菌株FE-1对扶桑绵粉蚧具有侵染能力。
进一步通过室内毒力测定发现,菌株FE-1对扶桑绵粉蚧雌成虫具有较高的致病力,随着分生孢子浓度的增大,致病力逐渐增强,孢子浓度为1×108 CFU/mL时,接种后7 d,扶桑绵粉蚧雌成虫的校正死亡率为87.50(±1.79)%,LC50为1.8×105 CFU/mL,与赵雪怡等[39]利用木贼镰刀菌防治桃蚜(Myzus persicae)的致病力结果相近。表明在室内实验室条件下,菌株FE-1对扶桑绵粉蚧雌成虫具有一定的生防潜力,下一步还需对其野外防治效果进行相关研究,以明确其在自然环境下对扶桑绵粉蚧的防治效果。
将镰刀菌类用于生物防治中也受到了一些因素的限制,如产生致癌的霉菌毒素、大量释放植物病原到自然环境中[46]。从某种程度上来说,镰刀菌属的应用仍存在很多争议,认为其存在应用真菌的安全性,对昆虫寄主植物或其他植物存在潜在的风险,并且真菌的特异性在不同属、属内甚至一个种的菌株之间差异很大[35]。因此,在考虑利用镰刀菌株防治昆虫之前,应对其宿主特异性进行研究,确定其对寄主植物或其他植物的安全性。本研究分离得到的木贼镰刀菌,对扶桑绵粉蚧具有较高的毒力,且对扶桑绵粉蚧的寄主植物扶桑没有致病能力,但对其他寄主植物是否有致病力还需要进一步研究。
4 结论本研究从扶桑绵粉蚧僵虫中分离得到菌株FE-1,经纯化及鉴定确定其为木贼镰刀菌。扫描电镜观察发现菌株FE-1可在扶桑绵粉蚧体壁产生膨胀的附着孢来进入昆虫体腔,表明该菌株对扶桑绵粉蚧具有侵染能力。回接结果也表明菌株FE-1可逐步侵染扶桑绵粉蚧致死。室内毒力测定发现,分生孢子浓度、接种后时间与校正死亡率呈正相关;孢子浓度为1×108 CFU/mL时,LT50为3.32 d,在接种后7 d,扶桑绵粉蚧雌成虫的校正死亡率为87.50(±1.79)%;接种后7d,LC50为1.8×105 CFU/mL。综上所述,木贼镰刀菌FE-1对扶桑绵粉蚧雌成虫有较好的致病效果,极具生防潜力。
| [1] |
TINSLEY J D. An ants'-nest coccid from New Mexico[J]. The Ca na dia n Entomolog i st, 1898, 30(2): 47-48. DOI:10.4039/Ent3047-2 |
| [2] |
WAQAS M S, SHI Z H, YI T C, RONG X, SHOAIB A A Z, ELABASY A S S, JIN D C. Biology, ecology, and management of cotton mealybug Phenacoccus solenopsis Tinsley (Hemiptera: Pseudococcidae)[J]. Pest Management Science, 2021, 77(12): 5321-5333. DOI:10.1002/ps.6565 |
| [3] |
武三安, 张润志. 威胁棉花生产的外来入侵新害虫- 扶桑绵粉蚧[J]. 昆虫知识, 2009, 46(1): 159-162, 169. DOI:10.3969/j.issn.0452-8255.2009.01.033 WU S A, ZHANG R Z. Ph e nac o cc u s solenopsis, threatening seriously to cotton production.[J]. Chinese Bulletin of Entomology, 2009, 46(1): 159-162, 169. DOI:10.3969/j.issn.0452-8255.2009.01.033 |
| [4] |
中华人民共和国农业农村部. 全国农业植物检疫性有害生物分布行政区名录[EB/OL]. 2022. http://www.moa.gov.cn/xw/bmdt/202207/t202207-6404284.htm. Ministry of Agriculture and Rural Affairs of the People's Republic of China. National agricultural plant quarantine pest distribution administrative region directory[EB/OL]. 2022]. http://www.moa.gov.cn/xw/bmdt/202207/t202207-6404284.htm. |
| [5] |
TONG H, AO Y, LI Z, WANG Y, JIANG M. Invasion biology of the cotton mealybug, Phenacoccus solenopsis Tinsley: Current knowledge and future directions[J]. Journal of Integrative Agriculture, 2019, 18(4): 758-770. DOI:10.1016/S2095-3119(18)61972-0 |
| [6] |
李美珍. 共生菌Tremblaya phenacola与扶桑绵粉蚧营养互作的基因组分析[D]. 杭州: 浙江大学, 2022. DOI: 10.27461/d.cnki.gzjdx.2022.002383. LI M Z. Genomic analysis of the nutrition interactions between the symbiont Tremblaya phenacola and the cotton mealybug [D]. Hangzhou: Zhejiang University, 2022. DOI: 10.27461/d.cnki.gzjdx.2022.002383. |
| [7] |
余海滨, 梁伟莎, 方天松, 潘志萍. 广东省扶桑绵粉蚧对园林植物为害及其天敌的调查[J]. 环境昆虫学报, 2015, 37(5): 1109-1112. DOI:10.3969/j.issn.1674-0858.2015.05.28 YU H B, LIANG W S, FANG T S, PAN Z P. Investigation of demage and its natural enemies of Phenacoccus solenopsis Tinsley on garden plants in Guangdong Province[J]. Journal of Environmental Entomology, 2015, 37(5): 1109-1112. DOI:10.3969/j.issn.1674-0858.2015.05.28 |
| [8] |
王琳, 姚挺, 孙嘉祥. 扶桑绵粉蚧的监测与防治[J]. 广东农业科学, 2010(2): 99-100, 110. DOI:10.16768/j.issn.1004-874X.2010.02.034 WANG L, YAO T, SUN J X. The monitoring and control of Phenacoccus solenopsis Tinsley[J]. Guangdong Agricultural Sciences, 2010(2): 99-100, 110. DOI:10.16768/j.issn.1004-874X.2010.02.034 |
| [9] |
吴珍平, 吴洁, 杨兆光, 乔艳艳. 50% 呋虫胺对入侵害虫扶桑绵粉蚧的室内毒力及田间药效[J]. 生物灾害科学, 2023, 46(2): 117-120. DOI:10.3969/j.issn.2095-3704.2023.02.20 WU Z P, WU J, YANG Z G, QIAO Y Y. Virulence and field efficacy of 50% dinotefuran water dispersible granules on the invasive pest, Phenacoccus solenopsis Tinsley[J]. Biological Disaster Science, 2023, 46(2): 117-120. DOI:10.3969/j.issn.2095-3704.2023.02.20 |
| [10] |
王伟兰, 陈红松, 黄立飞, 姜建军, 杨朗. 4种杀虫剂对取食朱槿的扶桑绵粉蚧的毒杀作用[J]. 广东农业科学, 2014, 41(9): 99-103, 107. DOI:10.16768/j.issn.1004-874X.2014.09.025 WANG W L, CHEN H S, HUANG L F, JIANG J J, YANG L. Toxic effects of four insecticides on mealybug, Phenacoccus solenopsis Tinsley (Hemiptera: Pseudococcidae) fed on Hibiscus rosa-sinensis (Malvales: Malvaceae)[J]. Guangdong Agricultural Sciences, 2014, 41(9): 99-103, 107. DOI:10.16768/j.issn.1004-874X.2014.09.025 |
| [11] |
吴珍平, 吴洁, 杨兆光, 赵沛, 乔艳艳. 4种植物源杀虫剂对扶桑绵粉蚧毒力及龟纹瓢虫安全评价[J]. 中国农学通报, 2023, 39(12): 111-115. DOI:10.11924/j.issn.1000-6850.casb2022-0349.casb2022-0349 WU Z P, WU J, YANG Z G, ZHAO P, QIAO Y Y. Toxicity of four botanical insecticides to Phenacoccus solenopsis and safety evaluation to predator Propylaea japonica[J]. Chinese Agricultural Science Bulletin, 2023, 39(12): 111-115. DOI:10.11924/j.issn.1000-6850.casb2022-0349.casb2022-0349 |
| [12] |
张琪, 赵成, 卢晓霞, 于波, 黄钰婷. 新烟碱类杀虫剂对非靶标生物毒性效应的研究进展[J]. 生态毒理学报, 2020, 15(1): 56-71. DOI:10.7524/AJE.1673-5897.20190328001 |
| [13] |
FAND B B, SUROSHE S S. The invasive mealybug phenacoccus solenopsis Tinsley, a threat to tropical and subtropical agricultural and horticultural production systems-a review[J]. Crop Protection, 2015, 69: 34-43. DOI:10.1016/j.cropro.2014.12.001 |
| [14] |
MANNINO M C, HUARTE-BONNET C, DAVYT-COLO B, PEDRINI N. Is the insect cuticle the only entry gate for fungal infection? Insights into alternative modes of action of entomopathogenic fungi[J]. Journal of Fungi, 2019, 5(2): 33. DOI:10.3390/jof5020033 |
| [15] |
宋晓兵, 彭埃天, 凌金锋, 陈霞, 崔一平. 昆虫病原真菌基因组学及多组学研究进展[J]. 广东农业科学, 2021, 48(1): 17-25. DOI:10.16768/j.issn.1004-874X.2021.01.003 SONG X B, PENG A T, LING J F, CHEN X, CUI Y P. Research progress in genomics and multi-omics of entomopathogenic fungi[J]. Guangdong Agricultural Sciences, 2021, 48(01): 17-25. DOI:10.16768/j.issn.1004-874X.2021.01.003 |
| [16] |
刘春来. 在农林害虫生物防治中的应用[J]. 黑龙江农业科学, 2017(03): 68-73. DOI:10.11942/J.ISSN1002-2767.2017.03.0068 LIU C L. Application of entomopathogenic fungi in the biological control of agroforestry pests[J]. Heilongjiang Agricultural Sciences, 2017(03): 68-73. DOI:10.11942/J.ISSN1002-2767.2017.03.0068 |
| [17] |
UJJAN A A. Use of entomopathogenic fungi in biological control
of cotton mealybug (Phenacoccus Solenopsis) and mustard aphid (Lipaphis Er ysimi)//International Conference on Recent Advances in Space Technologies[C]. IEEE, 2014. DOI: 10.13140/RG.2.2.36677.12004.
|
| [18] |
UJJAN A A, KHANZADA M A, MAHAR A Q, SHAHZAD S. Efficiency of Metarhizium spp. (Sorokin) strains and insecticides against cotton mealybug Phenacoccus solenopsis (Tinsley)[J]. Pakistan Journal of Zoology, 2014, 46(6): 100-105. |
| [19] |
KHANZADA A M, KHANZADA M A, SYED R N, LODHI M A. Comparative effectiveness of entomopathogenic fungi against okra mealybug Phenacoccus solenopsis[J]. Pakistan Journal of Botany, 2021, 53(1). DOI:10.30848/PJB2021-1(2) |
| [20] |
NAWAZ M, SHOAIB F. Pat hogen icit y of d i f ferent isolate s of entomopathogenic fungi on cotton mealybug, Phenaccocus solenopsis Tinsley[J]. Pakistan Journal of Zoology, 2022, 54(1): 275-282. DOI:10.17582/JOURNAL.PJZ/20161124031127 |
| [21] |
王震杰, 张美翠, 阮永明. 扶桑绵粉蚧虫生真菌的分离及分子鉴定[J]. 安徽农业科学, 2014, 42(10): 2966-2968. DOI:10.3969/j.issn.0517-6611.2014.10.052 WANG Z J, ZHANG M C, RUAN Y M. Isolation and molecule identification of fungi associated with Phenacoccus solenopsis Tinsley[J]. Journal of Anhui Agricultural Sciences, 2014, 42(10): 2966-2968. DOI:10.3969/j.issn.0517-6611.2014.10.052 |
| [22] |
袁盛勇, 孔琼, 沈登荣, 张宏瑞, 陈斌, 薛春丽, 张红艳, 丁丽. 球孢白僵菌对扶桑绵粉蚧致病力的测定[J]. 华中农业大学学报, 2015, 34(4): 27-30. DOI:10.13300/j.cnki.hnlkxb.2015.04.002.hnlkxb.2015.04.002 YUAN S Y, KONG Q, SHEN D R, ZHANG H R, CHEN B, XUE C L, ZHANG H Y, DING L. Study on virulence of Beauvaria bassiana against Phenacoccus solenopsis Tinsley[J]. Journal of Huazhong Agricultural University, 2015, 34(4): 27-30. DOI:10.13300/j.cnki.hnlkxb.2015.04.002.hnlkxb.2015.04.002 |
| [23] |
袁盛勇, 闫鹏飞, 孔琼, 邓裕亮, 张宏瑞, 刘正喜, 何红飞. 蜡蚧轮枝菌对扶桑绵粉蚧的致病性研究[J]. 环境昆虫学报, 2016, 38(4): 748-754. DOI:10.3969/j.issn.1674-0858.2016.04.13.issn.1674-0858.2016.04.13 YUAN S Y, YAN P F, KONG Q, DENG Y L, ZHANG H R, LIU Z X, HE H F. Study on virulence of Verticillium lecanii against Phenacoccus solenopsis Tinsley[J]. Journal of Environmental Entomology, 2016, 38(4): 748-754. DOI:10.3969/j.issn.1674-0858.2016.04.13.issn.1674-0858.2016.04.13 |
| [24] |
王音, 雷仲仁, 张青文, 问锦曾. 绿僵菌侵染小菜蛾体表过程的显微观察[J]. 昆虫学报, 2005, 48(2): 188-193. DOI:10.16380/j.kcxb.2005.02.007 WANG Y, LEI Z R, ZHANG Q W, WEN J Z. Microscopic observations of infection process of Metarhizium anisopliae on the cuticle of the diamondback moth, Plutella xylostella[J]. Acta Entomologica Sinica, 2005, 48(2): 188-193. DOI:10.16380/j.kcxb.2005.02.007 |
| [25] |
KHUN K K, ASH G J, STEVENS M M, HUWER R K, WILSON B A L. Transmission of Metarhizium anisopliae and Beauveria bassiana to adults of Kuschelorhynchus macadamiae(Coleoptera: Curculionidae) from infected adults and conidiated cadavers[J]. Scientific Reports, 2021, 11(1): 2188. DOI:10.1038/s41598-021-81647-0 |
| [26] |
雷妍圆, 官昭瑛, SHOAIB F, SYED M Z, ABID H, 章玉苹. 2种昆虫病原真菌对草地贪夜蛾体表侵染模式的扫描电镜观察[J]. 南方农业学报, 2021, 52(3): 578-588. DOI:10.3969/j.issn.2095-1191.2021.03.004 LEI Y Y, GUAN Z Y, SHOAIB F, SYED M Z, ABID H, ZHANG Y P. Mode of infection on the cuticle of Spodoptera frugiperda(Lepidoptera: Noctuidae)by two entomopathogenic fungi species revealed by scanning electron microscopy[J]. Journal of Southern Agriculture, 2021, 52(3): 578-588. DOI:10.3969/j.issn.2095-1191.2021.03.004 |
| [27] |
葛喆昊, 王文秀, 董广平, 潘宏阳, 陈凤毛. 爪哇棒束孢侵染美国白蛾过程及抗氧化酶活性变化[J]. 应用昆虫学报, 2021, 58(2): 364-370. DOI:10.7679/j.issn.20951353.2021.037 GE Z H, WANG W X, DONG G P, PAN H Y, CHEN F M. Infection of Hyphantria cunea with Isaria javanica and associated changes in antioxidant enzyme activity[J]. Chinese Journal of Applied Entomology, 2021, 58(2): 364-370. DOI:10.7679/j.issn.20951353.2021.037 |
| [28] |
魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979. WEI J C. Fungal identification manual[M]. Shanghai: Shanghai Science and Technology Press, 1979. |
| [29] |
WHITE T J, BRUNS T D, LEE S, TAYLOR J W. Analysis of
phylogenetic relationships by amplification and direct sequencing
of ribosomal RNA genes. PCR protocols: A guide to methods and
applications[M]. San Diego: Academic Press, 1990: 315-322.
|
| [30] |
邓嘉茹, 孙龙华, 毕可可, 张劲蔼, 唐立鸿, 余晓碧. 埃及吹绵蚧的筛选、鉴定及其致病性测定[J]. 植物保护学报, 2020, 47(1): 53-64. DOI:10.13802/j.cnki.zwbhxb.2020.2019009 DENG J R, SUN L H, BI K K, ZHANG J A, TANG L H, YU X B. Screening and identification of the entomopathogenic fungus isolated from Egyptian f luted scale Icerya aegyptiaca and bioassay of its pathogenicity[J]. Journal of Plant Protection, 2020, 47(1): 53-64. DOI:10.13802/j.cnki.zwbhxb.2020.2019009 |
| [31] |
张挺峰, 王睿, 刘长仲. 一株侵染豌豆蚜的的分离及鉴定[J]. 昆虫学报, 2020, 63(1): 22-28. DOI:10.16380/j.kcxb.2020.01.003 ZHANG T F, WANG R, LIU C Z. Isolation and identification of an entomopathogenic fungus infecting Acyrthosiphon pisum (Hemiptera: Aphididae)[J]. Acta Entomologica Sinica, 2020, 63(1): 22-28. DOI:10.16380/j.kcxb.2020.01.003 |
| [32] |
KURUVILLA S, JACOB A. Host range of the entomogenous fungus Fusarium oxysporum Schlecht and its safety to three crop plants[J]. Current Science, 1979, 48: 603. DOI:10.2307/24082815 |
| [33] |
SHARMA L, MARQUES G. Fusarium, an entomopathogen-A myth or reality?[J]. Pathogens, 2018, 7(4): 93. |
| [34] |
SANTOS A C D S, DINIZ A G, TIAGO A, OLIVEIRA P V, TINTI N. Entomopathogenic Fusarium species: A review of their potential for the biological control of insects, implications and prospects[J]. Fungal Biology Reviews, 2020, 34(1). DOI:10.1016/j.fbr.2019.12.002 |
| [35] |
李宏科. 虫生真菌—镰刀菌的研究[J]. 湖南农业科学, 1989(4): 36-37. DOI:10.16498/j.cnki.Hnnykx.1989.04.017 LI H K. The research of entomopathogenic fungus-Fusarium[J]. Hunan Agricultural Sciences, 1989(4): 36-37. DOI:10.16498/j.cnki.Hnnykx.1989.04.017 |
| [36] |
MAJUMDAR A, BOETEL M A, JARONSKI S T. Discover y of Fusarium solani as a naturally occurring pathogen of sugarbeet root maggot (Diptera: Ulidiidae) pupae: Prevalence and baseline susceptibility[J]. Journal of Invertebrate Pathology, 2008, 97(1): 0-8. DOI:10.1016/j.jip.2007.05.003 |
| [37] |
苑森行, 杨玉景. 虫生真菌—木贼镰刀菌的初步研究[J]. 微生物学通报, 1986, 13(1): 13-14. DOI:10.13344/j.microbiol.China.1986.01.004 YUAN S X, YANG Y J. Entomopathogenic fungus-The primary research of Fusarium equiseti[J]. Microbiology China, 1986, 13(1): 13-14. DOI:10.13344/j.microbiol.China.1986.01.004 |
| [38] |
WENDA-PIESIK A, SUN Z, GREY W E, WEAVER D K. Mycoses of wheat stem sawfly (Hymenoptera: Cephidae) larvae by Fusarium spp. isolates[J]. Environmental Entomology, 2009, 38(2): 387-394. DOI:10.1603/022.038.0211 |
| [39] |
赵雪怡, 柴军发, 张暄翊, 洪波, 贾彦霞. 木贼镰刀菌的鉴定及其对桃蚜的致病性测定[J]. 中国生物防治学报, 2023, 39(1): 8. DOI:10.16409/j.cnki.2095-039x.2022.07.002 ZHAO X Y, CHAI J F, ZHANG X Y, HONG B, JIA Y X. Identification of Fusarium equiseti and its pathogenicity to Myzus persicae[J]. Chinese Journal of Biological Control, 2023, 39(1): 8. DOI:10.16409/j.cnki.2095-039x.2022.07.002 |
| [40] |
TIAGO P V, CARNEIRO-LEAO M P, MALOSSO E, OLIVEIRA N T, LIMAEAD L A. Persistence and effect of Metarhizium anisopliae in the fungal community of sugarcane soil[J]. Biocontrol, 2012, 57: 653-661. DOI:10.1007/s10526-012-9445-3 |
| [41] |
LESLIE J F, SUMMERELL B A. The fusarium laboratory manual[M]. Blackwell Professional, 2006: 31-43. DOI:10.1002/9780470278376
|
| [42] |
BURGESS L W. 2011 McAlpine memorial lecture - a love affair with Fusarium[J]. Australasian Plant Pathology, 2014, 43: 359-368. DOI:10.1007/s13313-013-0261-8 |
| [43] |
SANDOVAL-DENIS M, CROUS P W. Removing chaos from confusion: Assig ning na mes to com mon huma n a nd a nima l pat hogens in Neocosmospora[J]. Persoonia, 2018, 41: 109-129. DOI:10.3767/persoonia.2018.41.06 |
| [44] |
SANTOS A C S, TRINDADE J V C, LIMA C S, BARBOSA R N, COSTA A F, TIAGO P V, OLIVEIRA N T. Morphology, phylogeny
and sexual stage of Fusarium caatingaense and Fusarium pernambucanum, new species of the Fusarium incarnatum-equiseti species complex associated with insects in Brazil[J]. Mycologia, 2019, 111: 244-259. DOI:10.1080/00275514.2019.1573047 |
| [45] |
LEGER R J S, COOPER R M, CHARNLEY A K. Cuticle - degrading enzymes of entomopathogenic fungi: Cuticle degradation in vitro by enzymes from entomopathogens[J]. Journal of Invertebrate Pathology, 1986, 47(2): 167-177. DOI:10.1016/0022-2011(86)90043-1 |
| [46] |
O'DONNELL K, MCCORMICK S P, BUSMAN M, PROCTOR R H, WARD T J, DOEHRING G, GEISER D M, ALBERTS J F, RHEEDER J P. 1984 "Toxigenic Fusarium species: Identity and mycotoxicology" revisited[J]. Mycologia, 2018, 110(6): 1058-1080. DOI:10.1080/00275514.2018.1519773 |
 2023, Vol. 50
2023, Vol. 50