文章信息
基金项目
- 国家自然科学基金(31902388);广东省自然科学基金面上项目(2021A1515010850);高水平农科院建设-青年研究员项目(R2021PY-QY001);佛山市财政专项2021年度共建广东农业科技示范市项目(大口黑鲈苗种工厂标准化培育关键技术攻关与应用)
作者简介
- 彭凯,博士,研究员,硕士生导师。主要从事水产动物营养与饲料、水产健康养殖技术研究与推广工作。现任中国粮油学会饲料分会理事、广东省农村科技特派员、广东省饲料生产许可证审核专家、广东省地理标志库专家、广东省农业科学院院地合作科技先锋、广东省农业科学院青年岗位能手。先后主持国家自然科学基金、国家外国专家项目、中央财政农业发展专项、广东省自然科学基金面上项目、广东省国际合作交流项目、广州市基础与应用基础研究项目等30余项课题。获广东省优秀科技成果奖1项、广东省农业科学院科学技术一等奖1项。发表论文90篇,其中SCI论文40篇;参编著作2部。授权第一发明人专利37件,其中发明专利17件、实用新型专利20件;授权计算机软件著作权15件。以第一完成人起草团体标准3项。彭凯(1987 -),男,博士,研究员,研究方向为水产动物营养与饲料研发,E-mail:pengkai1016@126.com.
通讯作者
- 黄文(1987 -),男,博士,研究员,研究方向为水产动物育种与健康养殖,E-mail:huangwen549@126.com.
文章历史
- 收稿日期:2023-06-30
2. 华中农业大学水产学院,湖北 武汉 430070;
3. 肇庆市佰仕科生物科技有限公司,广东 肇庆 526105;
4. 广州飞禧特生物科技有限公司,广东 广州 510640;
5. 加拿大农业与农业食品部莱斯布里奇研究中心,阿尔伯塔 莱斯布里奇 T1J4B1
2. College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China;
3. Zhaoqing Baishike Biotechnology Co., Ltd., Zhaoqing 526105, China;
4. Guangzhou Fishtech Biotechnology Co., Ltd., Guangzhou 510640, China;
5. Lethbridge Research and Development Center, Agriculture and Agri-Food Canada, Lethbridge T1J4B1, Canada
【研究意义】缩合单宁是由黄烷-3- 醇或黄烷3, 4- 二醇单体聚合而成的多酚类化合物,其广泛存在于植物界,是一类化学结构和生物活性特殊的植物次级代谢产物[1]。由于高剂量缩合单宁阻碍动物对营养物质的有效利用,甚至造成机体代谢紊乱、器官损伤,因此,长期以来缩合单宁被视为“抗营养因子” [2]。但近年来研究发现,低剂量缩合单宁具有促进动物健康的潜在应用价值[3],归因于低剂量缩合单宁所表现的抑菌、抗炎、抗氧化、抗病毒、促进糖脂代谢等生物活性。后抗生素时代,植物提取物缩合单宁的生物活性逐渐受到广泛关注,适量缩合单宁不仅不影响动物的生长性能,还能发挥抗氧化、免疫调节、降脂、调节肠道微生态等功效,具有良好的“替抗”应用前景[3]。因此,开展缩合单宁饲料添加剂应用研究对提升养殖动物的健康和品质具有现实意义。
【前人研究进展】目前缩合单宁在动物生产上的研究主要集中于畜禽动物,其作为水产饲料添加剂的研究虽然不多,但已有研究表明,缩合单宁在草鱼[4-5]、中国花鲈[6-10]、日本花鲈[11-14]、凡纳滨对虾[15-16]上表现出抗氧化、抗炎、调节肠道微生态平衡等积极作用。肝脏是鱼类重要的代谢器官和免疫器官,也是维持鱼类生理机能最核心的器官之一,因此肝脏健康对鱼类生长和抗逆至关重要。适量缩合单宁还能降低草鱼[5]和美洲鳗鲡[17]的肝脏脂肪水平,维持肝脏健康。【本研究切入点】大口黑鲈(Micropterus salmoides),又名加州鲈,属于典型的肉食性鱼类,因其生长快、骨刺少、营养美味、养殖经济效益高而深受市场和消费者青睐。据中国渔业统计年鉴数据显示,2022年我国淡水养殖的大口黑鲈产量高达70万t[18],在我国淡水渔业发展中起重要支撑作用。然而,高密度养殖模式下出现的大口黑鲈代谢紊乱、口感油腻、病害频发等问题亟待解决。此外,由于饲养不当容易导致“脂肪肝”问题(大多在养殖中后期的大规格大口黑鲈中出现),这不仅不利于大口黑鲈的生存和健康,还将导致鱼肉品质降低[19],使养殖蒙受经济损失。目前,缩合单宁应用于缓解大规格大口黑鲈“脂肪肝”以及促进动物肝脏健康的研究鲜有报道。【拟解决的关键问题】本试验通过在大口黑鲈饲料中添加0.1%、0.2% 和0.4% 的缩合单宁,探究缩合单宁的适宜添加量及其对大规格大口黑鲈生长性能、血清代谢物、肝脏组织结构及脂肪含量的影响,旨在为缩合单宁在大口黑鲈饲料中的应用以及大口黑鲈健康养殖提供参考。
1 材料与方法 1.1 试验材料本试验于2022年10—11月在广东省农业科学院白云区农业科学试验中心的池塘网箱养殖系统中进行。供试的大规格大口黑鲈购于佛山市顺锋渔联水产有限公司,于网箱中暂养2周以适应养殖环境,暂养期间投喂商品饲料(购于佛山市南海区杰大饲料有限公司)。本试验采用的缩合单宁来源于葡萄籽(纯度≥ 95%),购于肇庆市佰仕科生物科技有限公司。
1.2 饲料配制基础饲料(G1)的原料组成及实测营养水平见表 1。在G1基础上分别添加0.1%(G2)、0.2%(G3)和0.4%(G4)的缩合单宁配制试验饲料。全部饲料原料粉碎过孔径250 μm的标准筛,维生素和矿物质预混料等微量组分采用逐级扩大法混匀,缩合单宁经蒸馏水溶解后直接添加到原料中。全部饲料原料经混合机混匀,采用SLX-80型双螺杆挤压膨化机制成膨化颗粒饲料(直径2 mm),经55 ℃烘干后冷却至室温,装入密封袋中,于-20 ℃冰箱中保存备用。

|
1.3 试验设计与饲养管理
暂养结束后,选取初体重为510(± 10.4)g的大规格大口黑鲈600尾,随机分为4组,每组3个网箱(长1.5 m×宽1.5 m×高3 m),每个网箱50尾鱼。分别投喂1.2的4种饲料,采用饱食投喂方法,每天定时投喂2次(8:00和18:00),记录水温、水质、投喂量和死亡情况,试验周期为30 d。试验期间水温为26(± 3)℃,pH 7.6~8.0,氨氮含量≤ 0.1 mg/L,亚硝酸盐含量≤ 0.01 mg/L,溶氧含量>5.0 mg/L。
1.4 样品采集与分析1.4.1 生长性能指标测定 试验结束前24 h禁食,统计每个网箱中大口黑鲈的总数量和总体重,计算存活率、增重率、特定生长率、采食量和饲料系数。每缸随机取3尾鱼,解剖并分离腹腔内的脂肪进行称重,计算腹脂率。
存活率(%)=100×末尾数/初始尾数;
增重率(%)=100×(末体重- 初始体重)/ 初始体重;
特定生长率(%/d)=100×(ln末体体重-ln初始体重)/饲养天数;
采食量(g/尾)=摄食饲料总量/〔(初始尾数+ 终末尾数)/2〕;
饲料系数=摄食饲料总量/(末体重- 初始体重);
腹脂率(%)=100×腹腔脂肪总量/末体重。
1.4.2 血清代谢物测定 从每个网箱随机取10尾鱼,用40 mg/L间氨基苯甲酸乙酯甲磺酸盐(MS- 222)麻醉,于尾静脉处采集血液,室温下静置2 h后离心(3 500 r/min,10 min)制备血清,置于-20 ℃冰箱中保存,用于血清代谢物分析。血清代谢物如白蛋白、球蛋白、谷丙转氨酶、谷草转氨酶、葡萄糖、总胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇等采用全自动生化分析仪(日立7600,日本)测定。
1.4.3 肝脏组织结构观测 从每个网箱随机取6尾鱼,解剖取肝脏组织,先用数码相机拍照,随后将肝脏组织完全浸没于4% 多聚甲醛溶液中,放置48 h进行组织固定,制作石蜡切片,采用H&E染色法染色,于显微镜下拍照并观察肝脏的组织形态。
1.4.4 肝脏脂肪含量测定 从每个网箱随机取6尾鱼,解剖取肝脏组织并完全浸没于4% 多聚甲醛溶液中,放置48 h进行组织固定,然后脱水、石蜡包埋、切片(厚度8 μm)、油红O染色、拍照,用于肝脏中脂滴面积比的分析。从每个网箱另取6尾鱼,解剖取肝脏组织,采用乙醚抽提法(GB/T 6432-2006)分析肝脏粗脂肪含量。
1.5 数据统计与分析采用SPSS 17.0统计软件中的单因素方差分析(One-way ANOVA)和Duncan氏法均值多重比较法对试验结果的差异显著性进行分析,若不满足方差齐性则采用Dunnett-T3检验法进行多重比较。
2 结果与分析 2.1 饲料中添加缩合单宁对大规格大口黑鲈生长性能的影响饲料中添加缩合单宁对大规格大口黑鲈生长性能的影响如图 1所示。各组之间大口黑鲈的采食量、增重率和特定生长率无显著差异。与G1组相比,G2和G3组存活率无显著差异,G4组存活率显著下降15.79%(P < 0.05);G2、G3、G4组腹脂率显著下降12.03%、16.18%、13.69%(P < 0.05);G2、G3组饲料系数无显著差异,G4组饲料系数显著升高17.44%(P < 0.05)。

|
|
G1:基础饲料;G2、G3、G4:基础饲料分别添加0.1%、0.2%、0.4% 缩合单宁 柱上小写英文字母不同者表示差异显著(P < 0.05) G1: Basal diet; G2、G3、G4: Basal diet supplemented with 0.1%, 0.2%, 0.4% condensed tannins respectively Different lowercase letters on the columns indicate significant differences (P < 0.05) 图 1 饲料中添加缩合单宁对大规格大口黑鲈生长性能的影响 Fig. 1 Effects of dietary condensed tannins on growth performance of large-sized Micropterus salmoides |
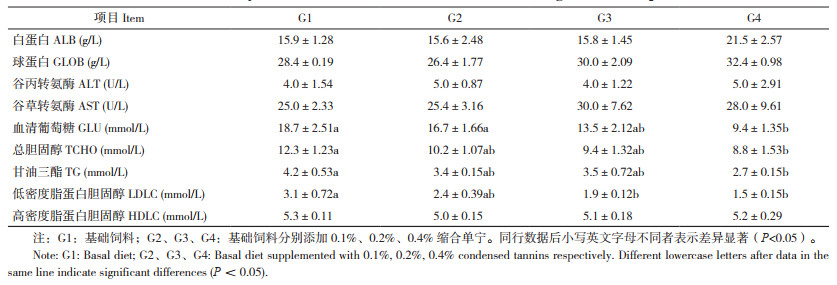
2.2 饲料中添加缩合单宁对大规格大口黑鲈血清代谢物的影响
饲料中添加缩合单宁对大规格大口黑鲈血清代谢物的影响如表 2所示。各组之间大口黑鲈的血清白蛋白、球蛋白、高密度脂蛋白胆固醇的含量及谷丙转氨酶、谷草转氨酶的活性无显著差异。与G1组相比,G2、G3组血清葡萄糖、总胆固醇、甘油三酯含量无显著差异,而G4组血清葡萄糖、总胆固醇、甘油三酯含量则分别显著下降49.73%、28.46%、35.71%(P < 0.05);G2组血清低密度脂蛋白胆固醇含量无显著差异,G3、G4组血清低密度脂蛋白胆固醇含量分别显著下降38.71%、51.61%(P < 0.05)。
|
2.3 饲料中添加缩合单宁对大规格大口黑鲈肝脏表观形态和组织结构的影响
饲料中添加缩合单宁对大规格大口黑鲈肝脏表观形态和组织结构的影响分别如图 2和图 3所示。由图 2可见,G1和G2组大口黑鲈的肝脏呈现不同程度的“花肝”现象,G3和G4组肝脏颜色鲜红、形态正常。图 3显示G1组肝细胞空泡化程度高,局部出现炎症浸润现象;G2组肝细胞有轻微的空泡化现象,局部出现炎症浸润;G3和G4组肝细胞形态结构正常,未见明显的炎症浸润。

|
| G1:基础饲料;G2、G3、G4:基础饲料分别添加0.1%、0.2%、0.4% 缩合单宁 G1: Basal diet; G2、G3、G4: Basal diet supplemented with 0.1%, 0.2%, 0.4% condensed tannins respectively 图 2 饲料中添加缩合单宁对大规格大口黑鲈肝脏表观形态的影响 Fig. 2 Effects of dietary condensed tannins on the livermorphology of large-sized Micropterus salmoides |

|
|
G1:基础饲料;G2、G3、G4:基础饲料分别添加 0.1%、0.2%、0.4% 缩合单宁 G1: Basal diet; G2、G3、G4: Basal diet supplemented with 0.1%, 0.2%, 0.4% condensed tannins respectively 图 3 饲料中添加缩合单宁对大规格大口黑鲈肝脏组织结构的影响(H&E染色,× 200) Fig. 3 Effects of dietary condensed tannins on liver histomorphology of large-sized Micropterus salmoides (H&E staining, × 200) |
2.4 饲料中添加缩合单宁对大规格大口黑鲈肝脏脂肪含量的影响
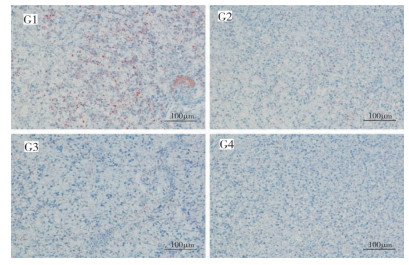
饲料中添加缩合单宁对大规格大口黑鲈肝脏脂肪分布、脂肪含量及脂滴面积比的影响分别如图 4和图 5所示。由图 4可见,肝脏经染色后脂质呈红色,细胞核呈蓝色,随着饲料中缩合单宁含量的增加,肝脏中代表脂质的染色面积显著降低。与G1相比,G2、G3和G4组大口黑鲈的肝脏脂肪含量分别显著降低9.52%、10.84%、11.25%(P < 0.05),G3和G4组肝脏脂肪含量分别显著低于G2组1.45%、1.91%(P < 0.05);大口黑鲈肝脏脂滴面积比由大到小依次为G1(4.32%)> G2(0.76%)> G3(0.57%)> G4(0.20%)(P < 0.05)(图 5)。
|
|
G1:基础饲料;G2、G3、G4:基础饲料分别添加 0.1%、0.2%、0.4% 缩合单宁 G1: Basal diet; G2、G3、G4: Basal diet supplemented with 0.1%, 0.2%, 0.4% condensed tannins respectively 图 4 饲料中添加缩合单宁对大规格大口黑鲈肝脏脂肪分布的影响(油红O染色,× 200) Fig. 4 Effects of dietary condensed tannins on liver lipid distribution of large-sized Micropterus salmoides (Oil red O staining, × 200) |

|
|
G1:基础饲料;G2、G3、G4:基础饲料分别添加0.1%、0.2%、0.4% 缩合单宁 柱上小写英文字母不同者表示差异显著(P < 0.05) G1: Basal diet; G2、G3、G4: Basal diet supplemented with 0.1%, 0.2%, 0.4% condensed tannins respectively Different lowercase letters on the columns indicate significant differences (P < 0.05) 图 5 饲料中添加缩合单宁对大规格大口黑鲈肝脏脂肪含量和脂滴面积比的影响 Fig. 5 Effects of dietary condensed tannins on liver fat content and lipid droplet area ratio of large-sized Micropterus salmoides |
3 讨论 3.1 饲料中添加缩合单宁对大规格大口黑鲈生长性能的影响
缩合单宁属于天然多酚类化合物,作为功能性饲料添加剂仅在草鱼[4-5]、中国花鲈[6-10]、日本花鲈[11-14]、凡纳滨对虾[15-16]、美洲鳗鲡[17]等少数水产动物品种上有相关研究,其对水产动物生长和健康影响的研究仍相当缺乏。本研究结果表明,各组之间大口黑鲈的采食量、增重率和特定生长率均无显著差异,说明饲料中添加0.1%~0.4% 缩合单宁不影响饲料的适口性,也不会对大口黑鲈的生长速率造成负面影响。0.1% 和0.2% 缩合单宁对大口黑鲈的存活率和饲料系数无显著影响,表明适量的缩合单宁(0.1%、0.2%)并不影响大口黑鲈的存活与饲料转化效率,而0.4% 剂量组大口黑鲈的饲料系数显著下降,可能与高剂量缩合单宁的抗营养特性有关。高剂量缩合单宁被视为“抗营养因子” [1],归因于缩合单宁具有较强的蛋白质结合能力,亦可与消化酶、碳水化合物、矿物质结合形成复合物,从而阻碍营养物质的消化和利用[20]。本试验结果与缩合单宁在花鲈[6]上的研究结果一致,即低剂量缩合单宁不影响成活率和饲料系数,而高剂量缩合单宁抑制饲料养分的消化和吸收,损伤肠道组织。海鲈[14]相关研究也表明,低剂量的葡萄籽缩合单宁不影响海鲈的生长性能和肠道组织结构,但高剂量缩合单宁造成肠道胰蛋白酶和刷状缘酶的活性下降。本试验中,0.4% 剂量组大口黑鲈存活率显著下降可能归因于高剂量缩合单宁对机体造成损伤,已有研究表明高剂量缩合单宁不仅可显著破坏草鱼[4]、花鲈[6, 10]、凡纳滨对虾[16]肠道组织结构,还可通过其代谢产物进入血液循环损害机体其他器官[21]。
3.2 饲料中添加缩合单宁对大规格大口黑鲈血清代谢物的影响血液代谢物水平可间接反映鱼体的健康状况。本研究结果表明,大口黑鲈血清葡萄糖、胆固醇及甘油三酯的含量随着缩合单宁添加量的升高而下降,并在0.4% 剂量时差异显著,说明高剂量缩合单宁具有促进糖脂代谢的效果。这与缩合单宁应用于花鲈[7]上的研究结果一致,即0.1%、0.2% 缩合单宁可促进花鲈血清糖脂代谢。低密度脂蛋白胆固醇的作用是将肝脏合成的内源性胆固醇运输到肝外组织(如转移至血液),而本研究中大口黑鲈血清低密度脂蛋白胆固醇含量随着缩合单宁剂量的升高而降低,并在0.2% 剂量时差异显著,说明缩合单宁可能抑制了胆固醇由肝脏向血液转移,从而导致血清中总胆固醇和低密度脂蛋白胆固醇的含量下降。此外,除血清糖脂含量降低外,腹脂率和肝脂含量也显著降低。缩合单宁添加组大口黑鲈的腹脂率均显著降低,肝脏油红O染色结果也说明缩合单宁可显著降低肝脏脂滴面积比,缓解大口黑鲈的“脂肪肝”现象,上述结果说明饲料中添加适量的缩合单宁对促进大口黑鲈糖脂代谢具有积极作用。相关研究表明,缩合单宁能够促进水产动物的糖脂代谢,如低于2 g/kg的缩合单宁可促进中国花鲈的糖脂代谢[7],饲料中添加0.1% 缩合单宁可改善海鲈由高碳水化合物引起的生长性能下降及血糖水平升高,归因于缩合单宁对海鲈肝脏糖代谢相关酶(如葡萄糖激酶、丙酮酸激酶)活性及基因表达的促进作用[11]。体外研究发现,缩合单宁可通过离子相互作用、疏水相互作用和分子间氢键直接与胆固醇结合,且其结合能力随缩合单宁的浓度升高而增强[22]。另有研究指出,缩合单宁还可通过与脂肪酶、胆固醇酯酶、胆汁酸的相互作用来减少脂质的消化[23-24]。Oliveira等[25]发现,缩合单宁除了通过抑制α- 淀粉酶阻碍葡萄糖吸收外,还能通过抑制胰脂肪酶从而间接抑制甘油三酯的吸收。综上,一方面缩合单宁可影响糖脂的消化和吸收进程,从而降低机体对糖脂的摄入量;另一方面缩合单宁可介导糖脂代谢途径、相关酶活性及基因表达,从而促进糖脂分解代谢并降低血液中的糖脂水平。
3.3 饲料中添加缩合单宁对大规格大口黑鲈肝脏组织结构和脂肪含量的影响组织结构观察能够直接反映动物器官的生理状态和健康程度,是判断组织器官是否发生病变的常用手段。本研究结果表明,饲料中添加缩合单宁有利于促进肝脏健康,缓解“花肝”现象。Kang等[26]报道,饲料中添加高剂量缩合单宁对大口黑鲈的肝脏造成氧化损伤,并诱发炎症反应。与之相反,低剂量缩合单宁却表现出缓解氧化应激和炎症损伤的效应,这与本研究结果相一致,即随着缩合单宁添加量上升,大口黑鲈“花肝”问题得到改善,且肝脏的空泡化、炎症浸润现象也减弱。相似地,缩合单宁还可缓解海鲈黄曲霉毒素B 1中毒[8]、高碳水化合物摄入[11]、铜离子应激[12]、缺氧胁迫[13]引起的氧化损伤,增强肝脏的抗氧化能力。本试验中缩合单宁改善大口黑鲈肝脏健康的原因可能是缩合单宁增强了肝脏的抗氧化功能,后续研究有待进一步证实。本试验结果表明,随着缩合单宁添加量的升高,大口黑鲈肝脏脂肪含量和脂滴面积比均显著下降,说明缩合单宁抑制了肝脏脂肪的沉积,其机制可能与缩合单宁调控脂代谢相关酶的活性、基因表达量及抑制脂肪细胞的生存有关。如顾艾鑫等[27]研究发现,缩合单宁通过下调脂肪酸合成酶和过氧化物酶体增殖剂激活受体PPAR γ的基因表达水平,或者通过抑制Wnt3a/β-catenin信号通路从而破坏脂肪细胞的增殖和分化,从而抑制脂肪合成。Han等[28]报道,缩合单宁通过削弱胰岛素抵抗、抗氧化应激作用,使肠道微生态及屏障功能恢复正常,进而抑制肝炎及肝脏脂肪蓄积。相似地,缩合单宁对海鲈肝脏糖酵解和糖异生酶的活性及基因表达具有积极影响[11]。在陆生动物上,缩合单宁对高脂诱导的鼠表现出改善糖脂代谢的效果,且肝脏脂肪沉积下降[29-30],这与本试验结果相一致。
4 结论在本研究条件下,较高添加剂量(0.4%)缩合单宁导致大规格大口黑鲈存活率显著下降,且饲料系数显著升高,但促进糖脂代谢作用明显,腹脂率显著下降,血清葡萄糖、总胆固醇、甘油三酯的含量及肝脏脂肪含量均显著下降。饲料中添加适量(0.1% 和0.2%)缩合单宁对大规格大口黑鲈存活率、增重率、特定增长率和饲料系数无显著影响,但能降低腹脂和肝脂含量,其中以0.2% 缩合单宁促进糖脂代谢作用效果较好。此外,随着缩合单宁添加量升高,大规格大口黑鲈肝脏健康问题逐渐改善,肝脏组织空泡化、炎症浸润现象减轻。以肝脏健康为评价依据,缩合单宁在大口黑鲈饲料中的适宜添加量为0.2%。
| [1] |
HUANG Q Q, LIU X L, ZHAO G Q, HU T M, WANG Y X. Potential and challenges of tannins as an alternative to in-feed antibiotics for farm animal production[J]. Animal Nutrition, 2018, 4(2): 137-150. DOI:10.1016/j.aninu.2017.09.004 |
| [2] |
CHUNG K T, WEI C I, JOHNSON M G. Are tannins a doubleedged sword in biology and health[J]. Trends in Food Science and Technology, 1998, 9(4): 168-175. DOI:10.1016/S0924-2244(98)00028-4 |
| [3] |
周雨瀚, 彭凯, 王国霞, 黄燕华, 陈冰, 莫文艳, 王海瑞, 曹俊明. 植物提取物单宁的生物活性及其在水产养殖上的研究进展[J]. 饲料研究, 2020, 43(5): 117-122. DOI:10.13557/j.cnki.issn1002-2813.2020.05.033 ZHOU Y H, PENG K, WANG G X, HUANG Y H, CHEN B, MO W Y, WANG H R, CAO J M. Biological activities and research progress in aquaculture of plant extract tannin[J]. Feed Research, 2020, 43(5): 117-122. DOI:10.13557/j.cnki.issn1002-2813.2020.05.033 |
| [4] |
黎梅. 缩合单宁对生长中期草鱼生产性能、肠道结构和免疫功能的影响及其机制[D]. 成都: 四川农业大学, 2019. DOI: 10.27345/d.cnki.gsnyu.2019.000940. LI M. Effects of condensed tannins on growth performance, intestinal structure and immune function as well as the mechanisms in ongrowing grass carp (Ctenopharyngodon idella)[D]. Chengdu: Sichuan Agricultural University, 2019. DOI: 10.27345/d.cnki.gsnyu.2019.000940. |
| [5] |
LU R H, QIN C B, YANG F, ZHANG W Y, ZHANG Y R, YANG G K, YANG L P, MENG X L, YAN X, NIE G X. Grape seed proanthocyanidin extract ameliorates hepatic lipid accumulation and inflammation in grass carp (Ctenopharyngodon idella)[J]. Fish Physiology and Biochemistry, 2020, 46(5): 1665-1677. DOI:10.1007/s10695-020-00819-3 |
| [6] |
彭凯, 陈冰, 赵红霞, 王丽娟, 朱喜锋, 黄文. 缩合单宁对海鲈生长性能、体成分、营养物质表观消化率及肠道组织结构的影响[J]. 中国畜牧兽医, 2022, 49(8): 2953-2960. DOI:10.16431/j.cnki.1671-7236.2022.08.011 PENG K, CHEN B, ZHAO H X, WANG L J, ZHU X F, HUANG W. Effects of condensed tannins on growth performance, body composition, apparent digestibility of nutrients, and intestinal morphology of Lateolabrax maculatus[J]. China Animal Husbandry and Veterinary Medicine, 2022, 49(8): 2953-2960. DOI:10.16431/j.cnki.1671-7236.2022.08.011 |
| [7] |
PENG K, CHEN B, ZHAO H X, WANG Y X, HUANG W. Condensed tannins improve glycolipid metabolism but induce liver injury of Chinese seabass (Lateolabrax maculatus)[J]. Frontiers in Marine Science, 2022, 9: 902633. DOI:10.3389/FMARS.2022.902633 |
| [8] |
PENG K, CHEN B, ZHAO H X, ZHENG C T, WANG Y X, LUO C Y, HUANG W. Condensed tannins alleviate aflatoxin B1-induced injury in Chinese sea bass (Lateolabrax maculatus)[J]. Aquaculture, 2022, 552: 738029. DOI:10.1016/J.AQUACULTURE.2022.738029 |
| [9] |
PENG K, CHEN B, ZHAO H X, WANG Y X, ZHENG C T, LU H J, HUANG M W, ZHAO J C, HUANG W. Reevaluation of dietary condensed tannins on growth, antioxidant and immune response and muscle quality of Chinese seabass (Lateolabrax maculatus)[J]. Aquaculture, 2022, 558: 738413. DOI:10.1016/J.AQUACULTURE.2022.738413 |
| [10] |
CHEN B, QIU J Q, WANG Y X, HUANG W, ZHAO H X, ZHU X F, PENG K. Condensed tannins increased intestinal permeability of Chinese seabass (Lateolabrax maculatus) based on microbiome-metabolomics analysis[J]. Aquaculture, 2022, 560: 738615. DOI:10.1016/J.AQUACULTURE.2022.738615 |
| [11] |
PENG K, WANG G X, ZHAO H X, WANG Y X, MO W Y, WU H M, HUANG Y H. Effect of high level of carbohydrate and supplementation of condensed tannins on growth performance, serum metabolites, antioxidant and immune response, and hepatic glycometabolism gene expression of Lateolabrax japonicus[J]. Aquaculture Reports, 2020, 18: 100515. DOI:10.1016/j.aqrep.2020.100515 |
| [12] |
PENG K, ZHOU Y H, WANG Y X, WANG G X, HUANG Y H, CAO J M. Inclusion of condensed tannins in Lateolabrax japonicus diets: Effects on growth, nutrient digestibility, antioxidant and immune capacity and copper sulphate stress resistance[J]. Aquaculture Reports, 2020, 18: 100525. DOI:10.1016/j.aqrep.2020.100525 |
| [13] |
PENG K, WANG G X, WANG Y X, CHEN B, SUN Y P, MO W Y, LI G M, HUANG Y H. Condensed tannins enhanced antioxidant capacity and hypoxic stress survivability but not growth performance and fatty acid profile of juvenile Japanese seabass (Lateolabrax japonicus)[J]. Animal Feed Science and Technology, 2020, 269: 114671. DOI:10.1016/j.anifeedsci.2020.114671 |
| [14] |
PENG K, ZHAO H X, WANG G X, CHEN B, MO W Y, HUANG Y H. Effect of condensed tannins on growth performance, intestinal immune capacity and bacterial microbiomes of Lateolabrax japonicus[J]. Aquaculture Research, 2021, 52(11): 5321-5331. DOI:10.1111/ARE.15402 |
| [15] |
彭凯, 陈冰, 莫文艳, 吴汉, 黄文. 饲料中添加缩合单宁对凡纳滨对虾生长性能、体成分、血清生化及抗氧化指标的影响[J]. 动物营养学报, 2022, 34(2): 1165-1174. DOI:10.3969/j.issn.1006-267x.2022.02.048 PENG K, CHEN B, MO W Y, WU H, HUANG W. Effects of dietary condensed tannins on growth performance, body composition, serum biochemical and antioxidant indexes of Litopenaeus vannamei[J]. Chinese Journal of Animal Nutrition, 2022, 34(2): 1165-1174. DOI:10.3969/j.issn.1006-267x.2022.02.048 |
| [16] |
PENG K, HUANG W, ZHAO H X, SUN Y P, CHEN B. Dietary condensed tannins improved growth performance and antioxidant function but impaired intestinal morphology of Litopenaeus vannamei[J]. Aquaculture Reports, 2021, 21: 100853. DOI:10.1016/J.AQREP.2021.100853 |
| [17] |
WANG Y, CHEN X H, WU X Y, CAI G H, ZHAI S W. Effects of dietary supplementation of peanut skin proanthocyanidins on growth performance and lipid metabolism of the juvenile American eel (Anguilla rostrata)[J]. Animals, 2022, 12(18): 2375. DOI:10.3390/ANI12182375 |
| [18] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2022中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2022. Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Aquatic Technology Extension Center, Chinese Fisheries Association. 2022 China Fishery Statistics Yearbook[M]. Beijing: China Agricultural Press, 2022. |
| [19] |
彭凯, 王国霞, 赵红霞, 黄燕华. 饲料单宁提高鱼类糖利用能力的作用机制研究进展[J]. 动物营养学报, 2021, 33(3): 1208-1215. DOI:10.3969/j.issn.1006-267x.2021.03.002 PENG K, WANG G X, ZHAO H X, HUANG Y H. Advances in studies on mechanisms of dietary tannins improving sugar utilization of fish[J]. Chinese Journal of Animal Nutrition, 2021, 33(3): 1208-1215. DOI:10.3969/j.issn.1006-267x.2021.03.002 |
| [20] |
MANZOOR F, NISA M N, HUSSAIN H A, AHMAD N, UMBREEN H. Effect of chestnut hydrolysable tannin on weight management and ovarian histopathology of healthy female rats[J]. Journal of Animal and Plant Sciences, 2021, 31(3): 831-840. DOI:10.36899/JAPS.2021.3.0273 |
| [21] |
艾庆辉, 苗又青, 麦康森. 单宁的抗营养作用与去除方法的研究进展[J]. 中国海洋大学学报, 2011, 41(S): 33-40. DOI:10.16441/j.cnki.hdxb.2011.z1.005 AI Q H, MIAO Y Q, MAI K S. The anti-nutritional effects and the degradations of dietary tannins: A review[J]. Periodical of Ocean University of China, 2011, 41(S): 33-40. DOI:10.16441/j.cnki.hdxb.2011.z1.005 |
| [22] |
ZENG X Q, DU Z J, DING X M, JIANG W B. Characterization of the direct interaction between apple condensed tannins and cholesterol in vitro[J]. Food Chemistry, 2020, 309: 125762. DOI:10.1016/j.foodchem.2019.125762 |
| [23] |
LI X X, PU Y J, XU Y, CAO J K, JIANG W B. Potential hypolipidemic effects of banana condensed tannins through the interaction with digestive juice components related to lipid digestion[J]. Journal of Agricultural and Food Chemistry, 2021, 69(31): 8703-8713. DOI:10.1021/ACS.JAFC.1C02794 |
| [24] |
NISHIDA S, KATSUMI N, MATSUMOTO K. Prevention of the rise in plasma cholesterol and glucose levels by kaki-tannin and characterization of its bile acid binding capacity[J]. Journal of the Science of Food and Agriculture, 2020, 101(5): 2117-2124. DOI:10.1002/jsfa.10834 |
| [25] |
OLIVEIRA R F, GONÇALVES G A, INÁCIO F D, KOEHNLEIN E A, DE SOUZA C G, BRACHT A, PERALTA R M. Inhibition of pancreatic lipase and triacylglycerol intestinal absorption by a pinhão coat (Araucaria angustifolia) extract rich in condensed tannin[J]. Nutrients, 2015, 7(7): 5601-5614. DOI:10.3390/nu7075242 |
| [26] |
KANG P, HANG Y, CHEN C, PAN Y C, WANG Q Q, HUA X M. Effects of replacing fishmeal with rapeseed meal and dietary condensed tannins on antioxidant capacity, immunity, and hepatic and intestinal health of largemouth bass (Micropterus salmoides)[J]. Aquaculture Reports, 2023, 30: 101548. DOI:10.1016/J.AQREP.2023.101548 |
| [27] |
顾艾鑫, 张童, 王天虎, 吴泽, 单安山, 李建平. 葡萄籽原花青素提取物对大鼠脂肪沉积及脂质代谢的影响[J]. 动物营养学报, 2021, 33(7): 4133-4141. DOI:10.3969/j.issn.1006-267x.2021.07.054 GU A X, ZHANG T, WANG T H, WU Z, SHAN A S, LI J P. Effects of grape seed proanthocyanidins extract on fat deposition and lipid metabolism in rats[J]. Chinese Journal of Animal Nutrition, 2021, 33(7): 4133-4141. DOI:10.3969/j.issn.1006-267x.2021.07.054 |
| [28] |
HAN X, ZHAO W, ZHOU Q, CHEN H, YUAN J, XIAOFU Z, ZHANG Z. Procyanidins from hawthorn (Crataegus pinnatifida) alleviate lipid metabolism disorder via inhibiting insulin resistance and oxidative stress, normalizing the gut microbiota structure and intestinal barrier, and further suppressing hepatic inflammation and lipid accumulation[J]. Food and Function, 2022, 13(14): 7901-7917. DOI:10.1039/D2FO00836J |
| [29] |
张艳华, 汪雄, 王文利, 张雷, 车会莲, 张雅丽. 葡萄籽原花青素对高脂高糖饮食诱导代谢综合征大鼠干预作用[J]. 食品科学, 2020, 41(1): 112-120. DOI:10.7506/spkx1002-6630-20190630-420 ZHANG Y H, WANG X, WANG W L, ZHANG L, CHE H L, ZHANG Y L. Effects of grape seed proanthocyanins on high-fat and high-sugar diet induced metabolic syndrome in rats[J]. Food Science, 2020, 41(1): 112-120. DOI:10.7506/spkx1002-6630-20190630-420 |
| [30] |
马蕾, 韩雪, 周晓铮, 赵明睿, 徐小康, 赵文, 王颉. 山楂原花青素改善肥胖小鼠糖脂代谢紊乱及脂肪肝的研究[J]. 河北农业大学学报, 2019, 42(2): 95-99. DOI:10.13320/j.cnki.jauh.2019.0040 MA L, HAN X, ZHOU X Z, ZHAO M R, XU X K, ZHAO W, WANG J. Improving effect ofhawthorn prpanthocyanidins on glucose and lipid metabolism disorder and fatty liver of obese mice[J]. Journal of Hebei Agricultural University, 2019, 42(2): 95-99. DOI:10.13320/j.cnki.jauh.2019.0040 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50




