文章信息
基金项目
- 广西重点研发计划项目(桂科AB18221047);广西农业科技创新联盟科技先锋队专项(桂农科盟202308-2)
作者简介
- 李宏月(1996—),女,硕士,助教,研究方向为食用菌种质资源利用,E-mail:1747651866@qq.com; 刘斌,博士,现任广西大学农学院教授、博士生导师,广西大学食用菌研究所所长,兼任中国菌物学会理事、广西食用菌协会副会长、广西食用菌学会副理事长。曾任国家现代农业产业技术体系广西创新团队食用菌产业首席专家(2011—2020年),美国哈佛大学访问学者。主要从事真菌系统分类、食用菌种质资源评价利用、食用菌病虫害防控等研究,主持国家自然科学基金、广西自然科学基金重点项目、广西重点研发计划等项目20余项,发现新物种30余个。发表学术论文100余篇,其中以第一或通信作者在《Fungal Diversity》《Pest Management Scienc》《Plant Disease》《Journal of Cleaner Production》等SCI期刊发表论文30余篇,获授权专利8件.
通讯作者
- 刘斌(1966—),男,博士,教授,研究方向为食用菌种质资源利用,E-mail:liubin@gxu.edu.cn.
文章历史
- 收稿日期:2023-07-30
2. 广东茂名农林科技职业学院生物技术系,广东 茂名 525000
2. Department of Biotechnology, Guangdong Maoming Vocational College of Agriculture and Forestry Science and Technology, Maoming 525000, China
【研究意义】香菇(Lentinula edodes)又名香蕈、冬菇,在分类归属方面一直存在许多探讨和争论,曾先后被归入过12个不同的属,1983年从韧伞属Lentinus转入香菇属Lentinula,即担子菌纲(Basidiomycetes)伞菌目(Agaricales)光茸菌科(Omphalotaceae)香菇属(Lentinula),延续至今。中国是香菇第一大生产国,也是最大的消费国。据中国食用菌协会统计,2020年我国香菇的总产量为1 188.21万t,占食用菌总产量的29.25%,为我国食用菌年产量最大、创汇额较高的单品[1]。香菇野生种质资源主要分布在澳大利亚、日本、韩国、马来西亚、朝鲜、越南、泰国等国家,其中属日本记载最多[2]。我国香菇属的种类及分布较广,主要分布于热带及亚热带地区,温带地区较少[3];野生香菇的多样性中心分布于西北和西南地区[2]。开展野生香菇种质资源的收集、鉴定和评价利用,挖掘优良野生香菇种质可促进香菇产业的发展[4]。分析对比野生香菇和栽培香菇的生物学特性,可为香菇优良品种的选育提供理论基础。【前人研究进展】我国香菇种质资源丰富,但香菇栽培品种的命名比较混乱,出现不少同名异物、同物异名等现象,因此香菇菌株的准确鉴定和命名极有必要。以往的香菇鉴定主要依赖形态学方法,但单纯的形态鉴定无法提供准确的物种信息[5]。目前认为形态学在食用菌鉴定中可作为辅助手段,但不能作为唯一的鉴定方法[6]。近年来基于分子标记的分子生物学鉴定方法应用越来越广泛[4, 7],由于此方法不易受外界环境的影响,具有特异性强、稳定性好、样品需求量少等特点,可直接利用菌丝体或子实体提取DNA进行鉴定[8-10]。Song等[11]研究表明,采用核糖体基因转录间隔区(Internal transcribed spacers,ITS)序列分析是鉴定香菇的理想分子标记。袁思明等[12]对采自云南的1株野生香菇进行了鉴定和菌丝生长条件试验,其最适碳源为麦芽糖,最适氮源为牛肉膏。熊雪等[13]对分离自贵州马桑树的野生香菇进行生物学研究,该菌菌丝生长的最优碳源为蔗糖,最优氮源为蛋白胨,培养温度以23~25 ℃最优,最适pH为7~10;方志荣等[14]研究了不同碳源、氮源、温度以及pH对分离自四川的2株野生香菇菌株菌丝生长的影响,其最佳碳、氮源分别为玉米粉和酵母膏,最适培养温度为25 ℃,最适pH为6.0;刘元涛等[15]通过单因素试验和正交试验的方法,研究中华小香菇生长发育过程中所需碳源、氮源等营养条件和温度、pH等环境条件,从而得出其菌丝体生长的最佳条件。【本研究切入点】我国香菇种质资源丰富,但功能性栽培品种较少,目前缺少适宜在南方高温地区栽培的优良香菇品种。利用形态学和分子生物学鉴定方法,对香菇野生种质进行鉴定。【拟解决的关键问题】本研究旨在对采集自广西的2株野生香菇菌株进行分离、鉴定,通过与香菇主要栽培菌株的生物学特性进行比较研究,探讨分析影响香菇菌丝生长的因素,在此基础上,根据不同菌株的综合表现,以期筛选出适宜当地高温气候条件的香菇种质资源和育种材料。
1 材料与方法 1.1 试验材料供试野生菌株林香18(LX18)、林香19(LX19),栽培菌株L12、L26和L808,均由广西大学食用菌研究所提供,其中LX18、LX19由采集于广西上林县大明山的野生子实体分离获得。申香34(SX34)、申香60(SX60)和浦香08(PX08)由上海市农业科学院食用菌研究所陈明杰研究员惠赠。
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g,水1 000 mL。
基本培养基:葡萄糖2%、蛋白胨0.5%、磷酸二氢钾0.2%、硫酸镁0.1%、琼脂1.5%、水1 L、pH自然。
1.2 试验方法1.2.1 形态鉴定 香菇子实体由菌盖、菌柄和菌褶组成。通过观察子实体的外观特征,如子实体大小、菌盖表面平整度、菌盖厚薄、菌柄长度、菌盖颜色、菌褶、菌环等进行鉴定。
1.2.2 分子鉴定 采用CTAB法提取DNA,随后用两对引物ITS1(5'-TCCGTAGGTGAACCTGCGG -3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3'),LR0R(5'-ACCCGCTGAACTTAAGC-3')和LR5(5'-ACCCGCTGAACTTAAGC-3'),进行PCR扩增,反应体系:总体系为25 μL,分别为GO Taq green master mix (2×) 13 μL;ITS1和ITS4或LR0R和LR5 (10 pmol/L) 各1 μL;DNA模板1 μl;Nucleasr-free water 9 μL。反应条件:预变性94 ℃ 5 min;变性94 ℃ 1 min,退火50 ℃ 1 min,延伸72 ℃ 1 min,共35个循环;补平72 ℃ 10 min,10 ℃ 30 min。扩增完成后4 ℃保存并进行电泳检测,PCR产物送生物公司进行测序。所得序列于GenBank数据库进行BLAST比对,下载相关序列并用Clustal X软件进行对比,并用MEGA 6.06中的Maximum Likelihood法构建系统发育树。
1.2.3 香菇生物学特性对比分析 (1)菌种活化。取保藏菌种接入斜面PDA培养基,于25 ℃下培养,待菌丝长好后再转接到PDA平板中心位置,25 ℃下培养,菌丝长满皿后备用。
(2)菌丝观察测定。长满菌丝的PDA平板,用直径0.5 cm的打孔器打孔取菌饼,接种到基础培养基平板中央,每个菌株3次重复,培养3 d后开始进行观察和测定。每个菌株取3个平板,以接种中心点为起点,测量菌落半径,计算平均值。长势以菌落圆整程度、菌丝浓密程度以及菌丝洁白程度来表示。
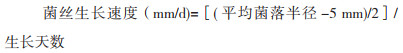
|
(3)温度对菌丝生长的影响。用直径0.5 cm的打孔器打取菌饼,接入无菌PDA培养皿中央,每个菌株3个重复,分别放入15、20、25、30 ℃培养箱中培养,记录菌丝萌发、生长时间及满皿天数。
(4)碳源对菌丝生长的影响。以基础培养基作对照,将基础培养基中的葡萄糖分别换成麦芽糖、蔗糖、乳糖、可溶性淀粉等,观察不同碳源对菌丝生长速度及长势的影响。
(5)氮源对菌丝生长的影响。以基础培养基作对照,将基础培养中的蛋白胨分别换成尿素、牛肉膏、酵母膏、硝酸钾等,观察不同氮源对菌丝生长速度及长势的影响。
(6)C/N对菌丝生长的影响。将基础培养基中葡萄糖用量固定为20 g,改变蛋白胨的用量,配制7个培养基处理,使葡萄糖与蛋白胨比例依次为10/1、20/1、30/1、40/1、50/1、60/1、70/1。观察不同C/N对菌丝生长速度及长势的影响。
1.2.4 数据处理 试验数据分析采用SPSS 20.0软件,应用邓肯氏新复极差法(Duncan)进行差异显著性分析。
2 结果与分析 2.1 野生香菇菌株的形态鉴定林香18野生子实体见图 1 A。子实体稍小,菌盖直径为3.0~3.5 cm,最大可达4.0 cm,扁平球形至稍平展,表面浅褐色,光滑无鳞片,无毛状物;厚度1.1~1.5 cm,菌肉白色,细密;菌褶白色,弯生,不等长;菌柄长4.5~4.8 cm,粗0.6~1.0 cm,中生,白色,直立;菌环以下无纤毛状鳞片,纤维质,内实,菌环易消失,白色。

|
| A:林香18;B: 林香19 A: Linxiang 18; B: Linxiang 19 图 1 野生香菇子实体 Fig. 1 Fruiting bodies of wild Lentinula edodes |
林香19子实体见图 1 B。子实体中等,菌盖直径为3.5~4.0 cm,最大可达4.5 cm,扁平球形至稍平展,表面深褐色、棕褐色,光滑无鳞片,无毛状物,厚度0.9~1.5 cm;菌肉白色,细密;菌褶白色,弯生,不等长;菌柄长4.8~5.3 cm,粗0.7~1.2 cm,中生至偏生,白色,常弯曲;菌环以下无纤毛状鳞片,纤维质,内实,菌环易消失。从形态学上可将野生食用菌初步鉴定为香菇属。
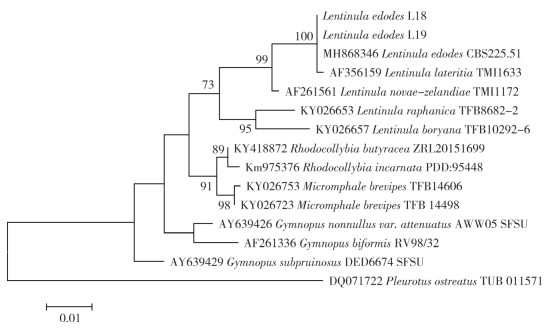
2.2 分子序列分析香菇野生菌株经PCR扩增、测序后获得的ITS和LSU序列,通过BLAST在GenBank数据库中进行相似性检索和比对,下载其他香菇序列进行对比,用MEGA 6.0构建系统发育树(图 2)。由图 2可知,野生菌株林香18、林香19与MH868346 Lentinula edodes CBS225.51和AF356159 Lentinula lateritia TMI 1633聚集在一个分支上,且该分支的最大似然引导支持率高达100%,因此把这两个菌株鉴定为香菇Lentinula edodes。
|
| 图 2 基于ITSLSU和序列采用极大似然法构建的系统发育树 Fig. 2 Phylogenetic tree generated from maximum likelihood based on ITS and LSU sequences |
2.3 香菇生物学特性对比分析
2.3.1 不同温度对香菇菌丝生长的影响 由表 1可知,8株供试菌株在温度15~30 ℃下均能生长,但菌丝生长速度存在较大差异。15 ℃时,L12和L26的菌丝生长速度最快、表现出耐低温的特性,而L808和林香19生长最慢、对低温比较敏感;20 ℃时,菌丝生长速度居前3位的分别为L26、林香18和L12;25 ℃为6株栽培菌株的最适生长温度,其中L808的菌丝生长速度最快、达4.91 mm/d;而30 ℃下,野生菌株林香18的菌丝生长速度最快,其次为align="left"808和林香19。综上,L808、林香18和林香19具有较强的耐高温特性,其他5个菌株均不耐高温。

|
2.3.2 不同碳源对香菇菌丝生长的影响 从表 2可以看出,当碳源为葡萄糖、可溶性淀粉、蔗糖、麦芽糖时,香菇L26、申香60和申香34的菌丝生长速度无显著差异,但当碳源为乳糖时三者的菌丝生长速度较慢。香菇L12在含葡萄糖培养基中菌丝生长速度最快、达4.17 mm/d,与其他碳源差异显著,而在含麦芽糖、蔗糖、乳糖和可溶性淀粉培养基中,乳糖的利用效果最差;香菇L808在含蔗糖的培养基上菌丝生长速度最快、为4.03 mm/d,其次是可溶性淀粉、葡萄糖、麦芽糖,乳糖最慢、菌丝生长速度仅2.42 mm/d;林香18在不同碳源培养基上菌丝生长速度差异显著,以蔗糖利用效果最好、菌丝生长速度达3.43 mm/d,乳糖利用效果最差、菌丝生长速度仅2.19 mm/d;林香19在所有碳源中,对可溶性淀粉的利用效果最好、菌丝生长速度最快、为3.75 mm/d,乳糖利用效果最差、菌丝生长速度最慢、仅3.18 mm/d;浦香08在所有碳源中,以麦芽糖培养基上菌丝生长速度最快、约为乳糖的2倍。

|
从表 3可以看出,不同碳源条件下,L26、L808、申香34、申香60、林香18和林香19的菌丝长势无显著差异,只有L12和浦香08的菌丝长势存在差异。在碳源为葡萄糖、乳糖和可溶性淀粉时,L12菌落圆整、菌丝较浓密、洁白,且在乳糖培养基上菌丝最为浓密;在可溶性淀粉培养基上菌丝浓密但老化快,存活时间较短。浦香08在乳糖和可溶性淀粉培养基上,菌丝极浓密,菌落圆整、洁白;在葡萄糖、蔗糖和麦芽糖培养基上菌丝较浓密,菌落圆整、浅白色。L26在5种碳源培养基上菌丝长势均表现极浓密,除了乳糖以外,其他4种碳源菌丝长势均为圆整、洁白。L808菌丝生长速度快,菌丝老化速度也较快,菌丝长势无显著差异,均为稀疏、灰白色、菌落完整。申香34菌丝长势均为浓密、菌落圆整,在葡萄糖、乳糖培养基上菌丝呈灰白色,在可溶性糖和蔗糖上菌丝颜色更为洁白。申香60菌丝长势无显著差异,菌丝长势较浓密、菌落圆整、浅白色。相比其他菌株,林香18在不同碳源培养基上的菌丝萌发及生长速度慢,但菌丝长势浓密、洁白、菌落圆整。林香19菌丝长势均表现稀疏圆整、浅白色,在5个碳源培养基上生长无显著差异。

|
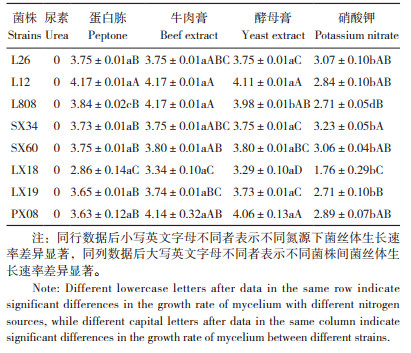
2.3.3 不同氮源对香菇菌丝生长速度的影响 由表 4可知,L26在不同氮源培养基上生长速率的表现依次为蛋白胨、牛肉膏、酵母膏>硝酸钾>尿素,在蛋白胨、牛肉膏、酵母膏上菌丝生长速度最快、达3.75 mm/d;L12在不同氮源培养基上生长速率的表现依次为蛋白胨、牛肉膏>酵母膏>硝酸钾>尿素,在蛋白胨、牛肉膏上菌丝生长速度最快、达4.17 mm/d;L808、林香18、林香19和浦香08在不同氮源培养基上生长速率的表现依次为牛肉膏>酵母膏>蛋白胨>硝酸钾>尿素,以上4种菌株在牛肉膏培养基上利用效果相对最好,生长速度分别为4.17、3.34、3.74、4.14 mm/d;申香34和申香60在不同氮源培养基上生长速率的表现依次为牛肉膏、酵母膏>蛋白胨>硝酸钾>尿素,两菌株对牛肉膏、酵母膏的利用效果较好,菌丝生长速度分别为3.75、3.8 mm/d。
|
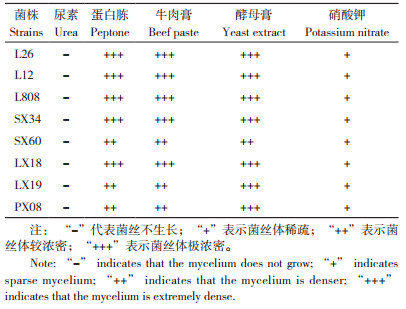
总体来看,8个菌株在尿素培养基上均无法生长,在牛肉膏培养基上生长速度最快,在硝酸钾培养基上菌丝生长速度最慢,L12菌株菌丝生长速度最快,林香18生长速度明显低于其他7个菌株。
从表 5可以看出,8个菌株在尿素培养基上均不能生长,在硝酸钾培养基上长势无明显差异,均表现为菌落较圆整,菌丝稀疏、浅白色。L26、L12、L808、申香34和林香18等5个菌株在其他3种氮源培养基上表现一致,菌丝均极为浓密、洁白,菌落圆整;申香60在蛋白胨、牛肉膏、酵母膏培养基上菌丝长势较浓密,无明显差异;林香19和浦香08在5种氮源培养基上表现一致,均在蛋白胨和牛肉膏上表现菌丝较浓密、洁白、菌落完整,在酵母膏上表现菌丝极浓密。综上,在酵母膏培养基上除申香60外其他7个菌株长势均为菌丝浓密、洁白、菌落圆整。
|
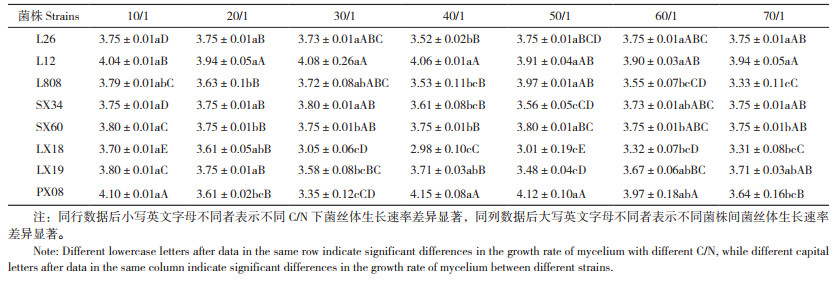
2.3.4 不同C/N对菌丝生长速度的影响 不同C/N条件下,香菇菌丝生长表现出明显差异。由表 6可看出,香菇菌丝可以在7个不同的C/N培养基中生长,其生长情况各有不同。香菇L26在C/N为10/1、20/1、50/1、60/1、70/1条件下菌丝生长速度相同,为3.75 mm/d;L12在C/N为30/1条件下,菌丝生长速度最快,为4.08 mm/d;L808在C/N为50/1时菌丝生长速度最快,为3.97 mm/d;申香34在C/N为30/1时菌丝生长速度最快,为3.8 mm/d;申香60在C/N为10/1和50/1生长速度相对较快,为3.8 mm/d;林香18在10/1时菌丝生长最快,为3.7 mm/d,林香18的总体生长速度低于其他7个品种;林香19在70/1-10/1的C/N条件下,菌丝生长范围在3.48~3.8 mm/d,10/1时菌丝生长速度最快,50/1速度最慢;浦香08在C/N为40/1时菌丝生长速度最快,为4.15 mm/d。
|
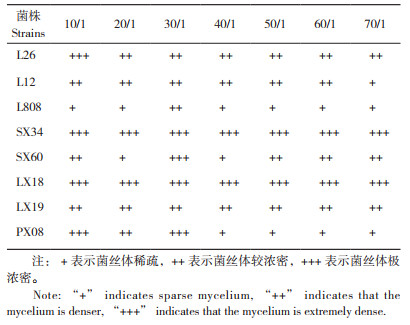
由表 7可知,在不同C/N的7个处理中,申香34、林香18与林香19无显著差异,申香34和林香18菌丝极为浓密、洁白,菌落圆整,而林香19菌丝较浓密、浅白色,菌落圆整;L808在C/N为30/1时菌丝生长表现浓密洁白,菌落圆整,其他6个处理菌丝生长表现稀疏,为浅白色,菌落圆整;L12只在C/N为70/1时菌丝长势表现稀疏、灰白色、菌落圆整,其他处理中菌丝生长表现差异不大,表现为浓密、浅白色,菌落圆整;L26在C/N为10/1时菌丝长势最好,菌丝洁白、极为浓密,菌落圆整,其他6个处理菌丝较浓密、洁白、菌落圆整;浦香08在C/N为10/1和30/1时菌丝极浓密、菌丝洁白、菌落圆整;申香60在C/N为20/1和40/1时菌丝稀疏、浅白色、菌落圆整,当C/N为10/1、50/1、60/1、70/1时菌丝均较浓密且洁白,菌落圆整,当C/N为30/1时菌丝极浓密、洁白、菌落圆整。综合看来,申香34、林香18、林香19菌丝长势不受C/N的影响,其他5个菌株菌丝长势受C/N的影响。
|
3 讨论
本研究对采自广西大明山的2份野生食用菌标本进行形态特征观察和分子序列分析,发现从野生标本分离的菌株林香18和林香19与香菇Lentinula edodes相似度最高,在ITS构建的系统发育树上聚集在一起,因此将其鉴定为香菇Lentinula edodes。两份材料的子实体外观形态差异不大,区别为林香18菌盖颜色为浅褐色,而林香19菌盖颜色为深褐色。广西野生香菇的研究报道较少,陈丽新[16]等曾对十万大山的野生香菇进行组织分离,认为分离部位不同,菌丝的生长速度和长势有差异。
野生菌的驯化栽培通常有赖于其菌种的生物学特性研究。本研究以香菇的2株野生菌株和6株栽培菌株为试材,测定不同温度、氮源、氮源、C/N对菌丝生长的影响,结果显示,供试的8株香菇菌丝在15~30 ℃条件下均可以生长,生长速度具有一定规律,多数菌株的菌丝生长速度在15~25 ℃呈上升趋势,25~30 ℃菌丝生长速度缓慢,6株栽培菌株生长的最适合温度均为25 ℃,而2株野生菌株在30℃时的菌丝生长速率最高。同时得出供试8个菌株菌丝生长的最适营养条件,其中L26最适碳源为葡萄糖,最适氮源为蛋白胨、牛肉膏或酵母膏,在7种不同C/N中无显著差别;L12最适碳源为葡萄糖,最适氮源是蛋白胨或牛肉膏,最佳C/N是30/1;L808最适碳源为蔗糖,最适氮源为牛肉膏,最适C/N为50/1;申香34最适碳源为可溶性淀粉,最适氮源为酵母膏或牛肉膏,最适C/N为30/1;申香60最适碳源是可溶性淀粉、麦芽糖或蔗糖,最适氮源为酵母膏或牛肉膏,最适C/N为10/1、50/1;林香18最适碳源是蔗糖,最适氮源为牛肉膏,最适C/N为10/1;林香19最适碳源是可溶性淀粉,最适氮源为牛肉膏,最适C/N为10/1;浦香08最适碳源为麦芽糖,最适氮源为牛肉膏,最适C/N为40/1。本研究结果与已往的文献报道相似,如袁思明等[12]对野生香菇菌丝最佳生长条件进行研究,菌丝在牛肉膏上生长最好。熊雪等[13]指出,野生马桑香菇菌丝的最优碳源为蔗糖,最优氮源为蛋白胨,培养温度以23~25 ℃最优。方志荣等[14]认为,香菇属的最佳碳源为玉米粉,最佳氮源为酵母膏,最适培养温度为25 ℃;伍燕等[17]研究发现,香菇菌丝在葡萄糖培养基上生长更好,而在尿素上不能生长。推测多数食用菌菌丝均无法直接利用尿素,可能是因为尿素在高压灭菌时发生了缩合反应,生成的缩二脲、缩三脲等无法被菌丝吸收利用,导致菌丝无法生长。曾茜等[18]发现,野生香菇黔香筛5号母种培养基的最佳碳氮源为葡萄糖和硫酸铵,最适培养温度25~30 ℃。廖真等[19]研究表明,野生香菇菌丝生长的最适碳源为果糖,最适氮源为牛肉膏,最适生长温度25 ℃,而在尿素培养基上菌丝无法生长。本研究结果野生香菇林香18和林香19菌丝生长的最适氮源是牛肉膏,这与袁思明等[12]、廖真等[19]的研究结果一致。由此推测在蛋白胨和牛肉膏为氮源的处理下,菌丝长势较好,可能是因为这种复合氮源中营养较为丰富,能够满足菌丝生长的营养需求。温度方面,本研究试材野生香菇林香18、林香19与曾茜等[18]研究的“野生香菇黔香筛5号”均为耐高温野生香菇,与熊雪等[13]研究的野生马桑香菇、方志荣等[14]研究的野生微香菇属(Lentinula) 真菌存在差异。
本研究中,8株香菇在7种不同C/N培养基上的菌丝生长速度没有任何规律,但多数菌株在C/N为10/1时菌丝生长速度最快,而张权[20]研究发现5种香菇(931-9,灵仙一号,南山一号,9608,L808)的最适C/N为20/1,由此推测不同品种的香菇在碳源、氮源需求上差异较小,但在C/N需求上存在较大差异,同一菌种不同菌株之间利用碳氮的能力也有所不同。
4 结论本研究通过形态学和分子学相结合的方法,将来自广西上林县大明山的两份野生食用菌鉴定为香菇。通过与6个主要栽培菌株进行生物学特性的比较分析,结果表明,两株野生菌株在30 ℃条件下的菌丝生长速度均高于25 ℃,表现出较强的耐高温特性,说明野生菌株为耐高温菌株,其他菌株为中温性品种,生长最适合温度在25 ℃。本试验筛选出适宜当地高温气候条件的香菇种质资源为林香18和林香19,为野生香菇种质资源的应用,特别是耐高温香菇新品种的选育提供了新材料及重要参考依据。
| [1] |
邰丽梅, 董娇, 张琳, 孙达锋. 中国香菇产业与标准化发展现状分析[J]. 中国食用菌, 2020, 39(5): 8-16. DOI:10.13629/j.cnki.53-1054.2020.05.002 TAI L M, DONG J, ZHANG L, SUN D F. Analysis of the current situation of China's mushroom industry and standardization development[J]. Edible Fungi of China, 2020, 39(5): 8-16. DOI:10.13629/j.cnki.53-1054.2020.05.002 |
| [2] |
杨瑞恒, 吴莹莹, 宋春艳. 基于公共数据库信息对中国野生香菇种质资源地理分布的再分析[J]. 菌物学报, 2018, 37(3): 335-351. DOI:10.13346/j.mycosystema.170102 YANG R H, WU Y Y, SONG C Y. Reanalysis of the geographical distribution of wild Lentinula edodes germplasm resources in China based on public database information[J]. Mycosystema, 2018, 37(3): 335-351. DOI:10.13346/j.mycosystema.170102 |
| [3] |
卯晓岚. 中国香菇属的种类及香菇的自然分布[J]. 中国食用菌, 1996(3): 34-36. MAO X L. Species and natural distribution of Lentinula in China[J]. Edible Fungi of China, 1996(3): 34-36. |
| [4] |
马宏, 张根伟, 刘萌, 刘昆昂, 李书生, 尹淑丽, 刘振国, 付艳菊. 7株野生香菇菌株的特性及出菇试验[J]. 中国食用菌, 2019, 38(3): 36-40. DOI:10.13629/j.cnki.53-1054.2019.03.007 MA H, ZHANG G W, LIU M, LIU K A, LI S S, YIN S L, LIU Z G, FU Y J. Characteristics and fruiting test of 7 wild Lentinula edodes strains[J]. Edible Fungi of China, 2019, 38(3): 36-40. DOI:10.13629/j.cnki.53-1054.2019.03.007 |
| [5] |
苏春密. 中国栽培灵芝菌株的遗传多样性研究及分子鉴定[D]. 南京: 南京农业大学, 2003. SU C M. Genetic diversity and molecular identification of Ganoderma strains cultivated in China[D]. Nanjing: Nanjing Agricultural University, 2003. |
| [6] |
张瑞颖. 香菇菌株多相鉴定鉴别技术研究[D]. 北京: 中国农业大学, 2004. ZHANG R Y. Polyphasic identification of Lentinula edodes strains[D]. Beijing: China Agricultural University, 2004. |
| [7] |
吴茜. 中国香菇自然种质遗传多样性SRAP和IGS2分析[D]. 武汉: 华中农业大学, 2010. WU Q. SRAP and IGS2 analysis of genetic diversity of Lentinula edodes natural germplasm in China[D]. Wuhan: Huazhong Agricultural University, 2010. |
| [8] |
刘作易. DNA指纹技术的发展及其在真菌分类上的应用[J]. 山东农业生物学报, 2000(6): 460-469. DOI:10.15958/j.cnki.sdnyswxb.2000.06.013.sdnyswxb.2000.06.013 LIU Z Y. Development of DNA fingerprinting technique and its application in fungal taxonomy[J]. Shandong Journal of Agricultural Biology, 2000(6): 460-469. DOI:10.15958/j.cnki.sdnyswxb.2000.06.013.sdnyswxb.2000.06.013 |
| [9] |
余仲东, 张星耀, 曹支敏. 真菌核糖体基因间隔区研究概况[J]. 西北林学院学报, 2000, 15(2): 107-112. YU Z D, ZHANG X Y, CAO Z M. Research on fungal ribosomal intergenic spacer[J]. Journal of Northwest Forestry University, 2000, 15(2): 107-112. |
| [10] |
许学锋, 林范学, 林芳灿. 中国香菇自然种质的rDNA遗传多样性分析[J]. 菌物学报, 2005, 24(1): 29-35. DOI:10.13346/j.mycosystema.2005.01.007 XU X F, LIN F X, LIN F C. rDNA genetic diversity analysis of natural germplasm of Lentinula edodes in China[J]. Mycosystema, 2005, 24(1): 29-35. DOI:10.13346/j.mycosystema.2005.01.007 |
| [11] |
SONG X X, ZHAO Y, SONG C Y, LI C H, YING SONG Y, CHEN M J, BAO D P, TAN Q. ITS1/5.8S/ITS2, a good marker for initial classification of shiitake culinary-Medicinal Lentinus edodes (Agaricomycetes) strains in China[J]. International Journal of Medicinal Mushrooms, 2018, 20(3): 227-242. DOI:10.1615/IntJMedMushrooms.2018025883 |
| [12] |
袁思明, 房丽丽, 何德, 李翠新. 一株野生香菇的鉴定及菌丝最佳生长条件研究[J]. 湖北民族学院学报(自然科学版), 2016, 34(1): 77-80. DOI:10.13501/j.cnki.42-1569/n.2016.03.020 YUAN S M, FANG L L, HE D, LI C X. Identification of a wild mushroom and study on the optimum growth conditions of mycelium[J]. Journal of Hubei University for Nationalities (Natural Science Edition), 2016, 34(1): 77-80. DOI:10.13501/j.cnki.42-1569/n.2016.03.020 |
| [13] |
熊雪, 李鹏, 廖小锋, 向准, 邓春英, 汪建文. 野生马桑香菇的鉴定及其生物学特性[J]. 北方园艺, 2021(4): 118-123. DOI:10.11937/bfyy.20202053 XIONG X, LI P, LIAO X F, XIANG Z, DENG C Y, WANG J W. Identification and biological characteristics of wild Lentinula edodes[J]. Northern Horticulture, 2021(4): 118-123. DOI:10.11937/bfyy.20202053 |
| [14] |
方志荣, 清源, 何晓兰, 乃戈日优. 两株野生微香菇属(Lentinula) 真菌的鉴定和生物学特性[J]. 北方园艺, 2022(6): 107-113. DOI:10.11937/bfyy.20213873 FANG Z R, QING Y, HE X L, NAIGE R Y. Identification and biological characterization of two wild Lentinula fungi[J]. Northern Horticulture, 2022(6): 107-113. DOI:10.11937/bfyy.20213873 |
| [15] |
刘元涛, 刘一鹏, 张志豪, 王建瑞, 刘宇. 中华小香菇的生物学特性研究[J]. 中国食用菌, 2021, 40(3): 27-32. DOI:10.13629/j.cnki.53-1054.2021.03.006 LIU Y T, LIU Y P, ZHANG Z H, WANG J R, LIU Y. Studies on biological characteristics of Lentinus chinensis[J]. Edible Fungi of China, 2021, 40(3): 27-32. DOI:10.13629/j.cnki.53-1054.2021.03.006 |
| [16] |
陈丽新, 韦仕岩, 陈振妮, 王灿琴, 周嘉运. 广西十万大山野生香菇子实体组织分离试验[J]. 食用菌, 2005(5): 19-20. CHEN L X, WEI S Y, CHEN Z N, WANG C Q, ZHOU J Y. Tissue isolation test of wild Lentinula edodes fruiting bodies from Shiwandashan, Guangxi[J]. Edible Fungi, 2005(5): 19-20. |
| [17] |
伍燕, 陈艳娟, 王柳忠, 申利群, 朱华. 1株野生香菇属菌株的鉴定及其胞内多糖的抗氧化活性[J]. 贵州农业科学, 2018, 46(3): 15-20. WU Y, CHEN Y J, WANG L Z, SHEN L Q, ZHU H. Identification of a wild Lentinula strain and antioxidant activity of its intracellular polysaccharide[J]. Guizhou Agricultural Sciences, 2018, 46(3): 15-20. |
| [18] |
曾茜, 陈旭, 杨雨. 野生香菇黔香筛5号菌丝的生物学特性及抗氧化活性[J]. 西南农业学报, 2022, 35(3): 558-563. DOI:10.16213/j.cnki.scjas.2022.3.011 ZENG Q, CHEN X, YANG Y. Biological characteristics and antioxidant activity of Qianxiangsi No.5 mycelium[J]. Journal of Southwest Agricultural Sciences, 2022, 35(3): 558-563. DOI:10.16213/j.cnki.scjas.2022.3.011 |
| [19] |
廖真, 林占熺, 徐志文, 李巧琪, 汪丽芳, 薛志香. 巴布亚新几内亚野生香菇的鉴定及生物学特性[J]. 北方园艺, 2021(14): 143-152. DOI:10.11937/bfyy.20204661 LIAO Z, LIN Z X, XU Z W, LI Q Q, WANG L F, XUE Z X. Identification and biological characteristics of wild Lentinula edodes in Papua New Guinea[J]. Northern Horticulture, 2021(14): 143-152. DOI:10.11937/bfyy.20204661 |
| [20] |
张权. 香菇胞外酶活性变化规律和农艺性状研究[D]. 洛阳: 河南科技学院, 2016. ZHANG Q. Study on the changes in extracellular enzyme activity and agronomic characters of Lentinus edodes[D]. Luoyang: Henan University of Science and Technology, 2016. |
 2023, Vol. 50
2023, Vol. 50