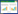文章信息
基金项目
- 国家重点研发计划项目(2017YFD0202102);云南省科技人才与平台计划“云南省丰锋专家工作站”(202305AF150146);广东海洋大学大学生创新训练项目(CXXL2022059)
作者简介
- 干雨露(1999—),女,在读硕士生,研究方向为园林植物资源与应用,E-mail:2861673180@qq.com; 丰锋,硕士,教授,硕士生导师,广东海洋大学滨海农业学院,云南省丰锋专家工作站负责人。主要从事菠萝蜜、香蕉、淮山薯等热带、南亚热带园艺植物新品种选育、良种繁育及安全高效生产技术研究。主持国家重点研发计划项目子课题、国家育种菠萝蜜联合攻关项目及广东省科技厅科技攻关课题6项,参与国家自然科学基金、科技部成果转化资金等各级课题10余项。以第一或通信作者发表学术论文50余篇。获广东省科学技术三等奖2项;获授权国家发明专利1件,计算机软件著作权1项;主持选育并通过广东省农作物品种审定委员会审定品种6个(菠萝蜜4个:海大1号、海大2号、海大3号、海大4号;辣椒2个:茂海大椒、茂海长线).
通讯作者
- 丰锋(1969—),男,硕士,教授,研究方向为组培快繁及安全高效生产技术,E-mail:ff1703@126.com.
文章历史
- 收稿日期:2023-07-20
【研究意义】迷你椒草(Cryptocoryne parva)属于天南星科隐棒花属观赏水草,因叶片及佛焰苞的形态和色彩丰富而具有较高的观赏价值,已被广泛应用于水族箱造景;同时,其在湿地系统中也发挥着重要作用,如可降低水中的营养盐含量、抑制藻类生长[1],吸收和积累重金属[2]以促进生态循环。目前,椒草种苗主要来源于组培快繁,但品种间差异较大,迷你椒草组培快繁存在增殖系数低、速度慢、易感染病原菌等问题。此外,在实际生产中也发现,高温髙湿季节下试管苗移栽成活率极低,严重限制了试管苗在热带地区、高温季节的推广。【前人研究进展】近年来,在植物抗逆性提高的研究中,硅的作用逐渐被重视。硅作为有益植物生长的元素,可通过调节植物的气孔来增强光合作用[3],进而促进叶绿素合成、增强植物细胞壁机械强度、促进植株对有机物的吸收[4]。大量研究表明,硅可提高植物过氧化物酶(POD)、超氧化物歧化酶(SOD)等保护酶活性来提高植物抗性[5-7]。王荔军等[8]认为植物叶片表皮积累的硅具有红外辐射能力,可以大幅降低叶片表皮温度,提高植物耐热能力。其次,施硅后可通过控制高温下的水分蒸腾、减少水分流失,以缓解高温环境给植物带来的伤害[9]。但在转录组分析中发现,在植物未受到胁迫时,硅的添加对植物基因表达的影响微乎其微[10],表明硅在植物受到胁迫时发挥更加重要的作用。此外,在组培过程中添加适当质量浓度的硅可在一定程度上减少试管苗褐化、玻璃化以及叶片畸形等情况的发生,对提高愈伤组织的诱导、增殖率以及组培苗的增殖和生根也有一定作用[11-12]。【本研究切入点】目前,硅在作物栽培、组培扩繁及抗逆性等方面的研究持续升温,但在组培中添加硅的研究较少,缺乏添加硅后对试管苗生理代谢方面的影响研究。【拟解决的关键问题】本研究针对试管苗移栽高温环境存活率低的问题,通过添加硅酸钾、硅酸钠、硅酸钙、二氧化硅4种不同的硅源,探究硅对椒草试管苗抗逆生理特性的影响,为后续试管苗移栽高温环境提供理论支持。
1 材料与方法 1.1 试验材料供试迷你椒草试管苗不定芽,来自广东海洋大学滨海农业学院植物细胞工程实验室。
硅酸钾、硅酸钙、二氧化硅试剂均购于上海麦克林生化科技有限公司,硅酸钠试剂购于广东光华科技股份有限公司。
1.2 试验方法1.2.1 硅对迷你椒草不定芽生理代谢的影响 采用单因素试验方法,在培养基(MS+6-BA 4.0 mg/L+NAA 0.2 mg/L+AD 10.0 mg/L)中分别添加硅酸钾、硅酸钠、硅酸钙、二氧化硅4种硅源,至终浓度分别为0.2、0.4、0.6、0.8、1.0 g/L,以不添加硅为对照(CK),每个处理20瓶,每瓶1丛,置于25 ℃、光照2 000 Lx(12 h/d)的条件下培养,30 d后统计增殖率。在不定芽接入培养基后的5、15、25 d时,每个处理分别取样(整株不定芽)5 g,存放于-40 ℃的冰箱待后续指标测定。
1.2.2 硅对高温高湿胁迫下迷你椒草生理代谢的影响 筛选出最佳硅源及浓度后,将不定芽进行生根培养(1/2 MS+NAA 0.2 mg/L+IBA 0.2 mg/L),以不添加硅处理为对照(CK)。25 d后在自然环境中炼苗7 d再移栽,每个处理10株,重复3次,随后放入人工气候箱(设置42 ℃、湿度95%、光照6 000 Lx),5 d后取样进行指标测定。
1.2.3 指标的测定 参照李合生[13]指标测定方法,采用蒽酮法测定可溶性糖含量,采用考马斯亮蓝G-250染色法测定可溶性蛋白含量,采用氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活性,采用愈创木酚氧化法测定过氧化物酶(POD)活性,采用电导率仪测定电导率,采用95% 乙醇提取法测定叶绿素含量。
以称重法计算增殖系数,公式如下:

|
采用DPS软件和Duncans分析法对不同指标进行差异显著性分析。使用SPSS 27.0利用隶属函数值和主成分分析赋予权重,得出不同硅处理综合评价D值进行排序。隶属函数值、各综合指标权重和综合评价D值的计算公式参考文献[14]。
2 结果与分析 2.1 不同硅源及硅浓度对迷你椒草不定芽增殖的影响由图 1可知,添加硅酸钾后,迷你椒草不定芽增殖率随硅酸钾浓度升高呈先上升后下降趋势,0.6 g/L硅酸钾处理不定芽的增殖系数显著高于其他处理,但与CK相比差异不显著,其他处理均低于CK。随各硅源浓度增加,硅酸钠处理中,不定芽增殖系数峰值出现在0.8 g/L(2.19);硅酸钙处理不定芽增殖系数呈现先升后降趋势;二氧化硅处理中,迷你椒草不定芽增殖率呈现逐渐降低趋势。
|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters above the columns represent significant differences 图 1 不同硅源及硅浓度对迷你椒草不定芽增殖的影响 Fig. 1 Effects of different silicon sources and silicon concentrations on adventitious bud proliferation of Cryptocoryne parva |
2.2 不同硅源及硅浓度对迷你椒草不定芽可溶性糖含量的影响
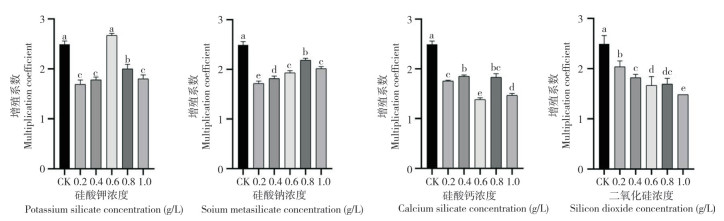
由图 2可知,0.2、0.4、0.6 g/L硅酸钾处理后,迷你椒草不定芽可溶性糖含量随处理时间延长呈先降后升趋势,25 d时各处理不定芽可溶性糖含量较CK分别增长53.84%、51.53%、95.39%、25.62%。硅酸钠处理后,不定芽可溶性糖含量随处理时间增加呈现先下降后上升趋势,并在0.4 g/L硅酸钠处理15 d、25 d后达到最高,与CK相比分别增加26.72%、97.92%。硅酸钙条件下,在5 d时除0.4 g/L处理不定芽的可溶性糖含量高于CK,其他处理均低于CK。25 d时0.4 g/L处理达到最大值(12.87 mg/g)。二氧化硅条件下第25 d,所有处理不定芽的可溶性糖含量均随二氧化硅浓度升高呈现先上升后下降趋势,0.4 g/L处理显著高于其他处理,较CK增长50.86%。
|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters above the columns represent significant differences 图 2 不同硅源及硅浓度对迷你椒草不定芽可溶性糖含量的影响 Fig. 2 Effects of different silicon sources and silicon concentrations on soluble sugars content in adventitious buds of Cryptocoryne parva |
2.3 不同硅源及硅浓度对迷你草不定芽可溶性蛋白含量的影响
由图 3可知,添加不同硅源25 d后,不定芽可溶性蛋白含量较CK均有不同程度地增加。硅酸钾处理后,不定芽可溶性蛋白含量随培养时间延长呈缓慢上升趋势,在0.8 g/L处理15 d、25 d时显著高于其他处理,此时硅酸钾各处理较CK增长14.7%~27.67%。添加0.2 g/L硅酸钠5 d后不定芽可溶性蛋白含量达到最大值(18.99 mg/g),较CK增长42.46%,1.0 g/L处理下随培养时间增加可溶性蛋白含量减少,表明高浓度硅酸钠不利于蛋白积累。硅酸钙处理25 d后,各处理不定芽可溶性蛋白含量与CK相比培养差异不明显,仅增长2.56%~7.88%。二氧化硅处理后,随培养时间增加,不定芽可溶性蛋白含量先上升后下降,25 d时各处理较CK增长13.49%~26.68%。

|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters above the columns represent significant differences 图 3 不同硅源及硅浓度处理对迷你椒草不定芽可溶性蛋白含量的影响 Fig. 3 Effects of different silicon sources and silicon concentrations on soluble proteins content in adventitious buds of Cryptocoryne parva |
2.4 不同硅源及硅浓度对迷你椒草不定芽SOD活性的影响
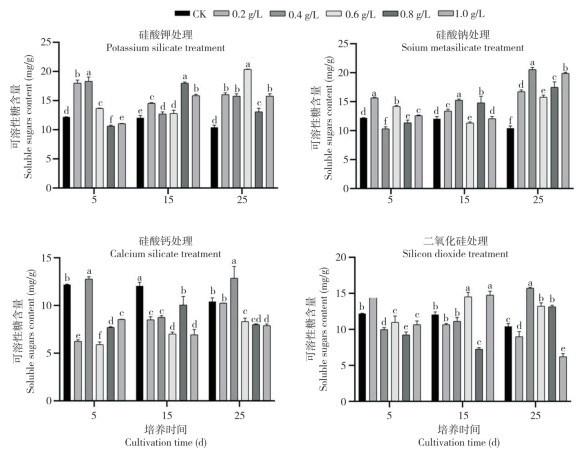
从图 4可以看出,不同浓度硅酸钾处理下,迷你椒草不定芽的SOD活性随培养时间增加先上升后下降,0.4、0.6 g/L硅酸钾处理在15 d、25 d时不定芽SOD活性均显著高于其他处理,25 d时加硅处理不定芽的SOD活性较CK增加40.71%~137.67%。0.8、1.0 g/L硅酸钠处理下,迷你椒草试管苗不定芽的SOD活性趋势相同,即先上升后下降,并在15 d时达到峰值;0.2、0.6 g/L硅酸钠处理25 d后其不定芽SOD活性与CK相比差异显著,较CK分别增长45.53%、41.99%。硅酸钙处理下,迷你椒草试管苗的SOD活性随硅酸钙浓度增加呈递减趋势,但随培养时间增加其SOD活性逐渐上升,25 d时较CK分别增长62.87%、58.1%、16.09%、31.68%。1.0 g/L二氧化硅处理15 d后,不定芽SOD活性下降、与CK无显著差异,0.2 g/L处理在15 d时达到峰值、较CK增长46.77%。
|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters above the columns represent significant differences 图 4 不同硅源及硅浓度处理对迷你椒草不定芽SOD活性的影响 Fig. 4 Effects of different silicon sources and silicon concentrations on SOD activities in adventitious buds of Cryptocoryne parva |
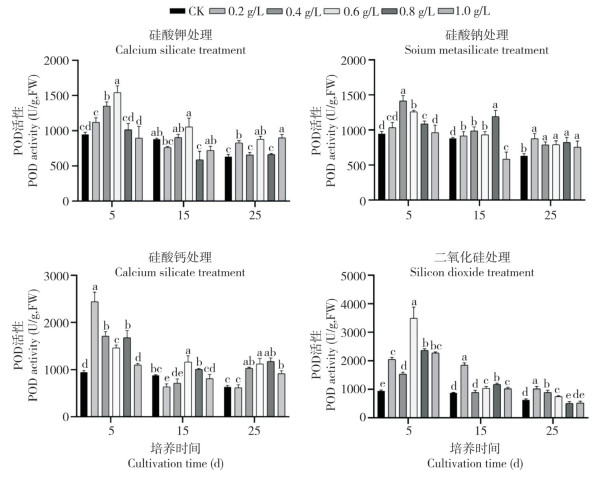
2.5 不同硅源及硅浓度对迷你椒草不定芽POD活性的影响
由图 5可知,施硅处理增加迷你椒草不定芽的POD活性,且4种硅处理下均随硅浓度增加呈先上升后下降趋势。0.6 g/L硅酸钾处理不定芽在整个阶段表现均较好,其POD活性分别比CK增加62.82%、19.97%、39.01%。硅酸钠处理15 d、25 d时各处理间POD活性差异较小,较CK分别增加4.15%~35.71%、19.49%~38.36%,0.4 g/L处理在第5 d显著高于其他处理。硅酸钙处理下,随培养时间增加其不定芽POD活性呈先下降后缓慢上升趋势,在25 d时除0.2 g/L处理外,其他浓度处理均高于CK,分别增长63.52%、98.11%、85.85%、44.65%。二氧化硅条件下,所有处理不定芽的POD活性在5 d时大幅增长,15 d时急聚下降,25 d时随二氧化硅浓度增加POD活性逐渐下降,仅0.2、0.4、0.6 g/L处理显著高于CK。
|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters above the columns represent significant differences 图 5 不同硅源及硅浓度处理对迷你椒草不定芽POD活性影响 Fig. 5 Effects of different silicon sources and silicon concentrations on POD activities in adventitious buds of Cryptocoryne parva |
2.6 不同硅源及硅浓度对迷你椒草不定芽MDA含量影响
由图 6可知,在处理25 d后,所有加硅处理的不定芽MDA含量均显著低于CK,硅酸钾0.2、0.4、0.6、0.8、1.0 g/L处理分别较CK降低9.67%、50.05%、56.20%、39.52%、46.43%。硅酸钠处理后,随培养时间增加不定芽MDA含量均呈现先增后降趋势,25 d时较CK降低31.72%~58.56%。硅酸钙处理25 d后,不定芽MDA含量较CK降低22.57%~49.12%。二氧化硅处理25 d时,不定芽MDA含量随二氧化硅浓度增加呈先降后升,较CK降低5.98%~48.73%。

|
| 柱上小写英文字母不同者表示差异显著 Different lowercase letters on the columns represent significant differences 图 6 不同硅源及硅浓度处理对迷你椒草不定芽MDA含量的影响 Fig. 6 Effects of different silicon sources and silicon concentrations on MDA content in adventitious buds of Cryptocoryne parva |
2.7 不同硅源及硅浓度下迷你椒草不定芽生理代谢综合性评价分析
通过计算综合指标的隶属函数值,根据主成分因子的贡献值大小,计算4个综合指标的权重,权重值分别为0.413、0.259、0.168、0.160(表 1)。再根据隶属函数值和权重大小,计算得到加硅各处理的综合评价值(D值),并对其进行排序,经综合评价排序得出硅酸钾0.6 g/L处理是较好的,其次是硅酸钾0.8 g/L、二氧化硅0.2 g/L。

|
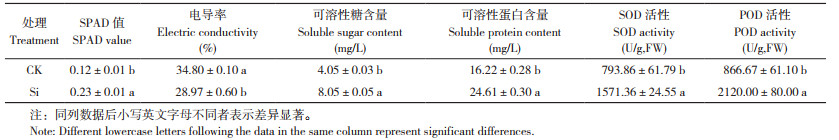
2.8 硅对高温高湿胁迫下迷你椒草生理代谢的影响
由表 2可知,加硅处理(硅酸钾0.6 g/L)的迷你椒草移栽高温高湿环境第5 d时,各指标均显著高于CK。加硅处理的可溶性蛋白和可溶性糖含量较CK分别提高51.91%、98.77%,叶绿素含量较CK提高91.67%。胁迫处理中,加硅处理抑制了迷你椒草电导率上升,显著提高了SOD、POD活性。
|
3 讨论
本试验以迷你椒草不定芽为研究对象,通过在培养基中添加不同硅源,探究硅对试管苗生理代谢的影响。结果表明,添加0.6 g/L硅酸钾25 d后,迷你椒草不定芽的增殖系数与CK相比无显著差异,但其他加硅处理的增殖率均低于CK,表明加硅处理对迷你椒草不定芽增殖无明显作用,甚至低于对照。有研究指出添加硅后,植物体内硅、磷两种元素的吸收会形成竞争关系,抑制植物对磷的吸收,导致增殖系数下降[15]。
硅酸钾、硅酸钠处理25 d时,迷你椒草不定芽的可溶性糖含量均显著高于CK;硅酸钾0.6 g/L处理不定芽可溶性糖含量显著高于其他处理,较CK增长95.39%;硅酸钠0.4 g/L处理不定芽可溶性糖含量较CK增长97.92%;二氧化硅处理在25 d时,随处理浓度增加,不定芽可溶性糖含量先增后降;而硅酸钙随处理浓度增加,不定芽可溶性糖含量则呈下降趋势,且在浓度0.6 g/L时其含量显著低于CK。季明德等[16]通过研究硅在蔗糖合成与分解反应中的作用,证明硅能促进植物对可溶性糖的积累,可溶性糖作为有机渗透调节物质不仅能为植物生长提供足够能量,还具有一定信号功能,能提高植物的抗逆性[17-18],但高浓度的硅对植物可溶性糖积累有抑制作用。可溶性蛋白可降低细胞冰点,缓解植物在逆境中的伤害[19],添加硅处理不定芽的可溶性蛋白含量较CK都有不同程度增长,且处理多呈先下降后上升趋势,有研究发现前期硅能增加植物细胞壁的强度和韧性,保持内外渗透压平衡,减弱可溶性蛋白的信号强度,导致可溶性蛋白累积量减少[20],硅酸钾0.6、0.8 g/L在培养25 d可溶性蛋白含量最高,两个处理间无显著差异,但分别较CK增长27.34%、27.76%,差异极显著。硅酸钠处理不定芽的可溶性蛋白含量在培养25 d较CK增长5.75%~24.73%,硅酸钙0.8 g/L处理显著高于其他处理, 二氧化硅所有处理可溶性蛋白含量均显著高于CK、增幅13.49%~26.63%,表明硅可促进迷你椒草可溶性蛋白积累。
SOD、POD作为植株体内活性氧清洁剂,有利于提高植物在逆境中的耐受性[21-22]。POD能催化过氧化氢氧化酚类的反应,对植物呼吸代谢起重要作用[21],SOD可将植物细胞中的O2转化为H2O2,防止胁迫环境下对细胞损伤[23-24]。本研究结果表明,4种硅的添加均可不同程度提高迷你椒草不定芽的POD、SOD活性。硅酸钾添加0.6 g/L时,不定芽SOD活性最高。硅酸钠添加0.2 g/L时,SOD活性较CK提高45.43%;0.8 g/L时,POD活性显著高于其他浓度处理。硅酸钙和二氧化硅处理不定芽的SOD活性较CK分别增长13.49%~62.87%、0.86%~75.85%;硅酸钙0.6 g/L处理不定芽的POD活性为1 253.73 μg/g,二氧化硅0.2 g/L处理不定芽的POD活性显著高于其他处理。MDA是膜脂过氧化物产物,可作为判断植物受伤害程度的依据[25],本研究中所有施硅处理不定芽的MDA含量均显著低于CK,表明硅可以在一定程度上减轻活性氧自由基对植物的伤害。
将试管苗生根移栽后进行高温高湿胁迫,结果表明加硅处理迷你椒草试管苗的叶绿素含量较CK增长91.67%,加硅处理能保持膜系统的活力,维持栅栏组织中叶绿素体形态,促进光合速率提高[3]。加硅处理迷你椒草不定芽的可溶性糖、可溶性蛋白含量均显著高于CK,SOD、POD活性均高于CK,表明加硅处理能提高迷你椒草试管苗的抗逆性,但也有待后续更深入的研究。
4 结论4种硅源处理后,迷你椒草试管苗的可溶性糖、可溶性蛋白含量较CK均有不同程度的增加,表明添加适宜浓度的硅可以提高植物碳水化合物代谢能力和体内SOD、POD的活性。主成分分析及隶属函数分析得出,在添加硅酸钾0.6 g/L时各指标表现最好。加硅处理通过提高迷你椒草叶绿素、可溶性蛋白、可溶性糖含量,以及调节SOD、POD活性,缓解高温高湿胁迫带来的伤害,增强试管苗抗逆境胁迫能力。
| [1] |
赵红艳, 何明先, 刘润红, 姜勇, 梁士楚. 中国重点保护湿地维管束植物初步研究[J]. 湿地科学, 2017, 15(4): 532-539. DOI:10.13248/j.cnki.wetlandsci.2017.04.009 ZHAO H Y, HE M X, LIU R H, JIANG Y, LIANG S C. A preliminary study on vascular plantsin wetlands under key protection in China[J]. Wetland Science,, 2017, 15(4): 532-539. DOI:10.13248/j.cnki.wetlandsci.2017.04.009 |
| [2] |
EBRAHIMBABAIE P, MEEINKUIRT W, PICHTEL J. Phytoremediation of engineered nanoparticles using aquatic plants: Mechanisms and practical feasibility[J]. Journal of Environmental Sciences, 2020, 93: 151-163. DOI:10.1016/j.jes.2020.03.034 |
| [3] |
何静, 朱婷, 黄雪玲, 马玲. 硅提高植物抗旱性的生理机制研究进展[J]. 热带亚热带植物学报, 2022, 30(6): 813-822. DOI:10.11926/jtsb.4558 HE J, ZHU T, HUANG X L, MA L. Research progress on physiological mechanism of silicon to improve plant drought resistance[J]. Journal of Tropical and Subtropical Botany, 2022, 30(6): 813-822. DOI:10.11926/jtsb.4558 |
| [4] |
卫宏健, 王咏琪, 丁杰, 杨文, 刘天增, 葛良法, 张巨明. 硅对磨损胁迫下狗牙根和结缕草表观质量与生理代谢的影响[J]. 草地学报, 2022, 30(7): 1790-1800. DOI:10.11733/j.issn.1007-0435.2022.07.021 WEI H J, WANG Y Q, DING J, YANG W, LIU T Z, GE L F, ZHANG J M. Effects of silicon on apparent quality and physiological metabolism of dog tooth roots and knotweeds under wear and tear stress[J]. Journal of Grassland, 2022, 30(7): 1790-1800. DOI:10.11733/j.issn.1007-0435.2022.07.021 |
| [5] |
ASHRAF M, RAHMATULLAH, AHMAD R, BHATTI A S, AFZAL M, SARWAR A, MAQSOOD M A, KANWAL S. Amelioration of salt stress in Sugarcane (Saccharum officinarum L.) by supplying potassium and silicon in Hydroponics[J]. Pedosphere, 2010, 20(2): 153-162. DOI:10.1016/S1002-0160(10)60003-3 |
| [6] |
周峰, 曾智, 刘春成. 正常环境条件下硅肥对作物生长影响研究进展[J]. 江西水利科技, 2023, 49(2): 102-107. ZHOU F, ZENG Z, LIU C C. Research progress on the effect of silica fertilizer on crop growth under normal environmental conditions[J]. Jiangxi Water Conservancy Science and Technology, 2023, 49(2): 102-107. |
| [7] |
ZHU Y X, JIANG X C, ZHANG J, HE Y, ZHU X M, ZHOU X K, GONG H J, YIN J L, LIU Y Q. Silicon confers cucumber resistance to salinity stress through regulation of proline and cytokinins[J]. Plant Physiology and Biochemistry, 2020, 156: 209-220. DOI:10.1016/j.plaphy.2020.09.014 |
| [8] |
王荔军, 李敏, 李铁津, 王运华, 张福锁. 植物体内的纳米结构SiO2[J]. 科学通报, 2001(8): 625-632. DOI:10.1360/csb2001-46-8-625 WANG L J, LI M, LI T J, WANG Y H, ZHANG F S. Nanostructure SiO2 in plants[J]. Science Bulletin, 2001(8): 625-632. DOI:10.1360/csb2001-46-8-625 |
| [9] |
LAW C, EXLEY C. New insight into silica deposition in horsetail (Equisetum arvencse)[J]. BMC Plant Biology, 2011, 11(1): 112. DOI:10.1186/1471-2229-11-112 |
| [10] |
FAUTEUX F, CHAIN F, BEL ZILE F. The protective role of silicon in the Arabidopsis-powdery mildew pathosystem[J]. Proceedings of the National Academy of Sciences, 2006, 103(46): 17554-17559. DOI:10.1073/pnas.0606330103 |
| [11] |
袁云香. 硅对南方红豆杉愈伤组织诱导及增殖培养的影响[J]. 科学技术与工程, 2018, 18(35): 121-123. DOI:10.3969/j.issn.1671-1815.2018.35.019 YUAN Y X. Effect of silicon on callus induction and proliferation culture of southern yew[J]. Science Technology and Engineering, 2018, 18(35): 121-123. DOI:10.3969/j.issn.1671-1815.2018.35.019 |
| [12] |
董倩, 黄国强, 王艳君, 邓祖湖, 陈如凯. 硅对果蔗组培腋芽苗增殖生长及相关指标的影响[J]. 热带作物学报, 2018, 39(1): 116-120. DOI:10.3969/j.issn.1000-2561.2018.01.018 DONG Q, HUANG G Q, WANG Y J, DENG Z H, CHEN R K. Effects of silicon on the proliferation and growth of axillary sprouts and related indexes in fruit cane tissue culture[J]. Chinese Journal of Tropical Crops, 2018, 39(1): 116-120. DOI:10.3969/j.issn.1000-2561.2018.01.018 |
| [13] |
李合生. 现代植物生理学[M]. 北京: 高等教育出版社, 2022. LI H S. Modern plant physiology[M]. Beijing: Higher Education Press, 2022. |
| [14] |
胡亮亮, 王素华, 王丽侠, 程须珍, 陈红霖. 绿豆种质资源苗期耐盐性鉴定及耐盐种质筛选[J]. 作物学报, 2022, 48(2): 367-379. DOI:10.3724/SP.J.1006.2022.04283 HU L L, WANG S H, WANG L X, CHEN X Z, CHEN H L. Identification of salt tolerance and salt-tolerant germplasm screening of mung bean germplasm resources at seedling stage[J]. Acta Agronomica Sinica, 2022, 48(2): 367-379. DOI:10.3724/SP.J.1006.2022.04283 |
| [15] |
江晓东, 华梦飞, 杨沈斌, 杨晓亚, 郭建茂, 姜琳琳. 喷施钾钙硅制剂改善高温胁迫水稻叶片光合性能提高产量[J]. 农业工程学报, 2019, 35(5): 126-133. DOI:10.11975/j.issn.1002-6819.2019.05.015 JIANG X D, HUA M F, YANG S B, YANG X Y, GUO J M, JIANG L L. Potassium-calcium-silicon preparation improved photosynthetic performance and yield of high-temperature stressed rice leaves[J]. Transactions of the Chinese Society of Agricultural Engineering, 2019, 35(5): 126-133. DOI:10.11975/j.issn.1002-6819.2019.05.015 |
| [16] |
季明德, 黄湘源, 鄢非. 硅元素对甘蔗增产和增糖作用机理的研究——Ⅱ甘蔗中不同形态硅元素的定量测定方法的研究[J]. 南昌大学学报(理科版), 1993(4): 50-54. JI M D, HUANG X Y, YAN F. Study on the mechanism of silicon on yield increase and sugar increase in sugarcane-Ⅱ. Study on quantitative determination methods of different forms of silicon elements in sugarcane[J]. Journal of Nanchang University (Science Edition), 1993(4): 50-54. |
| [17] |
孙晓玉. 硅对蓝莓试管苗生长及生理代谢的影响[D]. 大连: 大连理工大学, 2019. DOI: 10.26991/d.cnki.gdllu.2019.001917. SUN X Y. Effects of silicon on the growth and physiological metabolism of blueberry seedlings in vitro[D]. Dalian: Dalian University of Technology, 2019. DOI: 10.26991/d.cnki.gdllu.2019.001917. |
| [18] |
付婷婷, 王昊, 赵颖, 王蔚兰, 王旭. 根际NaCl浓度对冰菜形态和生理的影响[J]. 广东农业科学, 2023, 50(6): 36-43. DOI:10.16768/j.issn.1004-874X.2023.06.005 FU T T, WANG H, ZHAO Y, WANG W L, WANG X. Effects of rhizosphere NaCl concentration on morphology and physiology of ice cabbage[J]. Guangdong Agricultural Sciences, 2023, 50(6): 36-43. DOI:10.16768/j.issn.1004-874X.2023.06.005 |
| [19] |
赵江涛, 李晓峰, 李航, 徐睿文. 可溶性糖在高等植物代谢调节中的生理作用[J]. 安徽农业科学, 2006(24): 6423-6425, 6427. DOI:10.13989/j.cnki.0517-6611.2006.24.015 ZHAO J T, LI X F, LI H, XU R W. Physiological role of soluble sugar in metabolism regulation of higher plants[J]. Journal of Anhui Agricultural Sciences,, 2006(24): 6423-6425, 6427. DOI:10.13989/j.cnki.0517-6611.2006.24.015 |
| [20] |
陈海燕. 外源硅对低温胁迫下苗期水稻生理生化特性的影响[D]. 哈尔滨: 东北农业大学, 2018. CHEN H Y. Effects of exogenous silicon on physiological and biochemical characteristics of seedling rice under low temperature stress[D]. Harbin: Northeast Agricultural University, 2018. |
| [21] |
黄丽媛, 刘珍, 贾胜波, 邓思颖, 盛玉香, 王琼. 钙对铝胁迫下油茶生长及生理特性的影响[J]. 广东农业科学, 2023, 50(2): 1-10. DOI:10.16768/j.issn.1004-874X.2023.02.001 HUANG L Y, LIU Z, JIA S B, DENG S Y, SHENG Y X, WANG Q. Effects of calcium on growth and physiological characteristics of Camellia oleifera under aluminum stress[J]. Guangdong Agricultural Sciences, 2023, 50(2): 1-10. DOI:10.16768/j.issn.1004-874X.2023.02.001 |
| [22] |
区焯林, 喻敏, 王灼明. 硼、钼、硅对草坪草海滨雀稗CAT和POD活性的影响[J]. 韶关学院学报(自然科学版), 2009, 30(6): 57-60. DOI:10.3969/j.issn.1007-5348.2009.06.015 OU Z L, YU M, WANG Z M. Influence of born, molybdenum and silicon on the activity of the CAT and POD in Turfgrasses Paspalum vaginatum swarfz[J]. Journal of Shaoguan University (Natural Science), 2009, 30(6): 57-60. DOI:10.3969/j.issn.1007-5348.2009.06.015 |
| [23] |
许建光, 李淑仪, 王荣萍, 廖新荣, 蓝佩玲. 硅对铬胁迫下小白菜生理指标的影响[J]. 生态学杂志, 2007, 167(6): 865-868. DOI:10.1329/j.1000-4890.2007.0157 XU J G, LI S Y, WANG R P, LIAO X R, LAN P L. Effects of silicon on physiological indices of Chinese cabbage under chromium stress[J]. Chinese Journal of Ecology, 2007, 167(6): 865-868. DOI:10.1329/j.1000-4890.2007.0157 |
| [24] |
卜瑞方. 硅缓解黄瓜种子萌发和幼苗生长自毒作用的机理研究[D]. 兰州: 甘肃农业大学, 2016. BU R F. Study on the mechanism of silicon alleviating the autotoxicity of cucumber seed germination and seedling growth[D]. Lanzhou: Gansu Agricultural University, 2016. |
| [25] |
陈明灿, 王贺正, 姚孚荣, 朱志勇, 李友军. 硅对小麦幼苗生长及部分生理指标的影响[J]. 广东农业科学, 2014, 41(21): 7-10. DOI:10.16768/j.issn.1004-874X.2014.21.018 CHEN M C, WANG H Z, YAO F R, ZHU Z Y, LI Y J. Effects of silicon on growth and some physiological indexes of wheat seedlings[J]. Guangdong Agricultural Sciences, 2014, 41(21): 7-10. DOI:10.16768/j.issn.1004-874X.2014.21.018 |
(责任编辑 马春敏)
 2023, Vol. 50
2023, Vol. 50