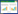文章信息
基金项目
- 国家重点研发计划项目(2017YFD0202102);云南省科技国家重点研发计划项目(2017YFD0202102);云南省科技人才与平台计划项目“云南省丰锋专家工作站”(202305AF150146)
作者简介
- 向星星(1997—),女,在读硕士生,研究方 向为园林植物资源与利用,E-mail:804378859@qq.com; 丰锋,硕士,教授,硕士生导师,广东海洋大学滨海农业学院,云南省丰锋专家工作站负责人。主要从事菠萝蜜、香蕉、淮山薯等热带、南亚热带园艺植物新品种选育、良种繁育及安全高效生产技术研究。主持国家重点研发计划项目子课题、国家育种菠萝蜜联合攻关项目及广东省科技厅科技攻关课题6项,参与国家自然科学基金、科技部成果转化资金等各级课题10余项。以第一或通信作者发表学术论文50余篇。获广东省科学技术三等奖2项;获授权国家发明专利1件,计算机软件著作权1项;主持选育并通过广东省农作物品种审定委员会审定品种6个(菠萝蜜4个:海大1号、海大2号、海大3号、海大4号;辣椒2个:茂海大椒、茂海长线).
通讯作者
- 丰锋(1969—),男,硕士,教授,研究方向为组培快繁及安全高效生产技术,E-mail:ff1703@126.com.
文章历史
- 收稿日期:2023-07-26
【研究意义】闽粤石楠(Photinia benthamiana Hance)属蔷薇科石楠属多年生灌木或小乔木,分布于我国广东、福建、湖南、浙江等地,位于陆地与海洋交界带的红树林滩涂,是生产力最高的生态系统之一,是海岸带区域重要的生态屏障。由于人们对沿海滩涂随意采伐、养殖和无序开发等行为,以及全球气候变化的加剧,红树林正面临多种威胁[1-2]。资源调查发现,在红树林沿海滩涂中,伴生多株耐盐闽粤石楠,利用这些耐盐单株建立耐盐闽粤石楠组培快繁体系,可在短时间内获得大量优质种苗,为沿海滩涂绿化提供种苗支持,具有非常重要的经济价值和生态价值[3-4],应用前景广阔。【前人研究进展】石楠属植物适应性较强,对土质要求不高,耐瘠薄、耐盐碱[5],其应用涉及生态绿化、医疗食品和生化产品等多个领域,在绿化产业生态建设中发挥着不可或缺的积极作用。目前关于石楠属植物的研究主要集中于扦插育苗技术[6-7]、容器育苗技术[8]、病虫害防治[9-10]等。在石楠属植物组培快繁研究方面,孔祥生等[11]最早以石楠侧枝嫩芽为外植体建立组培快繁体系;李明银等[12]以红叶石楠叶片和茎段为外植体诱导愈伤组织,结果表明TDZ和AgNO3对愈伤有促进作用,诱导率最高达55%;吴丽君等[13]以红叶石楠‘鲁宾斯’的茎段为外植体进行组培技术研究,但其离体培养存在增殖率高、生根率低的问题,生根率仅有49%;孙利忠等[14]以红叶石楠‘红罗宾’的带芽茎段诱导出不定芽并进行增殖、生根,仍存在增殖倍数低、分化率不高等问题。国外也有通过红叶石楠茎段组织培养的相关研究[15]。【本研究切入点】目前仍未见组培快繁繁殖耐盐闽粤石楠种苗的报道,因此建立一套完整、系统的耐盐闽粤石楠组培快繁体系具有重要现实意义。【拟解决的关键问题】本研究以耐盐闽粤石楠实生苗带芽茎段为材料,探讨无菌材料获得、腋芽诱导、不定芽增殖和生根培养的培养基,进而建立组培快繁体系。通过筛选耐盐闽粤石楠最佳外植体灭菌处理、离体快繁激素浓度最佳组合,旨在建立比较系统完整的耐盐闽粤石楠组培快繁体系,为沿海滩涂利用提供种苗支持。
1 材料与方法 1.1 试验材料2021年11月,在广东省深圳市大鹏新区红树林湿地采集耐盐闽粤石楠种子。试验于广东海洋大学实验室开展,将采集的种子洗净暗红色果皮,去除杂质后,用1% NaClO浸泡消毒20 min。将经过消毒的种子与细沙以体积比3∶1混匀置于自封袋内,湿度保持30%~40%,于4 ℃冰箱中低温沙藏。经低温沙藏保存3个月后播种,获得耐盐闽粤石楠实生苗。
1.2 试验方法1.2.1 外植体预处理及灭菌 选择长势健壮、规格统一的耐盐闽粤石楠实生苗,以耐盐闽粤石楠茎段为外植体,去掉叶片,用洗衣粉漂洗20 min,自来水冲洗60 min后,备用。外植体预处理后,在超净工作台中,首先将外植体用无菌水清洗1次,置于无菌空瓶中,分别以75% 乙醇(10、20、30 s)、0.15% 氯化汞(1、3、5 min)组合处理对外植体进行灭菌,然后切成1 cm左右的茎段,接种于MS基本培养基,每个处理接种10瓶,每瓶接种1个外植体,3次重复。接种后30 d统计污染率、成活率。

|
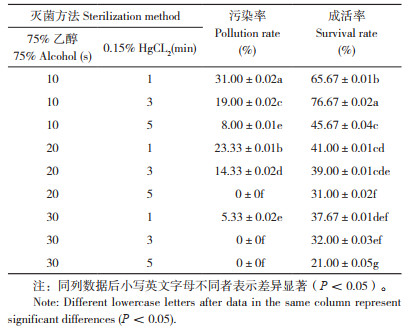
1.2.2 不定芽诱导培养 按照1.2.1的方法,将预处理后的外植体用75% 乙醇灭菌10 s、0.15% 氯化汞灭菌3 min,接种至不同诱导培养基中。以MS为基本培养基,以6-BA(0.5、1.0、2.0 mg/L)、NAA(0.1、0.2、0.3 mg/L)组合处理对外植体进行不定芽诱导,每个处理接种10瓶,每瓶接种2个茎段,3次重复。接种后30 d统计不定芽诱导率和平均萌芽数。

|
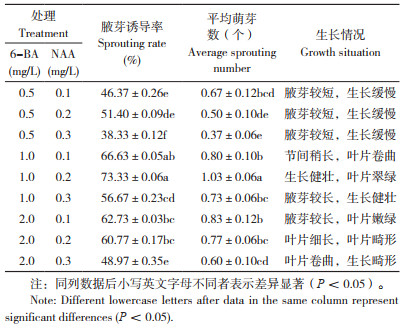
1.2.3 不定芽增殖培养 将1.2.2诱导的不定芽培养60 d,转接到不同增殖培养基。采用L9(34)正交试验设计方法,以基本培养基(MS、1/2MS、WPM)、6-BA(1.0、2.0、3.0 mg/L)、NAA(0.1、0.25、0.5 mg/L)组合处理进行不定芽增殖培养,每个处理接种10瓶,每瓶接种1个不定芽,3次重复。接种后30 d统计增殖系数。

|
1.2.4 不定芽生根培养 将1.2.3增殖培养获得的不定芽培养2~4代后,转接到不同生根培养基。采用单因素试验设计方法,以1/2MS为基本培养基,分别以NAA(0.2、0.4、0.6、0.8 mg/L)和IBA(0.2、0.4、0.6、0.8 mg/L)进行不定芽生根培养,每个处理接种10瓶,每瓶接种3~5株不定芽,3次重复。接种后60 d统计生根率、根长和根系数量,用直尺测定根长。
上述培养基均添加琼脂5.5 g/L、蔗糖30 g/L,pH 5.8;培养条件为:温度25(±1)℃、光照强度2 000 Lx、光照时间12 h/d。
试验数据分析采用DPS软件进行方差分析和多重比较分析(Duncan)。
2 结果与分析 2.1 不同灭菌方法对耐盐闽粤石楠茎段灭菌效果的影响如表 1所示,不同灭菌方法处理的耐盐闽粤石楠茎段污染率和成活率不同。随着75% 乙醇和0.15% 氯化汞处理时间的延长,外植体的污染率降低,成活率也降低。当75% 乙醇消毒20 s、0.15% 氯化汞消毒5 min后,外植体污染率为0,但外植体呈深褐色、不能诱导出不定芽,表明外植体受到了伤害。综合污染率和成活率,最佳的灭菌处理是75% 乙醇10 s+0.15% 氯化汞3 min,此时污染率为19.0%、成活率为76.67%,与其他处理差异显著。
|
2.2 6-BA与NAA不同浓度组合对耐盐闽粤石楠茎段诱导的影响
观察接种第14天的耐盐闽粤石楠茎段发现,腋芽在6-BA与NAA不同浓度组合的9种诱导培养基中均可萌发,少量培养基基部可见愈伤组织形成。如表 2所示,当NAA浓度一定时,随着6-BA浓度的升高,不定芽的诱导率显著提升;当培养基中添加1.0 mg/L 6-BA、0.2 mg/L NAA时,不定芽诱导率最高、达73.33%,平均萌芽数1.03个,生长状况良好(图 1),与其他处理差异显著。添加0.5 mg/L 6-BA、0.1 mg/L NAA以及添加2.0 mg/L 6-BA、0.3 mg/L NAA的处理诱导率均低于50%,表明培养基添加激素浓度过高或过低均不利于诱导不定芽产生。耐盐闽粤石楠不定芽最佳诱导培养基为MS+1.0 mg/L 6-BA+0.2 mg/L NAA。
|

|
| A:茎段诱导培养14 d;B:茎段诱导培养30 d;C:茎段诱导培养60 d A: 14 days after induction with stem segments; B: 30 days after induction with stem segments; C: 60 days after induction with stem segments 图 1 耐盐闽粤石楠茎段诱导培养生长情况 Fig. 1 Growth of salt-tolerant Photinia benthamiana Hance stems of induction culture |
2.3 基本培养基、6-BA和NAA对耐盐闽粤石楠不定芽增殖的影响
如表 3所示,以1/2MS为基本培养基处理的闽粤石楠不定芽增殖系数较高,且不定芽长势较好,叶片嫩绿;以WPM为基本培养基处理的不定芽生长较矮;随着6-BA浓度增加,不定芽增殖系数逐渐升高,当6-BA浓度为2.0 mg/L时,平均增殖系数为2.83,较1.0、3.0 mg/L 6-BA处理分别高0.29和0.52。通过对各因素进行极差分析发现,基本培养基、6-BA和NAA的极差值R分别为0.3、0.5、0.2,表现为6-BA>基本培养基>NAA,说明6-BA为增殖培养的主要影响因子,其次是基本培养基。综上,耐盐闽粤石楠最佳增殖培养基为1/2MS+2.0 mg/L 6-BA+0.5 mg/L NAA,增殖系数达3.1,且不定芽生长健壮(图 2)。
|

|
| A:不定芽增殖培养15 d;B:不定芽增殖培养30 d;C:不定芽增殖培养60 d A: Adventitious bud prolifera tion culture for 15 days; B: Adventitious bud proliferation culture for 30 days; C: Adventitious bud proliferation culture for 60 days 图 2 耐盐闽粤石楠不定芽增殖培养生长情况 Fig. 2 Growth of adventitious buds of salt-tolerant Photinia benthamiana Hance of proliferation culture |
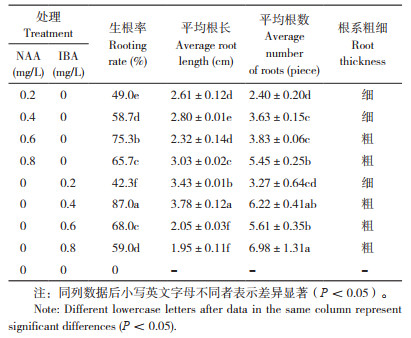
2.4 NAA和IBA对耐盐闽粤石楠不定芽生根的影响
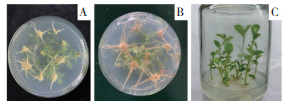
截取2~3 cm的不定芽进行单株生根培养,如表 4所示,组培苗在未添加激素的1/2MS培养基中,生根率为0;随着添加激素浓度提高,茎秆更加粗壮、根系变粗,基部产生大量愈伤组织(图 3),其中IBA较NAA对耐盐闽粤石楠不定芽的生根诱导效果更好,当IBA浓度为0.4 mg/L时,生根率为87%,平均根长为3.78 cm,平均根数为6.22条,显著高于其他处理。综上,耐盐闽粤石楠的最佳生根培养基为1/2MS+0.4 mg/L IBA。
|
|
| A:不定芽生根培养10 d;B:不定芽生根培养30 d;C:不定芽生根状态 A: Adventitious bud rooting culture for 10 days; B: Adventitious bud rooting culture for 30 days; C: Rooting state of adventitious buds 图 3 耐盐闽粤石楠不定芽生根培养生长情况 Fig. 3 Growth of adventitious buds of salt-tolerant Photinia benthamiana Hance of rooting culture |
3 讨论
本研究采用耐盐闽粤石楠茎段为外植体直接诱导不定芽,进而进行增殖和生根培养,缩短了从外植体到组培苗的整个诱导周期,是一种更加快速高效的再生体系[16]。降低耐盐闽粤石楠外植体污染率是研究其组培快繁技术需解决的重要问题,通常取自田间的外植体带菌较多,较难彻底消毒灭菌[17]。因此寻求最佳的灭菌药剂及其浓度和时间的组合,控制外植体污染和成活率,是灭菌环节的重要问题[18-19]。本试验通过取当年生耐盐闽粤石楠实生苗茎段为材料进行75% 乙醇灭菌10 s+0.15% 氯化汞灭菌3 min,外植体污染率为19%,成活率为76.67%,有效解决了无菌体系建立面临的污染率较高问题。刘松青等[20]在桑芽组织快繁技术研究中采用消毒75% 酒精处理1 min+5% 次氯酸钠溶液处理10 min进行筛选试验,效果较好。
增殖培养是种苗扩繁的重要阶段[21],生长素类物质和细胞分裂素物质对种苗质量和培养效率有很大影响[22-23]。正交实验设计也是一种高效率的方法[24]。本研究发现,6-BA和NAA对耐盐闽粤石楠不定芽诱导均有显著影响。龚霄雯[25]研究发现,在添加1.0 mg/L 6-BA和0.1 mg/L NAA的培养基中,红叶石楠‘红罗宾’的腋芽萌发率达95%;独山石楠在添加2.0 mg/L 6-BA+0.1 mg/L NAA的MS培养基中,腋芽萌发率达83.3%。基本培养基对不定芽的增殖系数和生长状况也有显著影响[26],MS培养基是增殖培养中常用的基本培养基,这与邢建宏等[27]研究结果相似。为更全面探讨不同培养基对耐盐闽粤石楠增殖效果的影响,本试验采用L9(34)正交试验设计,探讨MS、1/2MS、WPM培养基对其增殖培养的影响,发现1/2MS培养基的增殖效果优于MS培养基。这可能是由于MS培养基盐离子浓度过高,造成较高的渗透压,导致一定程度上抑制了植物细胞的分裂分化[28],表明基本培养基对石楠外植体的增殖培养中有一定影响。
木本植物生根是离体培养的关键步骤。研究表明,基本培养基及激素浓度配比、蔗糖和琼脂等添加物都会影响组培苗的生根效果[29]。NAA和IBA是诱导不定根形成的常用激素,其浓度配比影响植物生根效果,在保证生根的情况下,使根多且粗壮,利于移栽成活[30]。高浓度激素条件下,茎段基部产生大量愈伤组织,根数增加,但生根率降低,根长变短。由此推测,低浓度激素有利于促进耐盐闽粤石楠组培苗生根。
4 结论本研究以耐盐闽粤石楠茎段为材料,建立了一套外植体灭菌、腋芽诱导、不定芽增殖和生根培养的组培快繁体系。其中,茎段经75% 乙醇灭菌10 s+0.15% 氯化汞灭菌3 min处理后,灭菌效果最佳,污染率19%,成活率76.67%;诱导培养以MS+6-BA 1.0 mg/L+NAA 0.2 mg/L最佳,诱导率为73.33%,平均萌芽数1.03个;增殖培养以1/2MS+ 6-BA 2.0 mg/L+NAA 0.5 mg/L最佳,增殖系数为3.1,丛生芽生长快且健壮;生根培养以1/2MS+0.4 mg/L IBA最佳,生根率为87%,平均根数6.22条,平均根长3.78 cm。
| [1] |
吕晓波, 钟才荣, 张孟文, 方赞山, 程成, 陈旭. 海南东寨港秋茄种群结构与数量动态变化特征研究[J]. 广东农业科学, 2023, 50(3): 39-48. DOI:10.16768/j.issn.1004-874X.2023.03.005 LYU X B, ZHONG C R, ZHANG M W, FANG Z S, CHENG C, CHEN X. Dynamic change characteristics of population structure and quantity of Kandelia obovata in Dongzhai harnor of hainan[J]. Guangdong Agricultural Sciences, 2023, 50(3): 39-48. DOI:10.16768/j.issn.1004-874X.2023.03.005 |
| [2] |
黄凡非, 唐丽丽, 李瑞利. 近四十年来中国大陆红树林保护与恢复措施的生态效益分析[J/OL]. 北京大学学报(自然科学版), 2023, 26(8): 1-11. DOI: 10.13209/j.0479-8023.2023.046. HUANG F F, TANG L L, LI R L. Analysis of ecological benefits of mangrove protection and restoration measures in the mainland of China in the past 40 years[J/OL]. Journal of Peking University (Natural Science Edition), 2023, 26(8): 1-11. DOI: 10.13209/j.0479-8023.2023.046. |
| [3] |
林鹏, 林益明, 杨志伟, 王湛昌. 中国海洋红树林药物的研究现状、民间利用及展望[J]. 海洋科学, 2005, 29(9): 78-81. DOI:10.3969/j.issn.1000-3096.2005.09.016 LIN P, LIN Y M, YANG Z W, WANG Z C. Research status, folk utilization and prospect of marine mangrove drugs in China[J]. Marine Sciences, 2005, 29(9): 78-81. DOI:10.3969/j.issn.1000-3096.2005.09.016 |
| [4] |
李小朋, 王佳, 高伟勤, 刘厚诚, 赵秀芳, 余忠明. 红树林植物组织培养的研究进展[J/OL]. 分子植物育种, 2023: 1-13. http://kns.cnki.net/kcms/detail/46.1068.S.20230117.1333.004.html. LI X P, WANG J, GAO W Q, LIU H C, ZHAO X F, YU Z M. Research progress on tissue culture of mangrove plant[J/OL]. Molecular Plant Breeding, 2023: 1-13. http://kns.cnki.net/kcms/detail/46.1068.S.20230117.1333.004.html. |
| [5] |
吕明. 浅议红叶石楠的栽培管理技术[J]. 特种经济动植物, 2023, 26(5): 133-135. DOI:10.3969/j.issn.1001-4713.2023.05.045 LYU M. Cultivation and management technology of Photinia fraseri[J]. Special Economic Animals and Plants, 2023, 26(5): 133-135. DOI:10.3969/j.issn.1001-4713.2023.05.045 |
| [6] |
罗万德. 北衙地区不同激素对红叶石楠扦插的影响[J]. 现代园艺, 2022, 45(21): 13-14. DOI:10.14051/j.cnki.xdyy.2022.21.050 LUO W D. Effects of different hormones on cutting of Photinia frasery in Beiya area[J]. Contemporary Horticulture, 2022, 45(21): 13-14. DOI:10.14051/j.cnki.xdyy.2022.21.050 |
| [7] |
邵光忠, 陶杭军, 沈七一, 许邵远. 罗城石楠扦插繁育[J]. 中国花卉园艺, 2020(16): 46-47. SHAO G Z, TAO H J, SHEN Q Y, XU S Y. Cutting propagation of Photinia serrulata in Luocheng[J]. China Flowers & Horticulture, 2020(16): 46-47. |
| [8] |
张香杨, 江文林, 江生泉. 红叶石楠容器苗培育技术[J]. 安徽农学通报, 2021, 27(17): 77-78. DOI:10.16377/j.cnki.issn1007-7731.2021.17.026 ZHANG X Y, JIANG W L, JIANG S Q. Container seedling cultivation technology of Photinia frasery[J]. Anhui Agricultural Bulletin, 2021, 27(17): 77-78. DOI:10.16377/j.cnki.issn1007-7731.2021.17.026 |
| [9] |
路秋生, 瞿晓群, 胥静, 宋洁, 陈兴振. 4种彩叶树种主要病虫害种类及防治试验[J]. 山东林业科技, 2021, 51(3): 57-60. DOI:10.3969/j.issn.1002-2724.2021.03.015 LU Q S, QU X Q, XU J, SONG J, CHEN X Z. Common diseases and insect pests of four color leaf tree species and their control experiment[J]. Shandong Forestry Science and Technology, 2021, 51(3): 57-60. DOI:10.3969/j.issn.1002-2724.2021.03.015 |
| [10] |
付冬根, 陈玲. 红叶石楠主要病虫害及其防治要点[J]. 现代园艺, 2015(18): 71. DOI:10.14051/j.cnki.xdyy.2015.18.057 FU D G, CHEN L. Main pests and diseases of Photinia fraseri and its control points[J]. Contemporary Horticulture, 2015(18): 71. DOI:10.14051/j.cnki.xdyy.2015.18.057 |
| [11] |
孔祥生, 张妙霞, 杨正申, 李文安. 石楠的组织培养[J]. 植物生理学通讯, 1989(3): 47. DOI:10.13592/j.cnki.ppj.1989.03.017 KONG X S, ZHANG M X, YANG Z S, LI W A. Tissue culture of Photinia serrulata[J]. Plant Physiology Journal, 1989(3): 47. DOI:10.13592/j.cnki.ppj.1989.03.017 |
| [12] |
李明银, 陈莹. 红叶石楠(Photinia×Fraseri) 愈伤组织诱导研究[J]. 世界科技研究与发展, 2009, 31(6): 986-988, 985. DOI:10.16507/j.issn.1006-6055.2009.06.011 LI M Y, CHEN Y. Study of callus induction effect of Photinia×Fraseri in vitro[J]. World Sci-Tech R & D, 2009, 31(6): 986-988, 985. DOI:10.16507/j.issn.1006-6055.2009.06.011 |
| [13] |
吴丽君, 翁秋媛. 红叶石楠不同品种的组培技术研究[J]. 福建林业科技, 2008, 35(4): 165-169. DOI:10.13428/j.cnki.fjlk.2008.04.020 WU L J, WENG Q Y. Study of tissue culture technique of two varieties of Photinia fraseri[J]. Journal of Fujian Forestry Science and Technology, 2008, 35(4): 165-169. DOI:10.13428/j.cnki.fjlk.2008.04.020 |
| [14] |
孙利忠, 陈敬, 胡秀锦, 杨艳敏, 刘彤, 海新民. 红叶石楠离体组培快繁技术体系研究[J]. 北方园艺, 2022(14): 49-56. DOI:10.11937/bfyy.20220397 SUN L Z, CHEN J, HU X J, YANG Y M, LIU T, HAI X M. Technical system of rapid propagation of tissue culture in vitro of Photinia fraseri[J]. Northern Horticulture, 2022(14): 49-56. DOI:10.11937/bfyy.20220397 |
| [15] |
AKDEMIR H, KAYA E, OZDEN Y. In vitro proliferation and minimum growth storageof Fraser photinia: Influences of different medium, sugar combinations and culture vessels[J]. Scientia Horticulturae, 2010, 126(2): 268-275. DOI:10.1016/j.scienta.2010.07.005 |
| [16] |
高思丹, 王联星, 郭佳磊, 杨莉娜, 何桂芳, 何涛. 青海野生黑果枸杞再生体系的建立及遗传稳定性分析[J]. 西北植物学报, 2020, 40(2): 252-260. DOI:10.7606/j.issn.1000-4025.2020.02.0252 GAO S D, WANG L X, GUO J L, YANG L N, HE G F, HE T. Establishment of the regeneration system of wild Lycium ruthenicum from Qinghai and analysis in its genetic stability[J]. Acta Botanica Boreall-Occidentalia Sinica, 2020, 40(2): 252-260. DOI:10.7606/j.issn.1000-4025.2020.02.0252 |
| [17] |
吴霞, 凡莉莉, 王小妹, 陈凌艳, 何天友, 荣俊冬, 郑郁善. 银丝竹组培快繁体系建立[J/OL]. 分子植物育种, 2022: 1-19. http://kns.cnki.net/kcms/detail/46.1068.S.20220409.0854.004.html. WU X, FAN L L, WANG X M, CHEN L Y, HE T Y, RONG J D, ZHENG Y S. Rapid propagation system of Bambusa multiplex 'silverstrip' tissue culture[J/OL]. Molecular Plant Breeding, 2022: 1-19. http://kns.cnki.net/kcms/detail/46.1068.S.20220409.0854.004.html. |
| [18] |
莫银屏, 徐丰, 石雪晖, 杨国顺, 刘昆玉, 金燕, 钟晓红. 湘酿1号刺葡萄离体快繁技术试验[J]. 中外葡萄与葡萄酒, 2015(2): 26-28. DOI:10.13414/j.cnki.zwpp.2015.02.004 MO Y P, XU F, SHI X H, YANG G S, LIU K Y, JIN Y, ZHONG X H. Rapid propagation technology of Xiangniang-1 (Vitis davidii Foex) in vitro[J]. Sino-Overseas Grapevine & Wine, 2015(2): 26-28. DOI:10.13414/j.cnki.zwpp.2015.02.004 |
| [19] |
温鹏飞, 王蓓, 张建成, 牛铁泉, 仓国营, 邢廷富. 次氯酸钠对葡萄叶片组培褐变率的影响[J]. 山西农业科学, 2012, 40(6): 571-574. DOI:10.3969/j.issn.1002-2481.2012.06.03 WEN P F, WANG B, ZHANG J C, NIU T Q, CANG G Y, XING T F. Effect of sodium hypochlorite on the browning rate in leaf tissue culture of grape[J]. Journal of Shanxi Agricultural Sciences, 2012, 40(6): 571-574. DOI:10.3969/j.issn.1002-2481.2012.06.03 |
| [20] |
刘松青, 冯鸿, 祁伟亮, 张硕, 阮梅, 龚壁燃, 任迎虹. 桑芽的组织快繁技术研究[J]. 中国野生植物资源, 2017, 36(5): 40-44, 52. DOI:10.3969/j.issn.1006-9690.2017.05.010 LIU S Q, FENG H, QI W L, ZHANG S, RUAN M, GONG B R, REN Y H. Resea rch on tissue culture of mulberry buds[J]. Chinese Wild Plant Resources, 2017, 36(5): 40-44, 52. DOI:10.3969/j.issn.1006-9690.2017.05.010 |
| [21] |
叶维雁, 王连春, 刘惠民, 刘鹏, 叶红莲. 番木瓜组培快繁效率的影响因子研究[J]. 广东农业科学, 2015, 42(11): 59-64. DOI:10.16768/j.issn.1004-874X.2015.11.018 YE W Y, WANG L C, LIU H M, LIU P, YE H L. Influence factors of tissue culture and rapid propagation efficiency of papaya[J]. Guangdong Agricultural Sciences, 2015, 42(11): 59-64. DOI:10.16768/j.issn.1004-874X.2015.11.018 |
| [22] |
顾梦云, 曾伟达, 宿庆连, 黄明翅, 冯肖梅, 刘艳艳, 张雪莲, 周晓云. 不同LED光质配比和光照强度对红掌新品种福星组织培养的影响[J]. 广东农业科学, 2023, 50(5): 46-55. DOI:10.16768/j.issn.1004-874X.2023.05.006 GU M Y, ZENG W D, SU Q L, HUANG M C, FENG X M, LIU Y Y, ZHANG X L, ZHOU X Y. Effects of different LED light quality ratio and light intensity on tissue culture of a new Anthurium andraeanum cultivar fuxing[J]. Guangdong Agricultural Sciences, 2023, 50(5): 46-55. DOI:10.16768/j.issn.1004-874X.2023.05.006 |
| [23] |
陈汉鑫, 林艺辉, 张朝坤, 黄婉莉, 王锦玲, 马馨怡. 百香果组培苗快繁体系建立研究[J]. 中国南方果树, 2022, 51(3): 74-78. DOI:10.13938/j.issn.1007-1431.20210347 CHEN H X, LIN Y H, ZHAO C K, HUANG W L, WANG J L, MA X Y. Study on establishment of tissue culture system for rapid propagation of seedlings of Passiflora edulis[J]. South China Fruits, 2022, 51(3): 74-78. DOI:10.13938/j.issn.1007-1431.20210347 |
| [24] |
王冬梅, 黄学林, 黄上志. 细胞分裂素类物质在植物组织培养中的作用机制[J]. 植物生理学通讯, 1996(5): 373-377. DOI:10.13592/j.cnki.ppj.1996.05.023 WANG D M, HUANG X L, HUANG S Z. The action mechanism of cytokinsins in plant tissue culture[J]. Plant Physiology Journal, 1996(5): 373-377. DOI:10.13592/j.cnki.ppj.1996.05.023 |
| [25] |
龚霄雯. 红叶石楠'红罗宾'组织培养再生体系的建立和优化[D]. 上海: 上海交通大学, 2012. GONG X W. Establishment and optimization of tissue culture regeneration system of Photinia fraseri 'Red Robin'[D]. Shanghai: Shanghai Jiao Tong University, 2012. |
| [26] |
赵立军, 李茂林, 宋丽莎. 独山石楠幼茎的离体组织培养[J]. 农业与技术, 2020, 40(3): 65-66, 78. DOI:10.19754/j.nyyjs.20200215024 ZHAO L J, LI M L, SONG L S. In vitro tissue culture of young stem of Photinia serrulata[J]. Agriculture and Technology, 2020, 40(3): 65-66, 78. DOI:10.19754/j.nyyjs.20200215024 |
| [27] |
邢建宏, 侯滟新, 林家治. 红叶石楠'红罗宾'高频再生体系优化[J]. 北方园艺, 2019(14): 73-78. DOI:10.11937/bfyy.20184108 XING J H, HOU Y X, LIN J Z. Optimization of hight regeneration system of Photinia fraseri 'Red Robin'[J]. Northern Horticulture, 2019(14): 73-78. DOI:10.11937/bfyy.20184108 |
| [28] |
李子杰, 曹受金, 周围. 兔眼蓝莓'提夫蓝'组培快繁[J]. 北方园艺, 2022(9): 33-39. DOI:10.11937/bfyy.20214361 LI Z J, CAO S J, ZHOU W. Tissue culture and rapid propagation of Vaccinium ashei 'Tifblue'[J]. Northern Horticulture, 2022(9): 33-39. DOI:10.11937/bfyy.20214361 |
| [29] |
钟连香, 林东, 魏秋兰, 肖玉菲, 刘海龙, 覃子海. 非洲辣木组培快繁再生技术体系的建立[J]. 广西林业科学, 2022, 51(1): 23-28. DOI:10.19692/j.issn.1006-1126.20220104 ZHONG L X, LIN D, WEI Q L, XIAO Y F, LIU H L, QIN Z H. Establishment of regeneration system for tissue culture and rapid propagation of Moringa stenopetala[J]. Guangxi Forestry Science, 2022, 51(1): 23-28. DOI:10.19692/j.issn.1006-1126.20220104 |
| [30] |
SIDDIQUE I, ANIS M. Direct plant regeneration from nodal explants of Balanites aegyptiaca L. (Del.): A valuable medicinal tree[J]. New Forests, 2009, 37(1): 53-62. |
(责任编辑 邹移光)
 2023, Vol. 50
2023, Vol. 50