文章信息
基金项目
- 国家自然科学基金地区基金(32160784)
作者简介
-
许继国,博士,副教授,南昌师范学院生物技术研究院副院长,主要从事家禽分子育种研究,具有扎实的理论知识和丰富的育种实践经验。在研国家自然科学基金1项、江西省良种联合攻关项目1项。发表论文30余篇,其中SCI论文9篇;获授权国家发明专利12件,转化2件;获广东省科技进步一等奖1项,广东省农业技术推广奖一等奖和三等奖各1项。
许继国(1981—),男,博士,副教授,研究方向为家禽育种,E-mail:3425614@qq.com.
通讯作者
- 许桥(1990—),男,博士,副教授,研究方向为家禽育种,E-mail:1285537124@qq.com.
文章历史
- 收稿日期:2023-11-26
2. 南昌师范学院生物技术研究院,江西 南昌 330032;
3. 江西省农业技术推广中心,江西 南昌 330299
2. Department of Biological Technology, Nanchang Normal University, Nanchang 330032, China;
3. Jiangxi Agricultural Technology Extension Center, Nanchang 330299, China
毛色作为动物驯化过程中最直观且变化最丰富的表型性状,是品种特征的重要标志之一。相较于数量性状,毛色作为质量性状,其遗传模式相对简单,表型易于观察和区分,因此毛色一直是基础研究和发育学研究的重要课题。对农业经济动物而言,毛色性状的多样性可用于改良育种,丰富家畜毛皮产品的种类,从而产生可观的经济效益。家畜毛色性状研究对畜牧生产和育种具有重要的现实意义。
动物的被毛颜色表型大致可分为基础毛色、白毛色和稀释毛色3类。基础毛色(如黑色、棕色、红色)主要由黑素皮质素1受体(Melanocortin 1 receptor,MC1R)和刺鼠信号蛋白(Agouti signalling protein,ASIP)决定,它们调控真黑色素和褐黑色素的转换。除酪氨酸酶功能缺陷导致的白化外,白毛色可分为全身通白和白毛片两种类型,主要由v-kit Hardy-Zuckerman 4猫科肉瘤病毒致癌基因同源物(v-kit Hardy Zuckerman 4 feline sarcoma viral oncogene homolog,KIT)和黑素细胞诱导转录因子(Melanocyte inducing transcription factor,MITF)基因决定。稀释毛色是一种常见的动物表型性状,有关哺乳动物(鼠[1]、狗[2-4]、猫[5]、兔[6-8])稀释毛色的遗传学研究已取得一定进展。稀释毛色表型通常是由于黑素小体运输过程受损导致色素不规则聚集。这种不规则的黑素小体聚集导致纤维的光吸收减少,使得毛发呈现灰色。嗜黑素(Melanophilin,MLPH)与肌凝蛋白Va(Myosin Va,MYO5A)和RAS癌基因家族成员27a(Member RAS oncogene family,RAB27A)形成一种蛋白质复合物,将黑素小体运输到黑素细胞的骨架中[9]。这个蛋白质复合物已被证明是黑素小体运输所必需的[10]。MLPH、MYO5A和RAB27A的基因缺陷,均与人类的几种稀释表型和常染色体隐性格里塞利综合征(Griscelli syndromes)有关[11-12]。在格利塞利综合征中,Ⅲ型与MLPH的突变有关,并且是3种类型中唯一一种在没有神经或免疫异常的情况下表现出色素稀释(减退)的类型[12]。目前,仍有大量稀释毛色表型的遗传机理尚未解析。
本文综述了农业经济动物(主要是猪、马、牛、羊、鸡)稀释毛色表型的类型、其形成的因果基因和突变及遗传机理等研究进展,进一步阐述了毛色稀释因果基因产生的不同遗传突变对农业经济动物毛色变异的重要影响,以及农业经济动物类群中毛色稀释基因因果突变与某些重大遗传疾病的关联性,以期为动物稀释毛色遗传机制的深入研究提供参考和借鉴。
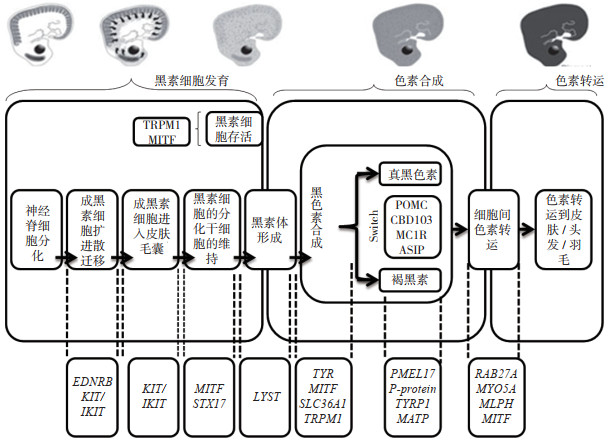
1 动物被毛颜色色素沉积遗传机制在被驯化前,动物祖先的被毛颜色可为逃避潜在的捕食者提供伪装;随着被驯化,动物对不同栖息地和气候条件的适应以及驯养者的不同偏好,导致动物存在大量的毛色表型变化[13]。许多影响色素沉积和被毛颜色相关位点的基因已经被鉴定。深入了解黑素细胞发育、色素合成和细胞内色素转运过程(图 1)的色素沉积遗传机制至关重要[14]。所有动物的色素沉积都是由于毛发和皮肤中黑色素的存在或缺失造成的。色素沉积本质上是由真黑色素和褐黑色素的分布决定,分别产生黑色/ 棕色和黄色/ 红色[15]。导致这两种黑色素合成的代谢途径目前大多已知,这一过程的关键酶是酪氨酸酶,它催化酪氨酸羟基化成二羟基化苯丙氨酸(Dihydroxyphenylalanine,DOPA),然后将该代谢物氧化成多巴醌。此外,真黑色素来源于DOPA色素代谢物,而褐黑色素则由5-s-半胱氨酰多巴代谢物产生[15]。黑色素是在黑素小体中合成和积累的。黑素小体为特殊的细胞器(位于真皮和表皮之间),在其生长过程中通过胞吐过程被转移到毛发中。在胚胎发育过程中,黑素细胞起源于神经嵴,再迁移到皮肤、毛囊、眼睛、内耳及其他器官和组织中,并在相应区域中产生色素沉积。当迁移过程被打断,相关区域缺乏黑素细胞,会导致该区域出现白色斑点,形成某些品种的特征斑点或白色毛色[16]。色素沉积的变化主要是由黑素细胞的不同大小、形状及向不同特定皮肤区域转运所造成的;此外,合成黑色素(即真黑色素或褐黑色素)的数量和类型差异也是色素沉积变化的影响因素[17]。
这些色素沉积基因的突变使色素在细胞发育、色素合成和转运过程中产生差异,影响黑色素的产生或其分布,从而造成丰富的毛色多样性[18]。被毛颜色的稀释可能发生在毛色形成途径的早期,导致真黑色素和褐黑色素的着色被稀释,或者在该途径的分支后只影响一种或另一种色素类型[19]。这种稀释效应的本质是毛囊内色素区域和非色素区域混合的结果。
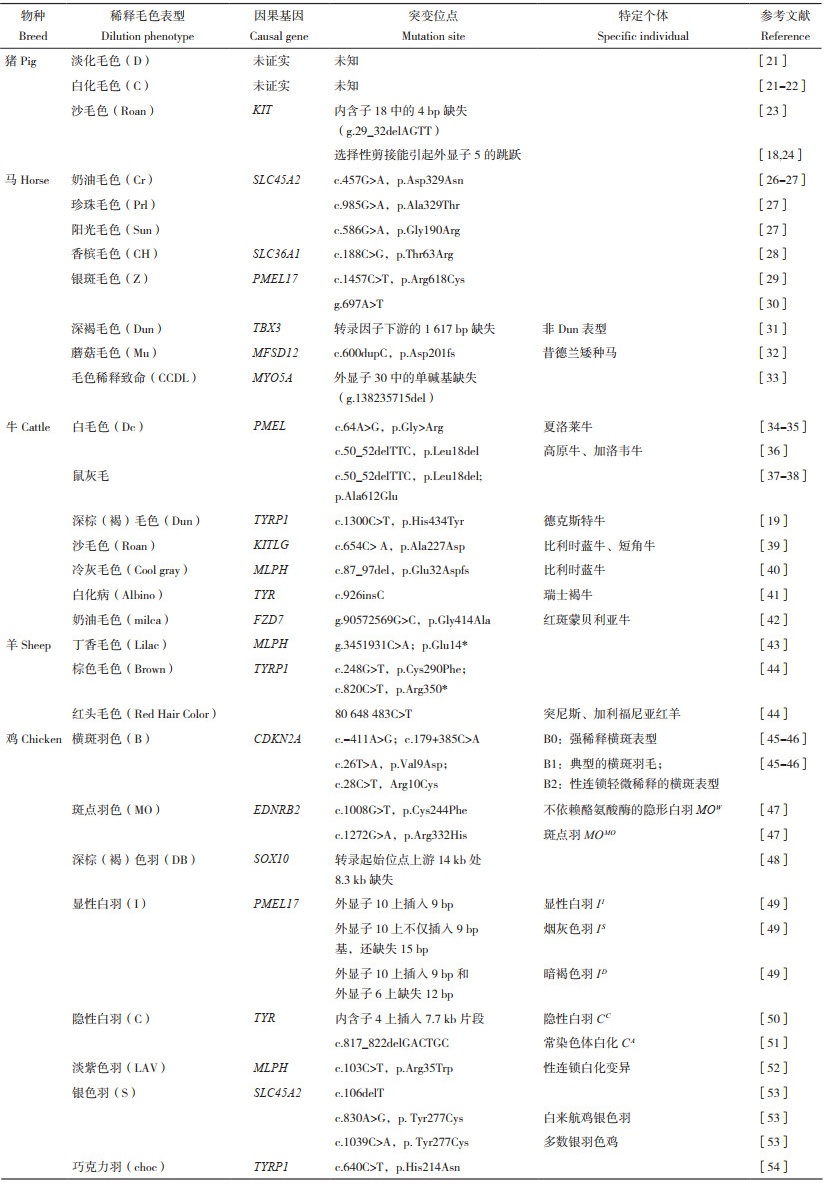
2 猪的稀释毛色表型及其形成的遗传机理在驯化和人工选育过程中,猪产生了不同的被毛颜色表型,这些毛色是不同品种和种群的特征,在鉴定品种纯度和亲缘关系等方面具有一定作用,可作为遗传标记用于辅助育种选择。猪的基础毛色主要有白色、黑色、棕色和花斑色[20],多个基因的变异已被证明影响猪被毛的色素沉积。例如,白毛色是由KIT基因拷贝数变异、剪切变异等引起的;MC1R基因的错义突变、2 bp插入等导致黑毛色;酪氨酸酶相关蛋白1(Tyrosinase related protein 1,TYRP1)基因的6 bp缺失形成了棕色毛;内皮素受体β(Endothelin receptor beta,EDNRB)基因的变异被证明与花斑或条带状毛色表型有关[15]。
猪的稀释毛色表型研究相对较少,主要有淡化毛色(D)、白化毛色(C)和沙毛色(Roan)(表 1)。淡化毛色由D基因座决定,主要控制色素表现的深浅程度,有D、Ds和Dp3个等位基因。D等位基因个体表现为正常毛色表型,Ds等位基因个体毛色表现为深棕色稀释,Dp等位基因个体毛色表现为隐性淡化基因稀释表型。白化毛色由C基因座决定,主要控制色素合成的强度,有Ce和Cch 2个等位基因[21]。研究认为,Cch等位基因控制曼格利察猪的暗白毛色稀释,而隐性的乌贼黑因子基因可能是该稀释位点的成员,Cch等位基因可能将某些巴克夏猪的黄毛色稀释成奶油色[22]。上述两种毛色稀释表型的因果基因均未证实。沙毛色的特征是白色毛与彩色毛混杂一起,主要在长白猪品种杂交时观察到[18]。该毛色稀释表型由IRn(也表示为ID,D表示稀释)等位基因决定,在野生型等位基因(i)中,IRn占显性地位,并导致沙毛色表型[18]。研究发现,在意大利本地灰猪群体中,单拷贝KIT基因内含子18中的4 bp缺失(g.29_32delAGTT)与沙毛色完全相关[23]。这种缺失可能是与因果变异处于连锁不平衡的沙毛色表型的DNA标记[15, 24]。在猪KIT基因中发现一个新的选择性剪接能导致IRn等位基因外显子5的跳跃,该变异只发生在沙毛色猪中,被认为是沙毛色稀释表型的因果突变[18, 24]。此外,伊比利亚红猪皮肤白化病Ⅱ(Oculocutaneous albinism Ⅱ,OCA2)基因的错义突变可以解释该品种被毛颜色强度变异的多态性[25],该基因也是引起粉红色眼睛的稀释主效基因[15]。
|
3 马的稀释毛色表型及其形成的遗传机理 3.1 基础毛色表型的遗传机理
人类通过选择性繁殖培育出各种色素沉着表型的马。基础毛色是马的普遍特征毛色,包括黑色、骝色和栗色[26]。马的基础毛色主要由2个基因(MC1R和ASIP)控制,在缺乏其他修饰因子的情况下,ASIP基因外显子2上11 bp缺失(c.191_201del)引起的隐性(a)等位基因不限制真黑色素合成,使马呈现全黑表型(黑色体和黑色点)[55]。马的骝毛色是由ASIP和MC1R基因共同决定的显性遗传表型。通过MC1R的信号传导进行色素转换,ASIP显性等位基因(A)使真黑色素局限于特定区域(如耳尖、鬃、尾部和腿下半部)合成;当与MCIR显性等位基因(E)结合时,在体内产生褐黑色素,从而导致骝色表型(红色体黑色点)。而MC1R功能等位基因(e)缺失(c.248C > T,p.Ser83Phe)的纯合马只能产生褐黑色素,从而呈现栗色表型(红色体和红色点),这与ASIP基因型无关;另一种与基础栗毛色有关的MC1R功能缺失被命名为ea(p.Asp84Asn)[55]。目前,这种等位基因只在黑森林马、匈牙利冷血马和哈福林格马品种中被检测到[55]。
3.2 稀释毛色表型的遗传机理随着马业的发展,各种稀释毛色表型的马(黑色素数量和类型的变化)被饲养者所选择。马的稀释毛色包括奶油色(Cream,Cr)、珍珠色(Pearl,Prl)、阳光色(Sunshine,Sun)、香槟色(Champagne,CH)、银斑色(Silver,Z)、深褐色(Dun,D)和蘑菇色(Mushroom,Mu)等[26-27, 32]。这7个等位基因通过稀释真黑色素、褐黑色素或两者兼有,进而影响马的稀释毛色表型。其中,Cr(c.457G > A,p.Asp329Asn),Prl(c.985G > A,p.Ala329Thr)和Sun(c.586G > A,p.Gly190Arg)3个等位基因均由溶质载体45家族A2(Solute carrier 45 family A2,SLC45A2)变异引起。这些变异被认为破坏了蛋白质功能及随后黑素体上的分子运输,导致色素产生减少,从而造成马毛色稀释[32]。
奶油色由Cr基因座决定,遗传模式为不完全显性,在杂合状态下影响褐黑色素的合成,使毛色由褐红色变为黄色,常见于在帕洛米诺马(浅栗色被毛伴有淡黄色或奶油色的长毛)[26];而在纯合状态下,它极端稀释真黑色素和褐黑色素,从而使马的皮肤呈粉红色,毛发灰白,眼睛呈蓝色,被称为双稀释毛色[27]。Cr等位基因纯合子的黑毛色马稀释现象不明显,被称为烟熏奶油毛色[27]。
珍珠色由Prl基因座决定,与奶油毛色位点不同,珍珠毛色是一种隐性稀释遗传,只影响纯合子马的眼睛、毛发和皮肤中真黑色素和褐黑色素的合成。杂合子珍珠毛色马有正常的眼睛和毛色,但皮肤可能有轻微的稀释和斑纹[27]。纯合子珍珠毛色与显性香槟毛色稀释非常相似,褐黑色素被稀释成金色,真黑色素被稀释成浅棕色或棕褐色[27]。同时带有单个Cr和Prl等位基因的马在表型上与纯合子的奶油毛色马相似,被称为假双重稀释[27]。
阳光色由等位基因Sun基因座决定,与珍珠毛色一样,同为隐性遗传模式,并稀释真黑色素和褐黑色素的合成[32]。阳光毛色表型是在一个标准马种与田纳西走马杂交中被鉴定出来,而这两个品种之前都没有不明原因的稀释报告[27]。
香槟色由CH基因座决定,遗传模式为完全显性,即不论是纯合或杂合个体,都能同时影响真黑色素和褐黑色素的合成。因此,纯合子马与杂合子马在表型上难以区分,细微差异在于纯合子马毛色比杂合子少一些斑纹,或者稍微浅色一些。研究表明,马的香槟色稀释表型是由溶质载体36A家族成员1(Solute carrier 36 family A1,SLC36A1)外显子2中的1个单核苷酸位点突变(c.188C > G,p.Thr63Arg)引起的,该错义突变通过改变pH值从而影响早期黑素小体的发育,进而调节黑素小体发育的途径[28]。
银斑色由Z基因座决定,其遗传方式为显性遗传,且仅影响真黑色素的合成。这导致黑毛色和骝毛色马的鬃毛和尾巴带有淡黄色的毛色稀释,而栗毛色马的被毛不受影响。研究证明,银斑毛色稀释表型是由前黑素体蛋白(Premelanosome protein,PMEL17,或称为PMEL、SILV)11外显子的错义突变(c.1457C > T)引起,该突变将细胞质区域的第2个氨基酸从精氨酸变为半胱氨酸(p.Arg618Cys),从而影响成熟黑素体中真黑素的正常沉积,造成稀释表型。这种突变在多个马品种中与银色表型完全相关,而在非银色马中没有发现,唯一的例外是1个栗毛色的个体与不同的非银色种马交配后产生了几个银色后代,这些后代也携带了该突变[29]。此外,PMEL17内含子9上的1个单碱基突变(g.697A > T)也与非栗毛色马的银斑毛色表型完全相关[30]。该突变单倍型仅在冰岛马和昔德兰矮种马中发现,等位基因频率分别为10.7% 和23.0%,推测该突变可能是引起PME17 mRNA前体的选择性剪接产生另一种转录脚本造成的银斑毛色稀释表型[30]。值得注意的是,银斑毛色稀释表型(Z等位基因)也与多效性疾病、多发性先天性眼异常(Multiple congenital ocular anomalies,MCOA)有关。MCOA是一种遗传性眼部异常,杂合子马通常表现为颞虹膜、睫状体或视网膜囊肿;纯合子马表现出包括角膜球形、葡萄膜囊肿、虹膜间质发育不全、持续瞳孔缩小和白内障等更为严重的眼部异常[56]。
深褐色由D基因座所决定,其遗传模式为完全显性,是一种已知既影响褐黑色素也影响真黑色素合成的被毛颜色稀释表型,其特征是伴有原始斑纹的毛色稀释(背部黑色条纹、腿部条纹、肩部条纹和前额的黑色斑纹,称为蛛网纹),被认为是一种野生型毛色表型(祖先表型),与CH基因座类似,在表型上难以区分纯合子与杂合子。研究发现,该稀释表型是由于T-box 3(TBX3)转录因子在马背中线毛囊中的局部高表达,而TBX3转录因子又决定了毛囊黑素细胞的分布,从而导致毛囊中色素颗粒的不对称沉积,造成背中线毛色深于身体两侧引起深褐毛色表型[31]。TBX3转录因子下游1 617 bp的缺失损伤了TBX3在毛囊中的表达,从而改变了背中线毛囊的色素沉积[31]。
蘑菇色由Mu基因座所决定,其遗传模式为隐性,是昔德兰矮种马中一种独特的毛色表型,其特征是栗毛色被稀释为棕褐色。与银斑毛色不同的是,蘑菇毛色稀释只影响褐黑色素的合成。研究发现,主要促进因子超家族结构域包含12(Major facilitator superfamily domain containing 12,MFSD12)中的移码突变(c.600dupC,p.Asp201fs)翻译时截断了277个氨基酸,破坏该蛋白的功能,从而减少褐黑色素的合成,产生了棕褐色稀释,最终导致昔德兰矮种马的蘑菇毛色表型[32]。目前尚不清楚蘑菇毛色稀释是否会引起类似银斑毛色的眼部异常。
3.3 稀释毛色疾病的遗传机理薰衣草马驹综合征(Lavender foal syndrome,LFS)又称毛色稀释致命(Coat color dilution lethal,CCDL),是除了上述几种常见的稀释毛色外的一种特殊毛色稀释类型,是马的一种致死性遗传病,疑似常染色体隐性遗传。该病症特征是多发的神经系统异常和毛色稀释。受该疾病影响的马驹可表现出一系列神经症状,包括强直性癫痫、角弓反张、躯干僵直和眼球震颤。有时可观察到轻度白细胞减少。这些神经损伤使马驹无法正常站立和哺乳,通常会被安乐死。此外,受影响的马驹还具有典型的稀释“薰衣草”毛色,表现为浅灰色、青灰色、浅栗色和薰衣草色。研究发现,肌球蛋白VA(Myosin VA,MYO5A)外显子30中的单碱基缺失(g.138235715del)是该疾病的因果突变[33]。所有患有此疾病的马均为该突变的纯合子,而在该性状分离的家系中,杂合子频率较高。在无亲缘关系的埃及阿拉伯马中,该突变的频率为10.3%。这种突变改变了阅读框,并提前终止密码子,导致该蛋白C端缺失379个氨基酸。这种缺失损害了球状尾部分泌囊泡特异结合域,破坏了肌球蛋白Va与具有相应受体转运细胞器的结合,从而导致囊泡运输功能丧失,干扰了黑素细胞和神经元的正常功能[33]。LFS主要在埃及阿拉伯马中被诊断出来,目前尚无治疗该疾病的方法。
4 牛的稀释毛色表型及其形成的遗传机理 4.1 基础毛色表型的遗传机理毛色和图案一直是许多牛品种的标志性特征。毛色作为牛最直观的体貌特征之一,常用于识别和描述牛品种特征,并判断其品种纯度。牛的毛色大致可分为两类:一类是有图案的(如黑白花、斑点、条纹等),例如带有黑白花图案的荷斯坦牛、黄白花图案的西门塔尔牛、躯干上带有1条白色背带的苏格兰加洛韦牛;另一类是无图案的(或深或浅的纯色),通常分为黑色、红色、黄色、白色、灰色和褐色,例如黑色的安格斯牛、红色的中国草原红牛、黄色的入鲁西黄牛等。牛的毛色遗传由几个不同基因座决定,例如:E基因座(Extension)、A基因座(Agouti)、B基因座(Brown,也称为dun)[19]、D基因座(Dilution),R基因座(Roan)和白化病(Albino)[34, 57]。黑色和红色是牛的基础毛色,主要受E和A基因座的控制。E基因座,即MC1R基因,包含3个等位基因ED(显性黑)、E+(野生型)、Ee(隐性红)。ED等位基因在编码区存在1个碱基突变(c.296T > C),使α促黑素细胞激素(α-MSH)与MC1R专一结合,只合成真黑色素,主要表现出黑毛色表型(如黑色安格斯牛)。E+等位基因,使MC1R可以结合α-MSH或者Agouti信号蛋白,在不同时期或不同部位产生真黑色素或褐黑色素,造成特殊的毛色表型(如条纹毛色牛)。Ee等位基因,在编码区310处缺失1个碱基G引起移码突变,使MC1R只与Agouti信号蛋白结合,从而只合成褐黑色素,表现出或强或弱红毛色表型(如挪威红牛)[35, 57]。A基因座编码ASIP基因,在小鼠中发现其能调节黑色和黄褐色颗粒产生,从而产生Agouti毛色小鼠[58]。然而,与小鼠相比,牛的ASIP基因在颜色变化中的作用似乎有限,因为在其编码序列中未发现等位基因突变[35]。Girardot等[59]在4头有斑纹的诺曼底牛ASIP基因的5'UTR中发现了一个LINE插入拷贝。研究表明,该插入突变是沼泽水牛白毛色表型的因果突变[60]。这是迄今为止在牛AISP上发现的一种潜在的功能突变。
4.2 稀释毛色表型的遗传机理在一些牛的品种中,如夏洛莱、高原、西门塔尔和德克斯特,观察到由E基因座所决定的底毛色变浅或稀释的现象。这种稀释现象产生了各种各样的颜色(白色、奶油色、深褐色、金色、黄色、淡红色、灰色或棕色)[35]。
夏洛莱品种表现出最极端的稀释情况,因为纯种夏洛莱具有均匀的白色被毛,尽管大多数夏洛莱个体具有e/e扩展基因型。因此,这一品种特有的被毛颜色是由整个身体的褐黑色素稀释造成的。夏洛莱被认为是纯合的稀释突变(稀释夏洛莱牛,Dc/Dc),在杂合子中(Dc/ dc+)产生中间表型:如果稀释适用于真黑色素(例如在黑色安格斯×夏洛莱杂交中),则呈灰色;如果背景色素是褐黑色素,则呈淡红色或黄色[61]。在毛色稀释遗传效应的研究中发现,PMEL基因(D基因座)与夏洛莱毛色稀释现象有关[34-35]。PMEL基因外显子1上存在1个单核苷酸变异(c.64A > G),导致甘氨酸被精氨酸取代(p.Gly > Arg),是其产生白毛色表型的因果突变[34-35]。在表现出毛色稀释表型的高原牛中,观察到PMEL基因外显子1上的3 bp对缺失导致信号肽中亮氨酸的缺失(c.50_52delTTC,p.Leu18del),这种突变等位基因以半显性的方式遗传,并且与MC1R的非上位性相互作用,使得高原牛表现出黑色、深灰(褐)色(dun)、银灰(褐)色(silver dun)、红色、黄色和白色6种毛色表型[36]。在Dun加洛韦牛中,发现带有1个缺失的等位基因(c.50_52delTTC),而silver dun加洛韦牛带有2个缺失的等位基因,这两种牛都表现出与高原牛类似的基于PMEL:c.50_52delTTC等位基因数量的剂量依赖性稀释效应。而在该两品种牛中均未发现带有PMEL:c.64G > A等位基因[36]。这些突变表明,PMEL基因对真黑色素和褐黑色素都具有稀释作用。研究表明PMEL p.Leu18del是导致日本熊本亚种棕色牛个体毛色稀释的因果突变,具有del/del型多态性的个体毛色被稀释,而杂合子毛色在不同稀释率下处于中间水平[62]。此外,一些被稀释的黑牛毛发稀疏,缺乏正常的尾毛发育,被称为“鼠尾”。“鼠尾”是牛的一种遗传性毛少症,只在稀释后的有色毛中表现出来。研究表明,PMEL位点是导致“鼠尾”表型3个位点复杂相互作用的一个组成部分[63-64],推测可能由2个PMEL突变的组合引起,即外显子1上3 bp缺失(c.50_52delTTC,p.Leu18del)和氨基酸612处的另一个错译突变(p.Ala612Glu)[37-38]。
在德克斯特牛中,发现存在棕色或深褐毛色稀释表型,这些牛传统上被称为dun,其毛色从金色到深褐色或深棕色不等。研究表明,这种毛色稀释表型与B基因座有关,即TYRP1基因[19]。该蛋白出现在黑色素合成途径中,位于真黑色素与褐黑色素合成的分支点之后[65],因此,推测它只影响与真黑色素相关的毛色。在德克斯特牛中,发现TYPR1外显子7中存在1个C → T的突变(c.1300C > T),该突变导致氨基酸残基434处从组氨酸变为酪氨酸(p.His434Tyr)。无论毛色是淡金色还是深棕色或深褐色的25头dun德克斯特牛都是带有该突变的纯合子,而且这种等位基因纯合子至少带有1个ED等位基因,这表明德克斯特牛dun毛色表型是由真黑色素稀释引起的[19]。dun也用于描述高原和加洛韦牛的不同毛色,但这些牛的dun毛色稀释不是由TYRP1突变引起的。对19个其他品种121头牛进行研究,均未发现该突变体,这似乎是德克斯特牛独有的[19]。因此,推测导致牛毛色稀释的基因可能因品种而异。
在牛中,沙毛色(Roan,R基因座)是有色被毛与无色被毛混杂的一种毛色表型,经常出现在短角牛和比利时蓝牛品种中,短角牛有红色沙毛,比利时蓝牛有蓝色沙毛,这些品种似乎具有相同的遗传突变,导致沙毛色表型[18, 57]。在共显性遗传下,两个品种存在几种毛色表型:当r等位基因处于纯合状态时,比利时蓝牛表现为黑斑点毛色和短角牛表现为纯红色;当R等位基因处于纯合状态时,两品种均表现为白色;当等位基因为杂合子(Rr)时,两品种均表现出沙毛色,即蓝色、白色混杂的被毛颜色[66]。研究发现,KIT ligand(KITLG)基因外显子7中的1个错义突变(c.654C > A)导致丙氨酸被天冬酰胺取代(p.Ala227Asp),为比利时蓝牛和短角牛沙毛色的因果突变[39]。此外,在比利时蓝牛中,发现了一种新的毛色稀释表型,被命名为“冷灰(Cool gray)”。该毛色稀释表型是由MLPH基因突变引起。该突变为MLPH编码区第1外显子上缺失10个碱基(c.87_97del),过早引入终止密码子(p.Glu32Aspfs),从而截断了94% 的氨基酸[40]。
许多品种的牛都患有白化病,包括短角牛、瑞士褐牛、荷斯坦牛等[57]。酪氨酸酶(TYR)的突变可以阻止黑色素合成,是导致牛的毛色稀释并完全白化的主要基因[41]。在白化病的瑞士褐牛TYR编码序列926处存在1个胞嘧啶(C)的插入(c.926insC),引起了移码突变,导致残基316处过早终止密码子,而正常序列包含517个氨基酸。白化病牛是这种突变的纯合子,这些牛对阳光敏感,有视觉和听觉缺陷。但在瑞士褐牛中发现的突变在白化荷斯坦牛中没有发现[41]。
此外,在红斑蒙贝利亚牛(Montbéliard)品种中发现一种常染色体隐性毛色表型,其特征是被毛的红色区域被稀释成奶油色,被命名为“milca”[42]。经对奶油毛色表型牛的全基因组重测序数据分析,在frizzled7(FZD7)基因编码区发现1个强候选变异(g.90572569G > C),该突变导致414处甘氨酸被丙氨酸取代(p.Gly414Ala)[42]。该突变等位基因的纯合子奶牛被毛均表现出奶油色表型,而所有杂合子奶牛均无毛色缺陷[42]。在牛中,FZD7的突变仅引起红色区域奶油毛色稀释表型,而没有任何其他强烈的不利影响。
5 羊的稀释毛色表型及其形成的遗传机理一直以来,绵羊毛色的选择为白色,因为白色羊毛能够染色。尽管白色羊毛仍然是商业羊毛市场的主导产品,但不断增长的手工纺纱市场更偏爱各种深浅和颜色的非白色羊毛,在小众市场,尤其是美国东北部,非白色羊毛的价格比白色羊毛高得多。这些非白色被毛颜色变化之一是稀释,通常表现为浅色色素沉着[43]。绵羊具有丰富的毛色,大致可以分为白色、黑色、棕(褐)色及稀释毛色[67]。
在雅各布羊品种中观察到一种被毛颜色稀释的现象,称为丁香色(Lilac)。这种稀释导致绵羊在正常情况下呈现黑色的地方变为灰色,家谱分析显示为常染色体隐性遗传。研究发现,在MLPH外显子1上存在1个非同义突变(g.3451931C > A),这与报道的丁香色稀释的常染色体隐性遗传性质相匹配。该突变导致过早引入终止密码子[43]。对其他丁香雅各布羊和已知携带者进行验证测试,显示突变和稀释之间完全一致。该突变可能是雅各布羊毛色稀释的因果突变[43-44]。
羊的棕毛色被识别与TYRP1基因有关,该基因编码区的2个非同义突变(c.248G > T,p.Cys290Phe和c.820C > T,p.Arg350*)可能是绵羊棕毛色的因果突变[44]。有色细毛羊和芬兰羊只携带与棕色相关的c.248G > T SNP,设得兰和冰岛品种羊只携带与棕色相关的c.820C > T SNP,而洛兰考羊和罗姆尼羊携带上述2种与棕色有关的SNP[44]。尽管在过去一个世纪里对绵羊的毛色进行了经典的遗传学研究,但这两个突变是目前绵羊TYRP1中唯一与棕色相关的变异。此外,在TYRP1内含子中发现了1个SNP(80 648 483C > T),该SNP在突尼斯和加利福尼亚红羊中固定,推测可能是绵羊红头毛色的因果突变[44]。
6 鸡的稀释羽色表型及其形成的遗传机理羽色是在鸡驯化过程中经自然和人工选择的可遗传表型,也是鸡的重要品种特征之一,其分子遗传解析为探究家鸡起源及演化、资源保护和产品质量控制等方面奠定基础。家鸡具有丰富的羽色表型多样性,目前已鉴定出12个家鸡羽色因果基因,包括扩展(E)、横斑(B)、深棕(褐)色(DB)、斑点(MO)和稀释(I、LAV、C、S和choc)基因座等(表 1)。
6.1 基础羽色表型的遗传机理鸡羽色性状的连锁分析揭示,黑羽与麻羽性状受MC1R编码的E基因座控制[68]。E基因座主要通过调控真黑色素和褐黑色素的相对分泌量,即影响黑色和红(或黄)色的分布比重。此基因座具有多个等位基因及其对应的羽色表型,包括E(扩展黑色)、ER(桦木色)、ewh(小麦色)、e+(野生毛色)、eb(棕色)、es(斑点色)、ebc(毛茛色)和ey(隐性小麦色),使羽毛表现出从全黑到暗黄等不同羽色。其显隐性关系为E > ER > ewh > e+ > eb > es > ebc > ey。与野生型等位基因e+相比,E等位基因含有3个错译突变位点,分别为c.274G > A(p.Glu92Lys)、c.212T > C(p.Met71Thr)和c637.T > C(p.Cys213Arg)突变,ER等位基因含有p.Glu92Lys突变或c.398T > A(p.Leu133Gln)突变,带有E和ER的个体羽色呈现全身黑色;eb等位基因存在p.Met71Thr、p.Glu92Lys、p.Cys213Arg和c.644A > C(p.His215Pro)突变,带有eb的公鸡羽色与野生型一致,只是羽毛底色略有差异,母鸡的脑部羽色有褐(棕)色的麻点;ewh和ey等位基因存在c.427A > G(p.Thr143Ala)错译突变,带有ewh和ey的公鸡羽色与野生型一样,母鸡羽色呈浅棕色[69-70]。
6.2 稀释羽色表型的遗传机理6.2.1 斑点稀释羽色表型的遗传机理 鸡的横斑羽具有性连锁横斑羽与常染色体横斑羽两种遗传模式。性连锁横斑羽表型由单基因B控制,个体表现为黑白相间的横向条纹。常染色体横斑羽表型由褐色羽基因(Dark brown,DB)、扩展基因E和铅笔线基因(Pencilling,PG)共同调控,个体表现为不规则且交替出现的深色和浅色横斑条纹。研究发现,B基因座编码细胞周期蛋白依赖性激酶抑制剂2A基因(Cyclin dependent kinase inhibitor 2A,CDKN2A),该基因存在的2个非编码突变(c.-411A > G和c.179+385C > A)和2个编码突变(c.26T > A,p.Val9Asp和c.28C > T,Arg10Cys)与横斑羽表型完全相关[45]。2个非编码突变会引起CDKN2A表达量上调,造成黑素细胞提前分化,导致毛囊内中缺乏黑素细胞,从而产生横斑羽基础表型(B0),为强稀释横斑表型。同时两编码突变在此基础上分别独立地削弱CDKN2A上调的作用,影响黑色素沉积程度,形成两种更显眼的横斑羽表型B1(典型的横斑羽毛)和B2(性连锁轻微稀释的横斑表型)[46]。
鸡羽色性状的斑点羽表型特征为羽毛顶部表现出白色,此表型为常染色体隐性遗传,由MO基因座控制,其等位基因为MON(野生型)、MOW(不依赖酪氨酸酶的隐形白羽)和MOMO(斑点羽)[47]。研究表明,内皮素受体B亚型2(Endothelin receptor B subtype 2,EDNRB2)基因编码MO基因座,是决定斑点羽色的因果基因,其外显子5上1 008处的错义突变(c.1008G > T)导致半胱氨酸变成了苯丙氨酸(p. Cys244Phe),是MOW等位基因的因果突变,而另一个外显子7上1 272处的非同义替换(c.1272G > A,p.Arg332His)是MOMO等位基因的因果突变[47]。
6.2.2 淡化稀释羽色表型的遗传机理 鸡羽色性状中的深棕(褐)色羽由DB基因座控制,该基因座抑制真黑色素合成,促进羽毛部分褐黑色素合成。研究表明,DB基因座由SRY-box转录因子10(SRY-box transcription factor 10,SOX10)编码[48]。SOX10基因转录起始位点上游14 kb处8.3 kb的缺失是造成深棕(褐)色羽的因果突变,此缺失片段含有增强子等调控元件,导致SOX10表达量下降,进而下调酪氨酸酶等色素合成关键酶(如酪氨酸酶)的表达,从而促进褐黑色素合成,最终导致羽毛表现为深棕(褐)色[48]。
鸡的白羽性状主要有显性白羽和隐性白羽两种羽色表型。显性白羽基因位于I基因座上(由PMEL17基因编码),该基因座分别有II(显性白羽)、ID(暗褐色羽)、IS(烟灰色羽) 和i(野生型)4种等位基因[49]。研究发现,显性白羽表型由PMEL17的突变造成,该基因外显子10上插入9 bp,导致此基因跨膜域上增加3个氨基酸,进而表现为显性白羽;烟灰色羽表型也由PMEL17的突变造成,该基因外显子10上除了9 bp插入外还存在15 bp缺失,导致跨膜域减少了5个氨基酸;暗褐色羽表型的成因是PMEL17基因在外显子10上插入9 bp以及在外显子6上缺失12 bp[49]。隐性白羽基因位于C基因座上(由TYR基因编码),该基因座具有CC(隐性白羽)、CRE(红眼白羽)、CA(常染色体白化)和CN(野生型)4个等位基因。除CN外,其他3种等位基因均导致个体羽色呈现白色。研究表明,隐性白羽表型是由于TYR基因内含子4上插入了7.7 kb片段,抑制了TYR基因表达,影响真黑色素合成所致[50]。而常染色体白化表型是由TYR基因817处缺失6 bp(c.817_822delGACTGC),导致丢失了色氨酸和天冬氨酸,进而影响了酪氨酸酶的生物活性所造成的[51]。
鸡羽色性状中的淡紫色羽属于常染色体隐性突变,它会使真黑色素和褐黑色素分别被稀释成浅灰色或淡黄色。LAV基因座调控淡紫色羽表型,该基因座有2种等位基因,即LAVN(野生型)和LAVL(淡紫色)。Vaez等[52]研究表明,MLPH基因外显子1上103处的非同义突变(c.103C > T)与淡紫色羽表型强相关,该突变导致色氨酸取代了精氨酸(p.Arg35Trp),造成MLPH转录本水平降低,从而影响黑色素的转运沉积,导致鸡羽毛色素稀释呈现淡紫色。
鸡羽色性状中的银色羽和金色羽由Z染色体上的S基因座控制,属于性连锁遗传,可用于雌雄鉴别。S基因座有S(银色)、s(金色)和Sal(不完全白化),其显隐性关系为S > s > Sal。Gunnarsson等[53]研究表明,SLC45A2基因编码S基因座,该基因第1外显子上1 bp的缺失(c.106delT)导致移码突变和转录提前终止,抑制了真黑色素和褐黑色素的合成,从而使个体呈现性连锁白化变异。而该基因的2个错义突变(c.830A > G,p. Tyr277Cys和c.1039C > A,p. Tyr277Cys)可抑制褐黑色素的合成,与银色羽表型有关,其中c.1039C > A突变控制大多数品种鸡银羽的形成,而白来航鸡银羽与c.830A > G突变有关[53]。
在鸡羽色性状中,巧克力羽色表型受choc基因座控制。该表型的产生源于因果基因TYRP1外显子3上的1个错义突变(c.640C > T,p.His214Asn)。此突变影响了TYRP1蛋白的功能,导致黑素小体出现异常结构,进而稀释了真黑色素[54]。
7 结语与展望动物的毛色(羽色)性状展现出丰富的多样性,随着研究不断深入,多个稀释毛色(羽色)表型的因果基因或突变已在不同动物中被陆续定位。然而,毛色(羽色)稀释的遗传机制是一个极其复杂的过程。在不同动物中,相同的毛色(羽色)稀释表型可能受到截然不同的基因调控。例如,dun稀释毛色表型,在马中的因果基因是TBX3,而在德克斯特牛中则由TYPR1的c.1300C > T突变引起。相同的基因可能受到基因间互作效应的影响,在不同动物中表现出完全不同的毛色(羽色)稀释表型。例如PMEL基因外显子1上的c.64A > G单核苷酸变异是夏洛莱牛白毛色稀释表型的因果突变,而其外显子11的错义突变(c.1457C > T)是马银斑毛色稀释表型的突变。这极大增加了毛色(羽色)稀释表型的研究难度。
随着科学技术的飞速发展,越来越多的新技术可用于挖掘动物毛色(羽色)稀释表型的相关新基因及突变位点,越来越多的稀释毛色表型遗传机理有望得以阐明。全基因组测序技术的发展和普及表明,基于SNP、插入/ 缺失、拷贝数变异和基因组结构性变异的比较基因组学或群体基因组学研究仍然是动物稀释毛色表型研究的重要发展方向。在此基础上,辅助转录组、蛋白组测序技术的联合解析已逐步成为研究农业经济动物复杂性状的现实手段。例如,Li等[71]对不同羽色(黄色、亚哥伦布色和银色)鸡颈部和翅膀羽毛毛囊组织进行转录组分析,发现SLC45A2和GPNMB可以促进鸡羽中黑色素沉积。此外,基因编辑(如CRISPR/Cas9)技术已日趋完善和成熟,有望通过CRISPR/Cas9编辑系统从细胞水平或个体水平对动物毛色稀释表型候选基因进行研究,而不再局限于分析相关基因在其组织中的相对表达量差异。例如,Laible等[72]利用CRISPR/Cas9编辑系统在荷斯坦牛PMEL基因中敲除3 bp(p.Leu18del PMEL),纯合编辑细胞产生的小牛显示出强烈的颜色稀释效应,表现出一种新的灰色和白色的毛色表型。但无论研究何种动物的稀释毛色(羽色)表型,基本前提是对被毛(羽毛)颜色或模式的精确区分。
通过深入解析动物稀释毛色表型的遗传机制,我们可以更好地理解这一表型的发生和演化过程。对于野外动物,稀释毛色表型可以为动物提供保护色,使其更好地融入周围环境,提高生存能力。对于家养动物,稀释毛色表型可以用于畜禽改良育种,丰富产品类型(如羊毛),增加产品的市场竞争力。但家养动物稀释毛色表型,往往伴随着某些生理缺陷或疾病的产生,而人类也发现了由毛色稀释基因突变引发的类似疾病。因此,动物毛色稀释表型遗传机制的揭示也可为人类某些遗传疾病的发病机理和治疗提供新思路。
| [1] |
ZHANG H, WU Z P, YANG L J, ZHANG Z, CHEN H, REN J. Novel mutations in the Myo5a gene cause a dilute coat color phenotype in mice[J]. The FASEB Journal, 2021, 35(4): e21261. DOI:10.1096/fj.201903141RR |
| [2] |
VAN BUREN S L, MINOR K M, GRAHN R A, MICKELSON J R, GRAHN J C, MALVICK J, COLANGELO J R, MUELLER E, KUEHNLEIN P, KEHL A. A third MLPH variant causing coat color dilution in dogs[J]. Genes (Basel), 2020, 11(6): 639. DOI:10.3390/genes11060639 |
| [3] |
CHRISTEN M, DE LE R M, JAGANNATHAN V, BECKER K, LEEB T. MYO5A frameshift variant in a miniature dachshund with coat color dilution and neurological defects resembling human griscelli syndrome type 1[J]. Genes (Basel), 2021, 12(10): 1479. DOI:10.3390/genes12101479 |
| [4] |
HEDAN B, CADIEU E, BOTHEREL N, DUFAURE D C C, LETKO A, RIMBAULT M, DROGEMULLER C, JAGANNATHAN V, DERRIEN T, SCHMUTZ S, LEEB T, ANDRE C. Identification of a missense variant in MFSD12 involved in dilution of phaeomelanin leading to white or cream coat color in dogs[J]. Genes (Basel), 2019, 10(5): 386. DOI:10.3390/genes10050386 |
| [5] |
ISHIDA Y, DAVID V A, EIZIRIK E, SCHAFFER A A, NEELAM B A, ROELKE M E, HANNAH S S, O'BRIEN S T, RAYMOND M M. A homozygous single-base deletion in MLPH causes the dilute coat color phenotype in the domestic cat[J]. Genomics, 2006, 88(6): 698-705. DOI:10.1016/j.ygeno.2006.06.006 |
| [6] |
DEMARS J, IANNUCCELLI N, UTZERI V J, AUVINET G, RIQUET J, FONTANESI L, ALLAIN D. New insights into the melanophilin (MLPH) gene affecting coat color dilution in rabbits[J]. Genes (Basel), 2018, 9(9): 430. DOI:10.3390/genes9090430 |
| [7] |
JIA X, DING P, CHEN S, ZHAO S, WANG J, LAI S. Analysis of MC1R, MITF, TYR, TYRP1, and MLPH genes polymorphism in four rabbit breeds with different coat colors[J]. Animals (Basel), 2021, 11(1): 81. DOI:10.3390/ani11010081 |
| [8] |
CHEN Y, HU S, LIU M, ZHAO B, YANG N, LI J, CHEN Q, ZHOU J, BAO G, WU X. Analysis of genome DNA methylation at inherited coat color dilutions of rex rabbits[J]. Frontiers in Genetics, 2020, 11: 603528. DOI:10.3389/fgene.2020.603528 |
| [9] |
NASCIMENTO A A, ROLAND J T, GELFAND V I. Pigment cells: A model for the study of organelle transport[J]. Annual Review of Cell and Developmental Biology, 2003, 19(1): 469-491. DOI:10.1146/annurev.cellbio.19.111401.092937 |
| [10] |
FUKUDA M, KURODA T S, MIKOSHIBA K. Slac2-a/melanophilin, the missing link between Rab27 and myosin Va: Implications of a tripartite protein complex for melanosome transport[J]. Journalof Biological Chemistry, 2002, 277(14): 12432-12436. DOI:10.1074/jbc.C200005200 |
| [11] |
HUME A N, USHAKOV D S, TARAFDER A K, FERENCZI M A, SEABRA M C. Rab27a and MyoVa are the primary Mlph interactors regulating melanosome transport in melanocytes[J]. Journal of Cell Science, 2007, 120(17): 3111-3122. DOI:10.1242/jcs.010207 |
| [12] |
VAN G M, DYNOODT P, LAMBERT J. Griscelli syndrome: A model system to study vesicular trafficking[J]. Pigment Cell & Melanoma Research, 2009, 22(3): 268-282. DOI:10.1111/j.1755-148X.2009.00558.x |
| [13] |
HUBBARD J K, UY J A, HAUBER M E, HOEKSTRA H E, SAFRAN R J. Vertebrate pigmentation: From underlying genes to adaptive function[J]. Trends in Genetics, 2010, 26(5): 231-239. DOI:10.1016/j.tig.2010.02.002 |
| [14] |
CIESLAK M, REISSMANN M, HOFREITER M, LUDWIG A. Colours of domestication[J]. Biological Reviews of the Cambridge Philosophical Society, 2011, 86(4): 885-899. DOI:10.1111/j.1469-185X.2011.00177.x |
| [15] |
FONTANESI L, RUSSO V. Molecular genetics of coat colour in pigs[J]. Acta Argiculturae Slovenica, 2013, 4: 16. |
| [16] |
VIDEIRA I F, MOURA D F, MAGINA S. Mechanisms regulating melanogenesis[J]. Anais Brasileiros de Dermatologia, 2013, 88(1): 76-83. DOI:10.1590/s0365-05962013000100009 |
| [17] |
HIROBE T. How are proliferation and differentiation of melanocytes regulated?[J]. Pigment Cell & Melanoma Research, 2011, 24(3): 462-478. DOI:10.1111/j.1755-148X.2011.00845.x |
| [18] |
VOSS K, BLAJ I, TETENS J L, THALLER G, BECKER D. Roan coat color in livestock[J]. Animal Genetics, 2022, 53(5): 549-556. DOI:10.1111/age.13240 |
| [19] |
BERRYERE T G, SCHMUTZ S M, SCHIMPF R J, COWAN C M, POTTER J. TYRP1 is associated with dun coat colour in Dexter cattle or how now brown cow?[J]. Animal Genetics, 2003, 34(3): 169-175. DOI:10.1046/j.1365-2052.2003.00985.x |
| [20] |
徐宁迎. 猪毛色遗传的研究进展[J]. 养猪, 1999(3): 33-34. XU Y N. Research progress of pig coat color inheritance[J]. Swine Production, 1999(3): 33-34. |
| [21] |
张建, 陈伟, 王慧, 曾勇庆. 猪毛色遗传机制的研究进展[J]. 猪业科学, 2013, 30(1): 100-103. DOI:10.3969/j.issn.1673-5358.2013.01.026 ZHANG W, CHEN W, WANG H, ZENG Y Q. Research progress on genetic mechanism of pig coat color[J]. Swile Industry Science, 2013, 30(1): 100-103. DOI:10.3969/j.issn.1673-5358.2013.01.026 |
| [22] |
白小青, 王金勇. 猪毛色遗传的研究进展[J]. 动物科学与动物医学, 2004, 21(8): 32-33. DOI:10.3969/j.issn.1673-5358.2004.08.015 BAI X Q, WANG J Y. The advance of researches of genetics of coat color of pigd[J]. Animal Science & Veterinary Medicine, 2004, 21(8): 32-33. DOI:10.3969/j.issn.1673-5358.2004.08.015 |
| [23] |
FONTANESI L, D'ALESSANDRO E, SCOTTI E, LIOTTA L, CROVETTI A, CHIOFALO V, RUSSO V. Genetic heterogeneity and selection signature at the KIT gene in pigs showing different coat colours and patterns[J]. Animal Genetics, 2010, 41(5): 478-492. DOI:10.1111/j.1365-2052.2010.02054.x |
| [24] |
LIM H T, ZHONG T, CHO I C, SEO B Y, KIM J H, LEE S S, KO M S, PARK H B, KIM B W, LEE J H. Novel alternative splicing by exon skipping in KIT associated with whole‐body roan in an intercrossed population of Landrace and Korean native pigs[J]. Animal Genetics, 2011, 42(4): 451-455. DOI:10.1111/j.1365-2052.2011.02225.x |
| [25] |
FERNANDEZ A, SILIO L, RODRIGUEZ C, OVILO C. Characterization of OCA2 cDNA in different porcine breeds and analysis of its potential effect on skin pigmentation in a red Iberian strain[J]. Animal Genetics, 2006, 37(2): 166-170. DOI:10.1111/j.1365-2052.2005.01393.x |
| [26] |
赵若阳, 赵一萍, 李蓓, 格日乐其木格, 张心壮, 陶克涛, 图格琴, 旭仁其木格, 青柏, 李超, 白东义, 芒来. 马毛色遗传机理研究进展[J]. 遗传, 2018, 40(5): 357-368. DOI:10.16288/j.yczz.17-371 ZHAO R Y, ZHAO Y P, LI B, BOUG, ZHANG X Z, MONGKE T, BAO T, GERELⅡN S, GERELTUUIN T, LI C, BAI D Y, DUGARJAVⅡN M L. Overview of the genetic control of horse coat color patterns[J]. Hereditas, 2018, 40(5): 357-368. DOI:10.16288/j.yczz.17-371 |
| [27] |
HOLL H M, PFLUG K M, YATES K M, HOEFS M K, SHEPARD C, COOK D G, LAFAYETTE C, BROOKS S A. A candidate gene approach identifies variants in SLC 45A2 that explain dilute phenotypes, pearl and sunshine, in compound heterozygote horses[J]. Animal Genetics, 2019, 50(3): 271-274. DOI:10.1111/age.12790 |
| [28] |
COOK D, BROOKS S, BELLONE R, BAILEY E. Missense mutation in exon 2 of SLC36A1 responsible for champagne dilution in horses[J]. PLOS Genetics, 2008, 4(9): e1000195. DOI:10.1371/journal.pgen.1000195 |
| [29] |
BRUNBERG E, ANDERSSON L, COTHRAN G, SANDBERG K, MIKKO S, LINDGREN G. A missense mutation in PMEL17 is associated with the silver coat color in the horse[J]. BMC Genetics, 2006, 7: 46. DOI:10.1186/1471-2156-7-46 |
| [30] |
REISSMANN M, BIERWOLF J, BROCKMANN G A. Two SNPs in the SILV gene are associated with silver coat colour in ponies[J]. Animal Genetics, 2007, 38(1): 1-6. DOI:10.1111/j.1365-2052.2006.01553.x |
| [31] |
IMSLAND F, MCGOWAN K, RUBINC J, HENEGAR C, SUNDSTROM E, BERGLUND J, SCHWOCHOW D, GUSTAFSON U, IMSLAND P, LINDBLAD T K, LINDGREN G, MIKKO S, MILLON L, WADE C, SCHUBERT M, ORLANDO L, PENEDO M C, BARSH G S, ANDERSSON L. Regulatory mutations in TBX3 disrupt asymmetric hair pigmentation that underlies dun camouflage color in horses[J]. Nature Genetics, 2016, 48(2): 152-158. DOI:10.1038/ng.3475 |
| [32] |
TANAKA J, LEEB T, RUSHTON J, FAMULA T R, MACK M, JAGANNATHAN V, FLURY C, BACHMANN I, EBERTH J, MCDONNELL S M, PENEDO M, BELLONE R R. Frameshift variant in MFSD12 explains the mushroom coat color dilution in shetland ponies[J]. Genes (Basel), 2019, 10(10): 826. DOI:10.3390/genes10100826 |
| [33] |
BROOKS S A, GABRESKI N, MILLER D, BRISBIN A, BROWN H E, STREETER C, MEZEY J, COOK D, ANTCZAK D F. Whole-genome SNP association in the horse: Identification of a deletion in myosin Va responsible for Lavender Foal Syndrome[J]. PLOS Genetics, 2010, 6(4): e1000909. DOI:10.1371/journal.pgen.1000909 |
| [34] |
KUKN C, WEIKARD R. An investigation into the genetic background of coat colour dilution in a Charolais×German Holstein F2 resource population[J]. Animal Genetics, 2007, 38(2): 109-113. DOI:10.1111/j.1365-2052.2007.01569.x |
| [35] |
GUTIERREZ G B, WIENER P, WILLIAMS J L. Genetic effects on coat colour in cattle: Dilution of eumelanin and phaeomelanin pigments in an F2-Backcross Charolais×Holstein population[J]. BMC Genetics, 2007, 8: 1-12. DOI:10.1186/1471-2156-8-56 |
| [36] |
KNAUST J, WEIKARD R, ALBRECHT E, BRUNNER R M, GUNTHER J, KUHN C. Interaction of MC1R and PMEL alleles on solid coat colors in highland cattle[J]. Animal Genetics, 2013, 44(1): 9-13. DOI:10.3390/genes11070788 |
| [37] |
HECHT B C. Sequence analysis of Pmel17 as candidate gene for causing rat-tail syndrome in cattle[M]. Provo: Brigham Young University, 2006.
|
| [38] |
BOVO S, SCHIAVO G, KAZEMI H, MOSCATELLI G, RIBANI A, BALLAN M, BONACINI M, PRANDI M, DALLOLIO S, FONTANESI L. Exploiting within-breed variability in the autochthonous Reggiana breed identified several candidate genes affecting pigmentationrelated traits, statureand udder defects in cattle[J]. Animal Genetics, 2021, 52(5): 579-597. DOI:10.1111/age.13109 |
| [39] |
SEITZ J J, SCHMUTZ S M, THUE T D, BUCHANAN F C. A missense mutation in the bovine MGF gene is associated with the roan phenotype in Belgian Blue and Shorthorn cattle[J]. Mammalian Genome, 1999, 10(7): 710-712. DOI:10.1007/s003359901076 |
| [40] |
LI W, SARTELET A, TAMMA N, COPPIETERS W, GEORGES M, CHARLIER C. Reverse genetic screen for loss-of-function mutations uncovers a frameshifting deletion in the melanophilin gene accountable for a distinctive coat color in Belgian Blue cattle[J]. Animal Genetics, 2016, 47(1): 110-113. DOI:10.1111/age.12383 |
| [41] |
SCHMUTZ S M, BERRYERE T G, CIOBANU D C, MILEHAM A J, SCHMIDTZ B H, FREDHOLM M. A form of albinism in cattle is caused by a tyrosinase frameshift mutation[J]. Mammalian Genome, 2004, 15(1): 62-67. DOI:10.1007/s00335-002-2249-5 |
| [42] |
FLORIOT S, DUCHESNE A, GROHS C, HOZE C, DELOCHE M C, FAYOLLE G, VILOTTE J L, BOICHARD D, FRITZ S, BOUSSAHA M. A missense mutation in the FZD7 gene is associated with dilution of the red areas of the coat in Montbeliarde cattle[J]. Animal Genetics, 2021, 52(3): 351-355. DOI:10.1111/age.13055 |
| [43] |
POSBERGH C J, STAIGER E A, HUSON H J. A Stop-Gain mutation within MLPH is responsible for the lilac dilution observed in jacob sheep[J]. Genes (Basel), 2020, 11(6): 618. DOI:10.3390/genes11060618 |
| [44] |
POSBERGH C J, STAIGER E A, HUSON H J. Chasing colors: Identifying the genetic variants responsible for coat color variation in sheep[M]. Isaka: Cornell University, 2020.
|
| [45] |
HELLSTROM A R, SUNDSTROM E, GUNNARSSON U, BEDHOM B, TIXIER B M, HONAKER C F, SAHLQVIST A S, JENSEN P, KAMPE O, SIEGEL P B, KERJE S, ANDERSSON L. Sex-linked barring in chickens is controlled by the CDKN2A /B tumour suppressor locus[J]. Pigment Cell & Melanoma Research, 2010, 23(4): 521-530. DOI:10.1111/j.1755-148X.2010.00700.x |
| [46] |
SCHWOCHOW T D, RING H, SUNDSTROM E, CAO X, LARSSON M, KERJE S, HOGLUND A, FOGELHOLM J, WRIGHT D, JEMTH P, HALLBOOK F, BEDHOM B, DORSHORST B, TIXIER B M, ANDERSSON L. The evolution of sex-linked barring alleles in chickens involves both regulatory and coding changes in CDKN2A[J]. PLOS Genetics, 2017, 13(4): e1006665. DOI:10.1371/journal.pgen.1006665 |
| [47] |
KINOSHITA K, AKIYAMA T, MIZUTANI M, SHINOMIYA A, ISHIKAWA A, YOUNIS H H, TSUDZUKI M, NAMIKAWA T, MATSUDA Y. Endothelin receptor B2 (EDNRB2) is responsible for the tyrosinase-independent recessive white (mo(w)) and mottled (mo) plumage phenotypes in the chicken[J]. PLOS One, 2014, 9(1): e86361. DOI:10.1371/journal.pone.0086361 |
| [48] |
GUNNARSSON U, KERJE S, BEDHOM B, SAHLQVIST AS, EKWALL O, TIXIER B M, KAMPE O, ANDERSSON L. The dark brown plumage color in chickens is caused by an 8.3 kb deletion upstream of SOX10[J]. Pigment Cell & Melanoma Research, 2012, 24(2): 268-274. DOI:10.1111/j.1755-148X.2011.00825.x |
| [49] |
KERJE S, SHARMA P, GUNNARSSON U, KIM H, BAGCHI S, FREDRIKSSON R, SCHUTZ K, JENSEN P, VON H G, OKIMOTO R, ANDERSSON L. The dominant white, dun and smoky color variants in chicken are associated with insertion/deletion polymorphisms in the PMEL17 gene[J]. Genetics, 2004, 168(3): 1507-1518. DOI:10.1534/genetics.104.027995 |
| [50] |
CHANG C M, COVILLE J L, COQUERELLE G, GOURICHON D, OULMOUDEN A, TIXIER B M. Complete association between a retroviral insertion in the tyrosinase gene and the recessive white mutation in chickens[J]. BMC Genomics, 2006, 7: 19. DOI:10.1186/1471-2164-7-19 |
| [51] |
TOBITA T T, JANG G Y, KINO K, SALTER D W, BRUMBAUGH J, AKIYAMA T. Autosomal albino chicken mutation (ca/ca) deletes hexanucleotide (-ΔGACTGG817) at a copper-binding site of the tyrosinase gene[J]. Poultry Science, 2000, 79(1): 46-50. DOI:10.1093/ps/79.1.46 |
| [52] |
VAEZ M, FOLLETT S A, BEDHOM B, GOURICHON D, TIXIER B M, BURKE T. A single point-mutation within the melanophilin gene causes the lavender plumage colour dilution phenotype in the chicken[J]. BMC Genetics, 2008, 9: 7. DOI:10.1186/1471-2156-9-7 |
| [53] |
GUNNARSSON U, HELLSTROM A R, TIXIER B M, MINVIELLE F, BEDHOM B, ITO S, JENSEN P, RATTINK A, VEREIJKEN A, ANDERSSON L. Mutations in SLC45A2 cause plumage color variation in chicken and Japanese quail[J]. Genetics, 2007, 175(2): 867-877. DOI:10.1534/genetics.106.063107 |
| [54] |
LI J, BEDHOM B, MARTHEY S, VALADE M, DUREUX A, MOROLDO M, PECHOUX C, COVILLE J L, GOURICHON D, VIEAUD A, DORSHORST B, ANDERSSON L, TIXIER B M. A missense mutation in TYRP1 causes the chocolate plumage color in chicken and alters melanosome structure[J]. Pigment Cell & Melanoma Research, 2019, 32(3): 381-390. DOI:10.1111/pcmr.12753 |
| [55] |
AVILA F, HUGHES S S, MAGDESIAN K G, PENEDO M, BELLONE R R. Breed distribution and allele frequencies of base coat color, dilution, and white patterning variants across 28 horse breeds[J]. Genes (Basel), 2022, 13(9): 1641. DOI:10.3390/genes13091641 |
| [56] |
ANDERSSON L S, WILBE M, VILUMA A, COTHRAN G, EKESTEN B, EWART S, LINDGREN G. Equine multiple congenital ocular anomalies and silver coat colour result from the pleiotropic effects of mutant PMEL[J]. PLOS One, 2013, 8(9): e75639. DOI:10.1371/journal.pone.0075639 |
| [57] |
SHEILA M. Bovine genomics[M]. USA: New Jersey, 2012.
|
| [58] |
BULTMAN S J, MICHAUD E J, WOYCHIK R P. Molecular characterization of the mouse agouti locus[J]. Cell, 1992, 71(7): 1195-1204. DOI:10.1016/s0092-8674(5)80067-4 |
| [59] |
GIRARDOT M, GUIBERT S, LAFORET MP, GALLARD Y, LARROQUE H, OULMOUDEN A. The insertion of a full-length Bos taurus LINE element is responsible for a transcriptional deregulation of the Normande Agouti gene[J]. Pigment Cell Research, 2006, 19(4): 346-355. DOI:10.1111/j.1600-0749.2006.00312.x |
| [60] |
LIANG D, ZHAO P, SI J, FANG L, PAIRO C E, HU X, XU Q, HOU Y, GONG Y, LIANG Z, TIAN B, MAO H, YINDEE M, FARUQUE M O, KONGVONGXAY S, KHAMPHOUMEE S, LIU G E, WU D D, BARKER J, HAN J, ZHANG Y. Genomic analysis revealed a convergent evolution of LINE-1 in coat color: A case study in water buffaloes (Bubalus bubalis)[J]. Molecular Biology and Evolution, 2021, 38(3): 1122-1136. DOI:10.1093/molbev/msaa279 |
| [61] |
OLSON T A. Genetics of colour variation[J]. The Genetics of Cattle, 1999(1): 33-53. |
| [62] |
KIMURA S, HATAKEYAMA T, KOUTAKA T, KUBO K, MORITA S, EGUCHI K, SAITON K, YAMAUCHI K, IMAI S, KASHIMURA A, INENAGA T, MATSUMOTO H. PMEL p.Leu18del dilutes coat color of Kumamoto sub-breed of Japanese brown cattle[J]. BMC Genomics, 2022, 23(1): 694. DOI:10.1186/s12864-022-08916-8 |
| [63] |
KNAUST J, HADLICH F, WEIKARD R, KUEHN C. Epistatic interactions between at least three loci determine the "rat-tail" phenotype in cattle[J]. Genetics Selection Evolution, 2016, 48: 26. DOI:10.1186/s12711-016-0199-8 |
| [64] |
KNAUST J, WEIKARD R, ALBRECHT E, BRUNNER R M, GUNTHER J, KUHN C. Indication of premelanosome protein (PMEL) expression outside of pigmented bovine skin suggests functions beyond eumelanogenesiss[J]. Genes (Basel), 2020, 11(7): 788. DOI:10.3390/genes11070788 |
| [65] |
KOBAYASHI T, IMOKAWA G, BENNETT D C, HEARING V J. Tyrosinase stabilization by Tyrp1 (the brown locus protein)[J]. Journal of Biological Chemistry, 1998, 273(48): 31801-31805. DOI:10.1074/jbc.273.48.31801 |
| [66] |
CHARLIER C, DENYS B, BELANCHE J I, COPPIETERS W, GROBET L, MNI M, WOMACK J, HANSET R, GEORGES M. Microsatellite mapping of the bovine roan locus: A major determinant of White Heifer disease[J]. Mammalian Genome, 1996(7): 138-142. DOI:10.1007/s003359900034 |
| [67] |
孙晓燕, 付琳, 陈灿灿, 任航行. 绵羊毛色相关基因MC1R和ASIP的研究进展[J]. 黑龙江畜牧兽医, 2019(9): 41-44. DOI:10.13881/j.cnki.hljxmsy.2018.11.0170 SUN X Y, FU L, CHEN C C, REN H X. Research advances in sheep coat color related genes MC1R and ASIP[J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(9): 41-44. DOI:10.13881/j.cnki.hljxmsy.2018.11.0170 |
| [68] |
KERJE S, LIND J, SCHUTZ K, JENSEN P, ANDERSSON L. Melanocortin 1-receptor (MC1R) mutations are associated with plumage colour in chicken[J]. Animal Genetics, 2003, 34(4): 241-248. DOI:10.1046/j.1365-2052.2003.00991.x |
| [69] |
LING M K, LAGERSTROM M C, FREDRIKSSON R, OKIMOTO R, MUNDY N I, TAKEUCHI S, SCHIOTH H B. Association of feather colour with constitutively active melanocortin 1 receptors in chicken[J]. European Journal of Biochemistry, 2003, 270(7): 1441-1449. DOI:10.1046/j.1432-1033.2003.03506.x |
| [70] |
KABIR M H, TAKENOUCHI A, HAQANI M I, NAKAMURA Y, TAKEUCHI S, TSUDZUKI M. Discovery of a new nucleotide substitution in the MC1R gene and haplotype distribution in native and non-Japanese chicken breeds[J]. Animal Genetics, 2020, 51(2): 235-248. DOI:10.1111/age.12906 |
| [71] |
LI R, WANG Y, LIU Y, LI D, TIAN Y, LIU X, KANG X, LI Z. Effects of SLC45A2 and GPNMB on melanin deposition based on transcriptome sequencing in chicken feather Follicles[J]. Animals (Basel), 2023, 13(16): 2608. DOI:10.3390/ani13162608 |
| [72] |
LAIBLE G, COLE S A, BROPHY B, WEI J, LEATH S, JIVANJI S, LITTLEJOHN M D, WELLS D N. Holstein Friesian dairy cattle edited for diluted coat color as a potential adaptation to climate change[J]. BMC Genomics, 2021, 22(1): 856. DOI:10.1186/s12864-021-08175-z |
(责任编辑 崔建勋)
 2024, Vol. 51
2024, Vol. 51