文章信息
基金项目
- 国家自然科学基金(32160708);云南省科技计划项目(202102AE090005,202205AR070001);云南省专家基层工作站项目
作者简介
- 邓明华(1974—),男,博士,教授,研究方向为蔬菜遗传育种,E-mail:dengminghua2013@sina.com.
通讯作者
- 张宏(1964—),男,高级实验师,研究方向为蔬菜生物学,E-mail:864197481@qq.com.
文章历史
- 收稿日期:2023-12-13
辣椒(Capsicum spp.)作为一种水果、蔬菜和香料作物,在世界各地得到广泛种植。辣椒属共有30余种,其中一年生辣椒(C. annuum)、浆果辣椒(C. bacaccatum)、中国辣椒(C. chinense)、灌木辣椒(C. frutescens)和绒毛辣椒(C. pubescens)等5个种得到驯化栽培[1]。传统上,辣椒用作开胃剂、调味品,并用于治疗风湿病、牙痛、肌肉痛、咳嗽、喉咙痛和伤口愈合等病症[2-4]。辣椒含有丰富且具有多种生物活性的营养物质,如维生素(尤其是维生素C和维生素E)和有色色素(β-胡萝卜素、玉米黄质、紫黄质、β-隐黄质、叶黄素、辣椒红素),以及辣椒素和类黄酮等非酚类物质[5-6]。这些化合物在辣椒中的含量受到辣椒基因型和栽培方式等因素的显著影响[2, 6-7]。辣椒果实的颜色是影响消费者对辣椒果实偏好的重要因素。植物通常会展现出彩色的花朵和多肉的果实来吸引传粉昆虫或种子传播者,这也影响了它们作为蔬菜的商业价值[8],如野生一年生辣椒会结出鲜艳的红色果实,吸引鸟类[9]。辣椒果实的颜色对其观赏性和审美价值有很大影响。在现代的一年生辣椒品种中,成熟果实的颜色大多数为红色、黄色或橙色,但未成熟果实的颜色变化很大,从浅绿色到紫色、巧克力棕色或接近黑色。这种变化主要是类胡萝卜素、叶绿素和花青素等3种色素不同组合的结果[10-11]。果实呈现红色主要是由于含有类胡萝卜素[11-13];果实呈现黄色、橙色主要是由于各种类胡萝卜素单体(如紫黄素、叶黄素和β-胡萝卜素)的积累[14]。
果实颜色是影响消费者偏好的显著特征,也是育种者开发新品种以满足消费者和生产者特定需求的重要因素。基因组和高通量测序的最新进展已经发掘和表征了许多控制辣椒果实颜色的基因。本文综述了近年来在辣椒果实色素(类胡萝卜素)生物合成遗传和分子生物学方面的研究进展,并对这些领域的研究现状和前景进行了展望,这将为选育富含类胡萝卜素的辣椒新品种提供更好的策略。
1 类胡萝卜素与辣椒果实颜色变化 1.1 类胡萝卜素的生理作用类胡萝卜素(Carotenoid)是一类天然色素总称,属于四萜类化合物。类胡萝卜素是亲脂性化合物,分为胡萝卜素(由碳、氢组成)和叶黄素(由碳、氢、氧组成)两类[15],据统计超过750种。在植物细胞中,类胡萝卜素通常在质体中积累[16]。类胡萝卜素是植物许多代谢过程的重要参与者,如光合作用、光保护、光形态建成和生长发育[17]。
由于共轭多烯链的广泛存在,类胡萝卜素在波段范围450~550 nm(可见光光谱的蓝绿色)中具有非常优良的光吸收性能,可以作为天然色素在光合作用中发挥重要作用。在植物的绿叶组织中,光合作用性能的高低与类胡萝卜素单体的构成和相对丰富度密切相关[18]。植物在光合作用过程中,会产生一部分中间体和副产物(如ROS),使光合组件受损、光合作用能力下降。一些抗氧化剂如类胡萝卜素、还原性谷胱甘肽,可以抑制中间体或副产物的合成,特别是ROS的生成,进而可以稳定植物的光合能力。现已证实类胡萝卜素作为抗氧化剂在维持白化的藻类和变异体光合作用中扮演重要作用,表明类胡萝卜素在植物光线保护中扮演着主要角色[17]。在植物光调控的形态建成过程中,类胡萝卜素协同叶绿素与其他元件一起形成类囊体结构。类胡萝卜素还是黄色、橙色和红色的果实和花朵呈色物质的主要成分[19],这些艳丽色彩在吸引授粉和传播种子的昆虫方面发挥着重要作用。类胡萝卜素是人体不可缺少的功能色素,能提高免疫力、预防癌症、延缓衰老、抑制细菌增殖、增强抗氧化功能[18]。人体无法自行合成类胡萝卜素,只能从外部世界获得。同时,由于类胡萝卜素需要从饮食中获得,因此一般也认为类胡萝卜素的获取和分布是自然选择的重要生命史轴[20]。此外,类胡萝卜素也是多种物质生物合成的前体物质,包括脱落酸(ABA) 和独脚金内酯两种植物激素[21-22]。发现负责内源性类胡萝卜素生物合成与调控的基因,为理解类胡萝卜素在生理学中的功能和重要性提供了新的机会。
1.2 类胡萝卜素参与辣椒果实颜色形成辣椒果实富含类胡萝卜素,包括β-胡萝卜素、叶黄素、β-隐黄质、玉米黄质、紫黄质、辣椒红素和辣椒玉红素。类胡萝卜素积累的种类和含量受辣椒基因型和果实成熟期等因素的影响且存在显著差异[6]。一般来说,果实成熟过程中,β-胡萝卜素、玉米黄质、花黄质和紫黄质含量增加,而叶黄素和新黄质等色素含量逐渐下降,到完全成熟时几乎耗尽[23]。β-胡萝卜素是几乎所有辣椒果实中最主要的类胡萝卜素化合物,而辣椒红素只存在于红色果实的辣椒中[12, 24]。
辣椒果实的颜色,无论是红色、橙色、橙红色还是黄色,都是由不同类胡萝卜素积累决定的。辣椒红果实中有不同含量的β-胡萝卜素、β-隐黄质、玉米黄质、花青素、辣椒红素和辣椒玉红素6种主要色素,叶黄素含量较少。在辣椒红果实中,β-胡萝卜素、β-隐黄质和玉米黄质的积累水平远低于辣椒红素[11]。采用高效液相色谱法对辣椒红色果实的类胡萝卜素含量进行分析,发现辣椒红素含量为37%、辣椒玉红素含量为3.2%、β-胡萝卜素含量为9%、玉米黄质含量为8%、叶黄素含量较少[25]。
辣椒果实呈现橙色是β-胡萝卜素和辣椒红素平衡积累的结果,β-胡萝卜素羟化酶控制β-胡萝卜素水平[10, 12],玉米黄质在玉米黄质环氧化酶的作用下生成花药黄质和紫黄质[26]。中国辣椒(RU72-241)橙色果实中含有少量的β-隐黄质、花药黄质和辣椒红素,其他橙色果实中含有紫黄素及微量的β-胡萝卜素和红色色素[27]。中国辣椒(RU72-241)的橙红色果实除了忽略不计的辣椒红素、辣椒玉红素、β-胡萝卜素和α-胡萝卜素外,几乎不含类胡萝卜素[27]。总的来说,辣椒果实的橙色是由黄色和红色类胡萝卜素的平衡沉积,或显橙色的β-胡萝卜素和玉米黄质的积累形成[12, 28]。黄色辣椒果实也可以积累类胡萝卜素,包括α-胡萝卜素、β-胡萝卜素和玉米黄质,但它们不积累辣椒红素或辣椒玉红素;相反,它们积累了高水平的紫黄质和叶黄素[27-30]。
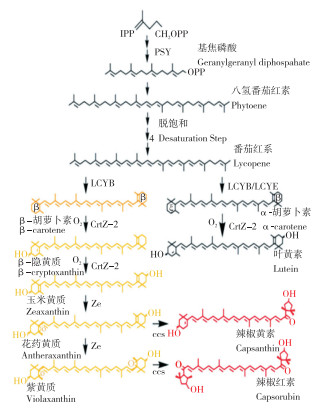
2 类胡萝卜素生物合成途径大多数植物中类胡萝卜素的生物合成途径都是保守的。植物通过甲基赤藓糖醇(MEP)-质体途径合成类胡萝卜素生物合成所需的前体物质异戊烯焦磷酸(IPP)。首先,IPP在异戊二烯焦磷酸异构酶(IPI)的作用下与二甲基烯丙基焦磷酸脂(DMAPP)相互转化。接着,牻牛儿基牻牛儿基焦磷酸合成酶(GGPS)催化IPP和DMAPP生成牻牛儿基牻牛儿基焦磷酸(GGPP)。GGPP是植物很多物质生物合成的重要前体物质,如它是类胡萝卜素、叶绿素、叶绿醌、生育酚等重要呈色物质生物合成的重要前体分子,也是独脚金内酯和赤霉素等植物激素生物合成的重要前体分子[22]。八氢番茄红素合成酶(PSY)是植物类胡萝卜素生物合成途径的关键酶和限速酶,PSY活性的高低通常决定类胡萝卜素含量的多少[31]。在类胡萝卜素生物合成过程中,GGPP通过PSY催化缩合生成八氢番茄红素;然后在特定的去饱和酶和异构酶催化下,八氢番茄红素经过连续的异构化和去饱和生成番茄红素(图 1)[32-33]。番茄红素一方面在番茄红素ε-环化酶(LCYE)的催化作用下生成δ-胡萝卜素,继而在番茄红素环化酶的催化下生成α-胡萝卜素,α-胡萝卜素在CYP酶(细胞色素P450)的作用下羟基化合成叶黄素(图 1)[32-33];另一方面番茄红素在β-环化酶(LCYB)的催化作用下生成γ-胡萝卜素,γ-胡萝卜素在番茄红素环化酶的催化下生成β-胡萝卜素,β-胡萝卜素通过β-胡萝卜素羟化酶(BCH)的作用羟基化合成玉米黄质,玉米黄质在玉米黄质环氧化酶(ZEP)的催化下转化成紫黄质,而紫黄质在紫黄质去环氧化酶(VDE)的催化下生成玉米黄质(图 1)[32-33]。在辣椒红熟果实中,因为积累了辣椒红素和辣椒玉红素而表现出红色。辣椒果实颜色发生变化是因为在辣椒红素-辣椒玉红素合成酶(Capsanthin-capsorubinsynthase,CCS)催化下,花药黄质转化为辣椒黄素,以及紫黄素转化为辣椒红素。此外,紫黄素在新黄质合成酶的催化下转化为新黄质,紫黄质和新黄质都是脱落酸(ABA)生物合成的关键前体物质[32-35]。
3 辣椒类胡萝卜素生物合成与果实颜色的分子遗传学研究 3.1 辣椒类胡萝卜素生物合成途径的结构基因
3.1.1 牻牛儿基牻牛儿基焦磷酸合成酶编码基因(GGPS) GGPS催化3分子的异戊烯焦磷酸和1分子的二甲基烯丙基焦磷酸脂生成1分子GGPP[20]。许多研究表明GGPS是类胡萝卜素生物合成过程中的限速酶,GGPP的合成控制着类胡萝卜素的产生[36]。GGPP是在植物生长和发育中具有不同生理功能的多种类异戊二烯的关键前体,是合成辣椒红素-辣椒玉红素途径的起始点,在辣椒红素-辣椒玉红素生物合成途径中发挥至关重要的作用。利用RT-PCR方法对GGPS基因的多组织表达研究表明,GGPS基因在果实和花器官中高表达,暗示GGPS基因在果实和花器官中发挥重要作用[22]。利用Western blot研究也发现,叶片GGPS基因响应Uv-B辐照,显著上调其表达,同时类胡萝卜素含量也显著提高[22]。Dogbo等[37]最早在辣椒质体中分离得到可溶性并具有功能的GGPS同源二聚体。模式生物拟南芥中共分离得到5种具有活性的GGPS,其亚细胞定位和功能还不是很清楚[31]。
3.1.2 八氢番茄红素合成酶编码基因(PSY) PSY催化两个GGPP分子缩合生成八氢番茄红素,PSY是辣椒类胡萝卜素合成通路的端口酶和限速酶,其表达丰度和活性高低直接调控植物体内类胡萝卜素的含量[36]。在所有辣椒类胡萝卜素生物合成基因中,PSY是高丰度表达的基因[31]。多数植物基因组均编码多个PSY基因,以保障体内类胡萝卜素合成顺利进行。Huh等[38]研究结果显示,辣椒基因组中鉴定出2个PSY基因,与普通烟草和番茄中的PSY基因具有高度相似性,其中PSY1和PSY2在叶片中表达量最高。大肠杆菌实验表明,辣椒中PSY1和辣椒红素-辣椒玉红素合成酶(CCS)基因沉默后,果实中仍积累了基础水平的类胡萝卜素,暗示PSY2基因可能补充了PSY1的损失,从而导致黄色辣椒果实呈黄色[39]。在一年生辣椒Micro PepYellow中,发现了PSY1基因的缺失(发生在CCS零突变的遗传背景下),但由于PSY2基因的功能补偿,果实颜色保持了黄色;否则,就会产生白色或象牙色的果实[39]。PSY在茄子果实和愈伤组织中表达较低,在茄子愈伤组织中异源表达细菌PSY基因,β-胡萝卜素积累量比未转化的愈伤组织高出约150倍。
3.1.3 八氢番茄红素脱氢酶编码基因(PDS) PDS是植物类胡萝卜素生物合成过程中的关键酶和限速酶,其酶活性的高低决定类胡萝卜素含量的多少[36]。大量研究表明,PDS基因在植物基因组中以单拷贝的形式存在,植物PDS基因相对比较保守,其核酸序列和氨基酸序列在不同物种间分别具有较高的同源性[20]。PDS蛋白主要存在两种形式:一种是没有酶活性的,通常以可溶态存在;另一种是具有酶活性的,通常以与膜结合的形式存在,与膜结合的越紧密,酶活性越高,反之,酶活性越低[19]。
3.1.4 ζ-胡萝卜素去饱和酶编码基因(ZDS) 在类胡萝卜素的合成途径中,ζ-胡萝卜素去饱和酶将ζ-胡萝卜素催化生成番茄红素[36]。目前已从小麦、拟南芥、木瓜等多种植物中分离鉴定到ZDS。研究发现,拟南芥中ZDS酶活力的缺失会导致β-胡萝卜素和叶黄素含量降低;在甘薯中过量表达ZDS基因能够增加阳性植株叶片和果实中叶黄素的含量[20]。
3.1.5 番茄红素环化酶编码基因(LCY) LCY存在两种类型,包括番茄红素β-环化酶(LCY-B)和番茄红素ε-环化酶(LCY-E)。LCY-B可催化番茄红素生成β-胡萝卜素[36]。目前对LCY-B基因的研究较多,已经从多种植物中获得编码LCY-B基因的碱基序列,最先是从模式植物拟南芥中获得(GBANL40176),然后陆续从辣椒(GBANX86221)、番茄(GBANX86452)、烟草(GBANX81787)和黄水仙(GBANX98768)等植物中获得。研究发现,LCY-B基因cDNA长度1.6~2.0 kb,其预测的蛋白质包含498~503个氨基酸[40]。对甜瓜LCY-B基因功能研究发现,LCY-B基因是组成型表达,随着果实的发育,LCY-B基因的表达量逐步升高,在果实生理成熟期达到峰值;然后随着果实的衰老,其表达量逐步降低,与类胡萝卜素含量的变化趋势基本一致[40]。LCY-E可催化番茄红素生成α-胡萝卜素[36]。目前已经从拟南芥(GBANU50738)和番茄(GBANY14387)等植物中克隆了LCY-E基因,研究发现LCY-E基因cDNA长度在1.7~19 kb之间,其预测的蛋白质包含524~526个氨基酸[11]。对胡萝卜植株中类胡萝卜素生物合成机理研究发现,LCY-E基因是决定类胡萝卜素含量高低的关键因子,LCY-E基因是组成型表达,但在不同的组织中,LCY-E基因的功能并不一致,在根中,LCY-E基因正调控α-胡萝卜素、β-胡萝卜素及总类胡萝卜素的生物合成,其酶活性与α-胡萝卜素、β-胡萝卜素及总类胡萝卜素含量呈显著正相关;而在胡萝卜叶片中,LCY-E基因负调控叶黄素和总类胡萝卜素的生物合成,其酶活性与叶片叶黄素和总类胡萝卜素含量呈显著负相关[11]。
3.1.6 辣椒红素/辣椒玉红素合成酶编码基因(CCS) CCS可催化花药黄质转化为辣椒黄素,催化紫黄素转化为辣椒红素[36]。1994年首次从辣椒中克隆到CCS基因,研究后发现辣椒CCS基因在辣椒基因组中以单拷贝的形式出现[26]。科研人员对辣椒CCS基因时空表达谱进行研究后发现,随着辣椒果实的发育,CCS基因的表达量也由不表达、开始表达到逐步增强表达,同时发现叶黄质慢慢消失,而辣椒红素或辣椒玉红素则逐步积累[40]。已有研究指出,辣椒呈现黄色是因为CCS基因的突变造成基因功能的失活,失去了将β-胡萝卜素转化成辣椒红素或辣椒玉红素的能力,以至于辣椒果实不能积累辣椒红素或辣椒玉红素,进而导致β-胡萝卜素的积累,表明CCS基因控制植物β-胡萝卜素及其下游产物的代谢[26]。Lee等[41]构建以橙色辣椒与红色辣椒为亲本的F2群体,检测分离群体的CCS基因发现,CCS基因上游区缺失是造成橙色辣椒成熟期不能转红的原因。将辣椒CCS基因转入烟草,发现转基因烟草叶片中的辣椒红素含量占类胡萝卜素总量的36%;将辣椒红素的关键基因CCS导入到大肠杆菌中,转基因大肠杆菌产生了辣椒红素。将百合的CCS基因转入番茄中,发现CCS基因的超表达可以使番茄果实颜色发生较大改变。
3.2 辣椒类胡萝卜素生物合成途径的调控基因尽管对颜色决定基因的研究非常广泛,但对辣椒类胡萝卜素生物合成途径调控基因的研究却很少,转录因子在调控类胡萝卜素生物合成途径基因中的作用仍未得到很好的解释。
3.2.1 MYB306 Ma等[42]研究表明,CaMYB306在辣椒红果中表达量较高。在MYB306沉默的辣椒果实中,重要的类胡萝卜素生物合成基因(包括PSY、BCH和ZEP)表达水平均显著下调,类胡萝卜素含量显著下降;在番茄中异源过表达CaMYB306(CaMYB306-OE),CaMYB306-OE番茄果实显色提前,类胡萝卜素积累增加,叶绿素和花青素含量降低。CaMYB306-OE果实中类胡萝卜素合成关键基因SlPSY、SlPDS和叶绿素分解代谢酶关键基因SlSGR、SlPAO的表达量升高,花青素合成关键基因SlF3H、SlCHS的表达量下调。综上,MYB306可能通过调节类胡萝卜素生物合成途径基因来控制辣椒果实的颜色。
3.2.2 DIVARICATA1 Song等[43]在辣椒中分离到一个R-R型MYB转录因子——DIVARICATA1,研究表明DIVARICATA1编码一种核定位蛋白,其主要功能是转录激活因子,其可通过直接结合并激活类胡萝卜素生物合成基因启动子转录,正向调节类胡萝卜素生物合成基因转录水平和辣椒红素水平;关联分析结果显示,DIVARICATA1转录水平与类胡萝卜素含量呈显著正相关[43]。在辣椒中,ABA通过诱导MYB转录因子DIVARICATA1的表达提高了辣椒红素水平[43]。由于ABA是类胡萝卜素途径的下游产物,ABA与DIVARICATA1之间的相互作用被认为形成一个反馈回路,进而影响类胡萝卜素的生物合成[43]。对茄科植物中DIVARICATA1的比较转录组学分析表明,其功能可能在不同物种间存在差异。另外,辣椒DIVARICATA1基因的表达可以通过成熟调控因子MADS-RIN进行调控[43]。
3.2.3 BBX20 Ma等[44]发现含有一个或多个B-box结构域的转录因子BBX20在果实成熟过程中表达上调,与果实色素变化趋势相一致;BBX20的沉默导致CCS基因表达下调,类胡萝卜素积累减少,表明BBX20对辣椒果实中类胡萝卜素的生物合成有积极影响。
此外,Song等[43]研究表明,CaERF82、CaERF97、CaERF66、CaERF107a和CaERF101与辣椒类胡萝卜素代谢相关。
3.3 辣椒果实颜色的分子遗传学研究颜色的优势性状表现为红色胜过黄色和橙色、浅黄色胜过白色[44]。研究表明,辣椒成熟果实的颜色由3个独立的基因位点决定的:C1、C2和Y[45]。遗传作图研究表明,这些基因位点分别编码PRR2、PSY1和CCS基因[38-39, 44]。研究发现,具有功能性C1等位基因的辣椒果实比含非功能性C1等位基因的呈色更鲜艳[46]。辣椒果实的颜色还与LCY-B和CRTZ-2(BCH)基因的表达有关,这些基因的不同表达谱可以导致果实颜色从黄色到红色,表现出丰富的多样性。一般来说,这些基因的突变或沉默会对辣椒果实颜色产生不同的影响[11]。
红色是辣椒最常见的颜色。研究发现红色果实需要Y位点上的显性等位基因(CCS),因为其负责产生辣椒红素和辣椒玉红素(图 1)。如果CCS基因发生突变失活,则无法合成辣椒红素和辣椒玉红素,果实也不能呈现出红色。此外,1-脱氧-d-木醛糖5-磷酸合成酶(DXS,MEP途径中的一种限速酶)也与果实红色的强度有关[47]。
黄色果实形成的原因是Y位点上的显性等位基因(CCS)发生功能性失活,导致紫黄质和花药黄质积累,从而产生黄色果实(图 1)。一年生辣椒SNU-miniOrange和SNU-miniYellow均携带功能性PSY1和突变的CCS,因此,突变体SNU-miniOrange成熟果实中玉米黄质和类胡萝卜素的含量高于SNU-miniYellow成熟果实,进而产生黄色果实[26]。此外,ZEP通过其酶活性调节玉米黄质水平,当ZEP活性较低时,玉米黄质转化为花药黄质和紫黄质,此时所利用的玉米黄质较少,导致玉米黄质积累,形成黄色果实[26]。
橙色果实形成的原因较复杂。研究发现,C2位点上的基因突变(PSY1)导致果实变成橙色[44]。CCS基因的多样性也是橙色果实形成的原因之一。迄今,辣椒中发现了CCS基因的多个等位基因[12, 48]。具有橙色果实的辣椒品种Fogo携带CCS基因突变等位基因(ccs-3),无法合成有催化功能的CCS酶,导致辣椒红素或辣椒玉红素缺失,而β-胡萝卜素和玉米黄质积累,因而,果实颜色表现为橙色[12]。此外,SNU-miniOrange果实的橙色是由ZEP基因的隐性突变引起的,该基因的突变导致类胡萝卜素含量增加,使其颜色增强,以至于外观呈橙色[26]。CRTZ-2基因突变导致β-胡萝卜素积累,成为主要的类胡萝卜素色素,果实表现为橙色[10]。一般来说,橙色果实还与PSY1、CRTZ-2和ZEP等3个基因的相互作用有关。当CRTZ-2活性较低时,β-胡萝卜素向下游的转化减少,导致β-胡萝卜素积累和下游类胡萝卜素含量降低,这种类胡萝卜素含量的变化有助于辣椒中橙色果实的形成。β-胡萝卜素和其他特定类胡萝卜素的积累,与橙色果实的颜色形成密切相关。
白色或象牙色果实形成的主要原因是没有色素积累。三位点模型表明,PSY1、CCS和PRR2这3个基因的突变可导致白色或象牙色的果实。Jeong等[46]研究发现,灌木辣椒IT231186中PSY1和CCS基因的非功能性突变,其成熟果实呈象牙色,不积累辣椒红素。果实缺乏类胡萝卜素而呈象牙色,也可能是由于prr2基因的突变[41]。果实呈象牙色或白色的IT158782辣椒在PSY1和CCS功能正常的遗传背景下,含有一个CaPRR2基因突变,减少了类胡萝卜素的积累[41]。
3.4 与辣椒果实颜色有关的QTL位点虽然已经证明果实颜色受质量性状基因的调控,但相关研究较少。Konishi等[49]发现控制辣椒红素含量的QTL包括Cst15.1和Cst13.1。控制类胡萝卜素总量和辣椒红素含量的主效QTL分别位于第8和第10染色体上[50]。QTL LA_BG-CST10与辣椒红素含量相关,LA_BG-ASTA10与ASTA色价相关,两者均存在于第10染色体上。控制类胡萝卜素总含量的QTL(FC15-tcar8)和控制ASTA值的QTL(FC17-ASTA8.1和FC17-ASTA8.2)位于8号染色体上,该染色体还含有2-C-甲基-D-赤藓糖醇4-磷酸胞基转移酶,与参与叶绿素和类胡萝卜素前体生物合成的MEP-质体途径有关。在1号染色体上检测到控制α-胡萝卜素含量的另一个QTL LA_BG-αCAR1。类胡萝卜素代谢或类异戊二烯生物合成途径上游的基因可能调控类胡萝卜素生物合成相关基因的表达。例如,参与类异戊二烯途径的GGPPS突变可导致表型多样化,并伴有类胡萝卜素水平降低[51]。
4 总结与展望天然类胡萝卜素作为抗氧化剂和天然着色剂,在食品工业中具有很高的价值。近年来食品行业对天然色素和香料的需求日益增长,而辣椒已成为这些化合物的宝贵来源。因此,深入了解辣椒类胡萝卜素生物合成与调控的分子机制,对研发类胡萝卜素含量高的辣椒新品种具有重要意义。
近年来,辣椒类胡萝卜素的生物合成及其调控的分子机理研究取得较大进展:(1)辣椒类胡萝卜素生物合成途径已经基本清楚,Davies等[52]最先构建辣椒类胡萝卜素的生物合成路径,然后许多科学家在此基础上不断完善,形成了比较完整的辣椒类胡萝卜素生物合成途径。(2)结构基因的变异影响辣椒类胡萝卜素各单体的含量,进而影响辣椒果实的颜色。这些结构基因的变异包括内含子和外显子的结构变异(突变、插入和缺失),可能会产生不同的转录本,或者提前终止、转录延长,导致基因失活或活性受到影响,干扰基因功能,进而导致表型变异。
辣椒类胡萝卜素生物合成与调控的分子机理仍有很多问题尚未弄清,目前结构基因的研究较多,但调节结构基因转录的转录因子研究极少;同时对上游产物的研究较多,但对下游产物如辣椒红素和辣椒玉红素的研究较少。今后应该从以下几个方面进行深入研究:(1)深入解析果实发育等因素影响辣椒类胡萝卜素积累的机制。类胡萝卜素在辣椒果实中的积累受多种因素的影响,包括发育过程、果实成熟和代谢信号[52]。辣椒果实成熟本身就会经历一个复杂的过程,包括转录、转录后和表观遗传调控等分子机制,它们共同影响调控基因和生物合成基因的表达和功能[53]。辣椒类胡萝卜素合成在转录和转录后水平上受到调控,并在果实成熟过程中发生变化,但目前相关研究还非常薄弱。(2)全面揭示外源因子影响辣椒类胡萝卜素积累的机制。类胡萝卜素在辣椒果实中的积累受外源物质、环境条件等因素的调控[53],如植物激素(包括乙烯、生长素和ABA等)也影响果实颜色的形成[54-56],其中ET在番茄果实发育和成熟过程中调节类胡萝卜素生物合成的作用已被广泛研究[57-60]。但关于ET在控制辣椒果实成熟过程中类胡萝卜素积累中的作用仍然知之甚少。(3)关键调控因子的发掘及调控网络的解析。类胡萝卜素的生物合成受转录因子的精密调控,但相关转录因子挖掘及其相互作用成分的鉴定仍然较为缺乏,类胡萝卜素生物合成调控网络尚未可知。例如,虽然PRR2被确定参与辣椒类胡萝卜素的生物合成和果实颜色调节[44],但PRR2基因是否参与辣椒果实中其他次生代谢途径基因的调节尚不清楚。(4)现代技术的发展可提高探索辣椒类胡萝卜素生物合成及其分子机制研究的效率。近年来,基因组学、转录组学、蛋白组学、代谢组学、表观组学等组学技术及单细胞测序、空间转录组和代谢组技术作为探索代谢物生物合成及其分子机制的有效方法而受到广泛欢迎[61-63],有望从多角度、多层面解析和构建辣椒类胡萝卜素生物合成的复杂调控网络。同时,随着辣椒遗传转化技术的进步和CRISPR/Cas9等基因编辑技术在辣椒上的应用,使得挖掘并表征辣椒类胡萝卜素生物合成的核心调控因子及调控网络成为可能。
| [1] |
LEE H Y, RO N Y, JEONG H J, KWON J K, KANG B C. Genetic diversity and population structure analysis to construct a core collection from a large Capsicum germplasm[J]. Bmc Genetics, 2016, 17: 1-13. DOI:10.1186/s12863-016-0452-8 |
| [2] |
CARVALHO A V, MATTIETTO R D A, RIOS A D O, MACIEL R D A, MORESCO K S, CRISTINE D S O T. Bioactive compounds and antioxidant activity of pepper (Capsicum spp.) genotypes[J]. Journal of Food Science & Technology, 2015, 52: 7457-7464. DOI:10.1007/s13197-015-1833-0 |
| [3] |
BADIA A D, SPINA A A, VASSALOTTI G. Capsicum annuum L.: An overview of biological activities and potential nutraceutical properties in humans and animals[J]. Journal of Nutritional Ecology and Food Research, 2017, 4(2): 167-177. DOI:10.1166/jnef.2017.1163 |
| [4] |
TAKEMURA M, SAHARA T, MISAWA N. Violaxanthin: Natural function and occurrence, biosynthesis, and heterologous production[J]. Applied Microbiology and Biotechnology, 2021, 105(16-17): 6133-6142. DOI:10.1007/s00253-021-11452-2 |
| [5] |
ANTONIO A, WIEDEMANN L, JUNIOR V V. The genus Capsicum: A phytochemical review of bioactive secondary metabolites[J]. RSC Advances, 2018, 8(45): 25767-25784. DOI:10.1039/c8ra02067a |
| [6] |
BAENAS N, BELOVI M, ILIC N, MORENO D A, GARCÍA-VIGUERA C. Industrial use of pepper (Capsicum annuum L.) derived products: Technological benefits and biological advantages[J]. Food Chemistry, 2019, 274: 872-885. DOI:10.1016/j.foodchem.2018.09.047 |
| [7] |
FAYOS O, OCHOA-ALEJO N, DE LA VEGA O M, SAVIRÓN M, ORDUNA J, MALLOR C, BARBERO G F, GARCÉS-CLAVER A. Assessment of capsaicinoid and capsinoid accumulation patterns during fruit development in three chili pepper genotypes (Capsicum spp.) carrying Pun1 and pAMT alleles related to pungency[J]. Journal of Agricultural and Food Chemistry, 2019, 67(44): 12219-12227. DOI:10.1021/acs.jafc.9b05332 |
| [8] |
JEREMY J, DON H F, CIPOLLINI J O, STIREMAN III. The role of carotenoids and their derivatives in mediating interactions between insects and their environment[J]. Arthropod-Plant Interactions, 2013, 7(1): 1-20. DOI:10.1007/s11829-012-9239-7 |
| [9] |
LI Z, WANG S, GUI X L, CHANG X B, GONG Z H. A further analysis of the relationship between yellow ripe-fruit color and the capsanthin-capsorubin synthase gene in pepper (Capsicum spp.) indicated a new mutant variant in C. annuum and a tandem repeat structure in promoter region[J]. PLoS One, 2013, 8(4): e61996. DOI:10.1371/journal.pone.0061996 |
| [10] |
BOROVSKY Y, TADMOR Y, BAR E, MEIR A, LEWINSOHN E, PARAN I. Induced mutation in β-CAROTENE HYDROXYLASE results in accumulation of β-carotene and conversion of red to orange color in pepper fruit[J]. Theoretical and Applied Genetics, 2013, 126: 557-565. DOI:10.1007/s00122-012-2001-9 |
| [11] |
TIAN S L, LI L, SHAH S N M, GONG Z H. The relationship between red fruit colour formation and key genes of capsanthin biosynthesis pathway in Capsicum annuum[J]. Biologia Plantarum, 2015, 59(3): 507513. DOI:10.1007/s10535-015-0529-7 |
| [12] |
GUZMAN I, HAMBY S, ROMERO J, BOSLAND P W, OCONNELL M A. Variability of carotenoid biosynthesis in orange colored Capsicum spp.[J]. Plant Science, 2010, 179(1-2): 49-59. DOI:10.1016/j.plantsci.2010.04.014 |
| [13] |
KILCREASE J, RODRIGUEZ-URIBE, RICHINS R D, ARCOS J M G, VICTORINO J, O'CONNELL M A. Correlations of carotenoid content and transcript abundances for fibrillin and carotenogenic enzymes in Capsicum annuum fruit pericarp[J]. Plant Science, 2015, 232: 57-66. DOI:10.1016/j.plantsci.2014.10.010 |
| [14] |
AZEVEDO-MELEIRO C H D, RODRIGUEZ-AMAYA D B. Qualitative and quantitative differences in the carotenoid composition of yellow and red peppers determined by HPLC-DAD-MS[J]. Journal of Separation Science, 2009, 32(21): 3652-3658. DOI:10.1002/jssc.200900311 |
| [15] |
RODRIGUEZ-CONCEPCION M, AVALOS J, BONET M L, BORONAT A, GOMEZ-GOMEZ L, HORNERO-MENDEZ D, LIMON M C, MELENDEZ-MARTINEZ A J, OLMEDILLA-ALONSO B, PALOU A. A global perspective on carotenoids: Metabolism, biotechnology, and benefits for nutrition and health[J]. Progress in Lipid Research, 2018, 70: 62-93. DOI:10.1016/j.plipres.2018.04.004 |
| [16] |
SADALI N M, SOWDEN R G, LING Q, JARVIS R P. Differentiation of chromoplasts and other plastids in plants[J]. Plant Cell Reports, 2019, 38: 803-818. DOI:10.1007/s00299-019-02420-2 |
| [17] |
NISAR N, LI L, LU S, KHIN N C, POGSON B. Carotenoid metabolism in plants[J]. Molecular Plant, 2015, 8(1): 68-82. DOI:10.1016/j.molp.2014.12.007 |
| [18] |
索海翠, 刘计涛, 王丽, 李成晨, 单建伟, 李小波. 马铃薯类胡萝卜素研究进展[J]. 广东农业科学, 2021, 48(12): 111-119. DOI:10.16768/j.issn.1004-874X.2021.12.013 SUO H C, LIU J T, WANG L, LI C C, SHAN J W, LI X B. Research progress in potato carotenoids[J]. Guangdong Agricultural Sciences, 2021, 48(12): 111-119. DOI:10.16768/j.issn.1004-874X.2021.12.013 |
| [19] |
傅秀敏, 唐劲驰, 杨子银. 茶叶类胡萝卜素合成、代谢调控研究进展[J]. 广东农业科学, 2021, 48(5): 18-27. DOI:10.16768/j.issn.1004-874X.2021.05.003 FU X M, TANG J C, YANG Z Y. Research progress in biosynthesis and metabolism regulation of carotenoids in tea plants[J]. Guangdong Agricultural Sciences, 2021, 48(5): 18-27. DOI:10.16768/j.issn.1004-874X.2021.05.003 |
| [20] |
张雄坚, 陈景益, 黄立飞, 王章英, 罗忠霞, 姚祝芳, 房伯平. 富含胡萝卜素鲜食型甘薯新品种广薯72的选育[J]. 广东农业科学, 2020, 47(3): 9-15. DOI:10.16768/j.issn.1004-874X.2020.03.002 ZHANG X J, CHEN J Y, HUANG L F, WANG Z Y, LUO Z X, YAO Z F, FANG B P. Breeding of the new fresh-eating sweet potato variety "Guangshu 72" rich in carotene[J]. Guangdong Agricultural Sciences, 2020, 47(3): 9-15. DOI:10.16768/j.issn.1004-874X.2020.03.002 |
| [21] |
CHESTERFIELD R J, VICKERS C E, BEVERIDGE C A. Translation of strigolactones from plant hormone to agriculture: Achievements, future perspectives, and challenges[J]. Trends in Plant Science, 2020, 25(11): 1087-1106. DOI:10.1016/j.tplants.2020.06.005 |
| [22] |
WATKINS J L, POGSON B J. Prospects for carotenoid biofortification targeting retention and catabolism[J]. Trends in Plant Science, 2020, 25(5): 501-512. DOI:10.1016/j.tplants.2019.12.021 |
| [23] |
HORNERO-MxENDEZ D, GOMEZ-LADRON DE GUEVARA R, MINGUEZ-MOSQUERA M I. Carotenoid biosynthesis changes in five red pepper (Capsicum annuum L.) cultivars during ripening: Cultivar selection for breeding[J]. Journal of Agricultural & Food Chemistry, 2000, 48(9): 3857-3864. DOI:10.1021/jf991020r |
| [24] |
MORALES-SORIANO E, PANOZZO A, UGAS R, GRAUWET T, VAN LOEY A, HENDRICKX M. Carotenoid profile and basic structural indicators of native Peruvian chili peppers[J]. European Food Research and Technology, 2019, 245: 717-732. DOI:10.1007/s00217-018-3193-2 |
| [25] |
DELI J, MOLNAR P, MATUS Z, TOTH G. Carotenoid composition in the fruits of red paprika (Capsicum annuum var. Lycopersiciforme rubrum) during ripening biosynthesis of carotenoids in red paprika[J]. Journal of Agricultural and Food Chemistry, 2001, 49(3): 1517-23. DOI:10.1021/jf000958d |
| [26] |
LEE S Y, JANG S J, JEONG H B, LEE S Y, VENKATESH J, LEE J H, KWON J K, KANG B C. A mutation in Zeaxanthin epoxidase contributes to orange coloration and alters carotenoid contents in pepper fruit (Capsicum annuum)[J]. The Plant Journal, 2021, 106(6): 1692-1707. DOI:10.1111/tpj.15264 |
| [27] |
WAHYUNI Y, BALLESTER A R, SUDARMONOWATI E, BINO R J, BOVY A G. Metabolite biodiversity in pepper (Capsicum) fruits of thirty-two diverse accessions: Variation in health-related compounds and implications for breeding[J]. Phytochemistry, 2011, 72(11-12): 1358-1370. DOI:10.1016/j.phytochem.2011.03.016 |
| [28] |
KIM J S, AN C G, PARK J S, LIM Y P, KIM S. Carotenoid profiling from 27 types of paprika (Capsicum annuum L.) with different colors, shapes, and cultivation methods[J]. Food Chemistry, 2016, 201: 64-71. DOI:10.1016/j.foodchem.2016.01.041 |
| [29] |
DA SILVEIRA AGOSTINI-COSTA T, DA SILVA GOMES I, DE MELO L A M P, REIFSCHNEIDER F J B, DA COSTA RIBEIRO C S. Carotenoid and total vitamin C content of peppers from selected Brazilian cultivars[J]. Journal of Food Composition and Analysis, 2016, 57: 73-79. DOI:10.1016/j.jfca.2016.12.020 |
| [30] |
SHU H, HE C, MUMTAZ M A, HAO Y, ZHOU Y, JIN W, ZHU J, BAO W, CHENG S, ZHU G. Fine mapping and identification of candidate genes for fruit color in pepper (Capsicum chinense)[J]. Scientia Horticulturae, 2023, 310: 111724. DOI:10.1016/j.scienta.2022.111724 |
| [31] |
ZHOU X, RAO S, WRIGHTSTONE E, SUN T, LUI A C W, WELSCH R, LI L. Phytoene synthase: the key rate-limiting enzyme of carotenoid biosynthesis in plants[J]. Frontiers in Plant Science, 2022, 13: 884720. DOI:10.3389/fpls.2022.884720 |
| [32] |
GOMEZ-GARCÍA M R, OCHOA-ALEJO N. Biochemistry and molecular biology of carotenoid biosynthesis in chili peppers (Capsicum spp.)[J]. International Journal of Molecular Sciences, 2013, 14(9). DOI:10.3390/ijms140919025 |
| [33] |
SATHASIVAM R, RADHAKRISHNAN R, KIM J K, PARK S U. An update on biosynthesis and regulation of carotenoids in plants[J]. South African Journal of Botany, 2021, 140: 290-302. DOI:10.1016/j.sajb.2020.05.015 |
| [34] |
MOISE A R, AL-BABILI S, WURTZEL E T. Mechanistic aspects of carotenoid biosynthesis[J]. Chemical Reviews, 2014, 114(1): 164-193. DOI:10.1021/cr400106y |
| [35] |
ALCAÍNO J, BAEZA M, CIFUENTES V. Carotenoid distribution in nature // CLAUCDIA S: Carotenoids in nature: Subcellular biochemistry[M]. Cham, Switzerland: Springer International Publishing, 2016: 3-33.
|
| [36] |
毛立霞, 魏小春, 原玉香, 段俊枝, 张晓伟, 姚秋菊. 辣椒红素的生物合成及代谢研究进展[J]. 分子植物育种, 2018, 15(1): 115-122. DOI:10.13271/j.mpb.016.000115 MAO L X, WEI X C, YUAN Y X, DUAN J Z, ZHANG X W, YAO Q J. Research progress on biosynthesis and metabolism of capsanthin in pepper (Capsicum annuum)[J]. Molecular Plant Breeding, 2018, 15(1): 115-122. DOI:10.13271/j.mpb.016.000115 |
| [37] |
DOGBO O, CAMARA B. Purification of isopentenylpyrophosphate isomerase and geranylgeranyl pyrophosphatesynthase from Capsicum chromoplasts by affinity chromatography[J]. Biochimica et Biophysica Acta (BBA), 1987, 920: 140-148. DOI:10.1016/0005-2760(87)90253-0 |
| [38] |
HUH J H, KANG B C, NAHM S H, KIM S, HA K S, LEE M H, KIM B D. A candidate gene approach identified phytoene synthase as the locus for mature fruit color in red pepper (Capsicum spp.)[J]. Theoretical and Applied Genetics, 2001, 102(4): 524-530. DOI:10.1007/s001220051677 |
| [39] |
JANG S J, JEONG H B, JUNG A, KANG M Y, KIM S, HA S H, KWON J K, KANG B C. Phytoene synthase 2 can compensate for the absence of PSY1 in the control of color in Capsicum fruit[J]. Journal of Experimental Botany, 2020, 71(12): 3417-3427. DOI:10.1093/jxb/eraa155 |
| [40] |
WANG Q, CAO T J, ZHENG H, ZHOU C F, WANG Z, WANG R, LU S. Manipulation of carotenoid metabolic flux by lycopene cyclization in ripening red pepper (Capsicum annuum var. Conoides) fruits[J]. Journal of Agricultural and Food Chemistry, 2019, 67(15): 4300-4310. DOI:10.1021/acs.jafc.9b00756 |
| [41] |
LEE S B, KIM J E, KIM H T, LEE G M, LEE J M. Genetic mapping of the c1 locus by GBS-based BSA-seq revealed Pseudo-Response Regulator 2 as a candidate gene controlling pepper fruit color[J]. Theoretical and Applied Genetics, 2020, 133(6): 1897-1910. DOI:10.1007/s00122-020-03565-5 |
| [42] |
MA X, YU Y N, JIA J H, LI Q H, GONG Z H. The pepper MYB transcription factor CaMYB306 accelerates fruit coloration and negatively regulates cold resistance[J]. Scientia Horticulturae, 2022, 295: 110892. DOI:10.1016/j.scienta.2022.110892 |
| [43] |
SONG J, SUN B, CHEN C, NING Z, ZHANG S, CAI Y, ZHENG X, CAO B, CHEN G, JIN D. An R-R-type MYB transcription factor promotes nonclimacteric pepper fruit carotenoid pigment biosynthesis[J]. The Plant Journal, 2023, 115(3): 724-741. DOI:10.1111/tpj.16257 |
| [44] |
MA J, DAI J X, LIU X W, LIN D. The transcription factor CaBBX20 regulates capsanthin accumulation in pepper (Capsicum annuum L.)[J]. Scientia Horticulturae, 2023, 314: 111907. DOI:10.1016/j.scienta.2023.111907 |
| [45] |
HURTADO-HERNANDEZ H, SMITH P G. Inheritance of mature fruit color in Capsicum annuum L.[J]. Journal of Heredity, 1985, 76(3): 211-213. DOI:10.1093/oxfordjournals.jhered.a110070 |
| [46] |
JEONG H B, KANG M Y, JUNG A, HAN K, LEE J H, JO J, LEE H Y, AN J W, KIM S, KANG B C. Single-molecule real-time sequencing reveals diverse allelic variations in carotenoid biosynthetic genes in pepper (Capsicum spp.)[J]. Plant Biotechnology Journal, 2019(6): 10811093. DOI:10.1111/pbi.13039 |
| [47] |
BERRY H M, RICKETT D V, BAXTER C J, ENFISSI E M A, FRASER P D. Carotenoid biosynthesis and sequestration in red chilli pepper fruit and its impact on colour intensity traits[J]. Journal of Experimental Botany, 2019, 70(10): 2637-2650. DOI:10.1093/jxb/erz086 |
| [48] |
RODR IGUEZ-UR IBE L, HERNANDEZ L, K ILCR EASE J P, WALKE S, O'CONNELL M A. Capsaicinoid and carotenoid composition and genetic diversity of Kas I and Ccs in new mexican Capsicum annuum L. landraces[J]. HortScience, 2014, 49(11): 1370-1375. DOI:10.21273/HORTSCI.49.11.1370 |
| [49] |
KONISHI A, FURUTANI N, MINAMIYAMA Y, OHYAMA A. Detection of quantitative trait loci for capsanthin content in pepper (Capsicum annuum L.) at different fruit ripening stages[J]. Breeding Science, 2019, 69(1): 30-39. DOI:10.1270/jsbbs.18070 |
| [50] |
JANG S, KIM G W, HAN K, KIM Y M, JO J, LEE S Y, KWON J K, KANG B C. Investigation of genetic factors regulating chlorophyll and carotenoid biosynthesis in red pepper fruit[J]. Frontiers in Plant Science, 2022, 13: 922963. DOI:10.3389/fpls.2022.922963 |
| [51] |
RUIZ-SOLA M A, COMAN D, BECK G, BARJA M V, COLINAS M, GRAF A, WELSCH R, RÜTIMANN P, BÜHLMANN P, BIGLER L. Arabidopsis geranylgeranyl diphosphate synthase 11 is a hub isozyme required for the production of most photosynthesis-related isoprenoids[J]. New Phytologist, 2016, 209(1): 252-264. DOI:10.1111/nph.13580 |
| [52] |
DAVIES B H, MATHEWS S, KIRK J T O. The nature and biosynthesis of the carotenoids of different colour varieties of Capsicum annuum[J]. Phytochemistry, 1970, 9(4): 797-805. DOI:10.1016/S0031-9422(00)85183-3 |
| [53] |
GIOVANNONI J, NGUYEN C, AMPOFO B, ZHONG S, FEI Z. The epigenome and transcriptional dynamics of fruit ripening[J]. Annual Reviews, 2017, 68(1): 61-84. DOI:10.1146/annurev-arplant-042916-040906 |
| [54] |
JONES B, FRASSE P, OLMOS E, ZEGZOUTI H, BOUZAYEN M. Down-regulation of DR12, an auxin-response-factor homolog, in the tomato results in a pleiotropic phenotype including dark green and blotchy ripening fruit[J]. Plant Journal, 2010, 32(4): 603-613. DOI:10.1046/j.1365-313X.2002.01450.x |
| [55] |
BOTTCHER C, KEYZERS R A, BOSS P K, DAVIES C. Sequestration of auxin by the indole-3-acetic acid-amido synthetase GH3-1 in grape berry (Vitis vinifera L.) and the proposed role of auxin conjugation during ripening[J]. Journal of Experimental Botany, 2010, 61(13): 3615-3625. DOI:10.1093/jxb/erq174 |
| [56] |
SUN L, YUAN B, ZHANG M, WANG L, CUI M, WANG Q, LENG P. Fruit-specific RNAi-mediated suppression of SlNCED1 increases both lycopene and β-carotene contents in tomato fruit[J]. Journal of Experimental Botany, 2012, 63(8): 3097-3108. DOI:10.1093/jxb/ers026 |
| [57] |
ITKIN M, SEYBOLD H, BREITEL D, ROGACHEV I, MEIR S, AHARONI A. TOMATO AGAMOUS-LIKE 1 is a component of the fruit ripening regulatory network[J]. The Plant Journal, 2009, 60(6): 1081-1095. DOI:10.1111/j.1365-313X.2009.04064.x |
| [58] |
VREBALOV J, PAN I L, ARROYO A J M, MCQUINN R, CHUNG M, POOLE M, ROSE J, SEYMOUR G, GRANDILLO S, GIOVANNONI J. Fleshy fruit expansion and ripening are regulated by the tomato SHATTERPROOF gene TAGL1[J]. The Plant Cell, 2009, 21(10): 3041-3062. DOI:10.1105/tpc.109.0 |
| [59] |
BEMER M, KARLOVA R, BALLESTER A R, TIKUNOV Y M, BOVY A G, WOLTERS-ARTS M, ROSSETTO P D B, ANGENENT G C, DE MAAGD R A. The tomato FRUITFULL homologs TDR4/FUL1 and MBP7/FUL2 regulate ethylene-independent aspects of fruit ripening[J]. The Plant Cell, 2012, 24(11): 4437-4451. DOI:10.2307/23327521 |
| [60] |
FUJISAWA M, SHIMA Y, NAK AGAWA H, K ITAGAWA M, KIMBARA J, NAKANO T, KASUMI T, ITO Y. Transcriptional regulation of fruit ripening by tomato FRUITFULL homologs and associated MADS box proteins[J]. Plant Cell, 2014, 26(1): 89-101. DOI:10.1105/tpc.113.119453 |
| [61] |
HAN K, JANG S, LEE J H, LEE D G, KWON J K, KANG B C. A MYB transcription factor is a candidate to control pungency in Capsicum annuum[J]. Theoretical and Applied Genetics, 2019, 132(4): 1235-1246. DOI:10.1007/s00122-018-03275-z |
| [62] |
PARK M, LEE J H, HAN K, JANG S, KANG B C. A major QTL and candidate genes for capsaicinoid biosynthesis in the pericarp of Capsicum chinense revealed using QTL-seq and RNA-seq[J]. Theoretical and Applied Genetics, 2019, 132(2): 515-529. DOI:10.1007/s00122-018-3238-8 |
| [63] |
MENG Y, ZHANG H, FAN Y, YAN L. Anthocyanins accumulation analysis of correlated genes by metabolome and transcriptome in green and purple peppers (Capsicum annuum)[J]. BMC Plant Biology, 2022, 22(1): 1-11. DOI:10.1186/s12870-022-03746-y |
(责任编辑 张辉玲)
 2024, Vol. 51
2024, Vol. 51