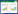文章信息
基金项目
- 广东省乡村振兴战略专项(2023KJ109);广东省农村科技特派员项目(2020)
作者简介
- 黄永丰(1996—),男,在读硕士生,研究方向为植物资源保护与利用,E-mail:1695102415@qq.com.
通讯作者
- 胡位荣(1966—),男,博士,教授,研究方向为果蔬采后生理与贮运技术,E-mail:weironghu@163.com.
文章历史
- 收稿日期:2023-08-31
2. 广东省农业科学院果树研究所/农业农村部南亚热带果树生物学与遗传资源利用重点实验室/广东省热带亚热带果树研究重点实验室,广东 广州 510640;
3. 仲恺农业工程学院园艺园林学院,广东 广州 510225
2. Institute of Fruit Tree Research, Guangdong Academy of Agricultural Sciences/Key Laboratory of South Subtropical Fruit Biology and Genetic Resource Utilization, Ministry of Agriculture and Rural Aff airs/Guangdong Key Laboratory of Tropical and Subtropical Fruit Tree Research, Guangzhou 510640, China;
3. College of Horticulture and Landscape Architecture, Zhongkai University of Agricalture and Engineering, Guangzhou 510225, China
【研究意义】香蕉不仅是国际鲜果贸易量最大的水果,也是全球4亿多人的主食[1],香蕉产业是我国热带、亚热带地区农业支柱产业之一,在国民经济中有着举足轻重的地位。然而由尖孢镰刀菌古巴专化型(Fusarium oxysporum f.sp. cubense,Foc)侵染引起的香蕉枯萎病(banana Fusarium wilt)严重威胁整个香蕉产业的安全和可持续发展,开展香蕉枯萎病菌有效抑菌物质筛选和研究,对防治香蕉枯萎病、促进香蕉产业发展有着重要意义。【前人研究进展】香蕉枯萎病是一种毁灭性真菌病害和典型的土传维管束植物病害。病原菌Foc主要从香蕉根部伤口侵入,通过维管束向假茎上部蔓延,堵塞木质部导管,从而使营养无法正常传输,引起香蕉出现黄叶症状,直至香蕉全株枯死[2]。香蕉枯萎病初侵染源主要来自病株残体和带菌土壤,Foc的厚垣孢子可在土壤中存数十年,该病菌一旦侵染,可能在3~4年内爆发流行,给香蕉产量带来严重损失[3]。根据致病香蕉品种,可将Foc分为4个生理小种(Race),其中热带4号小种(Foc tropical race 4,Foc TR4)是目前致病力最强、侵染香蕉品种数量最多、适应能力最广的香蕉枯萎病菌,已成为全球香蕉产业最主要的威胁[4]。自1996年开始,Foc TR4在我国传播并迅速蔓延,截至2019,Foc TR4在我国所有香蕉主产区均有报道[5],其中广东是华南地区受危害最严重的省份。广东省香蕉产量居全国第一,是我国最大的香蕉主产区,年产量400万t左右,但其香蕉种植区域均发病严重,部分果园发病率甚至超过50%。即使是当地的种植大户,在基础设施相对比较齐全、栽培管理技术相对规范的情况下,香蕉枯萎病在田间仍呈多点散发状[6]。目前,抗耐病品种在香蕉枯萎病的防控中发挥着关键作用,但近年来病原菌生理小种的多样化加速了品种抗病性的丧失;生物防治因其发挥作用所需时间较长、过程较为复杂,在香蕉枯萎病防控中仍处于研发阶段[7];化学防治因其有效、直接的防治方法被广泛应用,国内外学者一直致力于防治香蕉枯萎病化学药剂的研究,但目前防治香蕉枯萎病的理想药剂极少[8]。不断探索作用机制多样、积极有效的防治策略是香蕉枯萎病防治的永久课题。
【本研究切入点】我国的药用植物资源非常丰富,其种类超过1万种,中草药具有杀菌作用明显、食用安全、无化学毒害、无残留、无副作用等优点,为开发天然、安全、高效的植物源农药提供了基础[9]。中草药及其制剂可有效防治植物病害,如黄岑的丙酮提取物对棉花枯萎病原菌的抑制率可达80.4%,青木冬的丙酮提取物对番茄灰霉病菌抑制率达77.3%[10]。川穹、五加皮的乙醇提取液对柑橘白霉、褐腐疫霉的抑制率可达100%,最低抑菌浓度为1 mg/mL[11]。丁香的乙醇提取物对白菜软腐病菌、水稻恶苗病菌、玉米大斑病菌、玉米小斑病菌、水稻纹枯病菌的抑制率均可达100%,其最低抑菌浓度分别为50、6.25、12.5、12.5、6.25 mg/mL[12]。中草药提取物具有开发成绿色生物农药的巨大潜力,虽然中草药提取物或制剂防治植物病害已有较多研究,但在防治香蕉枯萎病方面少有报道。【拟解决的关键问题】本研究针对香蕉枯萎病病原菌,以在我国广泛应用的29种中草药作为参试材料,结合抑菌活性测定,分离检测中草药提取物中的抑菌活性成分,研究其对香蕉枯萎病菌Foc TR4的抑制作用,以期为利用中草药植物提取物抑制香蕉枯萎病菌提供理论依据,为研发防治香蕉枯萎病的植物源新农药提供参考。
1 材料与方法 1.1 供试材料1.1.1 供试中草药植物 试验所用大黄、川穹、苦参等29种中草药均购买自本地中药房,具体材料见表 1。

|
1.1.2 供试菌株 香蕉枯萎病菌:尖孢镰刀菌古巴专化型标准菌株Ⅱ5(Foc TR4, VCG01213/16),由广东省农业科学院果树研究所保存。
1.2 中草药植物提取物的制备及其对Foc TR4抑菌活性初步测定1.2.1 中草药植物提取物的制备 试验于2023年2—7月在广东省农业科学院果树研究所进行,参照蒋瑜[13]的方法将大黄、穿心莲、苦参等29种中草药植物粉碎,过孔径为0.15 mm筛,得到细度均匀的粉末,称取50~80 g粉末,按照料液比1∶9(W/V)加入95% 乙醇,静置60 min,超声(80 W,45 ℃)提取40 min,收集滤液。向残渣中继续加入95% 乙醇,按上述方法重复2次,合并收集的滤液。再用旋转蒸发仪55 ℃旋转浓缩至干燥,得到中草药植物的乙醇提取物并称量,再用95% 乙醇复溶提取物,配制质量浓度为250 mg/mL的母液,密封后4 ℃下保存备用。
1.2.2 提取物对Foc TR4抑菌活性初步测定 参照王彩霞等[14]的方法,采取生长速率法测定中草药提取物对Foc TR4菌丝的抑制效果:将灭菌的30 mL PDA培养基加热融化,冷却至50 ℃,加入720 µL上述母液,混合均匀,制成浓度为6 mg/mL的含药培养基,分别倒入3皿培养皿(直径9 cm)中,待凝固后,于平板中央加入直径7 mm的香蕉枯萎病菌饼。每个处理重复3次,以加入720 µL 95% 乙醇的PDA培养基作为对照(CK),28 ℃恒温培养箱内培养约7 d,待对照菌丝在培养皿中接近满皿的时候,使用十字交叉法测量菌丝的直径(mm),并计算各提取物的抑菌率。

|
1.3.1 对Foc TR4菌丝生长的影响 参照1.2的方法将大黄提取物母液配制成最终浓度10、5、2.5、1.25、0.625 mg/mL的溶液,以95% 乙醇溶液为对照,利用生长速率法测定不同浓度大黄提取物对病原菌Foc TR4的抑制作用,每个处理重复3次。7 d后检查结果并计算抑菌率。
1.3.2 菌丝形态观察 取1.3.1 PDA平板上培养7 d的香蕉枯萎病菌,用牙签挑取菌落边缘少量菌丝于pH 7.4磷酸盐缓冲液中,用移液枪轻轻吹打菌丝至分散,并吸取少量菌液滴加于载玻片上,盖上盖玻片,在光学显微镜下观察菌丝形态。
1.3.3 对Foc TR4孢子萌发的影响 参照张晨等[15]的方法,取20 µL新鲜Foc TR4菌液加入2 mL离心管中,分别加入100 µL稀释1.25、2.5、5、10、20倍的大黄提取液母液,再加入PDB液体培养基至2 mL,配制成含大黄提取物浓度为10、5、2.5、1.25、0.625 mg/mL的混合液,振荡充分混匀后取30 µL混合液涂布于载玻片上,以加入等体积乙醇的混合液作为对照(CK)。取一培养皿,将润湿的滤纸铺垫在培养皿中,再放入涂布好的载玻片,28℃生化培养箱中培养6 h,在显微镜20倍视野下观察并记录视野中的孢子总数和萌发孢子数,每个处理观察10个视野,重复3次,计算孢子萌发率和抑制率。

|
1.4.1 大黄不同极性溶剂萃取物的制备及萃取物抑菌活性测定 参照蒋瑜[13]的方法,将大黄(400 g)用粉碎机粉碎均匀,以料液比1∶9(W/V)加入95% 乙醇,静置30 min,超声(80 W,40 ℃)提取40 min,过滤提取液,剩余残渣按照以上方法重复提取两次,合并3次收集到的滤液,用旋转蒸发仪在55℃下旋转浓缩至棕黑色浸膏,得到大黄的乙醇粗提物。将该粗提物用300 mL蒸馏水充分溶解,依次使用等体积石油醚、氯仿、乙酸乙酯、正丁醇分别萃取3次,收集不同极性溶剂萃取液,减压浓缩至干燥,得到石油醚萃取物、氯仿萃取物、乙酸乙酯萃取物以及正丁醇萃取物,萃取后的水相减压浓缩至干燥得到萃余相浓缩物。
将上述得到的各萃取物用DMSO复溶,制成150 mg/mL的母液,参照1.3,将不同极性溶剂萃取物母液制成最终含药量为5 mg/mL的PDA培养基,利用生长速率法测试不同极性溶剂萃取物对香蕉枯萎病病菌的抑制活性,每个处理重复3次,培养7 d后计算抑菌率。
1.4.2 大黄不同极性溶剂萃取物对Foc TR4孢子萌发的影响 参照1.3.3,将各萃取物制成最终浓度为5 mg/mL的PDB液体培养基,加入20 µL Foc TR4菌液,采用悬滴法测定各萃取物对孢子萌发的影响。
1.4.3 大黄乙酸乙酯萃取物对Foc TR4的抑制作用测定 参照1.3.1将大黄乙酸乙酯萃取物配制成最终浓度10、5、2.5、1.25、0.625 mg/mL,利用生长速率法针对对病原菌进行抑菌活性测定。7 d后检查结果并计算抑菌率。
1.5 数据处理与分析采用SPSS Statistics 17软件及Excel 2010对数据进行处理,用单因素方差分析方法, 并选择Tukey’s多重比较法进行检验分析,用GraphPad Prism 8.0.2计算EC50值。
2 结果与分析 2.1 中草药提取物对Foc TR4的抑菌效果29种中草药植物提取物对香蕉枯萎病病原菌的抑制效果见表 1,当提取物浓度为6 mg/mL时,具有较好抑制作用的有大黄、穿心莲、苦参和野菊花。抑菌率表现为:大黄(48.57%)>穿心莲(14.84%)>苦参(14.29%)>野菊花(13.79%)。而其他25种中草药提取物则未表现出抑制作用(<10%),甚至有的中草药提取物对病原菌菌丝生长表现出促生作用(如荆芥,生姜等)。
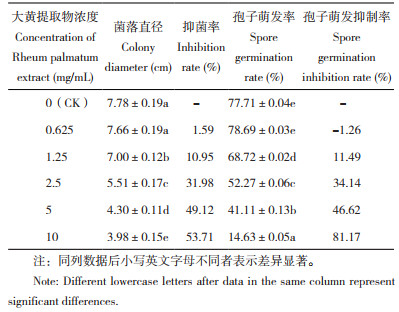
2.2 大黄提取物对Foc TR4菌丝生长和孢子萌发的抑制作用由表 2可知,大黄提取物对Foc TR4菌丝生长具有显著的抑制作用,且抑制率随浓度的升高而增加,10 mg/mL时对菌丝生长抑制率为53.71%;由图 1也可直观看出,随着大黄提取浓度的升高菌丝直径显著变小。经计算大黄提取物对Foc TR4菌丝生长EC50值为6.68 mg/mL。
|
|
| A: 0 mg/mL (CK); B: 0.625 mg/mL; C: 1.25 mg/mL; D: 2.5 mg/mL; E: 5 mg/mL; F: 10 mg/mL 图 1 不同浓度大黄提取物对Foc TR4的抑制效果 Fig. 1 Inhibitory effects of different concentrations of Rheum palmatum extract on Foc TR4 |
大黄提取物对孢子萌发的影响也显示出相同的趋势,随着浓度的升高Foc TR4孢子萌发率逐渐降低,在10 mg/mL时,Foc TR4的孢子萌发抑制率达到了81.17%。经计算,大黄提取物对孢子萌发抑制的EC50值为4.60 mg/mL(图 2)。

|
| A: 0 mg/mL(CK); B: 0.625 mg/mL; C: 1.25 mg/mL; D: 2.5 mg/mL; E: 5 mg/mL; F: 10 mg/mL 图 2 不同浓度大黄提取物对Foc TR4孢子萌发的抑制效果 Fig. 2 Inhibitory effects of different concentrations of Rheum palmatum extract on spore germination of Foc TR4 |
2.3 大黄提取物对Foc TR4菌丝形态的影响
利用光学显微镜观察大黄提取物处理对Foc TR4菌丝形态影响,如图3所示,提取物处理组和对照组菌丝存在显著的形态差异。对照组菌丝生长旺盛,表面光洁,粗细均匀,分枝正常;而处理组菌丝则存在大量的不规则分布的分枝,菌丝生长粗细不均,存在较多的黏连等畸形现象。
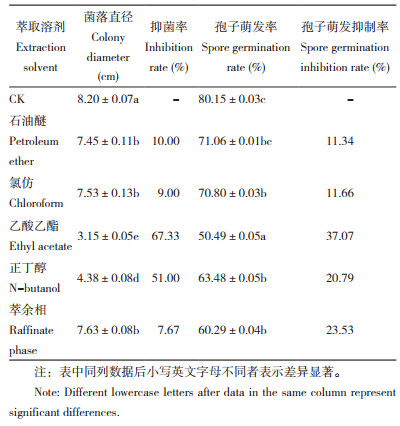
2.4 大黄不同极性溶剂萃取物对Foc TR4菌丝生长和孢子萌发的抑制作用大黄粗提物的不同萃取组分中,乙酸乙酯和正丁醇萃取组分对Foc TR4的抑制作用显著高于石油醚、氯仿和萃余相的萃取组分(表 3)。当浓度为5 mg/mL时,乙酸乙酯萃取组分对Foc TR4的抑菌率为67.33%,正丁醇萃取组分的抑菌率为51%,显著高于其他萃取组分。对Foc TR4孢子萌发抑制效果最佳的也是乙酸乙酯萃取组分,抑制率为37.07%。
|
2.5 乙酸乙酯萃取物对Foc TR4菌丝生长的抑制作用
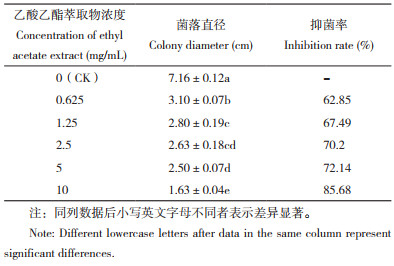
由表 4可知,大黄提取物的乙酸乙酯萃取组分对Foc TR4菌丝生长具有显著的抑制作用,且抑制率随着浓度的升高而升高,浓度为10 mg/mL时,抑制率达到85.68%。经计算,乙酸乙酯对Foc TR4菌丝生长的EC50值为0.16 mg/mL。
|
3 讨论
中草药植物是我国宝贵的植物资源,因其来源于自然界,有着安全、无化学毒害等优点,使中草药植物有着开发成绿色、安全、无公害植物源农药的巨大潜力。本研究筛选了29种中草药植物提取物对香蕉枯萎病菌的抑制效果,发现大黄、穿心莲、苦参和野菊花提取物均可有效抑制香蕉枯萎病菌,其中大黄提取物的抑制效果最佳。大黄是双子叶植物纲蓼科大黄属植物,是我国传统的中药材,具有抗肿瘤、抗菌、抗炎、镇痛、保护器官等作用[16],在医药和农用活性方面均有报道。在医药方面,大黄提取物对大肠杆菌具有抑制作用,最小抑菌浓度为1 000 mg/mL[17]。胡洋等[18]发现,大黄提取物对常见致龋菌中的变形链球菌和粘性放线菌具有较好抑制作用,最小抑菌浓度为5 mg/mL和2.5 mg/mL。在农用方面,谢娜等[19]发现,大黄提取物对魔芋软腐病菌、猕猴桃溃疡病菌具有明显抑制效果,最小抑菌浓度分别为7.8 µg/mL和3.9 µg/mL。蒋晶晶等[20]发现大黄水浸提液对辣椒疫霉病菌、西瓜蔓枯病菌、葡萄灰霉病菌均具有较好的抑制效果。本研究发现大黄提取物对香蕉枯萎病菌的菌丝形态具有一定的破坏作用,使菌丝产生产生大量分叉,菌丝生长不均匀,存在较多的黏连现象等,这为探究大黄提取对香蕉枯萎病菌的抑菌机理提供了基础。另外,虽然大黄提取物在室内测试中显示出了较强的抑菌效果,但其是否在活体试验中也能表现出显著的防治效果,还需要进一步研究证实。考虑到香蕉枯萎病属于土传病害,利用植物源抑菌物质控制该病害的剂型和施用方法需进一步探讨,大黄提取物对其他植物病害是否也具有抑制性,测试其广谱抑菌效果也需要进一步探索。
本研究筛选到具有对香蕉枯萎病菌较好抑菌效果的大黄植物粗提物,并且使用不同极性溶剂对大黄提取物进行了初步的粗分离,得到最有效的萃取组分为乙酸乙酯萃取组分,但对于开发相应的新型农药,试验需要进一步分离有效抑菌成分并明确具体抑菌物质的化学成分。侯媛媛[21]对大黄乙醇提取物的氯仿组分进行分析,发现主要成分分别是大黄素、大黄素、芦荟大黄素、大黄酸、大黄素甲醚和大黄酚,其中大黄素对大肠杆菌、大黄酸对金黄色葡萄球菌抑菌效果最好。研究表明大黄素具有广谱抑菌效果,对金黄色葡萄球菌、无芽孢厌氧菌、幽门螺旋杆菌、白色念珠菌、新型隐球菌、肺炎球菌白喉杆菌、炭痘杆菌、白假丝酵母菌等细菌和真菌都有一定的抑菌效果[22-26]。本研究有待进一步使用柱层析、薄层色谱层析,液相色谱与质谱等方法分离鉴定大黄乙醇提取物乙酸乙酯组分的有效活性成分,研究活性成分对香蕉枯萎病菌的抑制效果,明确其抑菌的作用机理,为开发相应的防治香蕉枯萎病菌的新型植物源农药提供依据。
4 结论本研究初筛的29种中草药提取物中,有4种提取物对香蕉枯萎病菌抑制效果较好,抑菌率表现为:大黄(48.57%)>穿心莲(14.84%)>苦参(14.29%)>野菊花(13.79%);且大黄乙醇提取物对菌丝生长的EC50值为6.68 mg/mL,对孢子萌发抑制的EC50值为4.60 mg/mL。大黄乙醇提取物对香蕉枯萎病菌的菌丝形态有影响,使菌丝产生大量的分叉,菌丝生长不均匀,存在较多的黏连现象。大黄乙醇提取物的各萃取组分中,乙酸乙酯萃取组分对香蕉枯萎病菌菌丝生长和孢子萌发的抑制活性最高,其对香蕉枯萎病菌的EC50值为0.16 mg/mL。
| [1] |
GERT H J K, ANDRÉ D, MIGUEL D, KEES J, SIETZE V, JETSE S. Editorial: Fusarium wilt of banana, a recurring threat to global banana production[J]. Frontiers in Plant Science, 2021, 11: 2177-2181. DOI:10.3389/FPLS.2020.628888 |
| [2] |
MICHALIS O, CONSTANTINA R, FOTIOS B, KALLIOPE P, URANIA M, CONSTANTINOS E, DIMITRIOS K. The impact of biofumigation and chemical fumigation methods on the structure and function of the soil microbial community[J]. Microbial Ecology, 2011, 61(1): 201-213. DOI:10.1007/s00248-010-9740-4 |
| [3] |
PLOETZ C R. Management of Fusarium wilt of banana: A review with special reference to tropical race 4[J]. Crop Protection, 2015, 73: 7-15. DOI:10.1016/j.cropro.2015.01.007 |
| [4] |
RANDY C P. Fusarium wilt of banana is caused by several pathogens referred to as Fusarium oxysporum sp. cubense[J]. Phytopathology, 2006, 96(6): 653-659. DOI:10.1094/PHYTO-96-0653 |
| [5] |
李华平, 李云锋, 聂燕芳. 香蕉枯萎病的发生及防控研究现状[J]. 华南农业大学学报, 2019, 40(5): 128-136. DOI:10.7671/j.issn.1001-411X.201905062 LI H P, LI Y F, NIE Y F. Research status of occurrence and control of Fusarium wilt of banana[J]. Journal of South China Agricultural Universit y, 2019, 40(5): 128-136. DOI:10.7671/j.issn.1001-411X.201905062 |
| [6] |
方伟, 唐诚, 王玉梅. 广东省香蕉产业发展现状、面临瓶颈及对策[J]. 中国果树, 2022(12): 90-93. DOI:10.16626/j.cnki.issn1000-8047.2022.12.020 FANG W, TANG C, WANG Y M. Current situation, bottleneck and countermeasures of banana industry in Guangdong Province[J]. China Fruits, 2022(12): 90-93. DOI:10.16626/j.cnki.issn1000-8047.2022.12.020 |
| [7] |
XINGANG Z, JINGYU Z, KHASHI U, DANMEI G, ZHONG W, FENGZHI W, FRANCISCO D. Interspecific plant interaction via root exudates structures the disease suppressiveness of rhizosphere microbiomes[J]. Molecular Plant, 2023, 16(5): 849-864. DOI:10.1016/J.MOLP.2023.03.009d |
| [8] |
桂莎. 碱性肥料和生防菌制剂防治香蕉枯萎病的效果及机理研究[D]. 广州: 华南农业大学, 2019. DOI: 10.27152/d.cnki.ghanu.2019.000084. GUI S. Effectiveness and mechanism of control of Fusarium wilt disease of banana by application of alkaline fertilizer and biocontrol agents[D]. Guangzhou: South China Agricultural University, 2019. DOI: 10.27152/d.cnki.ghanu.2019.000084. |
| [9] |
赵君微, 杨帅, 袁婧, 杨利国. 诃子提取物对3种致病菌的体外抑菌效果及其机制研究[J]. 华中农业大学学报, 2023, 42(2): 63-70. DOI:10.13300/j.cnki.hnlkxb.2023.02.008 ZHAO J W, YANG S, YUAN J, YANG L G. Study on in vitro bacteriostatic effect and mechanism of Chebula Chebula extract against three pathogenic bacteria[J]. Journal of Huazhong Agricultural University, 2023, 42(2): 63-70. DOI:10.13300/j.cnki.hnlkxb.2023.02.008 |
| [10] |
张应烙, 尹彩萍. 18种中药提取物对植物病原菌的抑制作用[J]. 江西植保, 2010, 33(2): 75-78. DOI:10.3969/j.issn.2095-3704.2010.02.007 ZHANG Y L, YI C P. Fungistasis of extracts from 18 kinds of Chinese herbs against plant pathogens[J]. Biological Disaster Science, 2010, 33(2): 75-78. DOI:10.3969/j.issn.2095-3704.2010.02.007 |
| [11] |
谢晶, 黄闺, 金晨钟. 川芎等中草药提取物对柑橘病原菌的抑制作用[J]. 中国农学通报, 2014, 30(34): 226-231. XIE J, HUANG G, JIN C Z. Application of chuanxiong and other Chinese herbal medicine extracts in restraining cirtus pathogens and cirtus fresh-keeping[J]. Chinese Agricultural Science Bulletin, 2014, 30(34): 226-231. |
| [12] |
闵华, 李青松. 中草药提取物对5种植物病原菌的抑菌活性研究[J]. 安徽农业科学, 2009, 37(21): 10037-10039. DOI:10.13989/j.cnki.0517-6611.2009.21.057 MING H, LI Q S. Research on inhibitory activities of ethanol extracts from Chinese herbal medicine against 5 kinds of phytopathogens[J]. Journal of Anhui Agricultural Sciences, 2009, 37(21): 10037-10039. DOI:10.13989/j.cnki.0517-6611.2009.21.057 |
| [13] |
蒋瑜. 茯苓的抗乳腺癌活性及作用机制的研究[D]. 无锡: 江南大学, 2020. DOI: 10.27169/d.cnki.gwqgu.2020.001039. JIANG Y. Study on the antibreast cancer activity and mechanism of Poria coco[D]. Wuxi: Jiangnan University, 2020. DOI: 10.27169/d.cnki.gwqgu.2020.001039. |
| [14] |
王彩霞, 兰妍彦, 孟衍朴, 王志颖, 封英建, 钟明娟, 马树杰, 张利辉, 董金皋. 87种植物提取物抑菌活性初步研究[J]. 植物保护, 2023, 49(4): 293-301, 308. DOI:10.16688/j.zwbh.2022425 WANG C X, LAN Y Y, MENG Y P, WANG Z Y, FENG Y J, ZHONG M J, MA S J, ZHANG L H, DONG J G. Antifungal activity of extracts from 87 plant species[J]. Plant Protection, 2023, 49(4): 293-301, 308. DOI:10.16688/j.zwbh.2022425 |
| [15] |
张晨, 吕建华, 董婧, 李长田. 蜜环菌发酵液提取物对人参链格孢霉菌的抑制作用[J]. 菌物研究, 2021, 19(3): 177-183. DOI:10.13341/j.jfr.2021.1436 ZHANG C, LYU J H, DONG J, LI C T. The effect of Armillaria mellea fermentation broth extract in inhibiting alternaria panaxin ginseng[J]. Journal of Fungal Research, 2021, 19(3): 177-183. DOI:10.13341/j.jfr.2021.1436 |
| [16] |
张红阳, 李波, 钟国跃, 王洪玲, 朱继孝. 土大黄提取物及其有效成分药理活性研究进展[J]. 中药新药与临床药理, 2018, 29(2): 240-246. DOI:10.19378/j.issn.1003-9783.2018.02.021 ZHANG H Y, LI B, ZHONG G Y, WANG H L, ZHU J X. Advances in pharmacological activities and active constituents of rumex madaio[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2018, 29(2): 240-246. DOI:10.19378/j.issn.1003-9783.2018.02.021 |
| [17] |
摆倩文, 张邵博, 陈士恩, 丁功涛. 三种中草药提取物对大肠杆菌的抑制作用[J]. 西北民族大学学报(自然科学版), 2020, 41(3): 73-78. DOI:10.14084/j.cnki.cn62-1188/n.2020.03.014 BAI Q W, ZHANG S B, CHEN S E, DING G T. Inhibitory effect of Chinese herbal medicine extracts on Escherichia coli[J]. Journal of Northwest Minzu University (Natural Science Edition), 2020, 41(3): 73-78. DOI:10.14084/j.cnki.cn62-1188/n.2020.03.014 |
| [18] |
胡洋, 宇翔, 陶茜, 陶玉玲. 五种中草药提取物对致龋菌的体外抑菌作用研究[J]. 江西医药, 2022, 57(7): 690-691, 700. HU Y, YU X, TAO Q, TAO Y L. Study on in vitro antibacterial effects of five Chinese herbal medicine extracts oncariogenic bacteria[J]. Jiangxi Medical Journal, 2022, 57(7): 690-691, 700. |
| [19] |
谢娜, 李超, 冯俊涛, 张兴. 11种植物提取物对4种病原细菌的抑菌活性筛选[J]. 热带作物学报, 2018, 39(6): 1166-1171. DOI:10.3969/j.issn.1000-2561.2018.06.019 XIE N, LI C, FENG J T, ZAHNG X. Screening of antibacterial activities of 11 plant extracts against four pathogenic bacteria[J]. Chinese Journal of Tropical Crops, 2018, 39(6): 1166-1171. DOI:10.3969/j.issn.1000-2561.2018.06.019 |
| [20] |
蒋晶晶, 彭沛穰, 苏锋锋, 周昭旭, 杜蕙. 中草药水浸提液对5种植物病原真菌的影响[J]. 安徽农业科学, 2020, 48(17): 172-174, 235. JIANG J J, PENG P R, SU F F, ZHOU Z X, DU H. Effect of Chinese herbal medicine water extract on five plant pathogenic fungi[J]. Journal of Anhui Agricultural Sciences, 2020, 48(17): 172-174, 235. |
| [21] |
侯媛媛. 大黄和黄芩抑菌活性物质追踪及其抑菌机理研究[D]. 上海: 上海海洋大学, 2015. HOU Y Y. Chemical compositions of rhubarb and Scutellaria baicalensis and antibacterial mechanism[D]. Shanghai: Shanghai Ocean University, 2015. |
| [22] |
周磊, 云宝仪, 汪业菊, 谢明杰. 大黄素对金黄色葡萄球菌的抑菌作用机制[J]. 中国生物化学与分子生物学报, 2011, 27(12): 1156-1160. DOI:10.13865/j.cnki.cjbmb.2011.12.006 ZHOU L, YUN B Y, WANG Y J, XIE M J. Antibacterial mechanism of emodin on Staphylococcus aureus[J]. Chinese Journal of Biochemistry and Molecular Biology, 2011, 27(12): 1156-1160. DOI:10.13865/j.cnki.cjbmb.2011.12.006 |
| [23] |
YAN W W, WEN Y G, XIAO H X, YI L. Calorimetric investigation of the effect of hydroxyanthraquinones in rheum officinale baill on Staphylococcus aureus growth[J]. Thermochimica Acta, 2005, 429(2): 1005-1008. DOI:10.1016/j.tca.2005.03.008 |
| [24] |
焉鑫. 大黄素与乳酸菌生物表面活性剂干预金黄色葡萄球菌生物被膜形成研究[D]. 哈尔滨: 东北农业大学, 2017. YAN X. Effect of emodin and Lactobacillus biosurfactant against Staphylococcus aureus biofilm in vitro[D]. Harbin: Northeast Agricultural University, 2017. |
| [25] |
HAZRINA H, NORAZLINA A, YUKIO H, KOICHI T, CHEE-YAN C. Phytochemical constituents from Cassia alata with inhibition against methicillin-resistant Staphylococcus aureus (MRSA).[J]. Planta Medica, 2008, 74(15): 1802-1805. DOI:10.1055/s-0028-1088340 |
| [26] |
董波, 夏德薇, 马淑霞. 大黄素对白假丝酵母菌抑菌作用的体外实验研究[J]. 中国微生态学杂志, 2016, 28(6): 681-684. DOI:10.13381/j.cnki.cjm.201606013 DONG B, XIA D W, MA S X. In vitro bacteriostasis of emodin on Candida albicans[J]. Chinese Journal of Microecology, 2016, 28(6): 681-684. DOI:10.13381/j.cnki.cjm.201606013 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51