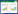文章信息
基金项目
- 国家自然科学基金(32172600,31972420);国家重点研发计划项目(2019YFD1000301)
作者简介
- 董依萍(2000—),女,在读硕士生,研究方向为辣椒遗传改良,E-mail:dong-yiping@webmail.hzau.edu.cn.
通讯作者
- 邓颖天(1986—),女,博士,副研究员,研究方向为茄科蔬菜发育与抗病机制,E-mail:dengyt@mail.hzau.edu.cn.
文章历史
- 收稿日期:2023-12-29
2. 湖南省农业科学院蔬菜研究所,湖南 长沙 410125
2. Vegetable Research Institute, Hunan Academy of Agricultural Sciences, Changsha 410125, China
【研究意义】辣椒(Capsicum annuum L.)作为重要的蔬菜作物,在世界广泛种植。中国是世界上种植辣椒的主要国家[1]。我国气候条件和消费者需求的多样化对辣椒的种质创新提出更高要求[2]。不断发展的基因工程与植物组织培养技术成为加速和实现辣椒遗传改良的有力辅助工具[3]。【前人研究进展】科学家们在水稻[4]、烟草[5]、番茄[6]和大豆[7]等多种植物中顺利开发了遗传转化体系,并创制多个优良品种。尽管辣椒分子育种已取得重要进展[8],但目前辣椒的遗传转化体系仍面临较大困难,主要表现为再生反应的基因型依赖性[9-10]、莲座状芽导致的芽伸长困难[11]。当前,PEG介导的原生质体转化法[12]、基因枪法[13]、病毒介导的基因沉默技术[14]等方法已应用于辣椒的遗传转化研究,但仍存在愈伤组织难分化、芽难伸长和转化不稳定等问题。与上述方法相比,农杆菌介导法成本低、外源基因拷贝数低、外源基因遗传稳定且操作简单[15],因此优化农杆菌介导的辣椒遗传转化体系具有重要意义。Flamingo-bill外植体是一种保留植物一侧子叶和胚根的外植体,由Pozueta-Romero等[16]首创,并将其应用于辣椒和番茄的再生研究。Flamingo-bill外植体保留的子叶和胚根能够产生营养物质和生长激素,保证不定芽的形成,同时,该外植体具有较高的芽诱导分化能力,且不容易形成簇状芽,解决了辣椒茎伸长培养困难这一难题。目前,Flamingobill外植体已应用于多种植物遗传转化试验中。报告基因产生的蛋白(又称指示分子)在基因工程研究中具有广泛应用。将报告基因与目标基因结合,可以实现基因在植物中的定位、定量和可视化,有利于深入了解目的基因的功能和调控机制[17]。植物基因研究中常用的报告基因有荧光素酶(Luc)、β-葡萄糖苷酸酶(GUS)、八氢番茄红素脱氢酶(PDS)和绿色荧光蛋白(GFP)基因等[18]。Luc具有高灵敏性、易检测、半衰期短等优势,但其在植物中活性相对不稳定,且必须将荧光底物引入植物内部,导致植物的生理活动受到不同程度的干扰[19]。GUS与底物反应产生的蓝色沉淀可被直观地观察到,常用于鉴定转基因植株,但不适用于目标基因为控制颜色表达的基因,且检测时对植物材料的破坏使得经GUS检测后的材料不能培养再生[20]。PDS常作为检验病毒诱导的基因沉默载体系统是否有效的报告基因,通过对漂白表型的观察确定转化植株,再用于瞬时表达基因沉默的研究中[21]。GFP具有异常稳定、可活体实时检测、检测方便、无需底物等优点,被誉为最有潜力的报告基因[22]。利用GFP优化农杆菌介导的遗传转化在水稻[23]、黄瓜[24]、柠檬[25]等植物中均有报道。GFP在辣椒的遗传转化中也有应用,杨博智等[26]和Jung等[27]利用GFP荧光检测技术结合抗生素筛选标记,在辣椒子叶外植体转化试验中筛选出成功转化的愈伤组织。
【本研究切入点】农杆菌介导的遗传转化是将目的基因转移到植物中的有效方法,辣椒中的转基因研究也多用此法,但仍无统一且高效的体系。本研究以GFP为报告基因,通过探讨最适外植体,建立再生体系,并进一步筛选农杆菌侵染浓度、侵染时间及预培养和共培养时间,进而优化农杆菌介导的辣椒遗传转化。【拟解决的问题】通过探究辣椒不同外植体的不定芽分化率、不定根分化率和荧光阳性率,寻求最佳的农杆菌侵染处理和外植体培养时间组合,为辣椒遗传转化体系的优化提供参考。
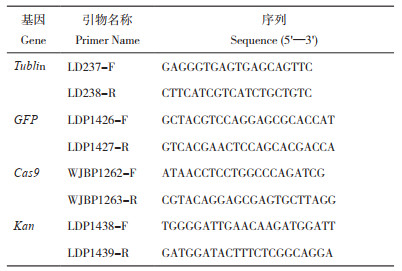
1 材料与方法 1.1 辣椒材料与表达载体辣椒品种‘HP’‘8214’‘L55’和含载体pKSE401-35S-GFP(图 1)的农杆菌菌株均由华中农业大学园艺林学学院辣椒功能基因组团队提供。
|
| 绿色区域为由35S启动子启动表达的GFP基因 Green region indicates the GFP gene drived by 35S promotor 图 1 pKSE401-35S-GFP表达载体图 Fig. 1 Map of pKSE401-35S-GFP expression vector |
1.2 辣椒组织培养培养基
本研究中所使用的辣椒组织培养培养基(表 1)主要参照蔡文[28]的方法,并稍作调整。
1.3 辣椒外植体制备及预培养
将消毒后的辣椒种子接种至无菌苗培养基,待辣椒无菌苗的子叶充分展开、生长点露出后制备外植体。取辣椒幼苗(图 2A),切除子叶尖端和基部,得到子叶外植体(图 2B);切取2~3 cm的下胚轴段(图 2C),得到下胚轴外植体;切除幼苗一边子叶和生长点(图 2D),Flamingo-bill外植体制备完成(图 2E)。将制备完成的外植体转入预培养基中分别培养1~2 d,用于后续试验。
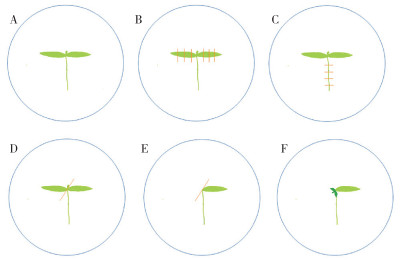
|
| A:辣椒幼苗;B:制备子叶外植体;C:制备下胚轴外植体;D:制备Flamingo-bill外植体;E:制备完成的Flamingo-bill外植体;F:再生芽从Flamingo-bill外植体的伤口处长出 A: Pepper seedlings; B: Preparation of cotyledon explant; C: Preparation of hypocotyl explant; D: Preparation of Flamingo-bill explant; E: Prepared Flamingo-bill explant; F: Regenerated buds growing from the wound of the Flamingo-bill explant 图 2 子叶、下胚轴及Flamingo-bill外植体制备和再生示意图 Fig. 2 Schematic diagram of preparation and regeneration of cotyledons, hypocotyls and Flamingo-bill explants |
1.4 农杆菌活化
在含Kan(Kanamycin,卡那霉素)50 mg/L、Rif(Rifampicin,利福平)10 mg/L的LB固体培养基上划线接种转化有pKSE401-35S-GFP载体的农杆菌株,28 ℃恒温培养2 d,获得农杆菌单菌落,4 ℃保存备用。
1.5 外植体与农杆菌共培养将农杆菌单菌落挑入4~6 mL LB液体培养基(含Kan 50 mg/L、Rif 10 mg/L)中,28 ℃振荡培养12~18 h。再转入100 mL上述LB液体培养基中培养6~8 h,4 000 r/min离心10 min,弃上清。用0.2倍MS液体培养基将菌液分别稀释至浓度为OD600=0.5、OD600=0.05。再将外植体浸入稀释后的菌液中,分别侵染10、30 min。用无菌滤纸吸干菌液,转入共培养培养基中分别避光培养1、2、3 d。将共培养后的外植体转入筛选及再生培养基进行培养。
1.6 GFP蛋白荧光检测将不定芽、不定根和愈伤组织放至荧光显微镜(OLYMPUS,SZX7)下检测GFP荧光,并拍照记录。
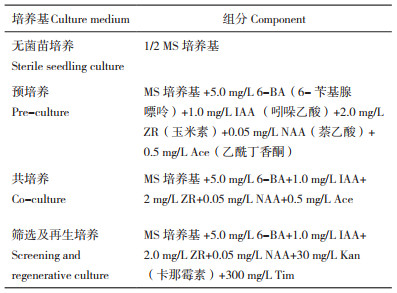
1.7 转基因辣椒PCR检测采用TPS法[29]提取表达GFP荧光的辣椒外植体DNA用于PCR检测,使用Snapgene设计引物,并由昆泰锐生物技术有限责任公司合成。PCR反应体系:DNA模板1.0 µL,上下游引物各1.0 µL,2×Taq Mix 7.5 µL,ddH2O 4.5 µL。反应程序:94 ℃ 3 min;94 ℃ 30 s、55 ℃ 30 s,72 ℃ 1 min,35次循环;72 ℃ 5 min。Tublin内参基因、Kan抗性基因、GFP基因和Cas9基因检测引物序列见表 2。

|
1.8 数据统计与分析
利用EXCEL 2019进行方差分析。采用最小显著差数法(LSD)和新复极差法(SSR)进行多重比较。
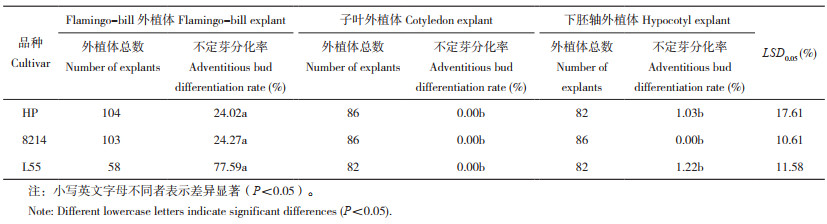
2 结果与分析 2.1 不同品种辣椒外植体的不定芽、不定根分化率及荧光阳性率比较对‘HP’‘8214’‘L55’3个辣椒品种的3种外植体进行无菌培养,并比较其不定芽分化率。由表 3可知,‘HP’‘8214’‘L55’ Flamingo-bill外植体的不定芽分化率均显著高于下胚轴与子叶外植体;3个品种的子叶外植体均未分化出不定芽。表明Flamingo-bill外植体的不定芽诱导能力高于下胚轴和子叶外植体。其中,‘L55’ Flamingo-bill外植体的不定芽分化率最高、达77.59%,因此选用‘L55’进行后续试验。
|
进一步观察与统计‘L55’的3种外植体数据(表 4、图 3),发现利用Flamingo-bill外植体和下胚轴外植体进行转化均得到了不定芽与不定根(图 3A、B、C、E、F、G),而利用子叶作为外植体转化只得到愈伤组织,未分化成不定芽或不定根(图 3I)。其中,Flamingo-bill外植体的不定根分化率显著高于子叶和下胚轴外植体,且下胚轴与子叶之间的不定根分化率差异不显著。

|

|
| A~D:Flamingo-bill外植体筛选培养、不定芽、不定根、荧光观察图;E~H:下胚轴外植体筛选培养、不定芽、不定根、荧光观察图;I、J:子叶外植体筛选培养、荧光观察图 A~D: Images of Flamingo-bill explant screening culture, adventitious buds, adventitious roots and fluorescence observation; E~H: Images of hypocotyl explants screening culture, adventitious buds, adventitious roots and fluorescence observation; I, J: Images of cotyledon explants screening culture and fluorescence observation 图 3 ‘L55’ 3种外植体筛选培养和荧光观察图 Fig. 3 Observation images of 3 different'L55' explants |
在3种外植体脱分化形成的全能性愈伤组织中均能观察到绿色荧光(图 3D、H、J),子叶和下胚轴外植体的荧光阳性率均为1.22%,低于Flamingo-bill外植体的荧光阳性率(5.17%),表明‘L55’3种外植体均具有转化农杆菌介导的表达载体的能力,其中Flamingo-bill外植体的再分化与遗传转化能力最强。
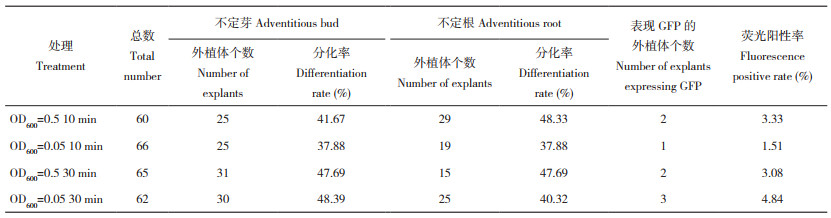
2.2 不同农杆菌侵染浓度与时间下‘L55’ Flamingo-bill外植体不定芽、不定根分化率及荧光阳性率比较对‘L55’Flamingo-bill外植体预处理和共培养1 d后,进行农杆菌不同侵染浓度与时间的组合筛选,发现4个处理条件下的Flamingo-bill外植体均可产生不定芽(图 4A、D、G、J)和不定根(图 4B、E、H、K)。然而在所产生的不定芽中均未观察到GFP绿色荧光,仅在农杆菌处理10 min后的愈伤组织和不定根(图 4C、F)中,以及处理30 min后的愈伤组织中(图 4I、L)观察到绿色荧光,其中,使用浓度为OD600=0.05的农杆菌侵染外植体30 min后产生的不定芽分化率和荧光阳性率最高、分别为48.39%、4.84%(表 5)。综上,‘L55’Flamingo-bill外植体在农杆菌不同侵染浓度和时间的4种组合处理下,均可产生表达GFP的脱分化组织,然而再分化形成的不定芽却未能成功表达转化的目的蛋白GFP。

|
| A、D、G、J:不定芽;B、E、H,K:不定根;C、F、I、L:荧光观察图 A, D, G, J: Adventitious buds; B, E, H, K: Adventitious roots; C, F, I, L : Fluorescence observations 图 4 不同侵染条件下‘L55’ Flamingo-bill外植体分化率及荧光阳性率情况 Fig. 4 Differentiation rate and fluorescence positive rate of'L55' Flamingo-bill explants under different infection condition |
|
2.3 不同预培养和共培养时间下‘L55’ Flamingobill外植体不定芽、不定根分化率及荧光阳性率比较
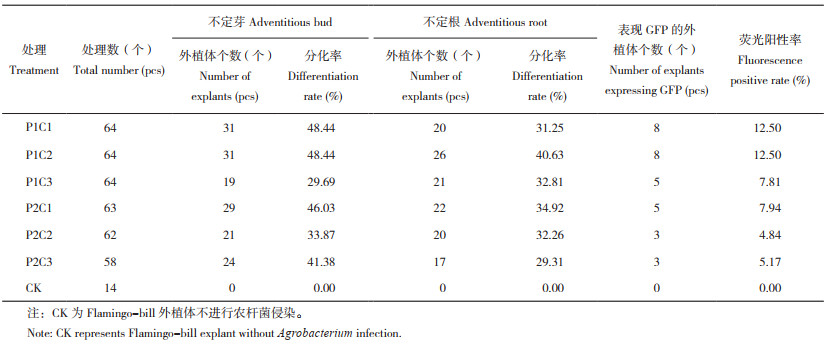
将‘L55’Flamingo-bill外植体在浓度为OD600=0.05的农杆菌中侵染30 min后,进一步比较不同预培养与共培养时间的组合条件下Flamingo-bill外植体的再生能力及转化效率(图 5),发现6种组合处理能产生不定芽(图 5A、D、G、J、M、P)、不定根(图 5B、E、H、K、N、Q)。然而在不定芽中均未观察到GFP绿色荧光,仅在不定根中观察到绿色荧光(图 5C、F、I、O、R)。且共培养时间相同时,预培养1 d的荧光阳性率和不定芽分化率均高于预培养2 d;预培养1 d共培养2 d(P1C2)条件下的不定芽、不定根分化率、荧光阳性率均最高、分别为48.44%、40.63%和12.50%(表 6)。

|
| “P”表示预培养,“C”表示共培养 "P" represents pre-culture, "C" represents co-culture 图 5 不同培养条件下‘L55’ Flamingo-bill外植体分化率及荧光阳性率情况 Fig. 5 Differentiation rate and fluorescence positive rate of 'L55' Flamingo-bill explants under different culture condition |
|
2.4 辣椒GFP发光外植体的PCR检测
从上述具有GFP荧光的外植体中随机挑选5个外植体(图 6A~J)进行PCR检测。由图 6K可知,各外植体Tublin内参基因表达均一,表明样品DNA提取成功。同时,GFP、Kan和Cas9基因在5个荧光阳性组织中均有信号,表明农杆菌介导的T-DNA插入成功,并发生稳定的转化。
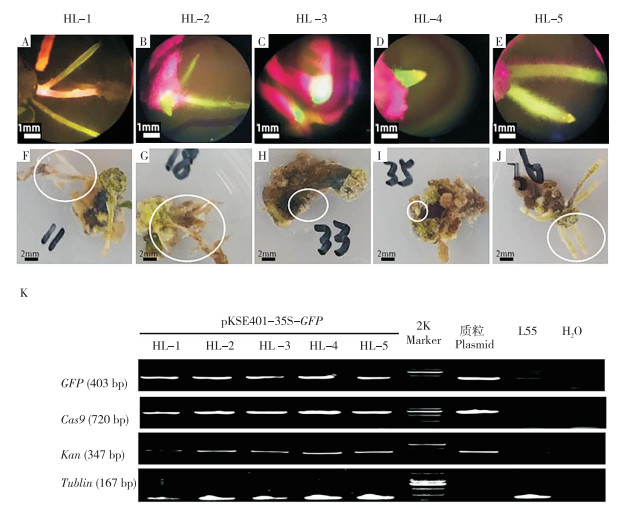
|
| HL-1~HL-5为随机挑选的5个表达GFP荧光的外植体;A~E:HL-1~HL-5荧光检测结果;F~J:HL-1~HL-5外植体;K:PCR检测结果;圆圈表示取样部位 HL-1-HL-5: Five randomly selected explants expressing GFP fluorescence.A-E: HL-1-HL-5 GFP fluorescence test results; F-J: HL-1-HL-5 explants; K: PCR test results; The circle indicates the position where corresponding fluorescence occurs 图 6 表达GFP荧光的外植体阳性检测结果 Fig. 6 Positive test results for explants expressing GFP fluorescence |
3 讨论
辣椒愈伤组织不定芽的诱导及芽点的伸长一直是辣椒遗传转化中的难点。在依赖农杆菌介导的辣椒遗传转化研究中,学者们分别利用下胚轴[30]、子叶[31]、带柄子叶[32]、子叶节[33]、茎尖[34]、花药[35]、胚轴的近端部分和胚根[36]、愈伤组织[37]等外植体,在不同的辣椒品种中进行遗传转化,然而对于最佳再生材料无统一定论。但研究发现,辣椒Flamingo-bill外植体的不定芽分化率显著高于子叶、带柄子叶和下胚轴[28],且芽伸长率也优于子叶、带柄子叶、带柄真叶3种外植体[38],这与本研究结果相似。本研究中,与子叶、下胚轴外植体相比,Flamingo-bill外植体的再生能力最佳。而Flamingo-bill外植体再生的不定芽均未表达GFP,表明Flamingo-bill外植体较易产生假阳性不定芽,也同时证明本研究所用GFP荧光指示可在遗传转化早期快速判断转化成功与否,从而减少工作量。
在遗传转化培养过程中,农杆菌侵染浓度与时间是影响转化效果的重要因素。侵染时间过长可能导致后期农杆菌残留且难以控制,引起植株死亡,侵染时间过短则会降低转化效率。本研究发现,辣椒‘L55’Flamingo-bill外植体的较佳农杆菌侵染浓度为OD600=0.05、侵染时间30 min。此外,预培养过程也可减轻农杆菌感染过程中对外植体的应激损伤,并促进细胞分裂,使其处于对农杆菌更加敏感的活化状态,易于农杆菌吸附,从而提高外植体的转化效率[39]。合适的共培养时间既有助于防止农杆菌过度生长而导致外植体严重褐化、死亡,也可避免因农杆菌侵染不充分而导致转化效率降低。本研究中,辣椒‘L55’Flamingo-bill外植体预培养1 d的荧光阳性率显著高于预培养2 d,这可能是由于预培养1 d的Flamingo-bill外植体切口处细胞活力比预培养2 d的更强、更易侵染。因此,预培养1 d共培养2 d更有利于辣椒Flamingo-bill外植体的遗传转化。
在植物遗传转化过程当中,GFP可用于定性检测目的基因是否成功导入。由于其可活体鉴定且操作简单,常被用于外植体发育早期的鉴定。在对黄瓜[24]和柠檬[25]进行遗传转化研究时,利用GFP作为报告基因对早期外植体脱分化形成的愈伤组织和继续分化产生的不定芽进行鉴定,GFP的表达情况可准确展示转化结果。本研究中,GFP在愈伤组织、不定根中均有指示;经PCR检测,目标基因阳性结果与GFP荧光检测结果相符,进一步表明GFP基因在辣椒遗传转化中作为报告基因的准确性,可在辣椒转化早期判断转化是否成功。
4 结论本研究以GFP为报告基因对农杆菌介导的辣椒遗传转化体系进行优化。通过对3个品种的不同外植体、农杆菌不同侵染浓度、侵染时间、预培养和共培养时间进行比较探究,发现辣椒品种‘L55’Flaming-bill外植体的再生能力最佳,其不定芽分化率达77.59%;Flamingbill外植体在浓度为OD600=0.05的农杆菌侵染液中侵染30 min的处理效果最佳,其不定芽分化率和荧光阳性率分别为48.39%和4.84%;同时,当Flaming-bill外植体在预培养1 d共培养2 d,其不定芽、不定根分化率最高(48.44%、40.63%),荧光阳性率为12.50%;最终表达GFP荧光的外植体经PCR验证显示T-DNA插入成功,与GFP荧光表达情况一致。
| [1] |
林巧, 辛竹琳, 孔令博, 杨小薇, 何微. 我国辣椒产业发展现状及育种应对措施[J]. 中国农业大学学报, 2023, 28(5): 82-95. DOI:10.11841/j.issn.1007-4333.2023.05.08 LIN Q, XIN Z L, KONG L B, YANG X W, HE W. Current situation of pepper industry development and breeding countermeasures in China[J]. Journal of China Agriculural University, 2023, 28(5): 82-95. DOI:10.11841/j.issn.1007-4333.2023.05.08 |
| [2] |
刘超. 中国加工辣椒产业现状及发展前景分析[J]. 食品安全导刊, 2018(21): 55. DOI:10.16043/j.cnki.cfs.2018.21.045 LIU C. Present situation and development prospect of chili pepper processing industry in China[J]. China Food Safety Magazine, 2018(21): 55. DOI:10.16043/j.cnki.cfs.2018.21.045 |
| [3] |
OCHOA-ALEJO N, RAMIREZ-MALAGON R. In vitro chili pepper biotechnology[J]. In Vitro Cellular & Developmental Biology, Plant, 2001, 37(6): 701-729. DOI:10.1007/s11627-001-0121-z |
| [4] |
王诗雨, 蒋莹莹, 徐恒, 朱英, 张华. 从水稻再生的研究进展看籼稻遗传转化的未来[J]. 植物生理学报, 2021, 57(11): 2069-2076. DOI:10.13592/j.cnki.ppj.2021.0123 WANG S Y, JIANG Y Y, XU H, ZHU Y, ZHANG H. The future of genetic transformation of indica rice: Perspectives from the research progress of rice regeneration[J]. Plant Physiology Journal, 2021, 57(11): 2069-2076. DOI:10.13592/j.cnki.ppj.2021.0123 |
| [5] |
陈永涛, 金吉林, 张兴无, 李兴忠, 罗会. 转基因烟草的研究进展[J]. 甘肃农业科技, 2015(10): 62-66. DOI:10.3969/j.issn.1001-1463.2015.10.023 CHEN Y T, JIN J L, ZHANG X W, LI X Z, LUO H. Research prog ress of t ra nsgenic tobacco[J]. Gan su Ag r ic ult ural Science and Technolog y, 2015(10): 62-66. DOI:10.3969/j.issn.1001-1463.2015.10.023 |
| [6] |
GERSZBERG A, HNATUSZKO-KONKA K, KOWALCZYK T, Andrzej K K. Tomato (Solanum lycopersicum L.) in the service of biotechnology[J]. Plant Cell, Tissue and Organ Culture, 2015, 120(3): 881-902. DOI:10.1007/s11240-014-0664-4 |
| [7] |
王立平, 何展泳, 年海, 王宏杰, 马启彬. 大豆遗传转化方法及再生体系研究进展[J]. 广东农业科学, 2020, 47(3): 16-27. DOI:10.16768/j.issn.1004-874X.2020.03.003 WANG L P, HE Z Y, NIAN H, WANG H J, MA Q B. Research progress in genetic transformation and regeneration system of soybean[J]. Guangdong Agricultural Sciences, 2020, 47(3): 16-27. DOI:10.16768/j.issn.1004-874X.2020.03.003 |
| [8] |
雷建军, 朱张生, 陈长明, 曹必好, 陈国菊, 郑婕, 吴昊, 肖艳辉, 蒋园园, 原远, 廖毅, 宋佳丽. 辣椒分子育种研究进展[J]. 西南大学学报(自然科学版), 2023, 45(7): 1-20, 247. DOI:10.13718/j.cnki.xdzk.2023.07.001 LEI J J, ZHU Z S, CHEN C M, CAO B H, CHEN G J, ZHENG J, WU H, XIAO Y H, JIANG Y Y, YUAN Y, LIAO Y, SONG J L. Progress on molecular breeding of pepper[J]. Journal of Southwest University(Natural Science Edition), 2023, 45(7): 1-20, 247. DOI:10.13718/j.cnki.xdzk.2023.07.001 |
| [9] |
MARTÍNEZ-LÓPEZ M, GARCÍA-PÉREZ A, GIMENO-PÁEZ E, PROHENS J, VILANOVA S, GARCÍA-FORTEA E. Screening of suitable plant regeneration protocols for several Capsicum spp.through direct organogenesis[J]. Horticulturae, 2021, 7(9): 261. DOI:10.3390/horticulturae7090261 |
| [10] |
ASHWANI S, RAVISHANKAR G A, GIRIDHAR P. Silver nitrate and 2-(N-morpholine) ethane sulphonic acid in culture medium promotes rapid shoot regeneration from the proximal zone of the leaf of Capsicum frutescens Mill[J]. Plant Cell Tissue and Organ Culture, 2017, 129: 175-180. DOI:10.1007/s11240-016-1157-4 |
| [11] |
KOTHARI S L, JOSHI A, KACHHWAHA S, OCHOA-ALEJO N. Chilli pepper: A review on tissue culture and transgenesis[J]. Biotechnology Advances, 2010, 28(1): 35-48. DOI:10.1016/j.biotechadv.2009.08.005 |
| [12] |
JEON J M, AHN N Y, SON B H, KIM C Y, HAN C, KIM G, GAL SW, LEE S. Efficient transient expression and transformation of PEGmediated gene uptake into mesophyll protoplasts of pepper (Capsicum annuum L.)[J]. Plant Cell, Tissue and Organ Culture, 2007, 88(2): 225-232. DOI:10.1007/s11240-006-9194-z |
| [13] |
BRITO-SÁNCHEZ S C, ZARAGOZA-PÉREZ F A, OLIVERAFLORES T D J, RIVERO-CRUZ J F, AMACOSTA J, GUTIÉRREZLUNA F M, VALENCIA-TURCOTTE L G, RODRÍGUEZ-SOTRES R. Biolistics transformation of callus and cell suspension cultures of Capsicum annuum L.'Serrano' is useful for in vitro studies of the relative contents of secondary metabolites[J]. Acta Agrobotanica, 2019, 72(4): 1792. DOI:10.5586/aa.1792 |
| [14] |
ZHOU Y J, DENG Y T, LIU D, WANG H Z, ZHANG X, LIU T T, WANG J B, LI Y, OU L J, LIU F, ZOU X X, OUYANG B, LI F. Promoting virus-induced gene silencing of pepper genes by a heterologous viral silencing suppressor[J]. Plant Biotechnology Journal, 2021, 19(12): 2398-2400. DOI:10.1111/pbi.13724 |
| [15] |
何丽云, 张树林, 崔百元, 朱庆锋, 刘圣杰, 刘文华. 根癌农杆菌介导的遗传转化及其在稻瘟病菌中的应用[J]. 广东农业科学, 2019, 46(3): 93-100. DOI:10.16768/j.issn.1004-874X.2019.03.014 HE L Y, ZHANG S L, CUI B Y, ZHU Q F, LIU S J, LIU W H. Application of Agrobacterium tumefaciens-mediated transformation in magnaporthe oryzae[J]. Guangdong Agricultural Sciences, 2019, 46(3): 93-100. DOI:10.16768/j.issn.1004-874X.2019.03.014 |
| [16] |
POZUETA-ROMERO J, HOULNÉG, CAÑAS L, SCHANTZ R, CHAMARRO J. Enhanced regeneration of tomato and pepper seedling explants for Agrobacterium-mediated transformation[J]. Plant Cell, Tissue and Organ Culture, 2001, 67(2): 173-180. DOI:10.1023/a:1011997926381 |
| [17] |
CHEN S, TAO L, ZENG L, VEGA-SANCHEZ M E, UMEMURA K. A highly efficient transient protoplast system for analyzing defence gene expression and protein-protein interactions in rice[J]. Molecular Plant Pathology, 2006, 7(5): 417-427. DOI:10.1111/j.1364-3703.2006.00346.x |
| [18] |
张衡. 农杆菌介导的中国石竹基因瞬时过表达体系建立及验证[D]. 呼和浩特: 内蒙古农业大学, 2022. DOI: 10.27229/d.cnki.gnmnu.2022.000350. ZHANG H. Establishment and validation of Agrobacterium-mediated gene transient overexpression system in dianthus chinensis[D]. Huhehaote: Inner Mongolia Agricultural University, 2022. DOI: 10.27229/d.cnki.gnmnu.2022.000350. |
| [19] |
ZIEMIENOWICZ A. Plant selectable markers and reporter genes[J]. Acta Physiologiae Plantarum, 2001, 23(3): 363-374. DOI:10.1007/s11738-001-0045-6 |
| [20] |
JEFFERSON R A, KAVANAGH T A, BEVAN M W. GUS fusions: Beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J]. The EMBO Journal, 1987, 6(13): 3901-3907. DOI:10.1002/j.1460-2075.1987.tb02730.x |
| [21] |
CHEN J C, JIANG C Z, GOOKIN T, HUNTER D, CLARK D, REID M. Chalcone synthase as a reporter in virus-induced gene silencing studies of flower senescence[J]. Plant Molecular Biology, 2004, 55(4): 521-530. DOI:10.1007/s11103-004-0590-7 |
| [22] |
SWENSON E S, PRICE J G, BRAZELTON T, KRAUSE D S. Limitations of green fluorescent protein as a cell lineage marker[J]. Stem Cells, 2007, 25(10): 2593-2600. DOI:10.1634/stemcells.2007-0241 |
| [23] |
唐甜甜, 李浩, 段永波, 李莉, 陆徐忠, 梁永亚, 杨剑波. 利用gfp报告基因优化农杆菌介导的水稻遗传转化[J]. 生物学杂志, 2012, 29(1): 88-91. DOI:10.3969/j.issn.2095-1736.2012.01.088 TANG T T, LI H, DUAN Y B, LI L, LU X Z, LIANG Y Y, YANG J B. Improvement of Agrobacterium-mediated genetic transformation of rice using gfp as a reporter gene[J]. Journal of Biology, 2012, 29(1): 88-91. DOI:10.3969/j.issn.2095-1736.2012.01.088 |
| [24] |
冯路路. 农杆菌介导的黄瓜遗传转化体系优化及T-DNA插入突变体的创制与鉴定[D]. 南京: 南京农业大学, 2020. DOI: 10.27244/d.cnki.gnjnu.2020.001067. FENG L L. Optimization of cucumber genetic transformation system mediated by Agrobacterium and creation and identification of T-DNA insertion mutants[D]. Nanjing: Nanjing Agricultural University, 2020. DOI: 10.27244/d.cnki.gnjnu.2020.001067. |
| [25] |
杨阳. 绿色荧光蛋白基因转化早花柠檬创制新种质[D]. 武汉: 华中农业大学, 2017. YANG Y. Production of transgenic early flowering lemon new germplasm with GFP gene[D]. Wuhan: Huazhong Agricultural University, 2017. |
| [26] |
杨博智, 宋钰, 童辉, 肖佳林, 黄湖荣, 周书栋, 邹学校. 辣椒子叶外植体高效离体再生及抗性愈伤组织诱导[J]. 植物生理学报, 2022, 58(4): 788-796. DOI:10.13592/j.cnki.ppj.2021.0382 YANG B Z, SONG Y, TONG H, XIAO J L, HUANG H R, ZHOU S D, ZOU X X. High-frequency regeneration from cotyledon explants and optimized resistant callus formation of chili pepper[J]. Plant Physiology Journal, 2022, 58(4): 788-796. DOI:10.13592/j.cnki.ppj.2021.0382 |
| [27] |
JUNG M, SHIN S H, PARK J M, LEE S N, LEE M Y, RYU K H, PAEK K Y, HARN C H. Detection of transgene in early developmental stage by GFP monitoring enhances the efficiency of genetic transformation of pepper[J]. Plant Biotechnology Reports, 2011, 5(2): 157-167. DOI:10.1007/s11816-011-0168-1 |
| [28] |
蔡文. Cap1基因转化辣椒的研究[D]. 广州: 华南农业大学, 2018. CAI W. Study on transformation of pepper with Cap1 gene by the Agrobacterium-mediated methods[D]. Guangzhou: South China Agricultural University, 2018. |
| [29] |
穆春华, 张发军, 李文才, 孙琦, 丁照华, 王磊, 孟昭东. 玉米叶片基因组快速提取方法研究[J]. 玉米科学, 2010, 18(3): 170-172. DOI:10.13597/j.cnki.maize.science.2010.03.005 MU C H, ZHANG F J, LI W C, SUN Q, DING Z H, WANG L, MENG Z D. A method of genomic DNA extraction of maize[J]. Journal of Maize Sciences, 2010, 18(3): 170-172. DOI:10.13597/j.cnki.maize.science.2010.03.005 |
| [30] |
BORYCHOWSKI A, NIEMIROWICZ-SZCZYTT K, JĘDRASZKO M. Plant regeneration from sweet pepper(Capsicum annuum L.)hypocotyl explants[J]. Acta Physiologiae Plantarum, 2002, 24(3): 257-264. DOI:10.1007/s11738-002-0049-x |
| [31] |
WON K H, PARK S, CHOI J, KIM H, KANG B C, KIM H. A reliable regeneration method in genome-editable bell pepper'Dempsey'[J]. Horticulturae, 2021, 7(9): 317. DOI:10.3390/horticulturae7090317 |
| [32] |
高玉尧, 许文天, 黄皓, 陈长明, 曹必好, 陈国菊, 刘实忠, 雷建军. 双价表达载体转化辣椒的体系优化[J]. 广东农业科学, 2014, 41(13): 132-135. DOI:10.16768/j.issn.1004-874X.2014.13.026 GAO Y Y, XU W T, HUANG H, CHEN C M, CAO B H, CHEN G J, LIU S Z, LEI J J. Transformation system optimization of binary expression vector with resistance to virus and insect on pepper[J]. Guangdong Agricultural Sciences, 2014, 41(13): 132-135. DOI:10.16768/j.issn.1004-874X.2014.13.026 |
| [33] |
GATZ A. Histological changes during the adventitious shoot formation in seedling explants of pepper(Capsicum annuum L.)cultured in vitro[J]. Acta Societatis Botanicorum Poloniae, 2014, 71(4): 269-274. DOI:10.5586/asbp.2002.031 |
| [34] |
PEDDABOINA V, THAMIDALA C, KARAMPURI S. In vitro shoot multiplication and plant regeneration in four Capsicum species using thidiazuron[J]. Scientia Horticulturae, 2006, 107(2): 117-122. DOI:10.1016/j.scienta.2005.06.010 |
| [35] |
KIM Y S, KUK Y I, KIM K M. Inheritance and expression of transgenes through anther culture of transgenic hot pepper[J]. Journal of Biosciences, 2007, 62(9/10): 743-746. DOI:10.1515/znc-2007-9-1018 |
| [36] |
KIM S, KIM S R, AN C S, HONG Y N, LEE K W. Constitutive expression of rice MADS box gene using seed explants in hot pepper(Capsicum annuum L.)[J]. Molecules and Cells, 2001, 12(2): 221-226. DOI:10.1016/S1388-1981(01)00164-0 |
| [37] |
LEE Y H, KIM H S, KIM J Y, JUNG M, PARK Y S. A new selection method for pepper transformation: Callus-mediated shoot formation[J]. Plant Cell Reports, 2004, 23(1/2): 50-58. DOI:10.1007/s00299-004-0791-1.DOI:10.1007/s00299-004-0791-1 |
| [38] |
张会敏, 谢玲, 胡碧波, 杨蕙铭, 陈保善. 天等1号辣椒遗传转化再生体系的研究[J]. 广西农业科学, 2007, 38(1): 16-20. DOI:10.3969/j.issn.2095-1191.2007.01.004 ZHANG H M, XIE L, HU B B, YANG H M, CHEN B S. Study on genetic regeneration and transformation of pepper variety Tiandeng No.1[J]. Guangxi Agricultural Sciences, 2007, 38(1): 16-20. DOI:10.3969/j.issn.2095-1191.2007.01.004 |
| [39] |
朱英, 刘永翔, 黄永会, 邱礽, 刘作易. 根癌农杆菌介导转化马铃薯研究[J]. 种子, 2013, 32(8): 42-44. DOI:10.16590/j.cnki.1001-4705.2013.08.057 ZHU Y, LIU Y X, HUANG Y H, QIU R, LIU Z Y. Research of genetic transformation mediated by Agrobacterium tumefaciens on pot ato[J]. S eed, 2013, 32(8): 42-44. DOI:10.16590/j.cnki.1001-4705.2013.08.057 |
(责任编辑 陈丽娥)
 2024, Vol. 51
2024, Vol. 51