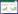文章信息
基金项目
- 广东省现代产业园项目;德庆县科学技术局资助项目(B72020173)
作者简介
- 何磊(1998—),男,在读硕士生,研究方向为作物生理与分子生物学,E-mail:473775200@qq.com.
通讯作者
- 张伟丽(1969—),女,博士,教授,研究方向为植物逆境生理与分子生物学、植物抗病分子机理,E-mail:zhangweili7218@163.com.
文章历史
- 收稿日期:2023-09-25
2. 仲恺农业工程学院教学科研基地管理中心,广东 广州 510225;
3. 德庆仲恺农业产业科技创新研究有限公司,广东 肇庆 526642
2. Management Center of Teaching and Research Base, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China;
3. Deqing Zhongkai Agricultural Tech. Innovation Research Co., Ltd., Zhaoqing 526642, China
【研究意义】巴戟天(Morinda officinalis How.)为茜草科巴戟天属,是我国“四大南药”之一[1-2]。它是生长于热带湿地雨的林藤本植物,喜好温暖湿润的气候,当年平均气温22 ℃ ~ 24 ℃、相对湿度89%以上、苗期的荫蔽度30%、平均年降雨量1 500~2 000 mm时,其在排水量好的沙质土壤生长最适[3]。在我国,巴戟天主要生长在南方沿海地区,主产区位于广东,种植面积占全国90%左右,产量占全国总产量的85%左右[4]。
巴戟天含有丰富的微量元素、多糖、寡糖、蒽醌类和环烯醚萜等物质。多糖具有调节免疫、抗衰老、抗病毒、抗炎症作用[5],其中耐斯糖是从巴戟天的根部提取精炼而成,是其抗抑郁疗效的主要单体成分,被认为是评估巴戟天质量的重要成分,也是药典中衡量巴戟天药效成分的唯一指标,随着耐斯糖含量增加,巴戟天浸出物的含量也会增加,其药用价值也随之提升。从巴戟天根中分离出来的蒽醌类药物有泻下、消炎、抗肿瘤、利尿等多种功效,还可能预防和治疗以过度骨吸收为特征的骨疾病[6];环烯醚萜类药物有抗菌、预防细胞染色体诱变和肿瘤形成的作用。巴戟天中Mn、Fe、Zn、Pb等微量元素含量较高,Mn可预防软骨生成损害,因此巴戟天可用于强筋健骨[7]。研究适用巴戟天的分子标记方法,不仅可对巴戟天种质资源进行快速鉴定评价,也可为巴戟天的选育提供参考。
【前人研究进展】目前,分子标记辅助选择育种是育种过程的重要方法,其可直接反映材料DNA水平的遗传多态性,由PCR介导的DNA标记已成为植物基因组分析中常用的方法[8-9]。相关序列扩增多态性(Sequence-related amplified polymorphism,SRAP)和保守DNA序列多态性(Conserved DNA-dervied polymorphism,CDDP)两种分子标记因其独特的优势而得到广泛应用。其中,SRAP分子标记对DNA的纯度和浓度比其他分子标记技术的要求较低,且由于SRAP分子标记的引物设计原则,使得其在基因组分布均匀、具有更强的稳定性和多态性。此外,SRAP分子标记融合了随机扩增多态性DNA(Random amplified polymorphic DNA,RAPD)、扩增片段长度多态性(Amplified length pdymorphism,AFLP)两者的优势,高频率共显性较强,比RAPD、AFLP、简单序列重复(Simple sequeme repeats,SSR)等其他分子标记方法更好地反映出生物的多样性。CDDP分子标记是借助单引物扩增反应可有效产生和目标性状连锁的功能性分子标记,与其他类分子标记相比,其引物长度更长、GC含量更高、稳定性和重复性更好、操作更简单,直接对基因组DNA进行PCR扩增即可[10]。
已有研究指出,巴戟天存在丰富的遗传变异性[8, 11]。丁平等[12]使用RAPD分子标记对来自德庆县云利村、永丰村和播植村的巴戟天进行遗传多态性分析,发现其多态百分率为50.0%,其中小叶巴戟天的遗传多样性较其他种类好;刘颖嘉等[13]运用简单重复序列区间(Inter simple squence repeats,ISSR)分子标记,发现巴戟天种质间的亲缘关系与栽培地之间存在较大的相关性;罗铭欣等[14]运用SRAP和CDDP分子标记分别对肇庆的9份巴戟天进行鉴别,得出其多态性比率分别为48.6%和75.9%的结论,表明CDDP分子标记在巴戟天的遗传多样性分析中优于SRAP分子标记。【本研究切入点】虽然不同地区的巴戟天均有相应的记载和分析,而德庆作为巴戟天的正宗产地,却尚未全面地对当地不同种质的巴戟天进行分类、记载。【拟解决的关键问题】本研究选择SRAP和CDDP两种分子标记,结合主成分分析,在表型和分子的水平上分析了24份来自德庆不同地区的巴戟天遗传多样性,为巴戟天种质资源的鉴评和遗传育种研究提供参考。
1 材料与方法 1.1 试验材料以从德庆各地收集的24份巴戟天(表 1)为试验材料,其中来自马圩镇1份、播植镇2份、武垄镇1份、凤村镇4份、官圩镇4份、高良镇12份。
1.2 试验方法
1.2.1 形态学指标测定 24份巴戟天表型数据在德庆仲恺研究院基地于2022年5月4日进行测定和记录。挑取生长状况良好的巴戟天植株,测量其自上而下第4片叶,使用万深LA-S叶面分析软件记录叶片的叶长、叶宽、叶周长、叶面积等表型,各指标设4个重复。
1.2.2 光合指标测定 类似地,挑取生长状况良好的巴戟天植株,测量其自上而下第4片叶,使用OPTI-SCIENCES CCM-200 plus叶绿素测定仪检测巴戟天叶片SPAD值,利用FluraCam便携式叶绿素荧光成像仪测定巴戟天叶片最大光化学量子产量,设置4次重复。
1.2.3 耐斯糖测定 由中国广州分析测试中心参照《中国药典》采用高效液相色谱法(HPLC)测定巴戟天的耐斯糖含量。
1.2.4 巴戟天基因组DNA提取 每份巴戟天采摘3~5棵植株的嫩叶用于DNA提取,称取健康新鲜的巴戟天嫩叶约100 mg,CDDP分子标记使用GBCBIOGO公司的Plant DNA Kit试剂盒;SRAP分子标记使用广州捷倍斯生物科技有限公司的植物DNA提取试剂盒;各得到24份巴戟天DNA。
1.2.5 SRAP分子标记扩增 扩增体系:40 ng DNA模板,1 μL上游引物(10 μmol/L),1 μL下游引物(10 μmol/L),4 μL Mg2+(20 mmol/L),1 μL dNTPs(10 mmol/L),1.5 μL Taq聚合酶(2 U/μL),2 μL 10×PCR Buffer,ddH2O补足至20 μL。
反应体系:94 ℃预变性5 min;94 ℃变性1 min,35 ℃退火1 min,72 ℃延伸1 min,循环35次;72 ℃延伸10 min。
1.2.6 CDDP分子标记扩增 扩增体系:1 μLDNA模板,0.2 μL上游引物(100 μmol/L),0.2 μL下游引物(100 μmol/L),1 μL dNTPs(10 mmol/L),0.6 μL Taq DNA聚合酶(10 U/μL),2 μL 10× PCR Buffer(含Mg2+),ddH2O补足至20 μL。
反应体系:94 ℃预变性3 min;94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸2 min,循环35次;72 ℃延伸5 min。
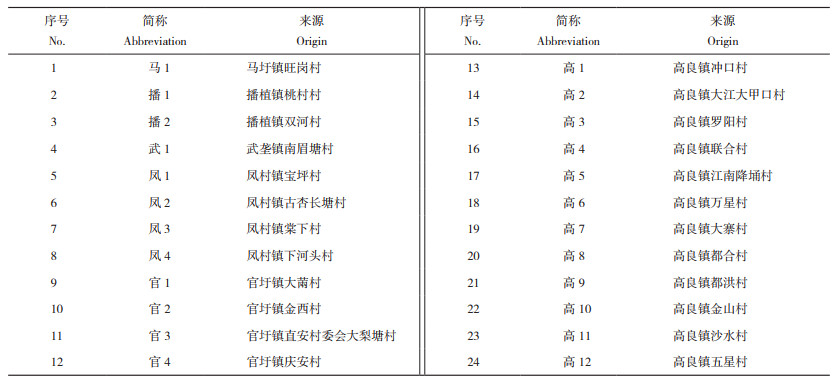
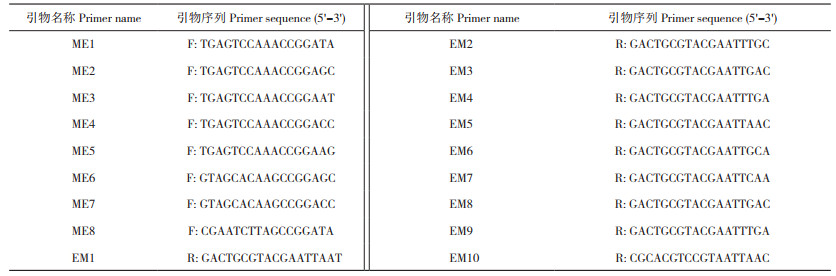
1.2.7 引物设计 参照罗铭欣等[14]设计引物,交由生工生物工程(上海)股份有限公司合成,SRAP引物序列见表 2,CDDP引物序列见表 3。
1.2.8 PCR产物的检测 SRAP-PCR和CDDPPCR分别使用浓度1.5%和1.2%的琼脂糖凝胶电泳。
1.2.9 聚类分析 根据PCR产物的电泳条带记录,以条带位置的同源性为原则将条带区的位点记成“1”,无条带位点用“0”进行统计[14-15]。
采用NTSYS-pc2.1软件,得到直接遗传相似系数GS,GSij=2a/(2a+b+c),GSij表示种质i和j的直接遗传相似系,a表示i与j共同的条带数目,b和c分别表示i与j的特定条带数目,遗传距离(Genetic distance,GD)为1-GS,并用遗传相似度进行不加权平均法的聚类分析,利用NTSYS-pc2.1进行聚类分析的树形图的绘制[16]。联合聚类分析以SRAP和CDDP两种分子标记的“0-1矩阵”结合一起得到遗传相似系数。
1.2.10 数据处理 使用IBM SPSS Statistics 25软件和Excel软件完成数据统计分析。
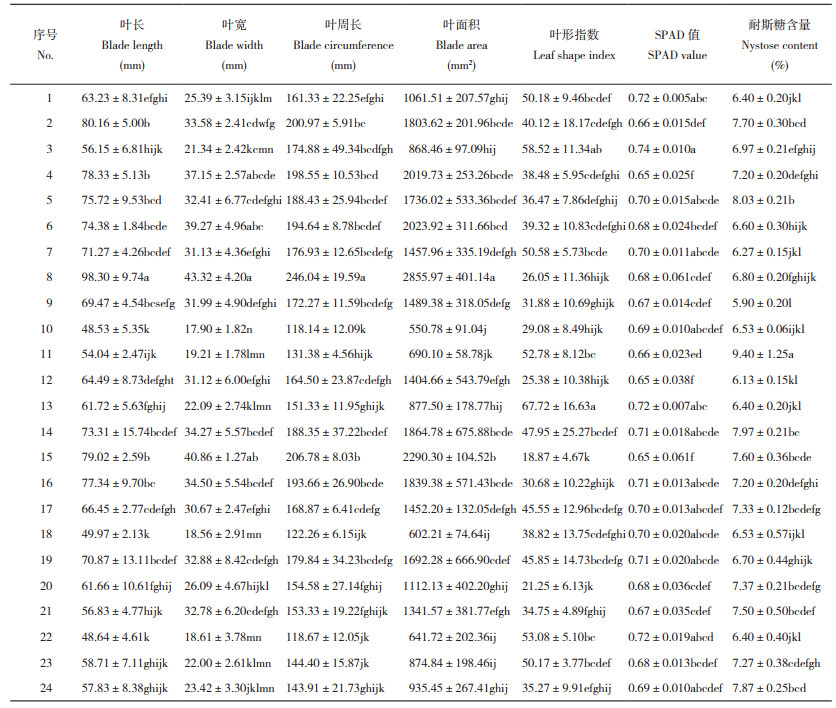
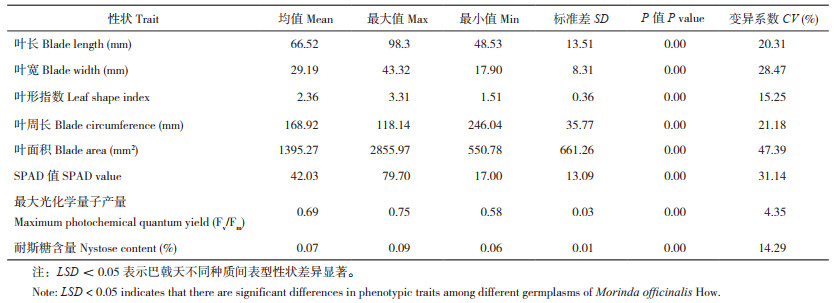
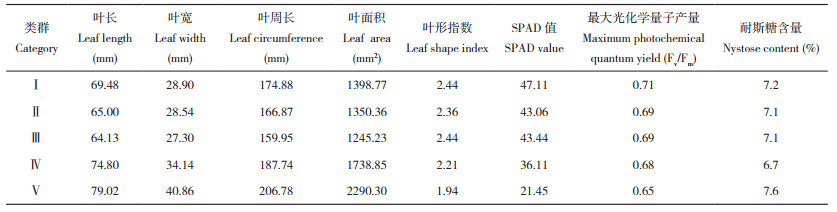
2 结果与分析 2.1 巴戟天表型性状及主成分分析2.1.1 巴戟天表型性状分析 由表 4和表 5可知,24份巴戟天种质各表型性状间均存在极显著差异(P<0.01)。变异系数可反映出种质间和种质内的离散程度,数值越小越稳定。CV值大于10%时表示各种质之间存在显著差异[17];在下表中,除最大光化学量子产量的变异系数外,均大于10%,说明各地区的巴戟天存在差异,其中叶面积的变异系数最大、为47.39%。最大光化学量子产量的变异系数则较小、为4.35%。
|
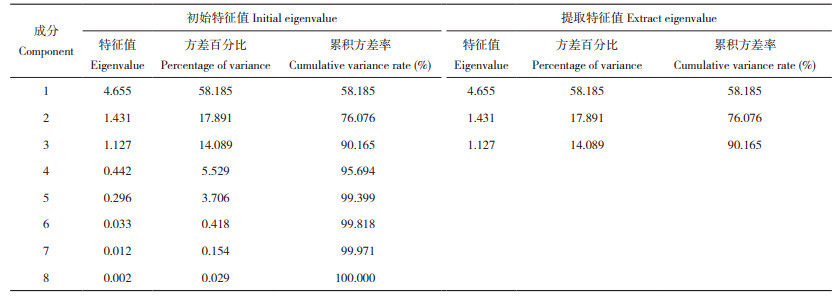
2.1.2 对数据标准处理及因子分析适用性检验 通过IBM SPSS Statistics 25软件,对24份不同种质的巴戟天进行因子分析。首先将原始数据进行Z值标准化(Z-score)处理,通过KMO和Bartlett检验法进行主成分分析的适用性验证。结果发现,KMO值大于0.60、为0.678;而且Sig值为0.000,小于0.05,说明各指标间有一定的相关性,且该数据适合进行主成分分析[18]。
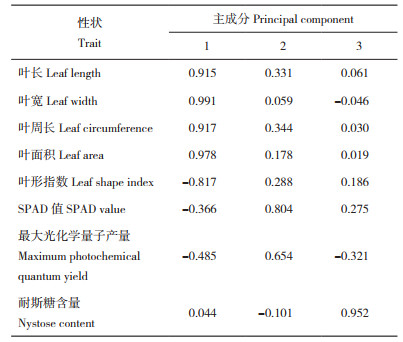
2.1.3 24份巴戟天的主成分综合分析 根据“特征值大于1且累积方差贡献率在85%左右[19] ”的原则,提取了3个主成分,累计方差率约90.17%,因而提取了3个公因子(表 6)。从表 7可以看出,主成分1受叶片表型的影响较显著,与叶长、叶宽、叶周长、叶面积呈显著正相关,与叶形指数呈显著负相关;主成分2则对巴戟天的光合生理特征有显著影响,与SPAD值和最大光化学量子产量均呈显著正相关;主成分3则与巴戟天中耐斯糖含量呈显著正相关。
|
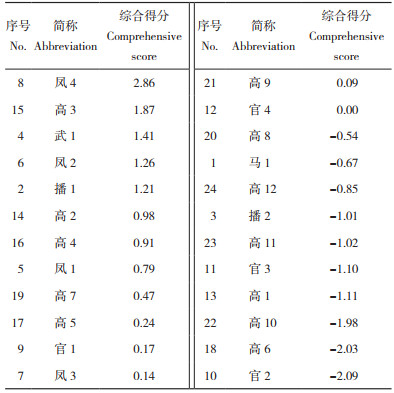
在此基础上,将3个主成分的线性系数进行加权平均,再用主成分分析法进行归一化,得到各项指标权重[20]。结果(表 8)显示,凤4和高3的主成分综合得分最高,分别为2.86和1.87;高6和官2的主成分综合得分最低,分别为-2.03和-2.09,综合表现整体良好。
|
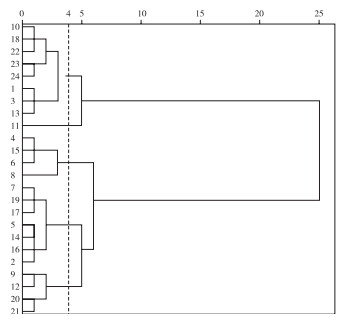
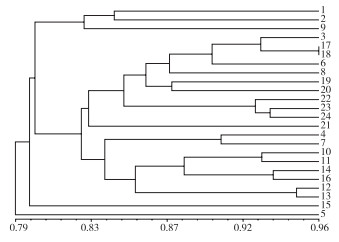
2.1.4 24份巴戟天种质的聚类分析 由表 8和图 1可知,当阈值处于4时,可将24份供试巴戟天种质分为5大类,第一类是综合得分最高的武1(4)、高3(15)、凤2(6)、凤4(8)等4份种质,综合得分为1.26~2.86;第二类是综合得分较高、0.14~1.21的凤3(7)、高7(19)、高5(17)、凤1(5)、高2(14)、高4(16)、播1(2)7份种质;第三类则是综合主成分得分较低的官1(9)、官4(12)、高8(20)、高9(21)共4个品种,得分区间在-0.54~0.17;第四类和第五类的得分则最低,分别为官2(10)、高6(18)、高10(22)、高11(23)、高12(24)、马1(1)、播2(3)、高1(13)共8份种质,得分在-2.09 ~ -0.67之间,以及第五类得分为-1.10的官3。
2.2 多态性分析
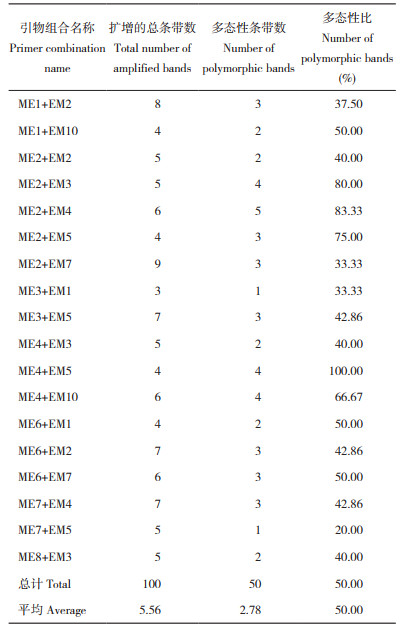
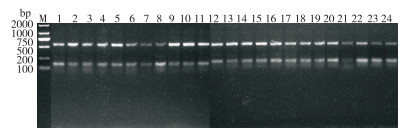
2.2.1 SRAP分子标记多态性分析 如表 9所示,从28对SRAP引物组合序列中,挑选出18对扩增效果良好的引物组合,在24份巴戟天样品中共扩增出100条条带,每对引物组合的平均扩增条带为5.56条,有50条多态性条带,平均多态性条带为2.78条,多态性比为50.0%。其中,扩增条带数最多的引物组合是ME2+EM7,共扩增出9条清晰条带数目(图 2);条带数目最少的是只有3条的引物组合ME3+EM1(图 3);此外引物组合ME4+EM5的扩增出的条带多态性为100%,PCR产物扩增片段为100~2 000 bp。
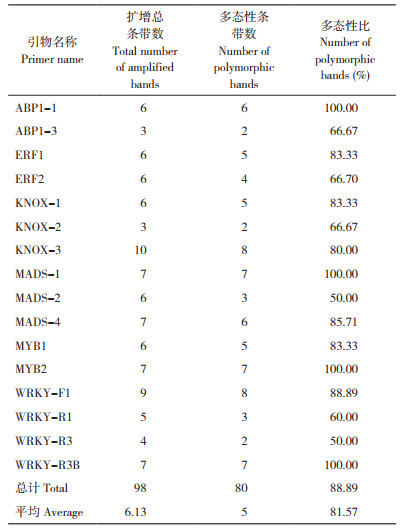
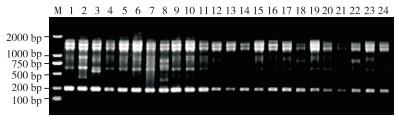
2.2.2 CDDP分子标记多态性分析 如表 10所示,在17条CDDP引物筛选出16条扩增效果好且条带数目清晰的引物,24份巴戟天种质共扩增得到98条条带,每条引物的平均扩增条带数为6.10条,扩增出80条多态性条带,其条带的多态性比高达81.6%,平均多态性比高达79.0%。引物KNOX-3扩增条带数最多(图 4)、为10条;其次是引物WRKY-F1,扩增出9条;引物ABP1-3和KNOX-2扩增的条带数最少,只有3条。此外,ABP1-1、MADS-1、MYB2和WRKY-R3B这3条引物的多态性比率达100%。
2.3 遗传相似性分析
2.3.1 SRAP遗传相似性分析 在SRAP分子标记方法中,24份巴戟天样品的遗传相似系数(GS)变化范围为0.71~0.97,平均遗传系数为0.87,平均遗传距离为0.13(表 11)。其中高5(17)和高6(18)GS最大、为0.97,表明两者有较近的亲缘关系;而马1(1)和高1(13)、官1(9)和高6(18)GS最小、为0.71,说明它们之间的亲缘关系较之最远。
2.3.2 CDDP遗传相似性分析 24份巴戟天样品在CDDP分子标记方法中的GS为0.71~0.96(表 12),平均遗传系数为0.86,平均遗传距离为0.14。在高5(17)和高6(18)之间GS最大、为0.96,表明其亲缘关系较近,基因相似程度可能较高;马1(1)和高1(13)、武1(4)和高1(13)之间的最小遗传系数最小、为0.71,说明其亲缘关系较远,基因相似程度较之更低。
2.4 聚类分析
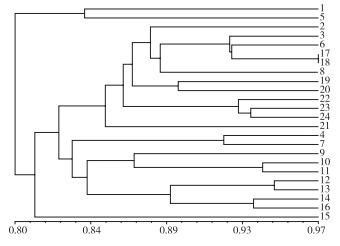
2.4.1 SRAP分子标记聚类分析 由SRAP聚类分析树状图(图 5)可知,遗传相似系数在0.82时可将24份巴戟天种质分为3大类,马1(1)、凤1(5)为第Ⅰ大类;第Ⅱ大类为只有高3(15)一份种质;其余21份全部归为第Ⅲ大类,大都来源于高良镇、播植镇、凤村镇和官圩镇,说明这些地方的种质之间具有一定的相似性,其中来自高良镇江南降埇村(17)和万星村(18)的亲缘关系最近。
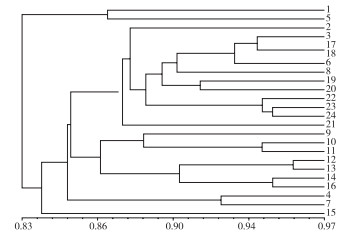
2.4.2 CDDP分子标记聚类分析 如图 6所示,当系数在0.82时,被分为4类,第Ⅰ类群有马1(1)、播1(2)、官1(9),第Ⅱ类群来源所属的镇较多,大部分来自高良镇和官圩镇,说明这2个地方的种质间具有一定相似性,其中来自高良镇江南降埇村(17)和万星村(18)的亲缘关系最近,该结果与SRAP遗传相似系数在0.82时的结果相一致;第Ⅲ类群高3(15)和第Ⅳ类群凤1(5)分别为2个类群。
2.4.3 SRAP和CDDP联合聚类分析 如图 7所示,在0.86的时候可分为5个类群,第Ⅰ类为马1(1)、凤1(5)2份种质,结合表 13,该类SPAD值和最大光化学量子产量最高,比较偏向生理光合特征;第Ⅱ类有的种质则比较多,主要来自于高良镇、官圩镇和凤村镇,并且高良镇江南降埇村(17)和万星村(18)的亲缘关系最近,这与CDDP和SRAP的遗传系数在0.82时的结果一致;第Ⅳ类是武1(4)、凤3(7),第Ⅴ类为15,这两类则偏向叶片表型,其叶长、叶周长、叶面积最大。
|
3 讨论
通过分子标记方法,能快速、高效的鉴定和分析作物的种质质量和遗传多样性[21]。本研究通过主成分分析以及SRAP和CDDP两种分子标记方法对广东省肇庆市不同地区的24份巴戟天进行表型性状和遗传亲属关系分析,从表型和分子水平上揭示了巴戟天丰富的遗传多样性。在表型性状分析中,其各指标在各个种质中具有较丰富的多样性。基于主成分分析的聚类分析图中,官圩镇和高良镇、凤村镇和高良镇聚类最近,分别分散在3个类群中,凤村镇和高良镇分散在2个类群中;而在CDDP和SRAP分子标记联合的聚类图中,官圩镇和高良镇聚为一个大类,凤村镇中只有古杏长塘村和下河头村与播植镇和高良镇为一个大类,表明,高良镇和官圩镇以及高良镇和凤村镇的种质具有一定的相似性。
在分子标记分析中,当多态率在50%以上则表明该种质具有较高的遗传多样性[11]。在两种分子标记法中,CDDP的平均条带为6.13条,高于SRAP的平均条带(5.56条);CDDP的平均多态率(81.57%)明显高于SRAP平均多态率(50.00%),表明两种分子标记都可以扩增出丰富的多态性条带,而CDDP标记比SRAP标记能更好揭示巴戟天的遗传多态性。由于SRAP是一种随机扩增的分子标记技术,而CDDP是一种基于单引物扩增的标记技术,与目的基因的一部分或基因紧密连锁的[22],因此CDDP标记在巴戟天遗传多样性分析上更具有优势。当遗传相似系数在0.82时,SRAP和CDDP分子标记聚类分析都表明高良镇、官圩镇和凤村镇的巴戟天种质具有一定的相似性,其中高良镇江南降埇村和万星村的亲缘关系最近,这在两种分子标记联合分析时,遗传相似系数在0.86时的结果一致。
4 结论本次研究通过表型性状和两种分子标记方法(SRAP和CDDP)对广东省德庆县不同地区的24份巴戟天进行遗传多样性分析,为巴戟天提供分子标记辅助育种的参考依据,在巴戟天的遗传育种中发挥重要作用。结果表明,各地区的巴戟天具有较丰富的遗传多样性,并且CDDP和SRAP两种分子标记均能用于分析巴戟天的遗传多样性,但CDDP的多态率和条带数都大于和高于SRAP的多态性和条带数,所以在巴戟天的多样性分析中,CDDP分子标记法优于SRAP分子标记法;其中结合表型和两种分子标记的联合中,高良镇和官圩镇以及高良镇和凤村镇的种质具有具有一定的相似性。
| [1] |
倪建成, 卢柱华, 莫舒云, 连增维, 阮少江, 叶祖云. 巴戟天化学成分的研究[J]. 中成药, 2021, 43(5): 1212-1216. DOI:10.3969/j.issn.1001-1528.2021.05.019 NI J C, LU Z H, MO S Y, LIAN Z W, RUAN S J, YE Z Y. Chemcial constituents from Morinda officinalis[J]. Chinese Traditional Patent Medicine, 2021, 43(5): 1212-1216. DOI:10.3969/j.issn.1001-1528.2021.05.019 |
| [2] |
蔡苗苗, 刘梦云, 杨丽, 冯冲, 丁平. 巴戟天种质资源和质量评价研究进展[J]. 中药材, 2021(4): 44. DOI:10.13863/j.issn1001-4454.2021.04.044 CAI M M, LIU M Y, YANG L, FENG C, DING P. Research progress on germplasm resources and quality evaluation of Morinda officinalis How[J]. Journal of Chinese Medicinal Materials, 2021(4): 44. DOI:10.13863/j.issn1001-4454.2021.04.044 |
| [3] |
姚辉, 陈士林, 谢彩香, 宋经元, 段立胜. 巴戟天的产地适宜性分析[J]. 广州中医药大学学报, 2009, 26(2): 176-180. DOI:10.3969/j.issn.1007-3213.2009.02.018 YAO H, CHEN S L, XIE C X, SONG J Y, DUAN L S. Suitability evaluation of producing areas of Morinda officinalis How.[J]. Journal of Guangzhou University of Traditional Chinese Medicine, 2009, 26(2): 176-180. DOI:10.3969/j.issn.1007-3213.2009.02.018 |
| [4] |
李小婷, 庞玉新, 杨全, 王丹, 范佐旺, 马青松. 四大南药资源开发利用现状分析[J]. 中国现代中药, 2015, 17(2): 99-104. DOI:10.13313/j.issn.1673-4890.2015.2.003 LI X T, PANG Y X, YANG Q, WANG D, FAN Z W, MA Q S. Analysis on the resources and current situation of exploitation and utilization of four southern herbal medicines[J]. Modern Chinese Medicine, 2015, 17(2): 99-104. DOI:10.13313/j.issn.1673-4890.2015.2.003 |
| [5] |
魏京邑, 岳广欣. 巴戟天抗抑郁成分药理机制研究进展[J]. 中医药通报, 2017, 16(2): 67-69. WEI J Y, YUE G X. Research progress on the pharmacological mechanism of antidepressant components of Morinda officinalis How.[J]. Traditional Chinese Medicine Journal, 2017, 16(2): 67-69. |
| [6] |
HE Y Q, ZHANG Q, SHEN Y, HAN T, ZHANG Q L, ZHANG J H, LIN B, SONG H T, HSU H Y, QIN L P, XIN H L, ZHANG Q Y. Rubiadin-1-methyl ether from Morinda officinalis How. inhibits osteoclastogenesis through blocking RANKL-induced NF-κB pathway[J]. Biochemical and Biophysical Research Communications, 2018, 506(4): 927-931. DOI:10.1016/j.bbrc.2018.10.100 |
| [7] |
宋开蓉, 高建德, 刘雄, 陈晖, 乔婧, 朱晓玉. 巴戟天现代研究进展[J]. 中兽医医药杂志, 2018, 37(3): 79-82. DOI:10.13823/j.cnki.jtcvm.2018.03.031 SONG K R, GAO J D, LIU X, CHEN H, QIAO J, ZHU X Y. Modern research progress of Morinda officinalis How.[J]. Journal of Traditional Chinese Veterinary Medicine, 2018, 37(3): 789-82. DOI:10.13823/j.cnki.jtcvm.2018.03.031 |
| [8] |
BOHAR R, CHITKINENI A, VARSHNEY R K. Genetic molecular markers to accelerate genetic gains in crops[J]. BioTechniques, 2020, 69(3): 158-160. DOI:10.21444/btn-2020-0066 |
| [9] |
AMITEYE S. Basic concepts and methodologies of DNA marker systems in plant molecular breeding[J]. Heliyon, 2021, 7(10): e8093. DOI:10.1016/j.heliyon.2021.e08093 |
| [10] |
兴旺, 郭晨晨, 孙燕红, 马龙彪, 吴刚东. 甜菜CDDP-PCR扩增体系的建立及优化[J]. 中国农学通报, 2017, 33(24): 47-51. XING W, GUO C C, SUN Y H, MA L B, WU G D. Construction and optimization of CDDP-PCR in Beet[J]. Chinese Agricultural Science Bulletin, 2017, 33(24): 47-51. |
| [11] |
LUO Z H, CHEN Z, LIU M, YANG L, ZHAO Z, YANG D, DING P. Phenotypic, chemical component and molecular assessment of genetic diversity and population structure of Morinda officinalis germplasm[J]. BMC Genomics, 2022, 23(1): 605. DOI:10.1186/s12864-022-08817-w |
| [12] |
丁平, 刘瑾, 仰铁锤, 邱金英. 巴戟天遗传多样性的RAPD研究[J]. 中草药, 2008, 39(12): 1869-1872. DOI:10.3321/j.issn:0253-2670.2008.12.039 DING P, LIU J, YANG T C, QIU J Y. Genetic diversity of Morinda officinalis by RAPD[J]. Chinese Traditional and Herbal Drugs, 2008, 39(12): 1869-1872. DOI:10.3321/j.issn:0253-2670.2008.12.039 |
| [13] |
刘颖嘉, 黄宇, 荣俊冬, 张颖, 薛艺敏, 郑郁善. 巴戟天遗传多样性的ISSR分析[J]. 福建林学院学报, 2011, 31(3): 203-206. DOI:10.13324/j.cnki.jfcf.2011.03.010 LIU Y J, HUANG Y, RONG J D, ZHANG Y, XUE Y M, ZHENG Y S. Genetic diversity analysis of Morinda officinalis by ISSR markers[J]. Journal of Fujian College of Forestry, 2011, 31(3): 203-206. DOI:10.13324/j.cnki.jfcf.2011.03.010 |
| [14] |
罗铭欣, 刘凤民, 张伟丽, 崔均涛, 利冬慧, 陈纪言, 董章勇. SRAP和CDDP标记在巴戟天遗传多样性分析中的应用[J]. 分子植物育种, 2021, 19(11): 3661-3669. DOI:10.13271/j.mpb.019.003661 LUO M X, LIU F M, ZHANG W L, CUI J T, LI D H, CHEN J Y, DONG Z Y. Application of SRAP and CDDP markers in genetic diversity analysis of Morinda officinalis How.[J]. Molecular Plant Breeding, 2021, 19(11): 3661-3669. DOI:10.13271/j.mpb.019.003661 |
| [15] |
IBRAR D, KHAN S, MAHMOOD T, BAKHSH A, AZIZ I, RAIS A, AHMAD R, BASHIR S, NAWAZ M, RASHID N, IRSHAD S, ALOTAIBI S S, DVORACKOVA H, DVORACEK J, HASNAIN Z. Molecular markers-based DNA finger printing coupled with morphological diversity analysis for prediction of heterotic grouping in sunflower (Helianthus annuus L.)[J]. Frontiers in Plant Science, 2022, 13: 916845. DOI:10.3389/fpls.2022.916845 |
| [16] |
张伟丽, 刘凤民, 刘艾. 柱花草SRAP-PCR体系优化及其遗传多样性分析[J]. 草业学报, 2011, 20(4): 159-168. DOI:10.11686/cyxb20110420 ZHANG W L, LIU F M, LIU A. Optimization of SRAP-PCR system and its application in genetic diversity analysis of Stylosanthes[J]. Acta Prataculturae Sinica, 2011, 20(4): 159-168. DOI:10.11686/cyxb20110420 |
| [17] |
谢文辉, 赵文武, 王雷挺, 赵丽丽, 王普敞. 22份百脉根种质资源表型数量性状的遗传多样性分析[J]. 草地学报, 2023, 31(1): 173-179. DOI:10.11733/j.issn.1007-0435.2023.01.020 XIE W H, ZHAO W W, WANG L T, ZHAO L L, WANG P C. Genetic diversity analysis of 22 lotus corniculatus germplasm resources based on phenotypic quantitative traits[J]. Acta Agrestia Sinica, 2023, 31(1): 173-179. DOI:10.11733/j.issn.1007-0435.2023.01.020 |
| [18] |
崔锦鹏, 耿晓桐, 程梦娟, 李伟峰, 张娟, 刘庆普, 雷敬卫, 谢彩侠. 基于指纹图谱及抗氧化活性考察不同杀青方法地黄叶的质量特征[J]. 中国实验方剂学杂志, 2022, 28(23): 197-204. DOI:10.13422/j.cnki.syfjx.20220446 CUI J P, GENG X T, CHENG M J, LI W F, ZHANG J, LIU Q P, LEI J W, XIE C X. Examination of quality characteristics of Rehmannia glutinosa leaves by different fixation methods based on fingerprint and antioxidant activity[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(23): 197-204. DOI:10.13422/j.cnki.syfjx.20220446 |
| [19] |
刘丙花, 唐贵敏, 梁静, 舒秀阁, 李萍萍, 赵登超, 侯立群. 不同树形对早实核桃'鲁光'坚果产量和品质的影响[J]. 果树学报, 2021, 38(1): 73-81. DOI:10.13925/j.cnki.gsxb.20200338 LIU B H, TANG G M, LIANG J, SHU X G, LI P P, ZHAO D C, HOU L Q. Effects of different tree shapes on yield and quality of 'Luguang' walnut[J]. Journal of Fruit Science, 2021, 38(1): 73-81. DOI:10.13925/j.cnki.gsxb.20200338 |
| [20] |
黄伊琦, 颜亚奇, 吴友炉, 陈笙, 李银, 易慧琳, 刘晓洲, 谭广文. 干旱胁迫下2种抗蒸腾剂对角茎野牡丹的光合参数影响[J]. 热带农业科学, 2021, 41(12): 11-17. DOI:10.12008/j.issn.1009-2196.2021.12.003 HUANG Y Q, YAN Y Q, WU Y L, CHEN S, LI Y, YI H L, LIU X Z, TAN G W. Effects of two transpiration inhibitors on photosynthetic parameters of Tibouchina granulosa under drought stress[J]. Chinese Journal of Tropical Agriculture, 2021, 41(12): 11-17. DOI:10.12008/j.issn.1009-2196.2021.12.003 |
| [21] |
陈婕英, 刘政国, 汪春玲, 陈庆明, 程志魁, 马连莲, 苟纪权. 冬瓜SSR多态性标记遗传及杂种种子纯度鉴定[J]. 分子植物育种, 2021, 19(13): 4423-4428. DOI:10.13271/j.mpb.019.004423 CHEN J Y, LIU Z G, WANG C L, CHEN Q M, CHENG Z K, MA L L, GOU J Q. Genetics of SSR polymorphism marker and purity identification of hybrid seeds in wax gourd (Benincasa hispida)[J]. Molecular Plant Breeding, 2021, 19(13): 4423-4428. DOI:10.13271/j.mpb.019.004423 |
| [22] |
周武先, 段媛媛, 卢超, 由金文, 何银生, 王智, 杨旭, 尹晓蛟, 程天周, 安小玲. 基于CDDP标记的重楼属种质资源鉴定及遗传多样性分析[J]. 中草药, 2019, 50(20): 5033-5039. DOI:10.7501/j.issn.0253-2670.2019.20.027 ZHOU W X, DUAN Y Y, LU C, YOU J W, HE Y S, WANG Z, YANG X, YIN X J, CHENG T Z, AN X L. Genetic diversity analysis and germplasm identification of Paris species by CDDP markers[J]. Chinese Traditional and Herbal Drugs, 2019, 50(20): 5033-5039. DOI:10.7501/j.issn.0253-2670.2019.20.027 |
(责任编辑 马春敏)
 2024, Vol. 51
2024, Vol. 51