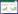文章信息
基金项目
- 国家自然科学基金(31902228);广东省重点建设学科科研能力提升项目(2022ZDJS040);佛山科学技术学院学科建设项目(CGZ0400162)
作者简介
- 孙军航(1999—),女,在读硕士生,研究方向为动物营养与饲料科学,E-mail:1468426088@qq.com.
通讯作者
- 柒启恩(1987—),男,博士,副教授,研究方向为动物营养与饲料科学,E-mail:qiqien1987@163.com.
文章历史
- 收稿日期:2024-01-11
2. 海南省农业科学院畜牧兽医研究所,海南 海口 571100
2. Institute of Animal Science and Veterinary Medicine, Hainan Academy of Agricultural Sciences, Haikou 571100, China
【研究意义】胃肠道是动物机体与外界接触最广泛的器官,不仅是营养吸收的主要器官,也是内部组织与肠腔内容物之间的一道选择性屏障[1]。肠道黏膜结构的完整性和肠道菌群的平衡是维持肠道功能和全身稳态的关键[2-3]。随着2020年7月1日农业农村部“禁抗”令正式实施,畜牧养殖业迫切需要找到新的方案,以期在一定程度上替代抗生素在动物生产中的作用。屎肠球菌在维持或改善人和动物胃肠道健康方面具有较大的潜在应用价值,目前作为益生菌制剂广泛应用于临床和畜牧业[4-6],可以改善人和动物胃肠道健康。屎肠球菌在动物生产中的研究应用,对于响应国家“禁抗”令,推动绿色安全的动物生产具有重要的促进作用。【前人研究进展】细胞外囊泡(Extracellular vesicles,EV)可由大多数生命体产生,包括真核生物、细菌、寄生虫、真菌和古细菌[7-11]。EV主要由膜蛋白的脂质双分子层结构组成,并含有蛋白质、脂质、核酸等代谢产物[12]。20世纪60年代,人们首次在大肠杆菌中发现了微生物细胞外囊泡(Bacterial extracellular vesicle,BEV) [13-14],其携带丰富的生物活性内容物,如毒力因子、DNA、黏附素、RNA、免疫调节因子和营养清除因子等[15-16]。BEV在毒力因子的运输、DNA转移中发挥重要作用,可以拦截抗生素分子,降低抗生素分子的杀菌作用[17-19]。此外,BEV还能够携带宿主防御因子,介导微生物与宿主间的交互作用,调节宿主免疫反应[20]。BEV具有药物装载效率高、易工程化改造、可大规模生产等优势,在许多生物医学中具有巨大的应用潜力,主要包括疫苗、癌症免疫治疗制剂、药物运载工具、抗菌药物和靶点、诊断生物标志物等应用[13]。
屎肠球菌(Enterococcus faecium,Efm) 是肠球菌属(Enterococcus)中一种常见的益生菌,为革兰氏阳性兼性厌氧菌[21-22]。屎肠球菌来源广泛、耐酸碱,可在人和动物的胃肠道内定殖,粘附在胃肠道黏膜上形成微生物保护层,减少致病菌的生存空间[23-24]。细菌素是屎肠球菌的重要代谢产物,这些物质能够抑制或杀灭病原菌,因此它们具有良好的益生效果[25]。
【本研究切入点】前期研究显示,口服屎肠球菌可改善腹泻仔猪的免疫器官指数、肠道屏障功能[26]。但是屎肠球菌细胞外囊泡(Enterococcus faecium extracellular vesicles,Efm-EV)对动物肠道健康的影响尚不清楚。【拟解决的关键问题】本研究对小鼠灌胃Efm-EV,分析小鼠生长性能、血清免疫及炎症因子、肠道形态结构及粪便菌群结构的变化,探讨Efm-EV对肠道健康的影响。屎肠球菌具有良好的益生作用,通过研究EfmEV对动物机体的影响,为屎肠球菌在畜禽生产中的应用提供理论依据。
1 材料与方法 1.1 试验材料供试的屎肠球菌为佛山科学技术学院动物营养实验室保存的菌株,经过16S rRNA测序鉴定为屎肠球菌DT1-1株。试验动物为SPF级的健康雄性C57BL/6小鼠,体重在15.5(±1.5)g,日龄为29(±1)d,购自广东省医学实验动物中心〔许可证号:SCXK(粤)2018-0002〕。试验于2019年3—4月在佛山科学技术学院开展。
1.2 试验方法1.2.1 Efm-EV的分离、纯化与鉴定 采用MRS液体培养基于37 ℃、200 r/min的水平摇床上震荡培养12~14 h,使菌液OD值为0.50~0.75。采用超速离心法获取Efm-EV[24],通过JEM- 2000EX透射电子显微镜(Transmission electron microscopy,TEM)观察Efm-EV的外部形态特征。利用BCA蛋白浓度测定试剂盒测定Efm-EV的蛋白质浓度。
1.2.2 试验设计 选用20只SPF级的健康雄性C57BL/6小鼠,随机分为两组,每组10只小鼠,单只单笼饲养。参照罗梅英等[27]的方法,每隔1 d对试验组小鼠灌胃150 µL Efm-EV悬液(含500 µg Efm-EV),对照组小鼠灌胃等体积PBS (CK),试验期为5 d。在试验过程中,温度保持在20~24 ℃,相对湿度保持在40%~60%,自由饮水和取食,试验前1周进行预饲,所有动物试验依照《实验动物管理条例》进行。
1.2.3 生长性能指标测定 在试验开始和结束当天进行空腹称重,记录小鼠每天的采食量,计算平均日增重(Average daily gain,ADG)、平均日采食量(Average daily feed intake,ADFI)和料重比(Feed/gain,F/G)。
1.2.4 血清免疫指标测定 对所有试验小鼠进行眼球采血,3 000 r/min离心20 min分离血清,并将其存放在2 mL离心管中,-80 ℃下密封保存,后续进行血清学指标测定。血清免疫球蛋白A (IgA)、白细胞介素-10(IL-10)、免疫球蛋白G(IgG)、血清肿瘤坏死因子-α(TNF-α)的含量均采用上海酶联生物科技有限公司生产的试剂盒进行测定。
1.2.5 肠道组织切片的制作和观察 断颈处死小鼠,剖开腹腔,于十二指肠、空肠和回肠中各截取约1.5 cm组织样品,于灭菌PBS中漂洗干净,然后将其浸入4% 甲醛溶液中。采用苏木精- 伊红(Hematoxylin-eosin,HE)对样品进行染色,使用显微镜观察,测量绒毛高度(Villus height,VH)、隐窝深度(Crypt depth,CD),计算绒隐比(VH/CD)。
1.2.6 粪便菌群测定 在试验结束后,收集小鼠粪便样本,将其放入无菌离心管中,-80 ℃保存。从小鼠粪便样品中提取基因组DNA,利用琼脂糖凝胶电泳检测DNA纯度和浓度。用带有Barcode的特异引物(341F:5'CCTACGGGNGGCWGCAG3';806R:5'GGACTACHVGGGTATCTAAT3') 扩增16S rDNA的V3+V4区。对PCR扩增产物切胶回收,用QuantiFluorTM荧光计进行定量。将纯化的扩增产物进行等量混合,连接测序接头,构建测序文库,利用Illumina Hiseq 2500上机测序。得到Raw Reads后,过滤掉低质量Reads,组装拼接得到高质量序列。用Uparse软件以97% 的一致性对所有样品的优化序列聚类成为操作分类单元(Operational taxonomic unit,OTU),采用细菌16S rRNA数据库(SILVA database,https://www.arb-silva.de/)进行比对分析,后期粪便菌群物种分析在基迪奥云平台上进行,原始测序数据保存在NCBI BioProject PRJNA725099。
1.3 数据处理经Excel 2021初步整理后,采用SPSS 19.0软件对试验数据进行t检验,P<0.05表示差异显著,0.05 ≤ P<0.10表示差异有显著趋势。
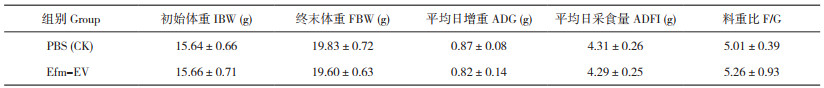
2 结果与分析 2.1 Efm-EV的形态特性采用超速离心法从屎肠球菌培养液上清中分离Efm-EV。通过TEM对Efm-EV的形态进行观察,结果(图 1)显示,分离纯化得到的EfmEV外观呈现圆形或杯形,直径约100 nm,符合细菌EV颗粒粒径要求。
|
| 图 1 TEM观察Efm-EV的形态 Fig. 1 Morphology of Efm-EV observed by TEM |
2.2 Efm-EV对小鼠生长性能的影响
由表 1可知,与对照组相比,灌胃Efm-EV小鼠的平均日增重、平均日采食量、料重比均无显著性差异,表明灌胃Efm-EV不影响小鼠的生长性能。
2.3 Efm-EV对小鼠血清免疫指标
与对照组相比,灌胃Efm-EV小鼠的血清IL-10水平显著提高4.7%(P<0.05),IgG和IgA水平显著降低6% 和11.6%(P<0.05),但对TNF-α的水平无显著影响(表 2)。
2.4 Efm-EV对小鼠肠道形态结构的影响
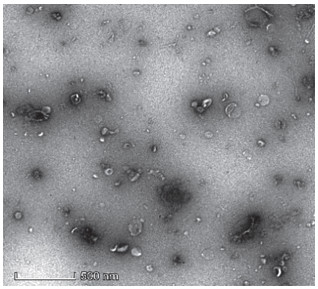
由图 2和表 3可知,与对照组相比,灌胃Efm-EV小鼠的十二指肠VH和CD变化不显著,但在数值上VH有所提高、CD有所降低,同时VH/CD显著提高(P<0.05),表明Efm-EV可以改善小鼠十二指肠形态结构。
|
| 图 2 Efm-EV对小鼠肠道形态的影响(× 40) Fig. 2 Effects of Efm-EV on intestinal morphology of mice (× 40) |
2.5 Efm-EV对小鼠粪便菌群的影响
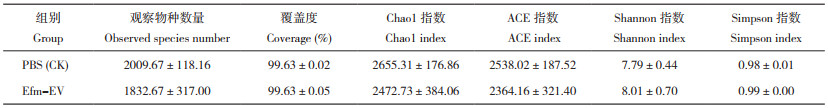
2.5.1 小鼠粪便菌群的Alpha多样性分析 由表 4可知,在PBS和Efm-EV处理中观察物种数量分别为2 010、1 833个,覆盖率均超过99.6%,两处理之间的Chao1、ACE、Shannon和Simpson指数均无显著差异。
|
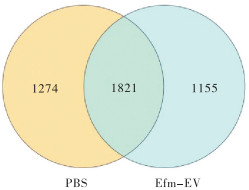
2.5.2 小鼠粪便菌群的韦恩图分析 通过图 3可以清楚地看到PBS和Efm-EV处理之间的OTU,以及它们之间的异同。两个处理共有1 821个OTU,Efm-EV处理独有的OTU有1 155个,而PBS处理则拥有1 274个。
|
| 图 3 小鼠粪便样品OTU韦恩图 Fig. 3 Venn diagram of OTU of fecal samples in mice |
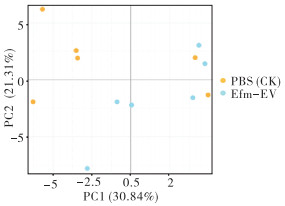
2.5.3 基于OTU的主成分分析(PCA) 通过PCA分析两组样本OTU组成,样本组成差异越大,在PCA图中的距离越远。如图 4所示,PBS和Efm-EV处理的样本明显分离,表明Efm-EV处理影响了小鼠粪便菌群组成。
|
| 图 4 小鼠粪便样品OTU PCA图 Fig. 4 PCA diagram of OTU of fecal samples in mice |
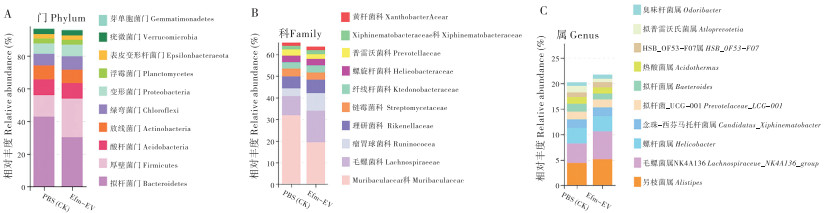
2.5.4 小鼠粪便菌群结构分析 在门水平(图 5A)上,厚壁菌门(Firmicutes)在PBS和EfmEV处理中的占比分别为13.19% 和23.60%,拟杆菌门(Bacteroidetes)的占比分别为42.84% 和30.26%,表明Efm-EV处理可提高厚壁菌门细菌的数量,降低拟杆菌门细菌的数量。
|
| 图 5 Efm-EV对小鼠粪便菌群结构的影响 Fig. 5 Effects of Efm-EV on fecal microbiota structure in mice |
在科水平(图 5B) 上,样本中获得的主要菌群分别属于Muribaculaceae科、毛螺菌科(Lachnospiraceae),在PBS处理样本中分别占31.89% 和8.83%,在Efm-EV处理样本中分别占19.4% 和14.59%。可见,Efm-EV在一定程度上可降低Muribaculaceae科的丰度、提高毛螺旋菌科的丰度。
通过在属水平(图 5C)上分析物种组成,发现PBS与Efm-EV处理中,阿里叶柄菌属(Alistipes)占比分别为4.44% 和5.15%,毛螺菌科NK4A136组(Lachnospiraceae_NK4A136_ group)分别占比3.79% 和5.45%。
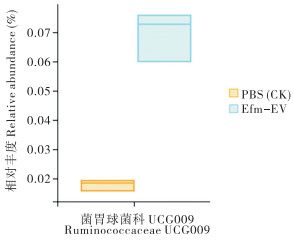
采用Wilcoxon秩和检验分析两处理间的微生物菌群,结果(图 6)显示,与PBS处理相比,Efm-EV处理的小鼠瘤胃球菌科UCG009的相对丰度显著增加(P<0.05)。
|
| 图 6 属水平上的菌群Wilcoxon秩和检验 Fig. 6 Wilcoxon rank sum test on microbiota at genus |
3 讨论
屎肠球菌具有高质量的生物学特性(耐热、耐酸、耐胆盐、粘附和抑菌)和益生菌特性,作为一种益生菌添加剂,可以提高动物的生产性能、免疫力,维持动物肠道微生物稳态,因此在畜牧业生产中具有良好的应用前景。本试验研究了屎肠球菌细胞外囊泡Efm-EV对小鼠生长性能的影响,结果显示,与PBS处理相比,灌胃Efm-EV对小鼠的ADFI、ADG、F/G没有显著影响,这与Broom等[28]的试验结果一致,在断奶仔猪饲粮中添加屎肠球菌不会对其生长产生显著影响。本试验中,灌胃Efm-EV可显著提高小鼠十二指肠绒隐比(P<0.05),表明Efm-EV可改善小鼠的小肠形态结构,从而改善肠道消化吸收功能。
IL-10是Th2细胞分泌的一种重要免疫因子,可减轻机体的炎症反应。IL-10有助于调节炎症过程,当IL-10水平降低时,机体的抗炎能力会减弱,导致机体炎症加重。因此,IL-10的水平与机体对炎症的应答密切相关[29]。研究表明,灌胃Efm-EV可显著提高小鼠血清的IL-10含量(P<0.05),表明Efm-EV在预防小鼠机体的促炎反应中发挥重要作用。
Broom等[28]在断奶仔猪饲粮中添加屎肠球菌,降低了断奶20 d仔猪血液中的IgG和肠道组织中IgA的水平。本研究中,Efm-EV可显著降低小鼠的血清IgG和IgA水平(P<0.05),表明Efm-EV引起了小鼠机体免疫力的下降,EfmEV可能介导了屎肠球菌的免疫调节作用。研究发现,炎症性肠病的特征是粘膜中IgG阳性细胞会增加[30]。因此,IgG和IgA水平的降低对于预防机体炎症反应具有积极作用。与PBS处理相比,Efm-EV处理显著降低了小鼠的血清IgA和IgG含量(P<0.05),进一步表明Efm-EV在预防小鼠炎症反应中的重要功能。
肠道菌群的稳定是衡量动物机体健康的重要指标,益生菌和致病菌数量可以从侧面反映小鼠肠道的菌群健康程度。为探究Efm-EV对动物肠道菌群的影响,通过16S rRNA基因高通量测序,分析Efm-EV和PBS处理小鼠的粪便菌群组间差异。Chao1、ACE指数及Shannon、Simpson指数用来表明菌群的丰富程度及菌群物种多样性,通过综合评估这些指数,可以全面了解小鼠菌群的丰富度和多样性[31]。本研究结果表明,灌胃Efm-EV对小鼠肠道菌群丰富度和多样性均无显著影响,对小鼠的肠道菌群不会造成大幅度变化。
研究发现,拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)是构成肠道菌群的两个重要组成部分[32-33],这两个门类的相对比例对于维持肠道微生物群落的稳定和健康功能至关重要。厚壁菌门和拟杆菌门占小鼠菌群2/3以上[34-35],与本研究结果相似。当拟杆菌门的数量减少而厚壁菌门的数量增加时,有助于动物机体的热量吸收和能量代谢、维持肠道微生物区系稳定[36]。与PBS处理相比,在门水平上,Efm-EV处理小鼠中拟杆菌门的相对丰度有下降趋势,厚壁菌门的相对丰度有升高趋势。在科水平上,EfmEV处理小鼠中Muribaculaceae科的相对丰度有下降趋势,毛螺旋菌科的相对丰度稍有提高。Muribaculaceaeke科可产生具有分解碳水化合物的酶,其作为小鼠肠道中的优势菌群,促进肠上皮细胞的生长发育,在小鼠能量代谢中起重要作用[37-38]。丁酸盐作为微生物菌群产生的主要短链脂肪酸之一,能够增强上皮屏障完整性,抑制机体炎症反应,对维持机体胃肠道健康起重要作用[39]。Sanna等[40]研究表明,毛螺旋菌科(Lachnospiraceae)细菌可产生丁酸盐,能够提供能量并选择性上调紧密连接蛋白的表达机制,可维持小鼠的肠道屏障完整性,并且与肠道通透性呈负相关。
瘤胃球菌科可以分解较复杂的碳水化合物,与肠道的吸收、免疫等密切相关,在调节肠道微生物群平衡和维持肠上皮细胞的形态和功能方面具有关键作用[41-42],本试验研究结果显示,与PBS处理相比,在属水平上,灌胃Efm-EV显著提高了小鼠肠道瘤胃球菌科UCG009的相对丰度。以上研究结果表明,Efm-EV可调节小鼠肠道菌群,提高肠道有益菌的相对丰度,可能会促进短链脂肪酸的产生,改善肠道内环境。
4 结论灌胃Efm-EV不会影响小鼠的生长性能,可提高小鼠血清中IL-10的水平,降低血清中IgA、IgG的水平,从而提高机体对抗炎症的能力,可提高十二指肠绒隐比,改善肠道形态结构。通过菌群结构分析,灌胃Efm-EV能够提高小鼠粪便厚壁菌门(Firmicutes)的相对丰度,降低拟杆菌门(Bacteroidetes)的相对丰度,提高毛螺旋菌科(Lachnospiraceae)的丰度,降低Muribaculaceae科的相对丰度。在属水平上,可显著提高瘤胃球菌科UCG009的相对丰度(P<0.05)。综上所述,Efm-EV具有调节小鼠肠道菌群的潜力,可增加肠道有益菌数量,改善肠道内环境和形态结构。这种调节可能会刺激短链脂肪酸的产生,进一步促进肠道健康。Efm-EV作为一种新的“细胞信使”介导屎肠球菌的益生功能。
| [1] |
邓旭, 汤亦斌, 杨泽荣, 梁文佳, 甘若丽. 玉林三黄鸡肠道健康状况调查与分析[J]. 广东农业科学, 2010, 37(9): 158-160. DOI:10.16768/j.issn.1004-874X.2010.09.077 DENG X, TANG Y B, YANG Z R, LIANG W J, GAN R L. Investigation and analysis of intestinal health status of Yulin Sanhuang chickens[J]. Guangdong Agricultural Sciences, 2010, 37(9): 158-160. DOI:10.16768/j.issn.1004-874X.2010.09.077 |
| [2] |
LI X, MAO M, ZHANG Y, YU K, ZHU W. Succinate modulates intestinal barrier function and inflammation response in pigs[J]. Biomolecules, 2019, 9(9): 486. DOI:10.3390/biom9090486 |
| [3] |
SINGH R K, CHANG H W, YAN D, LEE K M, UCMAK D, WONG K, ABROUK M, FARAHNIK B, NAKAMURA M, ZHU T H, BHUTANI T, LIAO W. Influence of diet on the gut microbiome and implications for human health[J]. Journal of Translational Medicine, 2017, 15(1): 73. DOI:10.1186/s12967-017-1175-y |
| [4] |
BYBEE S N, SCORZA A V, LAPPIN M R. Effect of the probiotic Enterococcus faecium SF68 on presence of diarrhea in cats and dogs housed in an animal shelter[J]. Journal of Veterinary Internal Medicine, 2011, 25(4): 856-860. DOI:10.1111/j.1939-1676.2011.0738.x |
| [5] |
HE Y, LIU X, DONG Y, LEI J, ITO K, ZHANG B. Enterococcus faecium PNC01 isolated from the intestinal mucosa of chicken as an alternative for antibiotics to reduce feed conversion rate in broiler chickens[J]. Microbial Cell Factories, 2021, 20(1): 122. DOI:10.1186/s12934-021-01609-z |
| [6] |
HE W, NI W, ZHAO J. Enterococcus faecium alleviates gut barrier injury in C57BL/6 mice with dextran sulfate sodium-induced ulcerative colitis[J]. Gastroenterology Research and Practice, 2021, 2021: 2683465. DOI:10.1155/2021/2683465 |
| [7] |
BÄUERL C, COLL-MARǪUÉS J M, TARAZONA-GONZÁLEZ C, PÉREZ-MARTÍNEZ G. Lactobacillus casei extracellular vesicles stimulate EGFR pathway likely due to the presence of proteins P40 and P75 bound to their surface[J]. Scientific Reports, 2020, 10(1): 19237. DOI:10.1038/s41598-020-75930-9 |
| [8] |
XIE M Y, HOU L J, SUN J J, ZENG B, XI Q Y, LUO JY, CHEN T, ZHANG Y L. Porcine milk exosome miRNAs attenuate LPS-induced apoptosis through inhibiting TLR4/NF-κB and p53 pathways in intestinal epithelial cells[J]. Journal of Agricultural and Food Chemistry, 2019, 67(34): 9477-9491. DOI:10.1021/acs.jafc.9b02925 |
| [9] |
DOUANNE N, DONG G, AMIN A, BERNARDO L, BLANCHETTE M, LANGLAIS D, OLIVIER M, FERNANDEZ-PRADA C. Leishmania parasites exchange drug-resistance genes through extracellular vesicles[J]. Cell Reports, 2022, 40(3): 111121. DOI:10.1016/j.celrep.2022.111121 |
| [10] |
LIEBANA-JORDAN M, BROTONS B, FALCON-PEREZ J M, GONZALEZ E. Extracellular vesicles in the fungi kingdom[J]. International Journal of Molecular Sciences, 2021, 22(13): 7221. DOI:10.3390/ijms22137221 |
| [11] |
LIU J, SOLER N, GORLAS A, CVIRKAITE-KRUPOVIC V, KRUPOVIC M, FORTERRE P. Extracellular membrane vesicles and nanotubes in Archaea[J]. Microlife, 2021, 2: uqab007. DOI:10.1093/femsml/uqab007 |
| [12] |
CHEN X, WAN Z, YANG L, SONG S, FU Z, TANG K, CHEN L, SONG Y. Exosomes derived from reparative M2-like macrophages prevent bone loss in murine periodontitis models via IL-10 mRNA[J]. Journal of Nanobiotechnology, 2022, 20(1): 110. DOI:10.1186/s12951-022-01314-y |
| [13] |
WORK E, KNOX K W, VESK M. The chemistry and electron microscopy of an extracellular lipopolysaccharide from Escherichia coli[J]. Annals of the New York Academy of Sciences, 1966, 133(2): 438-449. DOI:10.1111/j.1749-6632.1966.tb52382.x |
| [14] |
KNOX K W, CULLEN J, WORK E. An extracellular lipopolysaccharide-phospholipid-protein complex produced by Escherichia coli grown under lysine-limiting conditions[J]. Biochem Journal, 1967, 103(1): 192-201. DOI:10.1042/bj1030192 |
| [15] |
BROWN L, WOLF J M, PRADOS-ROSALES R, CASADEVALL A. Through the wall: extracellular vesicles in Gram-positive bacteria, mycobacteria and fungi[J]. Nature Reviews Microbiology, 2015, 13(10): 620-630. DOI:10.1038/nrmicro3480 |
| [16] |
XIE J, LI Q, HAESEBROUCK F, VAN HOECKE L, VANDENBROUCKE R E. The tremendous biomedical potential of bacterial extracellular vesicles[J]. Trends in Biotechnology, 2022, 40(10): 1173-1194. DOI:10.1016/j.tibtech.2022.03.005 |
| [17] |
DORWARD D W, GARON C F. DNA is packaged within membrane-derived vesicles of gram-negative but not gram-positive bacteria[J]. Applied and Environmental Microbiology, 1990, 56(6): 1960-1962. DOI:10.1128/aem.56.6.1960-1962.1990 |
| [18] |
ELLIS T N, KUEHN M J. Virulence and immunomodulatory roles of bacterial outer membrane vesicles[J]. Microbiology and Molecular Biology Reviews: MMBR, 2010, 74(1): 81-94. DOI:10.1128/mmbr.00031-09 |
| [19] |
李春玲, 柯海意, 徐民生, 卞志标, 张昆丽, 李艳, 翟少伦. 革兰氏阴性病原菌外膜囊泡的生物学作用与机制研究进展[J]. 广东农业科学, 2023, 50(7): 1-10. DOI:10.16768/j.issn.1004-874X.2023.07.001 LI C L, KE H Y, XU M S, BIAN Z B, ZHANG K L, LI Y, ZHAI S L. Research progress on biological roles and mechanisms of outer membrane vesicles derived from gram-negative pathogenic bacteria[J]. Guangdong Agricultural Sciences, 2023, 50(7): 1-10. DOI:10.16768/j.issn.1004-874X.2023.07.001 |
| [20] |
TOYOFUKU M, NOMURA N, EBERL L. Types and origins of bacterial membrane vesicles[J]. Nature Reviews Microbiology, 2019, 17(1): 13-24. DOI:10.1038/s41579-018-0112-2 |
| [21] |
鄂晓迪, 肖蕴祺, 李梦梅, 施寿荣. 屎肠球菌在家禽生产中的应用及安全性研究进展[J]. 中国家禽, 2022, 44(5): 95-103. DOI:10.16372/j.issn.1004-6364.2022.05.015 E X D, XIAO Y Q, LI M M, SHI S R. Progress in the ap-plication and safety of Enterococcus faecium in poultry production[J]. Poultry in China, 2022, 44(5): 95-103. DOI:10.16372/j.issn.1004-6364.2022.05.015 |
| [22] |
欧秀玲, 蔡扩军, 徐敏, 李新玲. 屎肠球菌益生作用研究概述[J]. 新疆畜牧业, 2021, 36(2): 4-6. DOI:10.16795/j.cnki.xjxmy.2021.2.001 OU X L, CAI K J, XU M, LI X L. Overview of the pro-biotic effects of Enterococcus faecium[J]. Xinjiang Animal Husbandry, 2021, 36(2): 4-6. DOI:10.16795/j.cnki.xjxmy.2021.2.001 |
| [23] |
FOULǪUIÉ MORENO M R, SARANTINOPOULOS P, TSAKALIDOU E, DE-VUYST L. The role and application of enterococci in food and health[J]. International Journal of Food Microbiology, 2006, 106(1): 1-24. DOI:10.1016/j.ijfoodmicro.2005.06.026 |
| [24] |
TAN Q, XU H, AGUILAR Z P, PENG S, DONG S, WANG B, LI P, CHEN T, XU F, WEI H. Safety assessment and probiotic evaluation of Enterococcus faecium YF5 isolated from sourdough[J]. Journal of Food Science, 2013, 78(4): M587-M593. DOI:10.1111/1750-3841.12079 |
| [25] |
ABDEL-HAMID M S, ANIS A, ELBAWAB R H, MOHAMMED A A B, ORABI S H, FATHALLA S I. Distinctive antagonistic role of new Enterococcus faecium ER-3M strain and its bacteriocin effect against Staphylococcus aureus Pneumonia[J]. Rendiconti Lincei Scienze Fisiche e Naturali, 2018, 29(3): 675-690. DOI:10.1007/s12210-018-0722-7 |
| [26] |
薛洋. 腹泻仔猪脏器指数、肠道形态和胃肠道内容物pH特征及灌服粪肠球菌对其影响[D]. 南京: 南京农业大学, 2015. DOI: 10.7666/d.Y3184833. XUE Y. Organ index, intestinal morphology and pH characteristics of gastrointestinal contents in piglets with diarrhea and effects of Enterococcus faecalis gavage on them[D]. Nanjing: Nanjing Agricultural University, 2015. DOI: 10.7666/d.Y3184833. |
| [27] |
罗梅英, 凌铭旺, 詹洲玲, 郑将鸿, 钟晓彤, 欧春秀, 梁樱倩, 冯鑫, 王瑞晓, 黄得纯, 张辉华, 柒启恩. 溶血性葡萄球菌来源的细胞外囊泡对小鼠生长性能、免疫力、肠道形态与微生物区系的影响[J]. 动物营养学报, 2021, 33(8): 4719-4729. DOI:10.3969/j.issn.1006-267x.2021.08.050 LUO M Y, LING M W, ZHAN Z L, ZHEN J H, ZHONG X T, OU C X, LIANG Y Q, FENG X, WANG R X, HUANG D C, ZHANG H H, QI Q E. Effects of extracellular vesicles derived from Staphylococcus haemolyticus on growth performance, immunity, intestinal morphology and microbiota in mice[J]. Chinese Journal of Animal Nutrition, 2021, 33(8): 4719-4729. DOI:10.3969/j.issn.1006-267x.2021.08.050 |
| [28] |
BROOM L J, MILLER H M, KERR K G, KNAPP J S. Effects of zinc oxide and Enterococcus faecium SF68 dietary supplementation on the performance, intestinal microbiota and immune status of weaned piglets[J]. Research in Veterinary Science, 2006, 80(1): 45-54. DOI:10.1016/j.rvsc.2005.04.004 |
| [29] |
SABAT R, GRUTZ G, WARSZAWSKA K, KIRSCH S, WITTE E, WOLK K, GEGINAT J. Biology of interleukin-10[J]. Cytokine & Growth Factor Reviews, 2010, 21(5): 331-344. |
| [30] |
RÜTHLEIN J, IBE M, BURGHARDT W, MÖSSNER J, AUER I O. Immunoglobulin G (IgG), IgG1, and IgG2 determinations from endoscopic biopsy specimens in control, Crohn's disease, and ulcerative colitis subjects[J]. Gut, 1992, 33(4): 507-512. DOI:10.1136/gut.33.4.507 |
| [31] |
LYU Y, REN G, REN X. Changes of intestinal flora and lymphocyte subsets in patients with chronic renal failure[J]. Evidence-Based Complementary and Alternative Medicine, 2021, 2021: 4288739. DOI:10.1155/2021/4288739 |
| [32] |
李英, 吴庆华, 杨华林, 李利, 余知和, 王允. 阿魏酸对抗生素应激小鼠血清抗氧化性及其肠道微生物的影响[J]. 广东农业科学, 2021, 48(6): 116-125. DOI:10.16768/j.issn.1004-874X.2021.06.016 LI Y, WU Q Y, YANG H L, LI L, YU Z Z, WANG Y. Effects of ferulic acid on serum antioxidant capacity and intestinal microflora in antibiotic stressed mice[J]. Guangdong Agricultural Sciences, 2021, 48(6): 116-125. DOI:10.16768/j.issn.1004-874X.2021.06.016 |
| [33] |
田力, 邱丹缨, 温扬敏. 蛋白核小球藻对小鼠抗氧化及肠道细菌的影响[J]. 广东农业科学, 2021, 48(2): 138-145. DOI:10.16768/j.issn.1004-874X.2021.02.018 TIAN L, QIU D Y, WEN Y M. Effect of Chlorella pyrenoidosa on antioxidant and intestinal bacterial in mice[J]. Guangdong Agricultural Sciences, 2021, 48(2): 138-145. DOI:10.16768/j.issn.1004-874X.2021.02.018 |
| [34] |
NKOSI B V Z, PADAYACHEE T, GRONT D, NELSON D R, SYED K. Contrasting health effects of bacteroidetes and firmicutes lies in their genomes: Analysis of P450s, ferredoxins, and secondary metabolite clusters[J]. International Journal of Molecular Sciences, 2022, 23(9): 5057. DOI:10.3390/ijms23095057 |
| [35] |
FAN J, WANG Y, YOU Y, AI Z, DAI W, PIAO C, LIU J, WANG Y. Fermented ginseng improved alcohol liver injury in association with changes in the gut microbiota of mice[J]. Food & Function, 2019, 10(9): 5566-5573. DOI:10.1039/c9fo01415b |
| [36] |
ABDALLAH I N, RAGAB S H, ABD E A, SHOEIB A R, ALHOSARY Y, FEKRY D. Frequency of Firmicutes and Bacteroidetes in gut microbiota in obese and normal weight Egyptian children and adults[J]. Archives of Medical Science: AMS, 2011, 7(3): 501-507. DOI:10.5114/aoms.2011.23418 |
| [37] |
LAGKOUVARDOS I, LESKER T R, HITCH T C A, GÁLVEZ E J C, SMIT N, NEUHAUS K, WANG J, BAINES J F, ABT B, STECHER B, OVERMANN J, STROWIG T, CLAVEL T. Sequence and cultivation study of Muribaculaceae reveals novel species, host preference, and functional potential of this yet undescribed family[J]. Microbiome, 2019, 7(1): 28. DOI:10.1186/s40168-019-0637-2 |
| [38] |
王伯韬. 青春双歧杆菌对高脂饮食引发肥胖症的缓解作用与机制研究[D]. 无锡: 江南大学, 2021. DOI: 10.27169/d.cnki.gwqgu.2021.000043. WANG B T. Effect of Bifidobacterium youth on obesity induced by high-fat diet and its mechanism[D]. Wuxi: Jiangnan University, 2021. DOI: 10.27169/d.cnki.gwqgu.2021.000043. |
| [39] |
HU S, WANG J, XU Y, YANG H, WANG J, XUE C, YAN X, SU L. Anti-inflammation effects of fucosylated chondroitin sulphate from Acaudina molpadioides by altering gut microbiota in obese mice[J]. Food & Function, 2019, 10(3): 1736-1746. DOI:10.1039/c8fo02364f |
| [40] |
SANNA S, VAN ZUYDAM N R, MAHAJAN A, KURILSHIKOV A, VICH VILA A, VÕSA U, MUJAGIC Z, MASCLEE A A M, JONKERS D, OOSTING M, JOOSTEN L A B, NETEA M G, FRANKE L, ZHERNAKOVA A, FU J, WIJMENGA C, MCCARTHY M I. Causal relationships among the gut microbiome, short-chain fatty acids and metabolic diseases[J]. Nature Genetics, 2019, 51(4): 600-605. DOI:10.1038/s41588-019-0350-x |
| [41] |
LEE K A, KIM S H, KIM E K, HA E M, YOU H, KIM B, KIM M J, KWON Y, RYU J H, LEE W J. Bacterial-derived uracil as a modulator of mucosal immunity and gut-microbe homeostasis in Drosophila[J]. Cell, 2013, 153(4): 797-811. DOI:10.1016/j.cell.2013.04.009 |
| [42] |
ZHANG H, LANG X, ZHANG Y, WANG C. Distribution of bacteria in different regions of the small intestine with Zanthoxylum bungeanum essential oil supplement in small-tailed Han sheep[J]. Frontiers in Microbiology, 2022, 13: 1062077. DOI:10.3389/fmicb.2022.1062077 |
(责任编辑 崔建勋)
 2024, Vol. 51
2024, Vol. 51