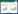文章信息
基金项目
- 广东省乡村振兴战略专项资金种业振兴项目(2022-SPY-00-013);中国水产科学研究院基本科研业务费资助项目(2023TD58)
作者简介
- 林欣(1998—),女,在读硕士生,研究方向为鱼类生物学,E-mail:1600662461@qq.com.
通讯作者
- 区又君(1964—),女,研究员,研究方向为鱼类及其发育生物学与水产增养殖技术,E-mail:ouyoujun@126.com.
文章历史
- 收稿日期:2023-12-15
2. 大连海洋大学水产与生命学院,辽宁 大连 116000;
3. 上海海洋大学水产与生命学院,上海 201306
2. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116000, China;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
【研究意义】四指马鲅(Eleutheronema tetradactylum)隶属于鲻形目(Mugiliformes)马鲅亚目(Polynemoidei)马鲅科(Polynemidae),俗称马友、午笋、午鱼等[1]。四指马鲅以其肉质鲜美、生长速度快、营养价值高而倍受人们喜爱,是一种极具发展潜力的鱼类[2]。养殖过程中,水体的溶解氧含量与鱼的生存状态有直接关系,而养殖池塘是一个独立的生态气候,一直处于动态变化过程中,非常容易受到外部影响。例如,雷雨天气时气压低、风力弱,气体交换量减少,或者人工养殖密度过高等情况,水体均容易出现低氧现象[3-4]。鱼类在应对低氧胁迫的过程中易造成机体内部失衡,引起机体组织和器官畸形,从而影响其生存。因此,研究低氧胁迫对四指马鲅组织器官的影响,对于促进其健康养殖具有一定的指导作用。【前人研究进展】鱼类低氧胁迫相关研究发现,卵形鲳鲹(Trachinotus ovatus)在急、慢性低氧胁迫下肝脏和鳃器官的生理组织及相关基因表达发生变化,肝组织间出现空泡化、肝小叶损伤,肝细胞内线粒体数量减少[5-6]。军曹鱼幼鱼(Rachycentron canadum)经低氧处理后,鳃小片血管收缩并出现轻微弯曲,其中红细胞数量增加,基底部的黏液细胞和线粒体丰富细胞数量增多,肝组织出现无序和空泡[7-9]。杂交黄颡鱼‘黄优1号’(Pelteobagrus vachelli ♂×Peteobagrus fulvidraco ♀)受低氧胁迫时,随着时间延长其肠道组织出现杯状细胞肿胀、肠粘膜坏死、肠绒毛糜烂的现象[10]。低氧状态下许氏平鲉(Sebastes schlegelii)的鳃丝基部充血萎缩,上皮细胞排列紊乱,上皮细胞和分泌氯化物的细胞出现空泡,鳃片逐渐变短、卷曲等[11]。青海湖裸(Gymnocypris przewalskii)受中度低氧胁迫时,肝组织结构出现肝血窦扩张,血窦内红细胞数量增多,重度低氧胁迫后肝细胞出现空泡化,且随低氧胁迫时间延长肝细胞空泡变性更严重[12]。团头鲂(Megalobrama amblycephala)处于低氧胁迫状态时鳃小片充血、弯曲变形,上皮细胞水肿脱落;肝细胞无序化,血窦扩张;肾小球萎缩,肾小管管腔缩小,上皮细胞轮廓模糊,甚至坏死,氧化损伤症状随着胁迫时间延长而加剧[13]。【本研究切入点】在一定的溶氧变化范围内鱼类能够正常生存,但如果溶解氧变化超出其适应性就会引起应激甚至死亡。对于水体溶氧变化,不同鱼类的应对机制各不相同。四指马鲅是我国近年发展起来的一种新型经济鱼种,在种群结构[14-16]、寄生虫病害、养殖生物学[17]、发育生物学[18-19]等领域已有较多研究,但低氧胁迫对四指马鲅脾脏和心脏组织形态变化的影响研究尚未见报道。【拟解决的关键问题】本研究拟以四指马鲅为研究对象,采用组织切片显微成像等方法,对缺氧条件下脾脏、心脏等器官的动态变化规律进行系统研究,以期揭示其对缺氧环境的适应机制,为其养殖提供理论依据。
1 材料与方法 1.1 试验材料试验用鱼为南海水产研究所广东省中山科技成果转化基地自繁自育所得,共90尾,平均全长为4.91(±0.2)cm,体质量为0.92(±0.13)g。试验开始前进行1周短期培养,养殖温度为22 ℃,水体盐度为4,24 h不间断充气,使水体溶解氧不小于6 mg/L;每天进行1次换水,换水量为1/3;每天9:00、18:00各投喂1次,投喂1 h后及时清除残饵和粪便,试验前停饲1 d。
1.2 试验方法1.2.1 试验设计 试验设置常氧组(CK)、中度低氧组和重度低氧组,各试验处理设3个平行,将四指马鲅幼鱼随机分至规格为30 cm×30 cm×45 cm、实际水体为27 L的水槽中,每个试验组水槽中放入10尾四指马鲅幼鱼。试验过程关闭流水,用YSIProODO光学溶解氧测量仪实时监测水体溶氧水平。常氧组溶氧充气条件保持暂养水平,测量溶氧量为6.33(±0.15)mg/L时开始计时;随后往低氧组水槽内充入氮气,使水中氧气快速溢出降低水体溶解氧含量,中度低氧组在10 min内将水体溶氧量降至3.99(±0.18)mg/L,用保鲜膜密封水槽上方,通过调节充气阀保持溶氧水平,开始计时;重度低氧组在10 min内将水体溶氧量降至2.05(±0.15)mg/L,用保鲜膜密封水槽上方,通过调节充气阀大小保持相应的溶氧水平,试验开始计时。试验全程维持低氧处理,低氧组幼鱼死亡过半时采集样本,其他环境条件与暂养时一致。
1.2.2 样品采集及石蜡切片制作 在试验29 h时从每个试验组随机选取10尾鱼,逐尾剖取心脏和脾脏,分别放入2 mL离心管中,倒入4%多聚甲醛溶液进行固定。组织切片制作如下:用长流水冲洗12 h,用50%~100%乙醇进行梯度脱水(50%乙醇2 h、70%乙醇4 h、80%乙醇2 h、85%乙醇2 h、95%乙醇45 min×2次、100%乙醇45 min×2次),再用二甲苯进行透明处理(1/2无水乙醇+1/2二甲苯混合溶液1 h、二甲苯15 min×2次),浸蜡(石蜡2 h×2次),用石蜡进行包埋,石蜡包埋处理后用Leica切片机进行连续切片,切片厚度4~6 μm,用HE染色和中性树脂封片,在ZEISS Axio Scope.A1型光学显微镜(德国)下观察并摄影记录。
1.3 数据处理采用IBM SPSS 26.0软件在单因素方差分析的基础上,采用Duncan多重比较法进行分析,以P<0.05作为差异显著的标准。
2 结果与分析 2.1 不同溶氧水平下四指马鲅幼鱼的行为变化及死亡率本研究将四指马鲅幼鱼直接放入不同溶解氧的环境下,常氧组幼鱼在水箱中自由、快速游动,呼吸频率正常。中度低氧组幼鱼在试验开始前期未出现异常,16 h后出现浮头现象,随着胁迫时长增加,幼鱼鳃盖张开幅度增加,且游动时开始侧倾不能保持平衡;20 h后部分幼鱼跃出水面,出现咧鳃等情况,随后幼鱼静卧水槽底部,鳃盖张合缓慢且不连续,最后死亡。重度低氧组幼鱼在试验开始时即出现焦躁状态,在水中乱窜,一段时间后幼鱼状态平稳,7 h后幼鱼游动速度减慢,并向水面游动和浮头;16 h时,幼鱼出现跃出水面的情况,一段时间后静卧水槽底部,鳃盖张合不连续、咧鳃,最后死亡。由表 1可见,不同溶氧水平下四指马鲅幼鱼的死亡情况不同,对照组在试验过程中未出现幼鱼死亡;试验23 h后,中度低氧组幼鱼死亡率为10.0%,重度低氧组幼鱼死亡率为13.3%;随着低氧胁迫时间的延长幼鱼死亡率显著上升(P<0.05),结果表明,试验26 h后,中度低氧组和重度低氧组幼鱼死亡率分别为30.0% 和40.0%;试验29 h后,中度低氧组和重度低氧组幼鱼死亡率分别为43.3%,和53.3%。
|
2.2 不同溶氧水平下四指马鲅幼鱼的组织显微结构变化
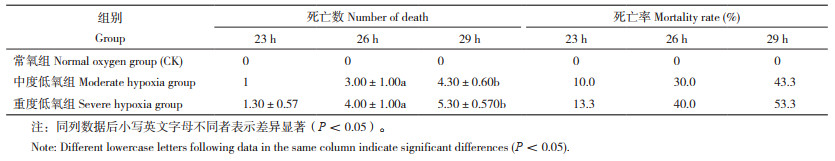
2.2.1 脾脏显微结构变化 通过组织病理学观察,发现常氧组幼鱼脾髓分布整个脾脏,红髓、白髓呈混合分布,界限不明显;黑色素巨噬细胞分布集中且数量较多(图 1A、B)。中度低氧组四指马鲅幼鱼与常氧组比较,其脾脏组织白髓增多,淋巴细胞数量增多,周围红髓稀散分布,黑素巨噬细胞数量减少(图 1C、D)。重度低氧组幼鱼与常氧组相比,脾脏组织充满红细胞,红髓面积扩大,白髓面积减小,淋巴细胞数量减少,黑色素巨噬细胞极少出现(图 1E、F)。
|
|
A、B:常氧组;C、D:中度低氧组;E、F:重度低氧组 WP:白髓;RP:红髓;MMCs:黑色素巨噬细胞;LYM:淋巴细胞;RBC:红细胞 A, B: Normal oxygen group (CK); C, D: Moderate hypoxia group; E, F: Severe hypoxia group WP: White pulp; RP: Red pulp; MMCs: Melanin macrophages; LYM: Lymphocyte; RBC: Erythrocyte 图 1 四指马鲅幼鱼脾脏显微结构(200×) Fig. 1 Microstructure of the spleen of Eleutheronema tetradactylum (200×) |
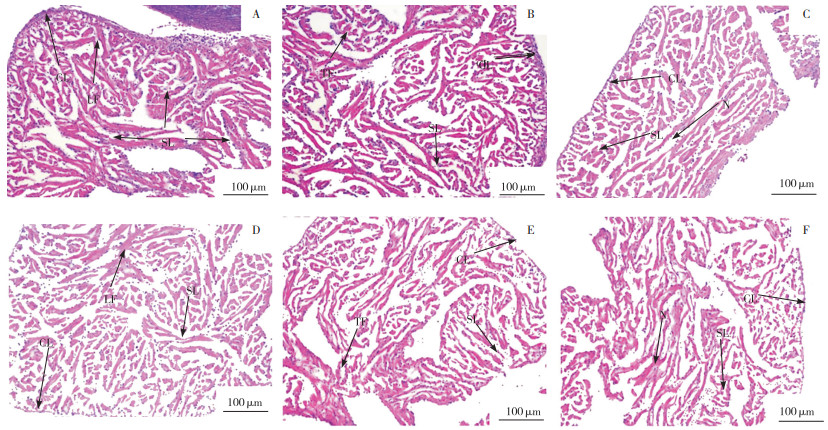
2.2.2 心脏显微结构变化 通过组织病理学观察,常氧组四指马鲅幼鱼心肌分层现象明显,分为表面致密层和内部多孔的海绵层;心肌纤维排列整齐、纹理清晰(图 2A、B)。中度低氧组幼鱼与常氧组相比,其心脏组织致密层变薄,海绵层心肌纤维变细,间距变宽;部分心肌纤维出现断裂现象(图 2C、D)。重度低氧组幼鱼的心脏组织致密层变薄程度加大,海绵层心肌纤维变细,间质空间相比低氧组扩张程度加重。部分心肌细胞破裂,细胞核突出;心肌纤维断裂,排列紊乱(图 2E、F)。
|
|
A、B:常氧组;C、D:中度低氧组;E、F:重度低氧组 CL:致密层;SL:海绵层;LF:心肌纤维(纵切);TF:心肌纤维(横切);N:心肌细胞核 A, B: Normal oxygen group (CK); C, D: Moderate hypoxia group; E, F: Severe hypoxia group CL: Compact layer; SL: Sponge layer; LF: Myocardial fiber (longitudinal section); TF: Myocardial fibers (transverse section); N: Myocardial cell nucleus 图 2 四指马鲅幼鱼心脏显微结构(200×) Fig. 2 Microstructure of the heart of Eleutheronema tetradactylum (200×) |
3 讨论 3.1 不同溶氧水平对四指马鲅幼鱼存活率的影响
四指马鲅为活泼性鱼类,游泳速度较快,对氧气需求较高,因此溶解氧是影响四指马鲅存活至关重要的影响因素之一。在面临水环境溶氧变化时,鱼类需要消耗大量能量进行调节以保护机体免受伤害[5-7],当超过适应能力范围时,将导致组织结构受损,影响其存活[11-12]。本研究发现,中度低氧组(3.99±0.18 mg/L)和重度低氧组(2.05±0.15 mg/L)四指马鲅幼鱼随着胁迫时间延长其死亡率均升高,相同胁迫时长下重度低氧组的死亡率较中度低氧组高。低氧胁迫开始后,幼鱼通过降低其游动速度减少氧气量消耗来适应相对低氧的水环境;随着胁迫时间延长,幼鱼无法适应溶氧水平变化,逐渐出现死亡。研究结果表明,长时间低氧水平会严重影响四指马鲅幼鱼的存活率,当水体溶解氧小于2.05(±0.15)mg/L时,幼鱼出现死亡。
3.2 不同溶氧水平对四指马鲅幼鱼脾脏组织结构的影响脾脏是硬骨鱼类免疫、造血、滤血的关键器官,其免疫细胞主要包括淋巴细胞、颗粒细胞、巨噬细胞等[20],在机体的免疫系统中具有重要地位[21]。低氧会引起免疫细胞功能失调,进而促进病变组织功能紊乱和疾病发展[22]。本研究中,溶氧水平为3.99(±0.18)mg/L的中度低氧组四指马鲅幼鱼相比常氧组,脾脏组织中白髓分布增多,相对周围红髓稀散分布。白髓是产生淋巴细胞、粒细胞的中心场所,如T细胞和B细胞等,T细胞作为抗原呈递介质在细胞免疫中起重要作用,B细胞可产生抗体进行免疫应答功能[23]。白髓分布增多表明四指马鲅为应对低氧环境增强了机体的免疫功能。而溶氧水平为2.05(±0.15)mg/L的重度低氧组四指马鲅幼鱼,脾脏组织充满红细胞,红髓面积扩大,白髓面积减小,淋巴细胞数量减少,黑色素巨噬细胞极少出现。巨噬细胞和嗜中性粒细胞是产生吞噬效应的主要免疫细胞[24]。吞噬作用是一种很重要的自然免疫系统,在清除病原微生物的过程中具有十分重要的作用,与低氧有关的全身性炎症反应也密切相关。随着氧气浓度下降,黑色素巨噬细胞也在减少,表明四指马鲅的免疫应答系统损伤,整体的免疫细胞功能减弱,导致巨噬细胞结构受损,阻碍了黑色素巨噬细胞的生成。Fritzenwanger等[25]研究发现,短期系统性低氧暴露会增加中性粒细胞的吞噬能力。由此可见,溶氧水平的变化会使机体对血氧分压的敏感程度发生变化,从而引起组织微环境的变化,对其生理机能产生重大影响。
3.3 不同溶氧水平对四指马鲅幼鱼心脏组织结构的影响心脏是鱼类最重要的供能器官,与机体物质运输、稳态维持及防御等功能密切相关。鱼的心脏由心房、心室、动脉锥和静脉窦4部分组成,其中心房与心室之间无独立腔,环模式为单循环循[26]。鱼的心室与心房由小梁组成,它们之间相互连接,部分鱼的心外膜区有明显的层化,心内膜区有疏松的海绵层。四指马鲅幼鱼心脏组织中致密层与海绵层分层明显,同时心机纤维排列整齐,肌原纤维清晰。致密层一般出现在大量消耗能量的鱼类心脏中,而没有致密组织的鱼类则往往对新陈代谢能量的需求较低[27]。由此推断,致密层的厚度与新陈代谢能力有关。本研究发现,溶氧水平为3.99(±0.18)mg/L的中度低氧组四指马鲅幼鱼的心脏组织致密层明显变薄,海绵层的心肌纤维变细,间质增宽;部分心肌纤维断裂。溶氧水平为2.05(±0.15)mg/L的重度低氧组中,四指马鲅幼鱼的心脏致密层与中度低氧组相比变得更薄,海绵层的心肌纤维变细、间质增宽;部分心肌细胞破裂,细胞核突出,心肌纤维断裂。心脏致密层变薄可能由于低氧状态下心脏受到损伤的同时,新陈代谢能力也有所下降,并且随着溶氧水平的下降,其新陈代谢能力下降程度更为明显。冯振龙等[28]研究低氧环境对大鼠心脏结构的影响,发现低氧胁迫后心肌变薄、间质变宽、血管扩大,部分心肌细胞出现断裂和肿胀,肌浆凝集、红染,出现横纹模糊等病理变化,这与本研究结果相似。不同低氧水平均造成四指马鲅幼鱼的心脏结构发生损伤性改变,为保护机体抵御损伤,调节新陈代谢速率以减少氧气消耗,这可能是四指马鲅适应低氧环境的调节机制。
4 结论水体溶解氧的变化对四指马鲅幼鱼存活率的影响至关重要,常氧组中四指马鲅幼鱼无死亡现象,当水体中溶解氧含量为3.99(±0.18)、2.05(±0.15)mg/L时,幼鱼胁迫29 h的死亡率分别达43.3%、53.3%%。当幼鱼受到低氧胁迫后其免疫系统被激活,脾脏组织中白髓增多,淋巴细胞数量增多,周围红髓稀散分布,黑素巨噬细胞数量减少。当幼鱼应激更强烈时,其脾脏组织中红髓面积扩大,白髓面积减小,淋巴细胞数量减少。溶解氧含量为3.99(±0.18)mg/L时,幼鱼的心脏组织致密层变薄,海绵层心肌纤维变细,间距变宽;出现部分心肌纤维断裂现象,溶解氧含量为2.05(±0.15)mg/L时,致密层变薄程度加大,部分心肌细胞破裂。水体中溶解氧急剧降低时会对四指马鲅幼鱼造成严重的低氧损伤,且随溶解氧下降加快幼鱼组织微观结构损伤程度加重。
| [1] |
孙典荣, 陈铮. 南海鱼类检索: 上册[M]. 北京: 海洋出版社, 2013: 380-382. SUN D R, CHEN Z. South China sea fish search: Vol Ⅰ[M]. Beijing: Ocean Press, 2013: 380-382. |
| [2] |
NESARUL H M, HENA M K A, SAIFULLAH S M, IDRIS M H. Breeding biology of Eleutheronema tetradactylum (Shaw, 1804) from the Bay of Bengal, Indian Ocean[J]. World Applied Sciences Journal, 2014, 30(2): 240-244. DOI:10.5829/idoisi.wasj.2014.30.02.82285 |
| [3] |
朱浩, 刘兴国, 王健, 顾兆俊, 程果锋, LIN C K. 养殖水体不同水层水质变化研究[J]. 渔业现代化, 2012, 39(4): 12-15. DOI:10.3969/j.issn.007-9580.2012.04.003 ZHU H, LIU X G, WANG J, GU Z J, CHEN G F, LIN C K. Study on characteristics of the vertical variation in aquaculture pond water[J]. Fishery Modernization, 2012, 39(4): 12-15. DOI:10.3969/j.issn.007-9580.2012.04.003 |
| [4] |
周礼敬, 刘桂兰, 杨林. 夏季池塘养鱼缺氧防治措施[J]. 科学种养, 2019(8): 55. DOI:10.13270/j.cnki.kxzh.2019.08.028 ZHOU L J, LIU G L, YANG L. Measures for preventing and controlling hypoxia in pond fish farming in summer[J]. Scientific Breeding, 2019(8): 55. DOI:10.13270/j.cnki.kxzh.2019.08.028 |
| [5] |
陈世喜, 王鹏飞, 区又君, 李加儿, 温久福, 王雯, 谢木娇. 急性和慢性低氧胁迫对卵形鲳鲹鳃器官的影响[J]. 南方水产科学, 2017, 13(1): 124-130. DOI:10.3969/j.issn.2095-0780.2017.01.016 CHEN S X, WANG P F, OU Y J, LI J E, WEN J F, WANG W, XIE M J. Acute and chronic hypoxia effect on gills of golden pompano (Trachinotus ovatus)[J]. South China Fisheries Science, 2017, 13(1): 124-130. DOI:10.3969/j.issn.2095-0780.2017.01.016 |
| [6] |
陈世喜, 王鹏飞, 区又君, 李加儿, 温久福, 王雯, 谢木娇. 急性和慢性低氧胁迫对卵形鲳鲹幼鱼肝组织损伤和抗氧化的影响[J]. 动物学杂志, 2016, 51(6): 1049-1058. DOI:10.13859/j.cjz.201606013 CHEN S X, WANG P F, OU Y J, LI J E, WEN J F, WANG W, XIE M J. The effect of acute and conic hypoxia stress on liver tissue structure and oxidation in juvenile golden pompano (Trachinotus ovatus)[J]. Chinese Journal of Zoology, 2016, 51(6): 1049-1058. DOI:10.13859/j.cjz.201606013 |
| [7] |
郭志雄, 曾泽乾, 黄建盛, 王维政, 李洪娟, 陈刚. 急性低氧胁迫对大规格军曹鱼幼鱼肝脏氧化应激、能量利用及糖代谢的影响[J]. 广东海洋大学报, 2020, 40(3): 134-140. DOI:10.3969/j.issn.1673-9159.2020.03.017 GUO Z X, ZENG Z Q, HUANG J S, WANG W Z, LI H J, CHEN G. Effects of acute hypoxia on oxidative stress, energy utilization and carbohydrate metabolism in liver of large-sized juvenile cobia (Rachycentron canadum)[J]. Journal of Guangdong Ocean University, 2020, 40(3): 134-140. DOI:10.3969/j.issn.1673-9159.2020.03.017 |
| [8] |
黄建盛, 陆枝, 陈刚, 张健东, 郭志雄, 洪越群. 急性低氧胁迫对军曹鱼大规格幼鱼血液生化指标的影响[J]. 海洋学报, 2019, 41(6): 76-84. DOI:10.3969/j.issn.0253-4193.2019.06.007 HUANG J S, LU Z, CHEN G, ZHANG J D, GUO Z X, HONG Y Q. Acute hypoxia stress on blood biochemical indexes of large-sized juvenile cobia(Rachycenron canadum)[J]. Haiyang Xuebao, 2019, 41(6): 76-84. DOI:10.3969/j.issn.0253-4193.2019.06.007 |
| [9] |
王维政, 曾泽乾, 黄建盛, 郭志雄, 李洪娟, 陈刚. 低氧胁迫对军曹鱼幼鱼抗氧化、免疫能力及能量代谢的影响[J]. 广东海洋大学学报, 2020, 40(5): 12-18. DOI:10.3969/j.issn.1673-9159.2020.05.022 WANG W Z, ZENG Z Q, HUANG J S, GUO Z X, LI H J, CHEN G. Effects of hypoxia stress on antioxidation, immunity and energy metabolism of juvenile cobia, Rachycentron canadum[J]. Journal of Guangdong Ocean University, 2020, 40(5): 12-18. DOI:10.3969/j.issn.1673-9159.2020.05.022 |
| [10] |
程景颢, 李谣, 沈铭浩, 杨智茹, 张伟健, 张凯, 王涛, 张国松, 尹绍武. 低氧胁迫和恢复对杂交黄颡鱼'黄优1号'肠道组织的影响[J]. 水生生物学报, 2022, 46(1): 1598-1608. DOI:10.7541/2023.2021.0342 CHENG J H, LI Y, SHEN M H, YANG Z R, ZHANG W J, ZHANG K, WANG T, ZHANG G S, YIN S W. Hypoxia stress and recovery on intestinal tissue of hybrid yellow catfish" Huangyou-1 (Pelteobagrus vachelli ♂×Peteobagrus fulvidraco ♀)[J]. Acta Hydrobiologica Sinica, 2022, 46(1): 1598-1608. DOI:10.7541/2023.2021.0342 |
| [11] |
高云涛, 高云红, 李明月, 王嘉伟, 孟振, 关长涛, 贾玉东. 许氏平鲉低氧耐受能力及血液学和鳃组织学变化[J]. 水产学报, 2023, 47(9): 40-51. DOI:10.11964/jfc.20210813028 GAO Y T, GAO Y H, LI M Y, WANG J W, MENG Z, GUANG C T, JIA Y D. Hypoxia tolerance and alternation of hematology and gill morphology in black rockfish (Sebastes schlegelii)[J]. Journal of Fisheries of China, 2023, 47(9): 40-51. DOI:10.11964/jfc.20210813028 |
| [12] |
陈付菊, 多杰当智, 付生云, 马敏, 赵宇田, 常兰. 不同溶解氧水平对青海湖裸鲤肝组织结构及抗氧化酶活性的影响[J]. 淡水渔业, 2021, 51(5): 13-20. DOI:10.13721/j.cnki.dsyy.2021.05.002 CHEN F J, DUOJIE D Z, FU S Y, MA M, ZHAO Y T, CHANG L. Effects of different dissolved oxygen levels on the liver tissue structure and antioxidant enzyme activities of Lake Qinghai Gymnocypris przewalskii[J]. Freshwater Fisheries, 2021, 51(5): 13-20. DOI:10.13721/j.cnki.dsyy.2021.05.002 |
| [13] |
王燚纬. 低氧、养殖密度对团头鲂生理生化指标和组织结构的影响[D]. 上海: 上海海洋大学, 2019: 32-34. DOI: 10.27314/d.cnki.gsscu.2019.000141. WANG Y W. Effects of hypoxia and culture density on physiological and biochemical indexes and tissue structure of Megalobrama amblycephala[D]. Shanghai: Shanghai Ocean Univerdsity, 2019: 32-34. DOI: 10.27314/d.cnki.gsscu.2019.000141. |
| [14] |
WANG G H, HAO R C, YANG G Z, ZAN L S. The complete mitochondrial genome sequence of Eleutheronema tetradactylum (Mugiliformes: Polynemidae) and phylogenetic studies of Mugiliformes[J]. Mitochondrial DNA (Part A), 2015, 27(6): 4457-4458. DOI:10.3109/19401736.2015.1089569 |
| [15] |
BALLGH A C, WELCH D J, NEWMAN S J, ALLOP Q, STAPLEY J M. Stock structure of the blue threadfin (Eleutheronema tetradactylum) across northern Australia derived from life-history characteristics[J]. Fisheries Research, 2012(121/122): 63-72. DOI:10.1016/j.fishres.2012.01.011 |
| [16] |
区又君, 谢木娇, 李加儿, 温久福, 周慧, 刘奇奇. 广东池塘培育四指马鲅亲鱼初次性成熟和苗种规模化繁育技术研究[J]. 南方水产科学, 2017, 13(4): 97-104. DOI:10.3969/j.issn.2095-0780.2017.04.012 OU Y J, XIE M J, LI J E, WEN J F, ZHOU H, LIU Q Q. First maturation and mass seedling propagation of cultured Eleutheronema tetradactylum in Guangdong Province[J]. South China Fisheries Science, 2017, 13(4): 97-104. DOI:10.3969/j.issn.2095-0780.2017.04.012 |
| [17] |
牛莹月. 四指马鲅(Eleutheronema tetradactylum)鳃结构发育以及应对盐度和低温胁迫的影响研究[D]. 上海: 上海海洋大学, 2021: 9-16. DOI: 10.27314/d.cnki.gsscu.2021.000203. NIU Y Y. The organization structure and early development of gill and its adaptation mechanism to salinity and low temperature stress in Eleutheronema tetradactylum[D]. Shanhai: Shanghai Ocean University, 2021: 9-16. DOI: 10.27314/d.cnki.gsscu.2021.000203. |
| [18] |
周慧, 李加儿, 区又君, 温久福, 王鹏飞, 谢木娇, 刘奇奇, 赵彦花. 四指马鲅视网膜早期发育的组织学研究[J]. 动物学杂志, 2017, 52(3): 458-467. DOI: 10.13859/j.cjz.201703012. ZHOU H, LI J E, OU Y J, WEN J F, XIE M J, LIU Q Q, ZHAO Y H. Histological observation on the development of retina in fourfinger threadfin (Eleutheronema tetradactylum) larvae[J]. Chinese Journal of Zoology, 2017, 52(3): 458-467. DOI: 10.13859/j.cjz.201703012. |
| [19] |
谢木娇, 区又君, 温久福, 李加儿, 周慧, 王鹏飞, 刘奇奇. 四指马鲅胚胎发育观察[J]. 应用海洋学学报, 2016, 35(3): 405-411. DOI:10.3969/J.ISSN.2095-4972.2016.03.012 XIE M J, OU Y J, WEN J F, LI J E, ZHOU H, WANG P F, LIU Q Q. Observation on embryonic development of Eleutheronema tetradactylum[J]. Journal of Applied Oceanography, 2016, 35(3): 405-411. DOI:10.3969/J.ISSN.2095-4972.2016.03.012 |
| [20] |
STEINIGER B, BARTH P. Microanatomy and function of the spleen[J]. Advances in Anatomy Embryology and Cell Biology, 2000, 151: 1-10. DOI:10.1007/978-3-642-57088-9 |
| [21] |
王鸿鹄, 李长玲, 曹伏君, 简纪常. 红笛鲷头肾和脾脏显微结构的观察[J]. 台湾海峡, 2006(3): 360-367. DOI:10.3969/j.issn.1000-8160.2006.03.009 WANG H H, LI C L, CAO F J, JIAN J C. Microstructure of head-kidney and spleen in Lujanus sanguineus[J]. Journal of Oceanography in Taiwan Strait, 2006(3): 360-367. DOI:10.3969/j.issn.1000-8160.2006.03.009 |
| [22] |
BERINGER A, NOASSCK M, MIOSSEC P. IL-17 in chronic inflammation: From discovery to targeting[J]. Trends in Molecular Medicine, 2016, 22(3): 230-241. DOI:10.1016/j.molmed.2016.01.00 |
| [23] |
罗俊标, 谢木娇, 区又君, 温久福, 李加儿, 王鹏飞. 四指马鲅头肾和脾脏组织学研究[J]. 生物学杂志, 2016, 33(4): 43-47. DOI:10.3969/j.issn.2095-1736.2016.04.043 LUO J B, XIE M J, OU Y J, WEN J F, LI J E, WANG P F. Studies on the morphology and histology of head-kidney and spleen in Eleutheronema tetradactylum[J]. Journal of Biology, 2016, 33(4): 43-47. DOI:10.3969/j.issn.2095-1736.2016.04.043 |
| [24] |
HACKAM D J, LI J, DAI S A, ANAND R J, RIPPEL C, QURESHI F, STOLZ D B, LEAPHART C, SORDHI C, GRIBAR S C, KOHLER J W. Activated macrophages inhibit enterocyte gap junctions via the release of nitric oxide[J]. American Journal of Physiology: Gastrointestinal and Liver Physiology, 2008, 294(1): 109-119. DOI:10.1152/ajpgi.00331.2007 |
| [25] |
FRITZENWAIGER M, JUNG C, GOEBEL B, LAUTEN A, FIGULLA H R. Impact of short-term systemic hypoxia on phagocytosis, cytokine production, and transcription factor activation in peripheral blood cells[J]. Mediators of Inflammation, 2011(5): 429-501. DOI:10.1155/2011/429501 |
| [26] |
王新栋. 斑马鱼脾脏、心脏与体肾的微细结构及其样品制备标准化[D]. 南京: 南京农业大学, 2018: 27-51. DOI: 10.27244/d.cnki.gnjnu.2018.001002. WANG X D. The fine structure of zebrafish spleen, heart and body kidney and the standardization of sample preparation[D]. Nanjing: Nanjing Agriculture University, 2018: 27-51. DOI: 10.27244/d.cnki.gnjnu.2018.001002. |
| [27] |
王新栋, 孙雪婧, 赵巧雅, 黄宇飞, 陈秋生, 林金杏. 斑马鱼心脏的显微与超微结构[J]. 水产学报, 2023, 47(8): 1733-1748. DOI:10.11964/jfc.20181011478 WANG X D, SUN X J, ZHAO Q Y, HUANG Y F, CGEN Q S, LIN J X. Microstructure and ultrastructure of zebrafish heart[J]. Journal of Fisheries of China, 2023, 47(9): 1733-1748. DOI:10.11964/jfc.20181011478 |
| [28] |
冯振龙, 赵彤, 成祥, 朱玲玲, 赵永岐, 施冰. 模拟高原低压低氧环境对大鼠心脏结构和功能影响[J]. 中国应用生理学杂志, 2019, 35(2): 173-177. DOI:10.12047/j.cjap.5751.2019.038 FENG Z L, ZHAO T, CHENG X, ZHU L L, ZHAO Y Q, SHI B. Effects of simulated high-altitude hypobaric hypoxia on cardiac structure and function in rats[J]. Chinese Journal of Applied Physiology, 2019, 35(2): 173-177. DOI:10.12047/j.cjap.5751.2019.038 |
(责任编辑 崔建勋)
 2024, Vol. 51
2024, Vol. 51