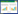文章信息
基金项目
- 福建农林大学科技创新专项基金(KFA19137A,KFA19136A);福建省作物有害生物监测与治理重点实验室开放课题项目(MIMCP-202002)
作者简介
- 翁志强(1999—),男,在读本科生,研究方向为生物学,E-mail: 1791978534@qq.com.
通讯作者
- 叶文雨(1977—),女,博士,助理研究员,研究方向为植物与微生物互作,E-mail: wenyuye08@163.com.
文章历史
- 收稿日期:2021-02-21
2. 福建省农业科学院植物保护研究所,福建 福州 350002
2. Instutute of Plant Protection, Fujian Academy of Agricultural Sciences, Fuzhou 350002, China
【研究意义】土壤微生物是土壤生态系统的分解者和土壤有机质循环的主要动力, 它参与土壤养分转化和循环过程, 是土壤生态系统的重要组成部分, 在植物养分供应和生长过程中发挥重要的作用[1-3]。土壤微生物分解有机质, 增加土壤养分, 为植物的生长提供养分。同时, 土壤微生物对土壤理化性质也有一定的影响。所以土壤微生物的数量种类与土壤肥力的高低具有一定的联系[4-5]。巨菌草(Pennisetum giganteum JUJUNCAO)隶属禾本科狼尾草属(Pennisetum), 是福建农林大学林占熺教授引进并选育的一类草本植物, 巨菌草是致富草、治沙草、脱贫草、友谊草, 已经帮助一些非洲国家突破了农业发展瓶颈。巨菌草具有广泛用途, 如食药用菌栽培、饲养牛羊、防风固沙、生物质能源制备、造纸等, 对其根际土壤展开土壤微生物群落的功能多样性的研究, 有助于对其进行更为合理的种植与利用[6-12]。【前人研究进展】土壤微生物群落在植物的生长过程中发挥着重要的作用, 土壤微生物促进植物的生长, 植物为土壤微生物提供营养。Biolog-ECO微平板具有31种碳源, 96孔板3次重复, 根据微生物对不同碳源的利用程度来研究土壤微生物的功能多样性。Biolog技术是研究土壤微生物群落的功能多样性的简单、快速方法之一, 越来越多的科研工作者使用该技术。目前, Biolog技术已经用于植物、果园、油田、矿区等林业、花卉等根际土壤微生物的研究。前人对巨菌草进行了栽培等方面的研究, 对巨菌草根际土壤微生物的研究尚未见文献报道[13-15]。【本研究切入点】将巨菌草根际土作为研究对象, 开展其微生物群落功能多样性的研究, 探讨适宜巨菌草自然生长的立地条件, 为巨菌草及其他植物的生长提供理论依据, 以期为更好地经营管理植物提供新的思路和基础理论基础。【拟解决的关键问题】本研究通过对平潭试验基地巨菌草根际土壤与非根际土壤不同碳源利用, 揭示根际土壤微生物群落功能的多样性, 促进巨菌草产业化种植, 保护生态, 同时为巨菌草生态治理应用提供参考。
1 材料与方法 1.1 试验材料供试土壤样品采自福州平潭实验基地巨菌草根际土与非根际土壤。土壤为砂质土壤, 保水性能差, 保肥性能弱。
主要仪器设备:酶联免疫检测仪SpectraMaxi3(美谷分子仪器(上海)有限公司)、八通道移液器(Eppendorf AG)、Biolog-Eco生态板(美国Biolog公司)、生化培养箱(宁波海螺赛福实验仪器厂)、UNIQUE-R20纯水机(锐思捷科学仪器有限公司)、超净工作台ZHJH-C1214B(厦门德维科技有限公司)等。
1.2 试验方法1.2.1 土壤样品的采集 在每块样地内以S型采样法选取5个采样点,用土钻采集根际土和非根际土壤样品,混合后装入已灭菌的土壤袋中,带回实验室后1 d内进行分析[16]。
1.2.2 巨菌草根际土及其对照土壤微生物群落多样性分析 采用Biolog-ECO技术对土壤微生物群落功能及代谢多样性进行分析,利用酶标仪在590 nm波长下进行测定和数据读取,分析其多样性,3次重复。生态板31种碳源分为6类:羧酸类7种、多聚合物类4种、糖类10种、酚类2种、氨基酸类4种、胺类2种。具体方法:称取10 g新鲜根际土壤,加入盛有100 mL、0.85% NaCl溶液的三角瓶中,摇床280 r/min,振荡30 min,取出后冰浴静置2 min,用0.85% NaCl溶液梯度稀释至1000倍。用移液器将上述稀释液加入Biolog-Eco微平板中,每孔加150 μL,25 ℃恒温培养,每隔24 h使用酶标仪读取数据,共记录7 d[17]。
将每次读板得到的吸光值减去对照(培养0 h)孔的吸光值,以去除本底干扰,负值全部归0。分别计算31个孔中碳源的平均颜色变化率(Average well color development,AWCD)和培养144 h的数据进行土壤微生物多样性分析。

|
式中,C为生态板中微孔的吸光度值(590 nm),R为生态板中空白对照孔的光密度值,n为底物数量(Eco板,n=31)。
Shannon-Wiener多样性指数、Simpson优势度指数、Pielou均匀度指数等采用DPS(7.05)软件进行数据处理与分析。以培养144 h的数据进行碳源代谢和主成分分析。
2 结果与分析 2.1 土壤微生物群落平均颜色变化率(AWCD)AWCD值反映了巨菌草根际土壤样品中微生物群落对碳源利用的整体情况和代谢活性。分别培养巨菌草根际土壤及其对照的微生物在0、24、48、72、96、120、144 h共7个时段的碳源利用情况,巨菌草根际土壤及其对照的微生物对碳源利用在144 h后趋于平缓。从图 1可以看出,无论是巨菌草根际土壤还是其对照土壤,微生物群落在0~48 h时段对碳源的利用最低,在144 h对碳源的利用趋于平缓,因此选择144 h的吸光值作为计算微生物群落多样性的指标值。巨菌草根际土壤AWCD值明显高于对照土样品,说明巨菌草根际土壤微生物对碳源的利用程度大于对照土壤。
|
| 图 1 巨菌草根际土壤与非根际土壤微生物碳源利用 Fig. 1 Carbon source utilization of microorganisms in rhizophere and non-rhizosphere soils of Pennisetum giganteum |
2.2 巨菌草根际土与非根际土壤微生物群落功能
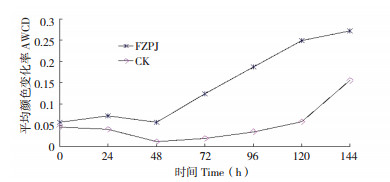
多样性分析Shannon多样性指数是均匀度和丰富度的综合指标,Simpson多样性指数值越大,表示多样性程度越高,Shannon多样性指数值越大,表示群落多样性越大。由表 1可知,巨菌草根际土壤的Simpson优势度指数、Shannon-Wiener多样性指数、Brillouin多样性指数、Pielou均匀度指数比非根际土壤略大,表明巨菌草根际土壤微生物的群落多样性程度高。
|
2.3 根际土壤微生物群落利用碳源情况
表 2为巨菌草根际土与非根际土壤样品144 h各类碳源利用情况。巨菌草根际土壤微生物群落不能利用的碳源有L- 苏氨酸、2-羟基苯甲酸、α-丁酮酸、D-苹果酸、α-D-乳糖、1-磷酸葡萄糖等碳源,其非根际土壤不能利用的碳源有腐胺、1-磷酸葡萄糖等碳源。

|
2.4 土壤微生物群落利用碳源主成分分析
运用SPSS19.0软件采取降维的方法,基于培养144 h的AWCD值进行样品土壤微生物利用碳源的主成分分析。
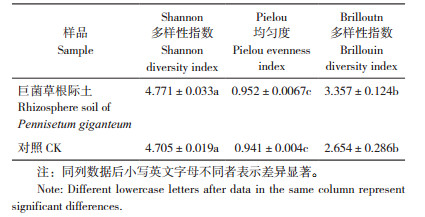
PCA1解释变量方差的54.727%,PCA2解释变量方差的45.273%,说明PCA1对群落的贡献略大。第一主成分与第二主成分贡献率之和达到100%,说明提取的PCA1和PCA2主成分可以反映土壤微生物对6类碳源的利用情况(表 3)。
|
31种碳源对PC1和PC2贡献的特征向量系数反映了单一碳源对PC1和PC2的贡献(图 2), 由图 2可知, 对PC1贡献大的碳源(系数>0.50)有22种, 其中糖类8种(β-甲基-D-葡萄糖苷、D, L-α-磷酸甘油、D-半乳糖酸γ-内酯、1-磷酸葡萄糖、α-D-乳糖、D-甘露醇、D-木糖、N-乙酰-D葡萄糖氨),羧酸类占5种(D- 苹果酸、D-葡糖胺酸、衣康酸、D-半乳糖醛酸、γ-羟丁酸),氨基酸类3种(L-苯丙氨酸、L- 丝氨酸、L-天门冬酰胺),多聚物3种(吐温40、吐温80、α-环式糊精),胺类2种(腐胺、苯乙胺),酚酸类1种(4-羟基苯甲酸)。可见影响PC1的主要为糖类和羧酸类;对PC2贡献大的碳源有7种, 其中酚酸类2种(2-羟基苯甲酸、4-羟基苯甲酸), 糖类1种(D-纤维二糖),氨基酸类3种(L-苯丙氨酸、L-苏氨酸、L-精氨酸)。可见影响PC2的主要为氨基酸类。4-羟基苯甲酸和L-苯丙氨酸对PC1和PC2贡献系数都>0.50。
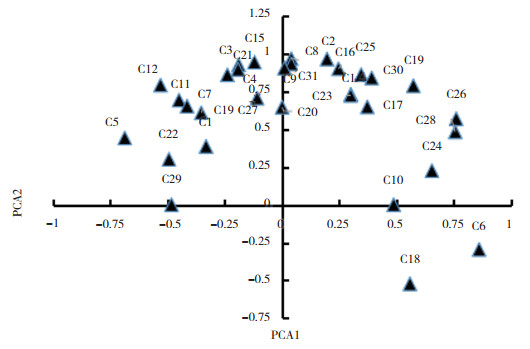
|
| 图 2 31种碳源对PC1和PC2贡献的特征向量系数 Fig. 2 Eigenvector coefficients of 31 carbon sources with loadings for PCA1 and PCA2 C1: 丙酮酸甲酯;C2: 吐温40;C3: 吐温80;C4:α-环式糊精;C5: 肝糖;C6:D-纤维二糖;C7:α-D-乳糖;C8:β-甲基-D-葡萄糖苷;C9:D-木糖;C10:i-赤藓糖醇;C11:D-甘露醇;C12:N-乙酰-D葡萄糖氨;C13:D- 葡糖胺酸;C14:1-磷酸葡萄糖;C15:D, L-α-磷酸甘油: C16;D-半乳糖酸γ- 内酯;C17:D-半乳糖醛酸;C18:2-羟基苯甲酸;C194-羟基苯甲酸;C20:γ-羟丁酸;C21: 衣康酸;C22:α-丁酮酸;C23:D-苹果酸;C24:L-精氨酸;C25:L-天门冬酰胺;C26:L- 苯丙氨酸;C27:L-丝氨酸;C28:L-苏氨酸;C29: 甘氨酰-L-谷氨酸;C30: 苯乙胺;C31: 腐胺 C1: Pyruvic acid methyl ester; C2: Tween 40; C3: Tween 80; C4: α-cyclodextrin; C5: Glycogen; C6: D-cellobiose; C7: α-D-lactose; C8: β-methyl-D-glucoside; C9: D-xylose; C10: i-Erythritol; C11: D-mannitol; C12: N-acetyl-D-glucosamine; C13: D-glucosaminic acid; C14: Glucose-1-phosphate; C15: D, L-α-glycerol phosphate; C16: D-galactonic acid γ-lactone; C17: D-galacturonic acid; C18: 2-hydroxy benzoic acid; C19: 4-hydroxy benzoic acid; C20: γ-hydroxybutyric acid; C21: Itaconic acid; C22: α-ketobutyric acid; C23: D-malic acid; C24: L-arginine; C25: L-asparagine; C26: L-phenylalanine; C27: L-serine; C28: L-threonine; C29: Glycyl-L-glutamic acid; C30: Phenylethylamine; C31: Putrescine |
3 讨论
巨菌草具有独特生态功能,根际微生物群落对其生长发育及环境适应性密切相关。Biolog-Eco技术是研究土壤微生物多样性的技术手段之一,采用该技术研究菌草根际土壤微生物群落功能多样性,有助于探寻巨菌草最适生长条件。环境条件、植被、土壤肥力、物质循环和能量转化都与土壤微生物的活性有极大的相关性,土壤微生物是土壤物质循环的主动力[20-24]。在利用Biolog- Eco生态板技术研究土壤微生物群落代谢活性时,如果AWCD(平均颜色变化率)值越高,说明土壤微生物群落代谢活性就高,反之,说明其微生物群落代谢活性低[25]。本研究中,巨菌草根际土壤各时段的AWCD值均高于非根际土壤,这表明巨菌草根际土壤微生物的代谢活性高于非根际土壤,同时也说明对碳源的利用程度也高于非根际土壤。一方面由于巨菌草植株高大,根系发达等特点,为土壤微生物创造了良好的生存环境,有利于土壤微生物群落多样性和功能多样性的形成。但是巨菌草根际土壤微生物活性的提高是否会影响巨菌草及其他植物的生长发育、产量及品质也未做相关研究。哪一类微生物对巨菌草的影响是显著的也是值得进一步的研究。
土壤微生物对不同碳源利用能力的差异可以在一定程度上指示土壤微生物的群落结构组成[26]。本实验碳源利用分析结果表明,巨菌草根际土壤微生物群落能利用六大类(糖类、多聚物类、氨基酸类、羧酸类、胺类和酚酸类)碳源,其生理活性高于非根际土壤,提高了对碳源的利用。这可能是由于巨菌草植株残体为土壤微生物群落提供了丰富的营养,进一步造成了土壤微生物生境不同,进而造成微生物群落利用碳源的不同,这种解释有待于进一步用培养基培养法分离微生物进行验证。
平潭菌草试验基地地处沙漠区,种植菌草后沙漠变绿洲,这在一定程度上改善了当地的生态环境条件。土壤微生物多样性指数比较分析表明,巨菌草根际土壤微生物的Pielou指数、Shannon指数、Brillouin指数高于非根际土壤,但差异不显著。这可能是由于植物根系分泌物不同所致。巨菌草根际土微生物群落结构和优势微生物的种类,还有待通过高通量测序技术、PLFA等技术进行进一步研究。
4 结论本研究通过Biolog-ECO技术分析巨菌草根际土壤微生物群落代谢功能多样性,结果表明,巨菌草根际土壤微生物群落具有较高的AWCD值,巨菌草根际土壤微生物群落的碳源代谢能力大于非根际土壤。巨菌草根际土壤微生物群落的代谢功能强于非根际土壤。L- 苏氨酸、2-羟基苯甲酸、α-丁酮酸、D-苹果酸、α-D-乳糖、1-磷酸葡萄糖等碳源巨菌草根际土壤微生物群落不能利用。应用培养基培养法研究土壤微生群落时,应优先考虑不能利用的其他碳源。巨菌草根际土壤微生物的活性及多样性均比非根际土壤高,该研究结果为巨菌草的合理种植、生态治理与土壤改良及提高产量的研究提供理论依据。
| [1] |
李延茂, 胡江春, 汪思龙, 王书锦. 森林生态系统中土壤微生物的作用与应用[J]. 应用生态学报, 2004, 15(10): 1943-1946. DOI:10.13287/j.1001-9332.2004.0402 LI Y M, HU J C, WANG S L, WANG S J. Function and application of soil microorganisms in forest ecosystem[J]. Chinese Journal of Applied Ecology, 2004, 15(10): 1943-1946. DOI:10.13287/j.1001-9332.2004.0402 |
| [2] |
SHANG S H, YI Y L. A greenhouse assay on the effect of applied urea amount on the rhizospheric soil bacterial communities[J]. Indian J Microbiol, 2015, 55(4): 406-414. DOI:10.1007/s12088-015-0551-7 |
| [3] |
BORE K E, APOSTEL C, HALICKI S, KUZYAKOV Y, DIPPOLD A M. Soil microorganisms can overcome respiration inhibition by coupling intra-and extracellular metabolism: 13C metabolic tracing reveals the mechanisms[J]. International Society for Microbial Ecology, 2017, 11: 1423-1433. DOI:10.1038/ismej.2017.3 |
| [4] |
RINEAU F, SHAH F, SMITS M M, PERSSON P, JOHANSSON T, CARLEER R, TROEIN C, TUNLID A. Carbon availability triggers the decomposition of plant litter and assimilation of nitrogen by an ectomycorrhizal fungus[J]. International Society for Microbial Ecology, 2013, 7(10): 2010-2022. DOI:10.1038/ismej.2013.91 |
| [5] |
韩冬雪, 王宁, 王楠楠, 孙雪, 冯富娟. 不同海拔红松林土壤微生物功能多样性[J]. 应用生态学报, 2015, 26(12): 3649-3656. DOI:10.13287/j.1001-9332.20150929.017 HAN D X, WANG N, WANG N N, SUN X, FENG F J. Soil microbial functional diversity of different altitude Pinus koraiensis forests[J]. Chinese Journal of Applied Ecology, 2015, 26(12): 3649-3656. DOI:10.13287/j.1001-9332.20150929.017 |
| [6] |
林占熺. 菌草学[M]. 第3版. 北京: 国家行政学院出版社, 2012. LIN Z X. JUNCAO Science[M]. Third Edition. Beijing: National School of Administration Press, 2012. |
| [7] |
薛志香, 曾峰, 曹秀明, 蔡杨星, 林冬梅, 罗海凌, 林占熺. 鲜菌草与干菌草栽培的香菇品质比较[J]. 福建农林大学学报(自然科学版), 2017, 46(6): 697-701. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2017.06.016 XUE Z X, ZENG F, CAO X M, CAI Y X, LIN D M, LUO H L, LIN Z X. A comparative study on the quality of Lentinus edodes cultivated by fresh Juncao grass and dry Juncao grass[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition), 2017, 46(6): 697-701. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2017.06.016 |
| [8] |
林兴生, 林占熺, 林冬梅, 林辉, 罗海凌, 胡应平, 林春梅, 朱朝枝. 荒坡地种植巨菌草对土壤微生物群落功能多样性及土壤肥力的影响[J]. 生态学报, 2014, 34(15): 4304-4312. DOI:10.5846/stxb201212071760 LIN X S, LIN Z X, LIN D M, LIN H, LUO H L, HU Y P, LIN C M, ZHU C Z. Effects of planting Pennisetum sp. (Giant juncao)on soil microbial functional diversity and fertility in the barren hillside[J]. Acta Ecologica Sinica, 2014, 34(15): 4304-4312. DOI:10.5846/stxb201212071760 |
| [9] |
梅兰, 黄在兴, 宋昭昭, 贾雨雷, 苏德伟, 林辉, 林占熺. 巨菌草不同生长时期对砒砂岩地区土壤理化性质及细菌群落结构的影响[J]. 微生物学报, 2019, 59(10): 2038-2050. DOI:10.13343/j.cnki.wsxb.20180586 MEI L, HUANG Z X, SONG Z Z, JIA Y L, SU D W, LIN H, LIN Z X. Effect of Pennisetum sp. and its different growth periods on physicalchemical properties and bacterial diversity in sandstone areas[J]. Acta Microbiologica Sinica, 2019, 59(10): 2038-2050. DOI:10.13343/j.cnki.wsxb.20180586 |
| [10] |
周晶, 林兴生, 林辉, 林冬梅, 阳伏林, 林占熺. 菌草研究与应用进展[J]. 福建农林大学学报(自然科学版), 2020, 49(2): 145-152. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2020.02.001 ZHOU J, LIN X S, LIN H, LIN D M, YANG F L, LIN Z X. Advances on Juncao research and application[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition), 2020, 49(2): 145-152. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2020.02.001 |
| [11] |
邓新为, 裘博文, 郝柳柳, 徐源, 罗娜, 孙志宏. 日粮添加发酵巨菌草对香猪生长期血液生化指标的影响[J]. 饲料工业, 2020, 41(6): 14-17. DOI:10.13302/j.cnki.fi.2020.06.004.fi.2020.06.004 DENG X W, QIU B W, HAO L L, XU Y, LUO N, SUN Z H. Effects of addition of fermented Pennisetum giganteum in ration on the blood biochemical parameters of BAMA miniature pig in the growth period[J]. Feed Industry, 2020, 41(6): 14-17. DOI:10.13302/j.cnki.fi.2020.06.004.fi.2020.06.004 |
| [12] |
黄晓飞, 孟庆翔, 杨甲轩, 解祥学. 巨菌草青贮替代全株玉米青贮对奶牛生产性能、乳成分和经济效益的影响[J]. 中国畜牧兽医, 2017, 44(7): 1997-2002. DOI:10.16431/j.cnki.1671-7236.2017.07.014 HUANG X F, MENG Q X, YANG J X, XIE X X. Effects of replacing the corn silage with puelia sinese roxb silage on production performance, composition of milk and economic bendfits in dairy cows[J]. China Animal Husbandry and Veterinary Medicine, 2017, 44(7): 1997-2002. DOI:10.16431/j.cnki.1671-7236.2017.07.014 |
| [13] |
付丽娜, 魏兰芳, 王震铄, 刘峰, 李淼, 姬广海. 三七根际微生物群落组成及多样性研究[J]. 生物技术进展, 2017, 7(3): 211-216. DOI:10.19586/j.2095-2341.2016.0124 FU L N, WEI L F, WANG Z S, LIU F, LI M, JI G H. Study on composition and diversity of rhizospheric microbial community from panax notoginseng[J]. Current Biotechnology, 2017, 7(3): 211-216. DOI:10.19586/j.2095-2341.2016.0124 |
| [14] |
陈喜蓉, 金映虹, 欧滨, 钟剑峰, 林芳能, 吴红萍. 基于BiologECO技术分析不同林下种植竹荪地土壤微生物功能多样性[J]. 基因组学与应用生物学, 2017, 36(1): 370-375. DOI:10.13417/j.gab.036.000370 CHEN X R, JIN Y H, OU B, ZHONG J F, LIN F N, WU H P. Analysis of soil microbial functional diversity of different understory planting dictyophora land[J]. Genomics and Applied Biology, 2017, 36(1): 370-375. DOI:10.13417/j.gab.036.000370 |
| [15] |
吴芳芳, 郑有飞, 吴荣军, 王锦旗, 李萍. 地表太阳辐射减弱对小麦根际土壤微生物碳代谢指纹的影响[J]. 生态学杂志, 2014, 33(4): 1021-1026. DOI:10.13292/j.1000-4890.2014.0105 WU F F, ZHENG Y F, WU R J, WANG J Q, LI P. Effects of reduced solar irradiance on soil microbial carbon metabolic fingerprint in maize rhizosphere[J]. Chinese Journal of Ecology, 2014, 33(4): 1021-1026. DOI:10.13292/j.1000-4890.2014.0105 |
| [16] |
郑华, 陈法霖, 欧阳志云, 方治国, 王效科, 苗鸿. 不同森林土壤微生物群落对Biolog-GN板碳源的利用[J]. 环境科学, 2007, 28(5): 1126-1130. DOI:10.13227/j.hjkx.2007.05.034 ZHENG H, CHEN F L, OUYANG Z Y, FANG Z G, WANG X K, MIAO H. Utilization of different carbon sources types in biolog-GN microplates by soil microbial communities from four forest types[J]. Environmental Science, 2007, 28(5): 1126-1130. DOI:10.13227/j.hjkx.2007.05.034 |
| [17] |
王超群, 焦如珍, 董玉红, 厚凌宇, 赵京京, 赵世荣. 不同林龄杉木人工林土壤微生物群落代谢功能差异[J]. 林业科学, 2019, 55(5): 36-45. DOI:10.11707/j.1001-7488.20190505 WANG C Q, JIAO R Z, DONG Y H, HOU L Y, ZHAO J J, ZHAO S R. Differences in metabolic functions of soil microbial communities of Chinese fir plantations of different ages[J]. Scientia Silvae Sinicae, 2019, 55(5): 36-45. DOI:10.11707/j.1001-7488.20190505 |
| [18] |
陈军, 黄珊瑜, 刘冰, 吴林坤, 林文雄. 不同菌肥处理对太子参根际微生物群落的影响[J]. 福建农业学报, 2015, 30(12): 1171-1177. DOI:10.19303/j.issn.1008-0384.2015.12.008 CHEN J, HUANG S Y, LIU B, WU L K, LIN W X. Effects of microbial fertilizerson microbial community struceure in radix spseudostellariae rhizosphere[J]. Fujian Joural of Agricultural Science, 2015, 30(12): 1171-1177. DOI:10.19303/j.issn.1008-0384.2015.12.008 |
| [19] |
刘玉珍, 邓振山, 高飞, 李静, 李征霆, 陈凯凯, 魏婷婷. 一株巨菌草内生细菌的鉴定及其促生特性初步分析[J]. 广东农业科学, 2018, 45(3): 88-93. DOI:10.16768/j.issn.1004-874X.2018.03.014 LIU Y Z, DENG Z S, GAO F, LI J, LI Z T, CHEN K K, WEI T T. Identification of an endophytic bacteria from Pennisetum sp. and the preliminary analysis of its growth promoting properties[J]. Guangdong Agricultural Sciences, 2018, 45(3): 88-93. DOI:10.16768/j.issn.1004-874X.2018.03.014 |
| [20] |
ZAK D R, HOLMES W E, WHITE D C, PEACOCK A D, TILMAN D. Plant diversity, soil microbial communities, and ecosystem function: Are there any links[J]. Ecology, 2003, 84(8): 2042-2050. DOI:10.1890/02-0433 |
| [21] |
席劲瑛, 胡洪营. Biolog方法在环境微生物群落研究中的应用[J]. 微生物学报, 2003, 43(1): 138-141. DOI:10.13343/j.cnki.wsxb.2003.01.022 XI J Y, HU H Y. Application of biolog system in the study of microbial community[J]. Acta Microbiologica Sinica, 2003, 43(1): 138-141. DOI:10.13343/j.cnki.wsxb.2003.01.022 |
| [22] |
刁婵, 鲁显楷, 田静, 张永清, 莫江明, 于贵瑞. 长期氮添加对亚热带森林土壤微生物碳源代谢多样性的影响[J]. 生态学报, 2019, 39(18): 6622-6630. DOI:10.5846/stxb201805251150 DIAO C, LU X K, TIAN J, ZHANG Y Q, MO J M, YU G R. Effects of long-term nitrogen addition on the metabolic diversity of microbial carbon sources in subtropical forest soils[J]. Acta Ecologica Sinica, 2019, 39(18): 6622-6630. DOI:10.5846/stxb201805251150 |
| [23] |
安丽芸, 李君剑, 严俊霞, 李洪建. 微生物多样性对土壤碳代谢特征的影响[J]. 环境科学, 2017, 38(10): 4420-4426. DOI:10.13227/j.hjkx.201702058 AN L Y, LI J J, YAN J X, LI H J. Effects of microbial diversity on soil carbon mineralization[J]. Environmental Science, 2017, 38(10): 4420-4426. DOI:10.13227/j.hjkx.201702058 |
| [24] |
DEMOLING L A, ERLAND, GREVE G. Effects of sulfamethoxazole on soil microbial communities after adding substrate[J]. Soil Biology and Biochemistry, 2009, 41(4): 840-848. DOI:10.1016/j.soilbio.2009.02.001 |
| [25] |
MARSCHNER P, NEUMANN G, KANIA A, WEISKOPF L, LIEBEREI R. Spatial and temporal dynamics of the microbial community structure in the rhizosphere of cluster roots of white lupin (Lupinus albus L.)[J]. Plant and Soil, 2002, 246(2): 167-174. DOI:10.1023/A:1020663909890 |
| [26] |
程万莉, 刘星, 高怡安, 张文明, 王蒂, 邱慧珍, 沈其荣. 有机肥替代部分化肥对马铃薯根际土壤微生物群落功能多样性的影响[J]. 土壤通报, 2015, 46(6): 1459-1465. DOI:10.19336/j.cnki.trtb.2015.06.028 CHEN G W L, LIU X, GAO Y A, ZHANG W M, WANG D, QIU H Z, SHEN Q R. Effects of chemical fertilizer partially replaced with organic fertilizer on functional diversity of microbial community in potatorhizosphere soil[J]. Chinese Journal of Soil Science, 2015, 46(6): 1459-1465. DOI:10.19336/j.cnki.trtb.2015.06.028 |
 2021, Vol. 48
2021, Vol. 48