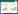文章信息
基金项目
- 国家自然科学基金(31902134);国家重点研发计划重点专项(2016YFD0500510);广东省现代农业水禽产业技术体系创新团队(2020KJ137);广东省自然科学基金(2018A030310009)
作者简介
- 付梦思(1997—),女,在读硕士生,研究方向为动物遗传育种,E-mail:fumengsi_fms@163.com.
通讯作者
- 张续勐(1989—),男,博士,高级畜牧师,研究方向为动物遗传育种,E-mail:zhangxumzku@163.com.
文章历史
- 收稿日期:2021-04-12
2. 广东省水禽健康养殖重点实验室, 广东 广州 510225
2. Guangdong Key Laboratory of Waterfowl Health Breeding, Guangzhou 510225, China
【研究意义】我国是世界上鸭生产与消费第一大国,广东省是我国水禽大省,凭借珠江三角洲的地理优势,近年来鸭养殖量呈快速增长趋势[1]。由于饲养条件和成本等原因,我国鸭饲养过程普遍实行集约化、规模化模式。规模化养殖和较高的饲养密度会对禽舍的温度﹑湿度、通风、有害气体、尘埃、微生物含量产生较大影响,从而间接对禽类采食量、生长性能以及健康产生一系列不良影响。揭示饲养密度对山麻鸭胸腿肌和胫骨发育的影响,可为优化饲养密度、提升山麻鸭生长性能提供借鉴。
【前人研究进展】已有研究表明,高密度饲养条件下,死亡率提高、生长速度降低与鸭舍内温度升高相关[2],并造成畜禽养殖场环境严重污染,不利畜禽生长[3]。张蒙等[4]发现,随着饲养密度增大,大午金凤商品代蛋雏鸡体重呈现显著下降的趋势。白皓等[5]通过对白羽肉鸭进行网上平养和笼养也得到与蛋鸡相似的结果。较高饲养密度会使禽类生活空间不足,畜舍养殖环境恶化,细菌病菌繁殖力增加,导致环境中脂多糖(Lipopolysaccharide,LPS)积累,从而引发禽类产生应激反应[6]。LPS作为一种内毒素,是革兰氏阴性细菌细胞壁的组成成分,通过以Toll样受体为媒介的信号转导途径产生一系列细胞因子,从而引起一系列炎性反应[7],而TNF-α和IL-6可以介导炎症的发生[8]。IL-6是由T细胞和巨噬细胞分泌产生的一种炎性细胞因子,表达水平与肌肉收缩反应密切相关[9];TNF-α主要由激活的巨噬细胞产生,是参与全身炎症的细胞信号传导蛋白[10]。
在肌肉发育过程中,一些关键的基因在合适的部位和时间发挥关键调控作用。如Myod在骨骼肌发育前期促进肌源性祖细胞增殖、分化形成成肌细胞[11];Myog主要在成肌细胞分化形成肌管过程中发挥重要作用[12];Myh1基因与肌肉收缩和肌肉发育显著相关,编码肌纤维的主要组成成分肌球蛋白重链蛋白[13];IGF-1能有效促进成肌细胞增殖及分化,从而促进骨骼肌再生,同时增强再生肌肉的收缩力[14];MSTN又称肌肉生长抑制素,发挥负调控肌肉生长和发育的功能[15]。
【本研究切入点】已有的研究主要关注饲养密度对禽类生长、繁殖性能的影响,鲜有研究不同饲养密度环境下对禽类胫骨和肌纤维生长的影响及其调控机制。而肌肉和胫骨生长状态对于育成期禽类的生长性能非常重要。【拟解决的关键问题】本试验通过构建不同饲养密度的养殖条件,系统探索其对山麻鸭饲养环境、血液内毒素、胸腿肌和胫骨生长的影响。
1 材料与方法 1.1 试验材料供试的56日龄健康山麻鸭雌鸭已进行常规免疫,由仲恺农业工程学院钟村农场提供。EC80545S鲎试剂盒购自厦门鲎试剂生物科技有限公司,Trizol购自Thermo Fisher Scientific公司,PSMARTTM RACE cDNA kit购自TaKaRa公司。
1.2 试验设计本试验于2020年8月在仲恺农业工程学院钟村农场进行。选取180只56日龄健康且体重相近的山麻鸭雌鸭随机分为低密度组(n=30)、中密度组(n=60)和高密度组(n=90),在饲养环境相同的情况下,分别于3个半开放式鸭舍中进行水陆-平养。鸭舍有遮阳棚3 m2、运动场6 m2、水池3 m2(低密度组2.5只/m2,中密度组5只/m2,高密度组7.5只/m2);舍内装通风扇和0.5 W节能灯(以避免夜间应激);每30只鸭配备1个饮水器;初始光照时长为10 h,正式试验开始后每周延长1 h,直至光照稳定在17 h。预饲期为8 d,正式试验期为40 d。试验期内每天按每只60 g蛋鸭料(掺适量玉米)的标准饲喂山麻鸭,每天记录采食情况;于正式试验第0、20、40 d每组分别随机选取10只鸭进行称重,同时进行翅下采血(2 mL/只),每组剖杀6只鸭进行胸腿肌及胫骨采样。
1.3 指标测定1.3.1 水体菌群数及内毒素测定 根据《食品微生物学检验菌落总数测定》(GB 4789.2-2010)配制PAC琼脂培养基、麦康凯琼脂培养基和SS琼脂培养基。在无菌条件下,将取得的水体样本经过104倍或103倍稀释后取100 μL涂在上述3种培养基中,用涂布棒涂匀并做标记,平放于培养箱中10~20 min,将平板倒扣于培养箱中37 ℃培养18~24 h,即可计数平板上的菌落数。
采用鲎试剂法测量水体和血清中的内毒素含量,检测步骤均按EC80545S鲎试剂盒说明书规范操作。
1.3.2 胸腿肌和胫骨生长指标测定 参照前人研究的方法[16]对胸腿肌和胫骨进行HE染色,随后用正置荧光显微镜(ZEISS, ImagerZ1)进行观察拍摄并采集图片。采用Image-pro plus 6.0软件(Media Cybernetics, Inc., Rockville, MD, USA) 统计HE染色胸腿肌和胫骨横切结果。所使用的每张切片均随机挑选3个及以上的400倍视野进行拍摄分析。拍摄时尽量让组织充满整个视野,并调整每张照片的背景光尽量达到一致。每张切片随机挑选5个肌纤维和胫骨切面位置,测量肌纤维的直径和胫骨骨质厚度、髓质厚度。统计每个视野中的纤维数和测量肌纤维的总横截面积,求出单位面积内肌纤维数量。
1.3.3 炎症相关基因和肌肉特异表达基因的检测 对炎症相关基因IL-6/TNF-α、肌肉特异表达基因Myod、MSTN、IGF-1、Myog和Myh1进行检测分析,引物序列见表 1。采用Trizol法提取肌肉组织总RNA,并用cDNA反转录试剂盒将RNA反转录成cDNA,在LightCycler480 Ⅱ(QuantStudio 7 Flex)上进行荧光定量PCR,反应程序为:预变性95 ℃ 10 min;变性95 ℃ 5 s、退火60 ℃ 1 min、延伸72 ℃ 30 s,40个循环。
1.4 数据处理
以每只雏鸭个体作为重复进行数据统计,数据分析使用SPSS(Version 20)。采用两因素方差分析计算组间差异,统计分析采用双侧检验,相对定量分析采用2-△△Ct法。
2 结果与分析 2.1 饲养密度对水体细菌数和内毒素含量的影响为了探索饲养密度对山麻鸭养殖水体环境的影响,本研究对不同时间点的水体细菌和内毒素进行检测。结果(图 1)发现,76日龄时,中、高密度组大肠杆菌数、沙门氏菌数和总细菌数均为低密度组的5倍以上(P < 0.05),并且高密度组沙门氏菌数也为中密度组的2倍以上(P < 0.001);同时高密度组水体内毒素水平显著高于中、低密度组(P < 0.001),但中、低密度组水体内毒素水平差异不显著。96日龄时,中、高密度组大肠杆菌、沙门氏菌数、总细菌数和水体内毒素均显著高于低密度组(P < 0.01),其中高密度组沙门氏菌和总细菌数显著高于中密度组(P < 0.05);与低密度组相比,中、高密度组大肠杆菌、沙门氏菌数和内毒素变化趋势和76日龄大体上一致,但总菌数提升幅度较大,增加至低密度组的5倍以上。研究结果表明,较高的饲养密度显著增加了养殖水体中的细菌数和内毒素含量。
|
| 图 1 饲养密度对水体大肠杆菌、沙门氏菌、总细菌数和内毒素含量的影响 Fig. 1 Effects of stocking densities on Escherichia coli, Salmonella, total bacteria number and endotoxin content in rearing water *:P<0.05;**:P<0.01;***:P<0.001 |
2.2 饲养密度对山麻鸭血液内毒素和体重的影响
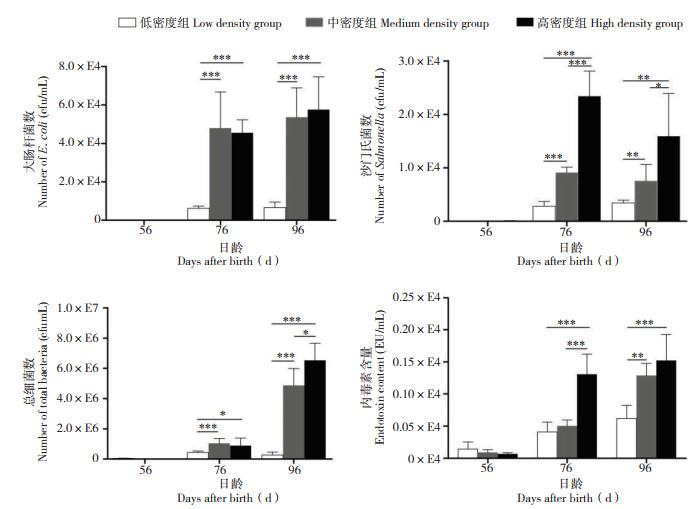
由图 2A可见,76日龄时,不同饲养密度组间山麻鸭血液内毒素含量均存在显著差异(P < 0.05),与低密度组相比,中、高密度组山麻鸭血液内毒素含量提高2倍以上,且饲养密度越大,血液内毒素含量越高;96日龄时,高饲养密度组血液内毒素含量显著高于中、低密度组(P < 0.001),与低密度组相比,中密度组山麻鸭血液内毒素含量与76日龄时差异不大,高密度组内毒素含量随饲养时间的增加大幅上升。结果表明,较高的饲养密度显著提高了山麻鸭血液中内毒素的含量。
|
| 图 2 饲养密度对山麻鸭血液内毒素和体重的影响 Fig. 2 Effects of stocking densities on blood endotoxin and body weight of Shan Partridge ducks *:P<0.05;**:P<0.01;***:P<0.001 |
由于供试山麻鸭已处于育成期,因此试验期内不同时间的山麻鸭体重变化较小(图 2B),但中、高密度组山麻鸭体重均显著低于低密度组(P < 0.01),76日龄时中、高密度组山麻鸭体重降低了0.1 kg左右,96日龄时体重略有升高,但中、高密度组的体重仍比低密度组低15% 左右(图 2B)。结果表明,较高的饲养密度显著降低了山麻鸭的体重。
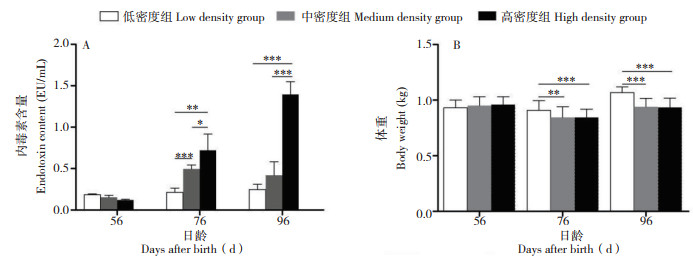
2.3 饲养密度对山麻鸭生长性能的影响2.3.1 饲养密度对山麻鸭胫骨生长的影响 由图 3可见,随着饲养时间的增加,3组山麻鸭的骨质厚度变化不大,髓质厚度呈现上升趋势。56、76日龄3组间的的骨质和髓质厚度差异均不明显,但到了96日龄,低密度组骨质厚度显著高于高密度组100 μm左右(P < 0.05),并且低密度组髓质厚度显著高于中、高密度组200 μm左右(P < 0.05)。结果表明,较高的饲养密度显著抑制了山麻鸭胫骨的生长。
|
|
图 3 饲养密度对山麻鸭胫骨生长的影响 Fig. 3 Effects of stocking densities on tibia growth of Shan Partridge ducks A:胫骨HE染色结果(标尺=1 000 μm);B:胫骨骨质和髓质厚度统计 A: HE staining results of tibia(scale bar = 1 000 μm); B: Statistical results of the thickness of bone and medulla substances of tibia *: P < 0.05;**: P < 0.01;***: P < 0.001 |
2.3.2 饲养密度对山麻鸭胸腿肌生长的影响 随着饲养时间的增加,3组山麻鸭的胸肌的肌纤维密度均出现下降,肌纤维直径则上升;而腿肌肌纤维密度也出现下降,肌纤维直径变化不明显。在胸肌方面(图 4),76日龄时3组山麻鸭的肌纤维密度之间均存在显著差异(P < 0.05),且饲养密度越高,肌纤维密度越大,中、高密度组肌纤维密度比低密度组分别增加25% 和50% 左右,而肌纤维直径则是高密度组显著低于低密度组(P < 0.05),中、高密度组肌纤维直径比低密度组分别减少10% 和25% 左右;96日龄时,高密度组肌纤维密度显著高于低密度组(P < 0.001),而肌纤维直径在3组间差异较小。
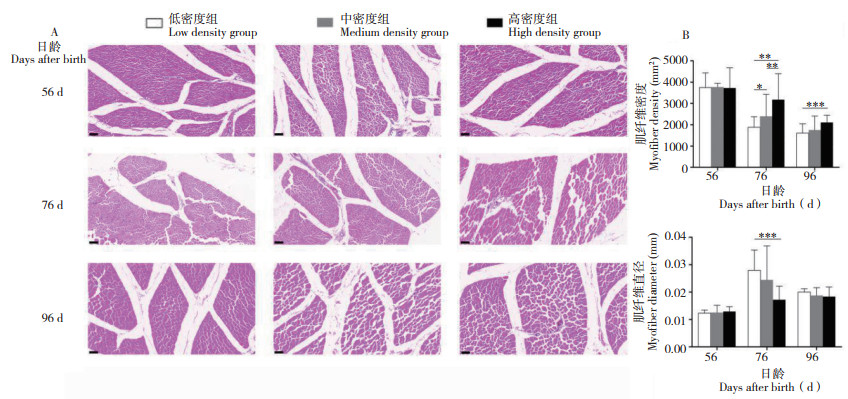
|
|
图 4 饲养密度对山麻鸭胸肌肌纤维直径和密度的影响 Fig. 4 Effects of stocking densities on the diameter and density of pectoral muscle fiber of Shan Partridge ducks A:胸肌HE染色结果(标尺=50 μm);B:胸肌肌纤维密度和直径统计 A: HE staining results of pectoral muscle of Shan Partridge ducks(scale bar = 50 μm); B: Statistical results of myofiber density and diameter in pectoral muscle fiber *: P < 0.05;**: P < 0.01;***: P < 0.001 |
在腿肌方面(图 5),76日龄时3组山麻鸭的肌纤维密度与肌纤维直径均存在显著差异(P < 0.05),且饲养密度越高,肌纤维密度越低,肌纤维直径越大,中、高密度组肌纤维密度比低密度组分别降低10% 和50% 左右,肌纤维直径比低密度组分别增加1% 和10% 左右;96日龄时,3组肌纤维直径差异显著(P < 0.05),且饲养密度越高,肌纤维直径越大,中、高密度组肌纤维直径比低密度组分别增加2% 和10% 左右,而肌纤维密度在组间差异较小。结果表明,饲养密度对山麻鸭胸腿肌生长产生了较为显著的影响。

|
|
图 5 饲养密度对山麻鸭腿肌肌纤维直径和密度的影响 Fig. 5 Effects of stocking densities on diameter and density of myofiber in leg muscle of Shan Partridge ducks A:腿肌HE染色结果(标尺=50 μm);B:腿肌肌纤维密度和直径 A: HE staining results of leg muscle of Shan Partridge ducks(scale bar = 50 μm); B: Statistical results of myofiber density and diameter of in leg muscle fiber *: P < 0.05;**: P < 0.01;***: P < 0.001 |
2.4 饲养密度对山麻鸭炎症因子和肌肉生长关键基因表达的影响
为了进一步分析饲养密度导致山麻鸭胸腿肌生长变化的原因,本研究检测了胸腿肌中几个重要的炎症因子和肌肉生长关键基因的表达量。
胸肌方面,研究发现山麻鸭各密度组炎症因子TNF-α基因的mRNA表达量在不同采样时间点差异均不显著;IL-6基因的表达量在76日龄时中密度组比低密度和高密度组高50% 以上(P < 0.05),96日龄时表达量整体呈现下降趋势,但差异不显著(图 6)。Myod基因的表达量随饲养时间的增加山麻鸭各密度组间无明显差异;Myog基因在76日龄时高密度组的表达量与其他两组相比增加2倍以上(P < 0.01),在96日龄时除高密度组外各组表达量均升高,但各组间差异不显著;Myh1基因在76日龄时低密度组表达量显著低于中密度组(P < 0.05),96日龄时高密度组表达量显著升高(P < 0.01),且高密度组比中密度组和低密度组升高2倍左右;IGF-1基因的表达量在76日龄时,与低密度组和高密度组相比,高密度组的表达量升高2倍以上(P < 0.01),在96日龄时各组间差异不显著;在96日龄时MSTN基因在中、高密度组的表达量较76日龄时升高,但差异不显著(图 7)。
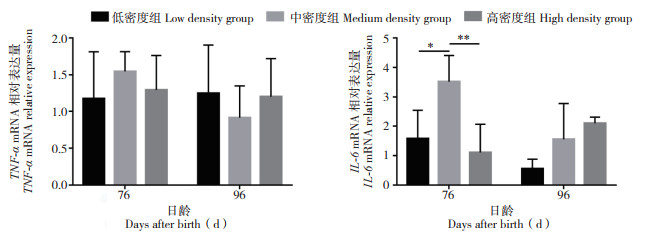
|
| 图 6 饲养密度对山麻鸭胸肌炎症因子表达的影响 Fig. 6 Effects of stocking densities on expression of inflammatory factors in pectoral muscle of Shan Partridge ducks *:P<0.05;**:P<0.01;***:P<0.001 |
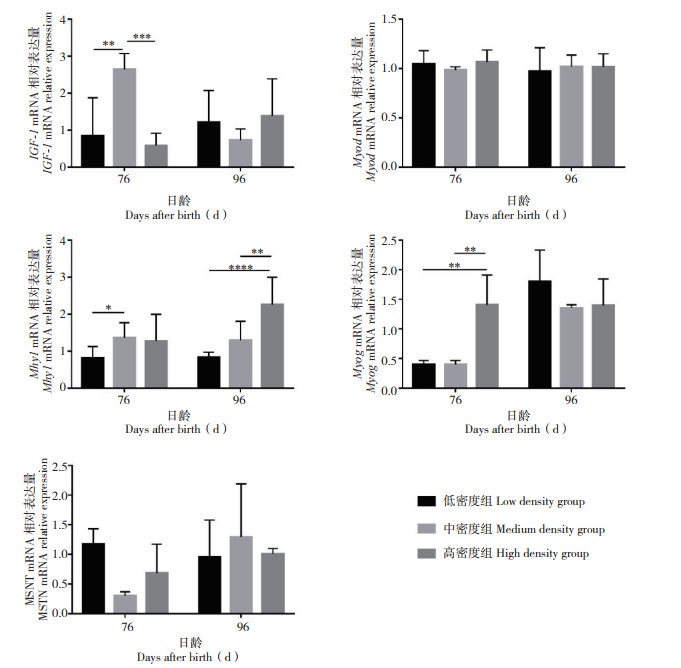
|
| 图 7 饲养密度对山麻鸭胸肌生长关键基因表达的影响 Fig. 7 Effects of stocking densities on expression of key genes in pectoral muscle growth of Shan Partridge ducks *:P<0.05;**:P<0.01;***:P<0.001 |
腿肌方面,炎症因子TNF-α的表达量在不同采样时间点表现为饲养密度越高,表达量也越高,但各组间均差异不显著;IL-6基因在96日龄时中密度组的表达量比低密度组和高密度组分别升高1倍和2倍左右(P < 0.05)(图 8)。76日龄时高密度组比中、低密度组Myod基因的表达量升高50% 左右(P < 0.001),96日龄时中、高密度组的表达量差异降低到与低密度组相似的水平;Myog基因在不同采样时间点低密度组和中密度组的表达量差异不大,而高密度组的表达量明显升高且于其他两组相比升高3倍左右P < 0.001);Myh1基因在76日龄时中密度组表达量显著低于其他两组(P < 0.01),96日龄时比76日龄升高2倍左右,达到与低、高密度组相似的水平,而低、高密度组随饲养天数增加变化不大;IGF-1基因的表达量在76日龄时各密度组间差异不大,96日龄时中密度组的表达量显著高于其他两组(P < 0.05);76日龄时MSTN基因随饲养密度增加表达量略有升高,但差异均不显著(图 9)。结果表明,饲养密度显著影响山麻鸭炎症因子和肌肉生长关键基因的表达。

|
| 图 8 饲养密度对山麻鸭腿肌炎症因子表达的影响 Fig. 8 Effects of stocking densities on expression of inflammatory factors in leg muscle of Shan Partridge ducks *:P<0.05;**:P<0.01;***:P<0.001 |
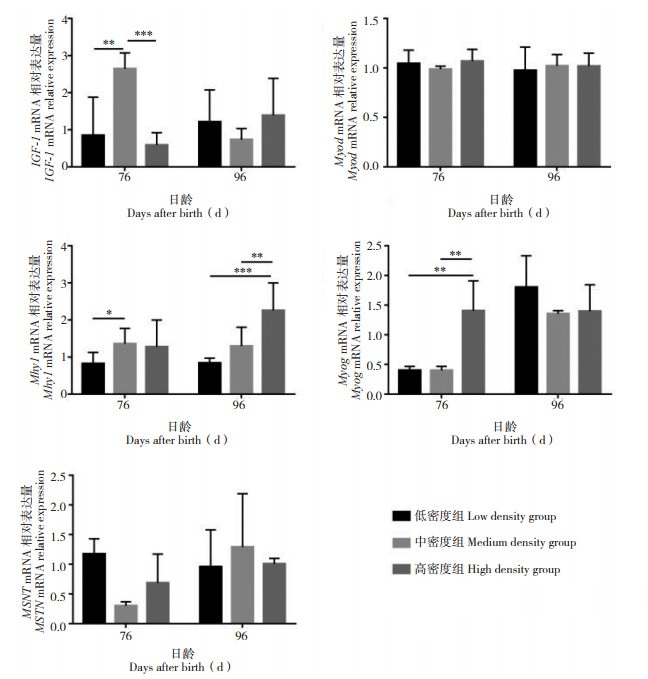
|
| 图 9 饲养密度对山麻鸭腿肌生长关键基因表达的影响 Fig. 9 Effects of stocking densities on expression of key genes in leg muscle growth of Shan Partridge ducks *:P<0.05;**:P<0.01;***:P<0.001 |
3 讨论
本研究发现饲养密度对鸭舍环境、山麻鸭血液内毒素以及胫骨、胸腿肌生长都有极大影响。饲养密度越高,鸭舍水池水体中的菌落数越多,水体和血液中的内毒素含量也越高,山麻鸭体重越低,而且较高的饲养密度显著抑制了山麻鸭胫骨和胸腿肌的生长,对炎症因子和肌肉生长关键基因的表达也产生了显著影响。
在本研究中,饲养密度的增加使得水体菌落数和内毒素含量大幅度增加,并导致内毒素在山麻鸭体内积累。由于试验期所有山麻鸭采食量一致,结合饲养密度越高,山麻鸭体重越低的结果推测,高饲养密度导致饲养环境污染,可能会通过内毒素在山麻鸭体内积累而导致其体重下降。冯培功等[17]发现饲养密度过大会造成空气中氨气、二氧化碳、硫化氢等有害气体浓度过高;而笼养肉鸡相比于平养肉鸡的活动受限,笼养肉鸡腿部疾病发病几率会增加,进而使肉鸡采食量下降,导致笼养肉鸡体重低于平养肉鸡[18]。此外,在高密度饲养条件下,鸡的脚垫损伤和趾部损伤程度也显著增加[19]。
本研究发现,较高的饲养密度也显著降低了96日龄山麻鸭胫骨骨质和髓质的厚度,这可能是由于较高的饲养密度导致山麻鸭运动强度受到影响,而饲养密度导致的养殖环境污染也可能影响了山麻鸭对钙等营养物质的吸收,从而影响了胫骨的发育。此外,胫骨指标与鸭体重存在正相关关系,因此饲养密度间接导致的胫骨指标下降,可能也是导致山麻鸭体重降低的原因之一。厉秀梅[20]也发现,高密度组饲养的肉鸡胫骨厚度显著低于低密度组,且抑制了软骨细胞增殖,不利于胫骨的生长发育。此外,家禽的活动量减少会引起胫骨软骨发育不良导致腿病,在笼养条件下,肉鸡容易出现骨骼问题,如骨畸形、骨质疏松症等,容易导致家禽死亡[19]。现代育种工作侧重于提高肉鸭的体重和饲料转化率,较少关注鸭的骨骼健康,这种不平衡的选择导致体重增加和骨骼生长钙化的不平衡,从而导致肉鸭易出现腹水、呼吸系统疾病和胫骨软骨发育不良等问题[21],以上问题的产生对于鸭的生长性能也有着较大影响。
本研究结果表明,饲养密度的增加对胸腿肌肌纤维密度和直径均有显著影响,并且胸腿肌出现相反的趋势。胸肌中,较高的饲养密度会导致肌纤维密度上升,肌纤维直径下降;腿肌中,较高的饲养密度导致肌纤维密度下降,肌纤维直径增加。导致这一现象的原因,一方面是由于胸腿肌生长模式存在一定差异[22],另一方面,可能是由于饲养密度的增加,导致山麻鸭对营养物质的吸收产生影响,从而影响了胸肌肌纤维肥大的过程,导致肌纤维直径下降。此外,在小鼠C2C12细胞中,外源性LPS可导致肌管显著变细[23],而本研究中山麻鸭血液内毒素增加,可能也会导致胸肌肌纤维直径下降;而腿肌则是山麻鸭运动的主要肌肉群,饲养密度的增加导致山麻鸭觅食等活动产生更强的竞争,使得该饲养环境下的山麻鸭可能有较高的腿肌运动强度,进而引起其肌纤维直径增加。与本研究结果类似,殷璐瑶等[24]研究表明,饲养密度对仔鹅的生长发育有显著影响,饲养密度的升高导致鹅的体重降低,料重比升高,当饲养密度大于5只/m2时,仔鹅的腿肌率和胸肌率会受影响,此外,鹅出现羽毛质量下降、行走能力变差和免疫机能下降等健康问题。由于胸腿肌生长受到营养、运动和发育等多方面的影响,因此其对山麻鸭体重的影响还需进一步研究。
在基因表达方面,本研究发现,饲养密度较高时炎症因子TNF-α的表达量变化不显著,但IL-6表达差异显著,可能是较高的饲养密度导致内毒素在山麻鸭体内积累产生炎症反应,这与冯培功等[17]发现的高饲养密度会提高肉鸭体内IL-6含量的结果相似。此外,山麻鸭的胸腿肌可能也产生了肌肉损伤修复的过程,进而激发了炎症因子的表达。有报道显示,添加适当浓度外源性LPS会影响体外培养的大鼠骨骼肌肌卫星细胞IL-6和TNF-a的表达,并促进其增殖和分化,而肌卫星细胞的增殖和分化是肌肉损伤修复的必经环节[25]。Myod和IGF-1基因主要参与肌肉发育前期肌原细胞增殖的过程,Myog和Myh1主要对肌肉分化过程起重要作用,MSTN则起到抑制肌肉发育的作用。在本研究试验期,山麻鸭已达到育成期,肌纤维的增殖过程已基本结束,主要进行的是肌纤维肥大的过程,此外由于高密度饲养环境的影响,山麻鸭体内产生的炎症可能导致肌肉损伤,加之运动量在不同密度组间存在差异,因此导致部分成肌相关基因的表达与饲养密度的关系仍不太明确,但Myod、Myog和Myh1的表达与饲养密度存在较强的关联性。有研究显示,肌肉损伤可导致Myod、Myog和Myh1基因的显著上调[26]。因此,我们推测饲养密度可能通过对骨骼肌产生炎症导致肌肉损伤修复过程增强,并通过运动量的改变引起炎症因子和肌肉生长关键基因表达的改变,最终影响了胸腿肌肌肉的发育,具体的分子机制还需进一步研究证实。
4 结论本研究结果表明,饲养密度对鸭舍的养殖环境以及育成期山麻鸭血液内毒素、体重、胫骨、胸腿肌生长、炎症因子和肌肉生长关键基因的表达都存在极大影响,2.5~5只/m2的饲养密度对山麻鸭饲养环境起到改善作用,并有效促进胫骨和胸腿肌的生长。本研究结果为阐明高饲养密度对山麻鸭胸腿肌和胫骨生长的具体影响提供了理论依据,为今后通过优化山麻鸭饲养密度从而提升山麻鸭生长性能提供了有益借鉴。
| [1] |
SUN A D, SHI Z D, HUANG Y M, LIANG S D. Development of out-of-season laying in geese and its impact on the goose industry in Guangdong Province, China[J]. World's Poultry Science Journal, 2007, 63(3): 481-490. DOI:10.1017/S0043933907001596 |
| [2] |
JONES T A, DAWKINS M S. Environment and management factors affecting Pekin Duck production and welfare on commercial farms in the Uk[J]. British Poultry Science, 2010, 51(1): 12-21. DOI:10.1080/00071660903421159 |
| [3] |
唐延天, 邓盾, 李贞明, 余苗, 陈卫东, 马现永. 畜禽规模化养殖场臭气减排调控技术研究进展[J]. 广东农业科学, 2020, 47(4): 106-113. TANG Y T, DENG D, LI Z M, YU M, CHEN W D, MA X Y. Research progress on control technology of odour emission reduction in large-scale livestock and poultry farms[J]. Guangdong Agricultural Sciences, 2020, 47(4): 106-113. |
| [4] |
张蒙, 黄晨轩, 岳巧娴, 锡建中, 代占辉, 赵晓钰, 陈辉. 饲养密度对大午金凤商品代蛋雏鸡生长性能、器官指数及血清抗氧化指标的影响[J]. 中国家禽, 2018, 40(4): 36-41. DOI:10.16372/j.issn.1004-6364.2018.04.008 ZHANG M, HUANG C X, YUE Q X, XI J Z, DAI Z H, ZHAO X Y, CHEN H. Effects of stocking density on growth performance, organ index and serum antioxidant indices of Dawu Jinfeng commercial laying chicks[J]. China Poultry, 2018, 40(4): 36-41. DOI:10.16372/j.issn.1004-6364.2018.04.008 |
| [5] |
白皓, 王统苗, 刘本帅, 仲黎, 张莘, 张扬, 江勇, 徐琪, 常国斌, 陈国宏. 饲养方式和密度对小体型肉鸭不同周龄体重的影响[J]. 中国家禽, 2019, 41(18): 56-59. DOI:10.16372/j.issn.1004-6364.2019.18.011 BAI H, WANG T M, LIU B S, ZHONG L, ZHANG S, ZHANG Y, JIANG Y, XU Q, CHANG G B, CHEN G H. Effects of feeding pattern and density on body weight of small meat ducks at different weeks of age[J]. China Poultry, 2019, 41(18): 56-59. DOI:10.16372/j.issn.1004-6364.2019.18.011 |
| [6] |
DEMMERS T G M, WATHES C M, RICHARDS P A, TEER N, TAYLOR L L, BLAND V, GOODMAN J, ARMSTRONG D, CHENNELLS D, DONE S H, HARTUNG J. A facility for controlled exposure of pigs to airborne dusts and gases[J]. Biosystems Engineering, 2003, 84(2): 217-230. DOI:10.1016/S1537-5110(2)00243-X |
| [7] |
CAVAILLON J M. Exotoxins and endotoxins: Inducers of inflammatory cy tokines[J]. Toxicon, 2018, 149: 45-53. DOI:10.1016/j.toxicon.2017.10.016 |
| [8] |
邵强, 黄友解, 韩月, 邹梅, 王友明. 酵母细胞壁的结构组成、生物学功能及在养殖业中的应用[J]. 浙江畜牧兽医, 2017, 42(1): 13-16. SHAO Q, HUANG Y J, HAN Y, ZOU M, WANG Y M. Structure composition, biological function and application of yeast cell wall in aquaculture[J]. Zhejiang Animal Science and Veterinary Medicine, 2017, 42(1): 13-16. |
| [9] |
GREGORY D.CARTEE. Mechanisms for greater insulin-stimulated glucose uptake in normal and insulin-resistant skeletal muscle after acute exercise[J]. American Journal of Physiology. Endocrinology and Metabolism, 2015, 309(12): 949-959. DOI:10.1152/ajpendo.00416.2015 |
| [10] |
BENSON A B, VENOOK A P, Al-HAWARY M M, CEDERQUIST L, CHEN Y J, CIOMBOR K K, COHEN S, COOPER H S, DEMING D, ENRSTROM P F, GREM J L, GROTHEY A, HOCHSTER H S, HOFFE S, HUNT S, KAMEL A, KIRILCUK N, KRISHNAMURTHI S, MESSERSMITH W A, MEYERHARDT J, MULCAHY M F, MURPHY J D, NURKIN S, SALTZ L, SHARMA S, SHIBATA D, SKIBBER J M, SOFOCLEOUS C T, STOFFEL E M, STOTSKY-HIMELFARB E, WILLETT. Rectal cancer, Version 2.2018, NCCN clinical practice guidelines in oncology[J]. Journal of the National Comprehensive Cancer Network, 2018, 16(7): 874-901. DOI:10.6004/jnccn.2018.0061 |
| [11] |
BRAUN T, BISCHHAUSEN-DENKER G, BOBER E, TANNICH E, ARNOLD H H. A novel human muscle factor related to but distinct from MyoD1 induces myogenic conversion in 10T1/2 fibroblasts[J]. The EMBO Journal, 1989, 8(3): 701-709. DOI:10.1002/j.1460-2075.1989.tb03429.x |
| [12] |
王琼, 刘益平, 蒋小松, 杨朝武, 杜华瑞, 邱莫寒, 朱庆. MyoG基因多态性与优质肉鸡屠宰性状和肉质性状的相关性分析[J]. 遗传, 2007(9): 1089-1096. DOI:10.16288/j.yczz2007.09.017 WANG Q, LIU Y P, JIANG X S, YANG C W, DU H R, QIU M H, ZHU Q. Correlation analysis of MyoG gene polymorphism with slaughtering traits and meat quality traits of high-quality broilers[J]. Genetic, 2007(9): 1089-1096. DOI:10.16288/j.yczz2007.09.017 |
| [13] |
GHOSH M, SODHI S S, SHARMA N, MONGRE R K, KIM N, SINGH AK, LEE S J, KIM D C, KIM S W, LEE H K, SONG K D, JEONG D K. An integrated in silico approach for functional and structural impact of non-synonymous SNPs in the MYH1 gene in Jeju Native Pigs[J]. BMC Genetics, 2016, 17(1): 35. DOI:10.1186/s12863-016-0341-1 |
| [14] |
TIMMER L T, HOOGAARS W M H, JASPERS R T. The role of IGF-1 signaling in skeletal muscle atrophy[J]. Advances in Experimental Medicine and Biology, 2018, 1088. DOI:10.1007/978-981-13-1435-3_6 |
| [15] |
MCPHERRON A C, LAWLER A M, LEE S J. Regulation of skeletal muscle mass in mice by a new TGF-p superfamily member[J]. Nature, 1997, 387(6628): 83-90. DOI:10.1038/387083a0 |
| [16] |
徐立, 胡瑞斌, 李兆波, 王冲, 张红. STZ诱导糖尿病大鼠胰腺及肝脏石蜡切片HE染色改进方法[J]. 临床与实验病理学杂志, 2019, 35(9): 1122-1124. DOI:10.13315/j.carolcarrollnkicjcep.2019.09.031 XU L, HU R B, LI Z B, WANG C, ZHANG H. An improved method of HE staining of paraffin sections of pancreas and liver in diabetic rats induced by STZ[J]. Journal of Clinical and Experimental Pathology, 2019, 35(9): 1122-1124. DOI:10.13315/j.carolcarrollnkicjcep.2019.09.031 |
| [17] |
冯培功, 郭艳丽, 杨华明, 班志彬, 梁浩, 张芳毓. 畜禽饲养密度对畜禽生产性能及健康影响的研究进展[J]. 黑龙江畜牧兽医, 2018(7): 34-38. DOI:10.13881/j.carolcarrollnkicjcep.hljxmsy.2017.06.0128 FENG P G, GUO Y L, YANG H M, BAN Z B, LIANG H, ZHANG F Y. Livestock and poultry breeding density on livestock and poultry production performance and the research progress of health effects[J]. Journal of Animal Husbandry and Veterinary in Heilongjiang Province, 2018(7): 34-38. DOI:10.13881/j.carolcarrollnkicjcep.hljxmsy.2017.06.0128 |
| [18] |
秦鑫, 卢营杰, 苗志强, 袁建敏, 武玉钦, 张雪, 张可可, 杨玉, 田文霞, 施寿荣, 李建慧. 饲养方式和密度对爱拔益加肉鸡生产性能、肉品质及应激的影响[J]. 中国农业大学学报, 2018, 23(12): 66-74. QIN X, LU Y J, MIAO Z Q, YUAN J M, WU Y Q, ZHANG X, ZHANG K K, YANG Y, TIAN W X, SHI S R, LI J H. Effects of feeding pattern and density on performance, meat quality and stress of Arbor Acres broilers[J]. Journal of China Agricultural University, 2018, 23(12): 66-74. |
| [19] |
万文龙, 俸艳萍, 龚炎长, 张弘毅, 王莹. 不同饲养密度对地面平养蛋鸡福利状况和生产性能的影响[J]. 中国家禽, 2019, 41(19): 39-45. DOI:10.16372/j.issin.1004-6364.2019.19.008 WAN W L, FENG Y P, GONG Y C, ZHANG H Y, WANG Y. Effects of different feeding densities on the welfare and performance of laying hens[J]. China Poultry, 2019, 41(19): 39-45. DOI:10.16372/j.issin.1004-6364.2019.19.008 |
| [20] |
厉秀梅. 饲养密度与偏热环境对肉鸡骨骼和肌肉生长、氧化及肠道形态的影响[D]. 北京: 中国农业科学院, 2018. LI X M. Effects of stocking density and warm environment on bone and muscle growth, oxidation and intestinal morphology of broilers[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. |
| [21] |
SHIM M Y, KARNUAH A B, MITHELL A D, ANTHONY N B, PESTI G M, AGGREY S E. The effects of growth rate on leg morphology and tibia breaking strength, mineral density, mineral content, and bone ash in broilers[J]. Poultry Science, 2012, 91(8): 1790. DOI:10.3382/ps.2011-01968 |
| [22] |
任婷. 鹅胚胎期及出生早期骨骼肌发育过程中MRFs/Pax3/Pax7和Tmem8c的表达模式和调控机制研究[D]. 杭州: 浙江农林大学, 2017. REN T. Expression patterns and regulatory mechanisms of MRFS/PAX3/PAX7 and TMEM8c during embryonic and early natal skeletal muscle development in geese[D]. Hangzhou: Zhejiang A & F University, 2017. |
| [23] |
BAKER L A, MARTIN N R W, KIMBER M C, PRITCHARD G J, LINDLEY M R, LEWIS M P. Resolvin E1(Rv E1)attenuates LPS induced inflammation and subsequent atrophy in C2C12 myotubes[J]. Journal of Cellular Biochemistry, 2018, 119(7): 6094-6103. DOI:10.1002/jcb.26807 |
| [24] |
殷璐瑶. 饲养密度对仔鹅生长、肉用性能及福利状况的影响[D]. 扬州: 扬州大学, 2018. YIN L Y. Effects of stocking density on growth, meat performance and welfare of geese[D]. Yangzhou: Yangzhou University, 2018. |
| [25] |
路睿睿, 白祥军. 脂多糖诱导体外培养骨骼肌卫星细胞表达肝细胞生长因子的变化[J]. 中国组织工程研究与临床康复, 2007(46): 9246-9249. LU R R, BAI X J. Effects of lipopolysaccharide on the expression of hepatocyte growth factor in cultured skeletal muscle cells[J]. Chinese Journal of Tissue Engineering Research and Clinical Rehabilitation, 2007(46): 9246-9249. |
| [26] |
DUMONT N A, WANG Y X, RUDNICKI M A. I. Intrinsic and extrinsic mechanisms regulating satellite cell function[J]. Development, 2015, 142(9): 1572-1581. DOI:10.1242/dev.114223 |
 2021, Vol. 48
2021, Vol. 48