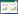文章信息
基金项目
- 国家自然科学基金(32072598);广东省重点建设学科科研能力提升项目(2021ZDJS004);贵州省自然科学技术基金项目(黔科合基础〔2018〕1184);广东省省级乡村振兴战略专项(粤财农〔2021〕37号)
作者简介
- 谢炳春(1997—), 男, 在读硕士生, 研究方向为辣椒果实香气形成机理, E-mail: 2406365581@qq.com.
通讯作者
- 衡周(1988—), 男, 博士, 助理研究员, 研究方向为辣椒果实香气形成机理, E-mail: hengzhou@gdaas.cn.
文章历史
- 收稿日期:2022-08-18
2. 广东省农业科学院蔬菜研究所/广东省蔬菜新技术研究重点实验室, 广东 广州 510640
2. Vegetable Research Institute, Guangdong Academy of Agricultural Sciences/Guangdong Key Laboratory for New Technology Research of Vegetables, Guangzhou 510640, China
【研究意义】辣椒(Capsicum spp.)是茄科(Solanaceae)辣椒属(Capsicum L.)植物,原产于中南美洲,是我国种植面积最大的蔬菜[1]。中国辣椒(Capsicum chinense Jacq.)是辣椒5个主要栽培种之一,其大多数资源均富含浓郁果香味,具有更丰富的味觉层次,是极好的商品性状,如海南黄灯笼辣椒[2]、广西小黄灯笼辣椒[3]和云南涮辣[4]等。据报道,中国辣椒中果香物质主要为3- 甲基丁酸-4- 甲基戊酯、2- 甲基丁酸-4- 甲基戊酯和3- 甲基丁酸-4- 烯-6- 甲基庚酯等支链酯类物质[5]。植物支链酯类主要通过支链氨基酸途径合成。BCAT催化支链氨基酸生成相应的2- 氧代酸[6],经过多步反应后合成支链酯[8]。研究表明,BCAT基因在辣椒支链酯及相关代谢物合成过程中发挥着重要作用,因此开展中国辣椒BCAT基因的克隆和时空表达特征分析,对该基因功能研究和提升华南地区辣椒品质育种具有重要意义[8-9]。【前人研究进展】BCAT作为催化植物支链酯类物质合成第一步反应的酶,受到许多研究重视。2002年Diebold等[10]首次鉴定并克隆出拟南芥中6个BCAT基因并对其进行基因功能验证,结果显示AtBCAT1、AtBCAT2、AtBCAT3、AtBCAT5和AtBCAT6参与支链氨基酸合成,AtBCAT2、AtBCAT3、AtBCAT5蛋白定位于叶绿体,AtBCAT1蛋白位于线粒体。Schuster等[11] 2005年使用GUS染色和酶促动力学等方法证明AtBCAT1参与拟南芥所有组织中支链氨基酸代谢;2006年发现AtBCAT4参与蛋氨酸的链延长途径[12]。2008年Knill等[13]推测AtBCAT3最有可能催化蛋氨酸链延长过程中的末端步骤,从而产生短链硫代葡萄糖苷。随后又有研究者相继对番茄[14]、水稻[6]和小麦[14-15]中的BCAT基因进行功能验证,相关基因功能与拟南芥的结果一致。2014年郭道义[16]通过联合改造酵母的亮氨酸、缬氨酸和脂肪酸途径,成功实现支链醇和支链酯的生物合成,目前微生物中BCAT参与支链醇和支链酯合成已经被研究得比较清楚[17-18]。在乳球菌[19]、甜瓜[20]和香蕉[21]中均有报道显示其表达量与支链酯类含量呈正相关。【本研究切入点】广东省农业科学院蔬菜研究所茄果研究室研发的辣椒品种金田1号具有浓郁果香,据先前预实验分析得知其挥发性有机物质主要为支链酯,这为中国辣椒支链氨基酸转氨酶研究提供了物质基础,前人研究表明BCAT基因参与支链酯和辣椒素等次生代谢物的生物合成,但在辣椒中还没有BCAT基因家族相关的报道。【拟解决的关键问题】本研究拟通过对中国辣椒BCAT基因家族的生物信息学鉴定、表达模式分析及克隆,明确中国辣椒基因组中BCAT基因的数目及分布,获得其BCAT基因时空表达特征及确切序列。本研究是辣椒BCAT功能研究的基础,可为辣椒支链酯类物质代谢机理研究提供一定的理论支持
1 材料与方法 1.1 试验材料供试材料为中国辣椒栽培种金田1号(图 1、图 2),由广东省农业科学院蔬菜研究所茄果研究室李颖提供。2021年7月将辣椒种子浸泡12 h后于28℃催芽,露白后播种于装有专用育苗基质的32孔穴盘,待幼苗长至5~6片真叶,移栽到广东省农业科学院白云试验基地露地栽培,按常规田间栽培管理。开花坐果后分别挂牌,每隔5 d取样1次,分别取名为F1~F8,设3个生物学重复,液氮速冻后带回实验室液氮下研磨成粉末保存于–80℃超低温冰箱。

|
| 图 1 辣椒植株 Fig. 1 Plant of Capsicum chinense |

|
| 图 2 不同生长时期辣椒果实 Fig. 2 Different stage of pepper fruit |
1.2 试验方法
1.2.1 辣椒BCAT家族数据获取与鉴定 由NCBI网站(https://www.ncbi.nlm.nih.gov/)下载中国辣椒基因组数据,查询相关文献已经验证过的BCAT基因的序列信息(表 1),在Pfam网站(https://web.expasy.org/protparam/)下载BCAT(PF01063)的hmm文件,使用HMMER(V3.3.1)软件和TB Tools(V1.09876)软件对蛋白质的氨基酸序列进行比对(E-value < 1×10-5,其余参数默认)。通过在线BLAST、hmmsearch及hmmbuild和hummsearch联用等手段对辣椒BCAT基因家族成员进行鉴定。
1.2.2 辣椒BCAT基因家族成员蛋白理化性质、亚细胞定位预测和染色体定位 辣椒BCAT蛋白的氨基酸数目、分子量大小、等电点、亲水性及亚细胞定位预测分别由在线软件ExPASyProtParam(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)和Plant-mPLoc serve(http://gsds.gao-lab.org/)完成,染色体分布图绘制在软件MapChart 2.32上完成。
1.2.3 辣椒BCAT基因家族进化树构建 使用MAGA X(Version 10.2.6)软件对拟南芥、番茄、水稻、小麦和辣椒BCAT家族成员构建系统进化树(邻接法,1 000次重复)。
1.2.4 辣椒BCAT基因家族成员内含子外显子分析 使用在线工具GSDS2.0(http://memesuite.org/tools/meme)对辣椒BCAT基因家族成员内含子外显子进行分析。
1.2.5 辣椒BCAT家族基因保守基序分析 使用在线软件MEME(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对辣椒BCAT蛋白进行保守基序(Motif)分析,最大motif检索数值为20。
1.2.6 辣椒BCAT家族基因蛋白质二级结构、三级结构分析、活性位点和配体预测 分别使用在线软件SOPMA(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)和数据库Phyre2(https://zhanggroup.org/COACH/)提交所得蛋白序列,经过运算后得到蛋白质二级结构和三级结构。使用蛋白质活性位点预测数据库COACH(https://pymol.org/2/)对辣椒BCAT蛋白进行活性位点及配体预测,提取配体结合度最高的结果,使用软件PyMOL(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行修饰,查看BCAT基因家族成员蛋白的溶剂催化通道。
1.2.7 辣椒BCAT家族基因启动子区域顺式作用元件分析 提取BCAT基因家族成员起始密码子上游2 000 bp序列,利用在线网站Plant CARE(http://kns.cnki.net/kcms/detail/46.1068.S.20220524.2020.011.html)结合TBtool软件对BCAT基因家族成员启动子区域的顺式作用元件进行预测分析。
1.2.8 辣椒BCAT基因家族成员时空表达量分析 使用北京全式金生物技术股份有限公司RNA提取试剂盒提取辣椒根、茎、叶、花和各个时期果实的总RNA;反转录试剂盒和荧光定量试剂盒SYBR Premix Ex TaqTM均购自日本TaKaRa公司,以上所有操作均按照试剂盒说明书进行。反转录体系使用20 µL体系,荧光定量PCR采用25 µL体系,扩增程序为95℃ 30 s、95 ℃ 5 s、60℃ 30 s,40个循环;溶解曲线绘制程序为:65 ℃到95 ℃每0.5℃依次读板,每个样品3次重复。目标基因相对表达量计算使用2–ΔΔCT法。荧光定量PCR引物信息如表 2。
1.2.9 CcBCAT1~4基因克隆 根据CcBCAT1~4基因模板序列于目标基因前后设计带接头特异引物(表 2),使用cDNA进行扩增胶回收后连接pNC-Cam1304-SubN载体[22]。连接好的载体转入Trans5α,菌液PCR阳性后送北京擎科生物科技有限公司测序。
2 结果与分析 2.1 辣椒BCAT基因家族成员鉴定和进化分析通过自建隐马尔可夫模型和下载隐马尔可夫模型分别得到7个BCAT基因,去除重复和保守结构域筛选后鉴定出5个BCAT基因家族成员,分别命名为CcBCAT1、CcBCAT2、CcBCAT3、CcBCAT4、CcBCAT5。染色体物理位置定位分析显示,辣椒BCAT1~BCAT5染色体位置分别位于12、4、2、8和4号染色体(图 3)。这些基因位于4条染色体末端,其中CcBCAT2和CcBCAT5重复相近地位于4号染色体上,这两个基因在表达上可能有所联系,其余辣椒BCAT基因分别位于一条染色体上。
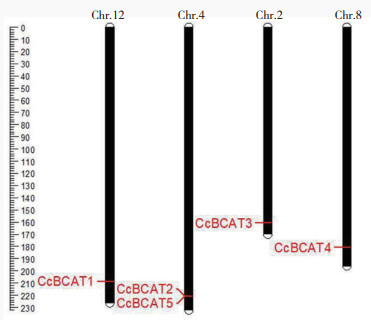
|
| 图 3 CcBCATs基因染色体定位图 Fig. 3 Chromosome location of the CcBCAT genes |
系统进化分析显示辣椒BCAT基因的同源性与同为茄科的番茄同源性极高,如SlBCAT1、SlBCAT2和SlBCAT3分别与CcBCAT1、CcBCAT2、CcBCAT3高度同源,可以推测对应蛋白质具有相似的功能;CcBCAT4则呈现独立进化;CcBCAT5与AtBCAT1同源性较高(图 4)。
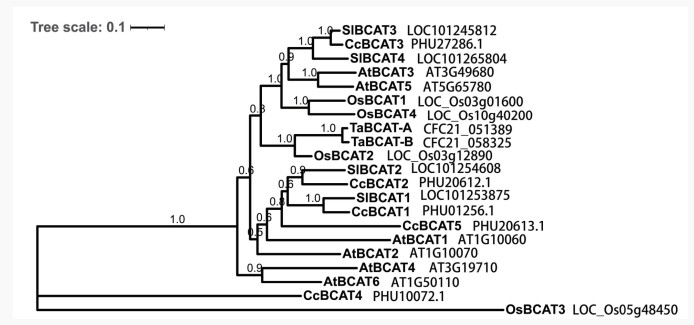
|
| 图 4 拟南芥、番茄、水稻小麦和中国辣椒中BCAT蛋白的系统发育树 Fig. 4 Phylogenetic tree of BCAT proteins in Arabidopsis, tomato, rice, wheat and Capsicum chinense |
辣椒BCAT基因家族成员内含子外显子分析结果(图 5)表明,BCAT1和BCAT3含有9个内含子,BCAT2、BCAT4和BCAT5分别含有8、18、4个内含子。BCAT1的内含子序列最长,将近17 kb;BCAT2的内含子序列最短,仅有2 kb左右。
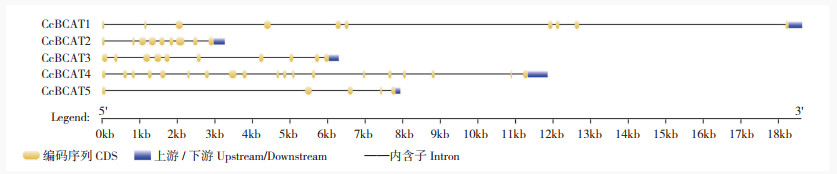
|
| 图 5 CcBCATs基因的结构 Fig. 5 Structure of CcBCAT genes |
2.2 CcBCATs启动子区域顺式作用元件分析
启动子控制着基因的时空表达,对基因的调控具有重要作用。辣椒BCAT基因家族成员启动子顺式作用元件如图 6所示,BCAT基因家族成员启动子区域含有14种启动子,如光响应元件、茉莉酸响应元件、低温响应元件等常见启动子。BCAT1-5启动子区域均发现MYB转录因子结合位点。

|
| 图 6 CcBCAT基因家族成员启动子区域顺式元件分析 Fig. 6 Cis-acting elements analysis for the promoter of CcBCAT gene family members |
2.3 CcBCATs基因家族成员理化性质和亚细胞定位预测
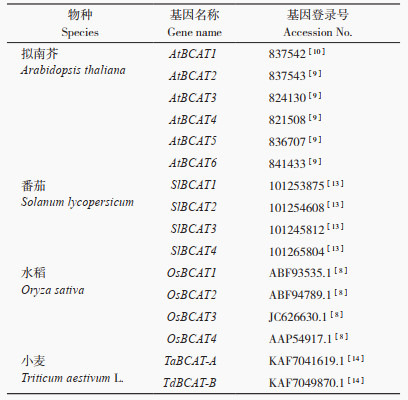
CcBCATs蛋白的理化性质如表 3,CcBCATs编码氨基酸序列长度在184 aa(CcBCAT5)至557 aa(CcBCAT4),分子量在20 289.41 u(CcBCAT5)至89 598.03 u(CcBCAT4),等电点从5.57(CcBCAT5)至8.34(CcBCAT2),疏水性系数均为负值,为亲水性蛋白。亚细胞定位预测显示,CcBCAT1基因编码的蛋白定位在叶绿体和线粒体,其他CcBCAT家族基因编码的蛋白均定位在叶绿体,这与番茄中BCAT基因定位结果[13]一致。
2.4 CcBCATs基因保守基序分析
在线软件MEME对CcBCATs基因保守基序(Motif)分析结果表明,CcBCAT蛋白中含有8个保守基序,有着相似的保守基序组成的辣椒BCAT基因家族成员可能有着相似功能。其中基序4和基序7共同组成Aminotran_4结构域(图 7),除CcBCAT5基因不含有此结构域,其他辣椒BCAT基因家族成员均含有。对应MEME预测的辣椒中基序1、基序2、基序4和基序7均为4个基因成员含有,其中CcBCAT4不含基序1和基序2、CcBCAT5不含基序4和基序7。
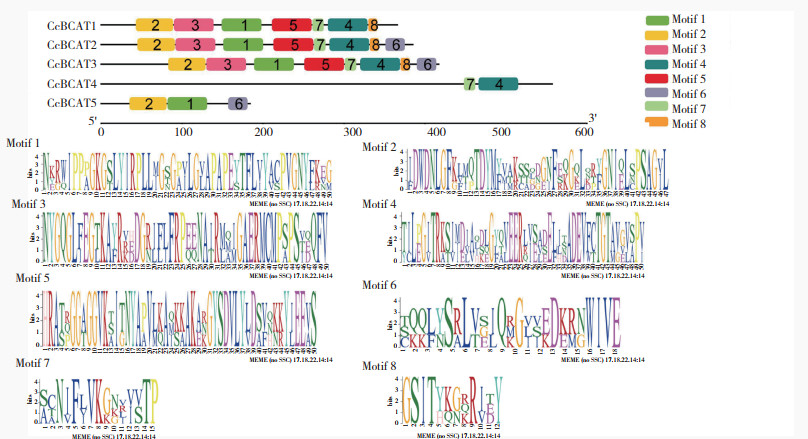
|
| 图 7 CcBCAT蛋白质Motif分析 Fig. 7 Protein motif analysis of CcBCAT protein |
2.5 CcBCATs基因蛋白质二级结构和三级结构分析
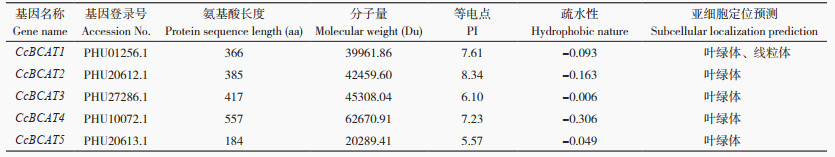
CcBCAT基因家族成员蛋白质二级结构分析结果(图 8)表明,5个基因家族成员均有α- 螺旋、延伸链、β- 转角和无规则卷曲4种结构元件。CcBCAT4的α- 螺旋占比(34.83%)高于其他4个基因家族成员;CcBCAT5延伸链占比高于其他4个基因家族成员,β- 转角则相反;5个基因家族成员蛋白的无规则卷曲数量占比一致(表 4)。
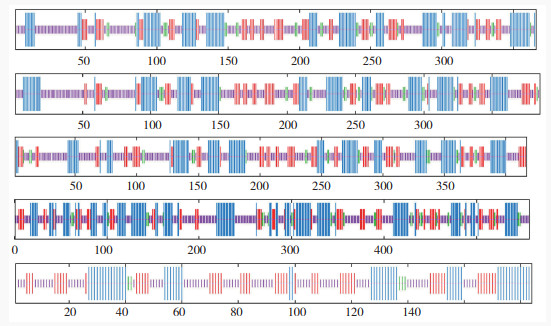
|
| 蓝色:α-螺旋;红色:延伸链;绿色:β-转角;紫色:无规则卷曲 Blue: Alpha helix; Red: Extended strand; Green: Beta turn; Purple: Random coil 图 8 CcBCAT蛋白二级结构预测分析结果 Fig. 8 Prediction analysis of the secondary structure of CcBCAT protein |
CcBCAT基因家族成员蛋白三级结构、活性位点和配体预测如图 9所示,其蛋白质三级结构外型相似,活性位点均在蛋白质腔体内部。配体预测结果显示BCAT1-4的配体均为4-甲基-2- 氧戊酸,BCAT5则没有合适配体。
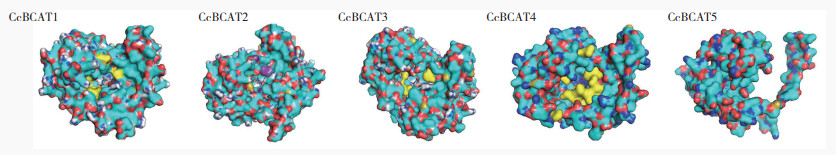
|
| 棍棒结构:配体;黄色:活性位点 Culb structure: Ligand; Yellow: Active site 图 9 CcBCAT蛋白三级结构预测分析结果 Fig. 9 Prediction analysis of the tertiary structure of CcBCAT protein |
2.6 CcBCAT基因家族成员时空表达量分析
CcBCAT基因家族成员时空表达量分析如图 10所示,辣椒BCAT基因家族成员在不同组织表达情况分析发现:CcBCAT1在F1期表达量最高,CcBCAT2在花中的表达量最高,CcBCAT3、CcBCAT4在成熟辣椒中表达量最高,CcBCAT5在根、茎、叶、花和果实中均没有表达。

|
| 图 10 CcBCAT基因在不同组织及果实发育中的表达情况 Fig. 10 Expression of CcBCAT genes in different tissues and developing fruits |
对BCAT基因家族成员在辣椒果实成熟过程基因表达量进行分析,结果显示,CcBCAT1表达量在辣椒果实成熟过程中呈现逐步下调的趋势并在成熟果实中达到最低值,CcBCAT2和CcBCAT3的表达量在辣椒发育过程中呈现先下降后升高并在成熟果实中达到峰值,CcBCAT4表达量在辣椒发育成熟过程中逐步提升并在成熟果实中达到最高。
2.7 CcBCAT1~CcBCAT4基因克隆根据CcBCAT1~CcBCAT4的CDS序列设计PCR特异引物,以cDNA为模板,对目标基因进行PCR扩增,获得长度约为2 000 bp大小的片段(图 11)。片段胶回收,连载体转入大肠杆菌中,将PCR阳性菌落送测序,测序序列与目标参考序列进行比对,CcBCAT1、CcBCAT2和CcBCAT4克隆序列与模板序列完全一致;CcBCAT3则显示第18、23、225和903处有单个碱基突变,造成CcBCAT3氨基酸序列第8处的缬氨酸(V)变成丙氨酸(A)。

|
| M: DL 2000 DNA marker; 1: CcBCAT1; 2: CcBCAT2; 3: CcBCAT3; 4: CcBCAT4 图 11 CcBCAT1~CcBCAT4基因扩增结果 Fig. 11 Amplification result of CcBCAT1~CcBCAT4 genes |
3 讨论
BCAT基因家族作为一个小基因家族,最早于拟南芥中开始研究,是生物体内支链氨基酸代谢的重要一环,对辣椒合成相关支链氨基酸衍生物如辣椒素[23]和支链酯[7, 24]等应对生物及非生物胁迫具有重要意义,在拟南芥[10-11]、番茄[14]、水稻[6]和小麦[15]中均有报道。本研究从中国辣椒基因组中鉴定出5个BCAT基因,发现CcBCAT1~CcBCAT3在进化关系上分别与番茄[14] SlBCA-T1-3高度同源;CcBCAT4虽然在进化树位置上呈现独立进化,但是CcBCAT4的氨基酸序列拥有BCAT基因的Aminotran_4结构域,并且配体预测结果与4- 甲基-2- 氧戊酸[7]底物特异性结合;CcBCAT5则与拟南芥AtBCAT1同源性较高。CcBCAT亚细胞定位结果显示,除CcBCAT1定位在叶绿体或线粒体,其他均在叶绿体中,符合支链氨基酸转氨酶亚细胞定位结果[6, 14]。因此所鉴定出的5个CcBCAT基因与经过验证的BCAT[6, 10-11, 14-15]基因序列特征相似,具有支链氨基酸转氨酶蛋白的主要特征。
启动子是一段位于结构基因5' 端上游区的DNA序列,决定基因的表达与否。对启动子的研究有利于了解CcBCAT基因的调控模式和对外界环境的响应。启动子顺式元件分析显示,辣椒BCAT基因家族成员基因在启动子区域具有多种顺式作用元件,包括调控辣椒素及次生代谢物合成的MYB转录因子结合区域。MYB转录因子是植物中第一大类转录因子家族,广泛参与调控植物次生代谢物合成,对植物抵御外界生物胁迫[25-27]和非生物胁迫具有重要意义。例如,2014年Li等[28]发现苹果MYB1和MYB6可以与苹果AAT2启动子区域的MYB位点结合,增强其转录活性;2019年Zhu等[29]发现MYB31基因能激活辣椒合成途径相关基因,使辣椒素得以合成积累,2022年Zhang等[30]对辣椒素合成途径相关基因启动子区域分析,发现多个功能基因上游均有MYB结合位点。还有研究发现,苹果中BCAT参与了苹果支链酯合成[31]。结合本研究结果和已有文献推测,CcBCAT可能在辣椒素和相关酯类物质合成中起到重要作用。
基因的表达量是影响蛋白表达丰度进而影响相应酶功能的重要因素。对CcBCAT基因的表达分析显示其存在组织特异性表达,且在果实的不同发育时期表达规律也有所差异。CcBCAT5虽然有完整的开放阅读框、能编码完整的蛋白,但是在所有组织器官中均检测不到表达,这一结果与番茄中SlBCAT5-6表达模式[32]一致。但CcBCAT5是否是一个假基因还需要进一步验证。CcBCAT4仅在辣椒花和果实中有表达,并且随着果实的生长表达量不断提高,与辣椒素积累量[33]、辣椒挥发性有机物质积累量呈正相关,推测其参与中国辣椒的辣椒素合成,该结果与Zhang等[30]、Zhang等[34]和Kim等[23]研究结果一致,而番茄果实中BCAT则一直呈现低水平表达[14]。CcBCAT2和CcBCAT3的表达模式相似,辣椒果实发育时两者的表达量变化一致,CcBCAT2和CcBCAT3两者之间有可能与拟南芥AtBCAT3-4的关系[12-13]相似,参与蛋氨酸碳链延长步骤中的一环,不过两者的功能和相关性还需要更多实验数据进行支撑。
4 结论通过生物信息学的方法鉴定出中国辣椒基因组中5个BCAT基因,并对其蛋白质理化性质、二级结构、三级结构、活性位点、配体和时空表达特异性等进行分析,克隆出CcBCAT1~CcBCAT4等4个关键基因。结果表明中国辣椒BCAT基因家族是一个结构复杂的小基因家族,除CcBCAT5可能是个假基因,其他基因的表达均有特异性,如CcBCAT4在辣椒果实中表达模式与辣椒素和相关挥发性代谢物积累模式一致,有可能参与支链氨基酸衍生物合成。本研究将有利于推进辣椒支链氨基酸代谢研究,为辣椒风味品质提升提供数据支持。
| [1] |
邹学校, 朱凡. 辣椒的起源、进化与栽培历史[J]. 园艺学报, 2022, 49(6): 1371-1381. DOI:10.16420/j.issn.0513-353x.2021-0853 ZOU X X, ZHU F. Origin, evolution and cultivation history of the pepper[J]. Acta Horticulturae Sinica, 2022, 49(6): 1371-1381. DOI:10.16420/j.issn.0513-353x.2021-0853 |
| [2] |
王炳, 刘进平. 黄灯笼辣椒高产优质栽培技术[J]. 热带农业科学, 2020, 40(12): 5-9. DOI:10.12008/j.issn.1009-2196.2020.12.002 WANG B, LIU J P. High yielding cultivation of high-quality yellow lantern pepper[J]. Chinese Journal of Tropical Agriculture, 2020, 40(12): 5-9. DOI:10.12008/j.issn.1009-2196.2020.12.002 |
| [3] |
王立浩, 张宝玺, 张正海, 曹亚从, 于海龙, 冯锡刚. 辣椒遗传育种研究进展[J]. 园艺学报, 2020, 47(9): 1727-1740. DOI:10.16420/j.issn.0513-353x.2020-0487 WANG L H, ZHANG B X, ZHANG Z H, CAO Y C, YU H L, FENG X G. Research progress in genetics and breeding of Capsicum[J]. Acta Horticulturae Sinica, 2020, 47(9): 1727-1740. DOI:10.16420/j.issn.0513-353x.2020-0487 |
| [4] |
顾晓振, 郑宇峰, 张正海, 曹亚从, 张宝玺, 李锡香, 王立浩. 云南地方辣椒品种涮辣和雀辣的植物学分类[J]. 植物遗传资源学报, 2016, 17(5): 809-814. DOI:10.13430/j.cnki.jpgr.2016.05.003.jpgr.2016.05.003 GU X Z, ZHENG Y F, ZHANG Z H, CAO Y C, ZHANG B X, LI X X, WANG L H. The botanical classification of local pepper varieties'Shuan La'and 'Que La'in Yunnan[J]. Journal of Plant Genetic Resources, 2016, 17(5): 809-814. DOI:10.13430/j.cnki.jpgr.2016.05.003.jpgr.2016.05.003 |
| [5] |
叶子, 商智勋, 李美奇, 任洪冰, 屈用函, 胡小松, 易俊洁. 基于HSSPME-GC-MS非靶向分析不同发酵小米辣的风味差异[J]. 食品科学, 2022, 43(6): 309-316. DOI:10.7506/spkx1002-6630-20210308-098 YE Z, SHANG Z X, LI M Q, REN H B, QU Y H, HU X S, YI J J. Untargeted analysis of lavor differences among fermented Capsicum frutescens from different cultivars based on headspace solid phase Microextraction-Gas Chromatography-Mass Spectrometry[J]. Food Science, 2022, 43(6): 309-316. DOI:10.7506/spkx1002-6630-20210308-098 |
| [6] |
孙阳阳. 水稻转录因子OsbZIP18和OsBCAT家族基因的功能研究[D]. 武汉: 华中农业大学, 2020. SUN Y Y. Functional analysis of rice transcription factor OsbZIP18 and OsBCAT family genes[D]. Wuhan: Huazhong Agricultural University, 2020. |
| [7] |
SUGIMOTO N, ENGELGAU P, DANIEL JONES A, SONG J, BEAUDRY R. Citramalate synthase yields a biosynthetic pathway for isoleucine and straight-and branched-chain ester formation in ripening apple fruit[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(3): e2009988118. DOI:10.1073/PNAS.2009988118 |
| [8] |
钱玉磊, 闫晋强, 杨松光, 刘文睿, 谢大森, 吴智明, 江彪. 冬瓜抗氧化基因的克隆及其在非生物胁迫下的表达分析[J]. 广东农业科学, 2022, 48(7): 33-41. DOI:10.16768/j.issn.1004-874X.2022.07.005 QIAN Y L, YAN J Q, YANG S G, LIU W R, XIE D S, WU Z M, JIANG B. Analyses on cloning and expression of oxidation resistance genes in Wax Gourd under abiotic stress[J]. Guangdong Agricultural Sciences, 2022, 48(7): 33-41. DOI:10.16768/j.issn.1004-874X.2022.07.005 |
| [9] |
李颖, 王恒明, 徐小万, 徐晓美, 王得元, 李乃坚, 余小林. 华南地区辣椒品种选育及育种技术研究进展[J]. 广东农业科学, 2020, 47(11): 60-69. DOI:10.16768/j.issn.1004-874X.2020.11.007 LI Y, WANG H M, XU X W, XU X M, WANG D Y, LI N J, YU X L. Breeding of pepper cultivars in South China and research progress in pepper breeding technology[J]. Guangdong Agricultural Sciences, 2020, 47(11): 60-69. DOI:10.16768/j.issn.1004-874X.2020.11.007 |
| [10] |
DIEBOLD R, SCHUUSTER J, DASCHNER K, BINDER S. The branched-chain amino acid transaminase gene family in Arabidopsis encodes plastid and mitochondrial proteins[J]. Plant Physiology, 2020, 129(2): 540-50. DOI:10.1104/pp.001602 |
| [11] |
SCHUSTER J, BINDER S. The mitochondrial branched-chain aminotransferase (AtBCAT-1) is capable to initiate degradation of leucine, isoleucine and valine in almost all tissues in Arabidopsis thaliana[J]. Plant Molecular Biology, 2005, 57(2): 241-254. DOI:10.1007/s11103-004-7533-1 |
| [12] |
SCHUSTER J, KNILL T, REICHELT M, GERSHENZON J, BINDER S. Branched-chain aminotransferase4 is part of the chain elongation pathway in the biosynthesis of methionine-derived glucosinolates in Arabidopsis[J]. The Plant Cell, 2006, 18(10): 2664-2679. DOI:10.1105/tpc.105.039339 |
| [13] |
KNILL T, SCHUSTER J, REICHELT M, GERSHENZON J, BINDER S. Arabidopsis branched-chain aminotransferase 3 functions in both amino acid and glucosinolate biosynthesis[J]. Plant Physiology, 2008, 146(3): 1028-1039. DOI:10.1104/pp.107.111609 |
| [14] |
MALONEY G S, KOCHEVENKO A, TIEMAN D M, TOHGE T, KRIEGER U, ZAMIR D, TAYLOR M G, FERNIE A R, KLEE H J. Characterization of the branched-chain amino acid aminotransferase enzyme family in tomato[J]. Plant Physiology, 2010, 153(3): 925-936. DOI:10.1104/PP.110.154922 |
| [15] |
BUFFAGNI V, VURRO F, JANNI M, GULLI M, KELLER A A, MARMIROLI N. Shaping durum wheat for the future: Gene expression analyses and metabolites profiling support the contribution of BCAT genes to drought stress response[J]. Frotiers in Plant Science, 2020, 11: 891. DOI:10.3389/fpls.2020.00891 |
| [16] |
郭道义. 组合代谢途径扩展脂肪酸酯的生物合成[D]. 武汉: 武汉大学, 2014. GUO D Y. Expanding of fatty acid esters biosynthesis through the combination of different metabolic pathways[D]. Wuhan: Wuhan University, 2014. |
| [17] |
SHI J, ZHAN Y Y, ZHOU M L, HE M, WANG Q, LI X, WEN Z Y, CHEN S W. High-level production of short branched-chain fatty acids from waste materials by genetically modified Bacillus licheniformis[J]. Bioresource Technology, 2019, 271: 325-331. DOI:10.1016/j.biortech.2018.08.134 |
| [18] |
于爱群, 庞亚如, 胡智慧, 肖冬光. 平台化学品短链支链脂肪酸和短链支链醇的微生物代谢工程[J]. 微生物学通报, 2018, 45(1): 173-180. DOI:10.13344/j.microbiol.china.170196 YU A Q, PANG Y R, HU Z H, XIAO D G. Advances in metabolic engineering for the microbial production of short branched-chain fatty acids and short branched-chain alcohols[J]. Microbiology China, 2018, 45(1): 173-180. DOI:10.13344/j.microbiol.china.170196 |
| [19] |
RIJNEN L, YVON M, KRANENBURG R V, COURTIN P, VERHEUL A, CHAMBELLON E, SMIT G. Lactococcal aminotransferases AraT and BcaT are key enzymes for the formation of aroma compounds from amino acids in cheese[J]. International Dairy Journal, 2003, 13(10): 805-812. DOI:10.1016/S0958-6946(03)00102-X |
| [20] |
GONDA I, BAR E, PORTONY V, LEV S, BURGER J, SCHAFFER A A, TADMOR Y, GEPSTEIN S, GIOVANNONI J J, KATZIR N, LEWINSOHN E. Branched-chain and aromatic amino acid catabolism into aroma volatiles in Cucumis melo L. fruit[J]. Journal of Experimental Botany, 2010, 61(4): 1111-1123. DOI:10.1093/jxb/erp390 |
| [21] |
SHIVASHANKARA K S, PAVITHRA K C, GEETHA G A, ROY T, PATIL P, MENON R. Seasonal influence on volatile aroma constituents of two banana cultivars (Grand Naine and Nendran) under Kerala conditions[J]. Journal of Horticultural Science, 2018, 12(2): 109-117. DOI:10.1016/j.scienta.2020.109214 |
| [22] |
YAN P, ZENG Y J, SHEN W T, TUO D C, LI X Y, ZHOU P. Nimble cloning: a simple, versatile, and efficient system for standardized molecula r cloning[J]. Front iers in Bioe ng ineer ing and Biotechnology, 2019, 7: 460. DOI:10.3389/fbioe.2019.00460 |
| [23] |
KIM S, PARK M, YEOM S I, KIM Y M, LEE J M, LEE H A, SEO E Y, CHOI J Y, CHEONG K, KIM K T, JUNG K, LEE G W, OH S K, BAE C, KIM S B, LEE H Y, KIM S Y, KIM M S, KANG B C, JO Y D, YANG H B, JEONG H J, KANG W H, KWON J K, SHIN C, LIM J Y, PARK J H, HUH J H, KIM J S, KIM B D, COHEN O, PARAN I, SUH M C, LEE S B, KIM Y K, SHIN Y, NOH S J, PARK J, SEO Y S, KWON S Y, KIM H A, PARK J M, KIM H J, CHOI S B, BOSLAND P W, REEVES G, JO S H, LEE B W, CHO H T, CHOI H S, LEE M S, YU Y, CHOI Y D, PARK B S, DEYNZE A V, ASHRAFI H, HILL T, KIM W T, PAI H S, AHN H K, YEAM I, GIOVANNONI J J, ROSE J K C, SORENSEN I, LEE S J, KIM R W, CHOI I Y, CHOI B S, LIM J S, LEE Y H, CHOI D. Genome sequence of the hot pepper provides insights into the evolution of pungency in Capsicum species[J]. Nature Genetics, 2014, 46(3): 270-278. DOI:10.1038/ng.2877 |
| [24] |
MA Q, XU Y Q, XIAO H, MARIGA A M, CHEN Y P, ZHANG X C, WANG L, LI D, LI L, LUO Z S. Rethinking of botanical volatile organic compounds applied in food preservation: Challenges in acquisition, application, microbial inhibition and stimulation[J]. Trends in Food Science & Technology, 2022, 125: 166-184. DOI:10.1016/J.TIFS.2022.05.007 |
| [25] |
祁全梅, 李秋荣. 昆虫气味受体研究进展[J]. 广东农业科学, 2022, 49(1): 111-120. DOI:10.16768/j.issn.1004-874X.2022.01.013 QI Q M, LI Q R. Research progress of insect odorant receptors[J]. Guangdong Agricultural Sciences, 2022, 49(1): 111-120. DOI:10.16768/j.issn.1004-874X.2022.01.013 |
| [26] |
刘冰霜, 王臣, 杨冲, 刘庆华, 谭周亮. 基于蛋白组学对苯胺降解菌Rhodococcus sp. AN-P1苯胺胁迫响应的研究[J]. 广东农业科学, 2020, 47(4): 85-91. DOI:10.16768/j.issn.1004-874X.2020.04.012 LIU B S, WANG C, YANG C, LIU Q H, TAN Z L. Research on aniline-degrading bacterium Rhodococcus sp. AN-P1 in response to aniline based on proteomics[J]. Guangdong Agricultural Sciences, 2020, 47(4): 85-91. DOI:10.16768/j.issn.1004-874X.2020.04.012 |
| [27] |
陈博雯, 肖玉菲, 李军集, 张烨, 覃子海, 张晓宁, 刘海龙. EuCAD基因小片段RNAi对烟草木质素合成的影响[J]. 广东农业科学, 2020, 47(6): 1-7. DOI:10.16768/j.issn.1004-874X.2020.06.001 CHEN B W, XIAO Y F, LI J J, ZHANG Y, QIN Z H, ZHANG X N, LIU H L. Effect of RNA interference triggered by small fragment of EuCAD gene on lignin synthesis in tobacco[J]. Guangdong Agricultural Sciences, 2020, 47(6): 1-7. DOI:10.16768/j.issn.1004-874X.2020.06.001 |
| [28] |
LI P C, YU S W, SHEN J, LI Q Q, LI D P, LI D Q, ZHENG C C, SHU H R. The transcriptional response of apple alcohol acyltransferase (MdAAT2) to salicylic acid and ethylene is mediated through two apple MYB TFs in transgenic tobacco[J]. Plant Molecular Biology, 2014, 85(6): 627-638. DOI:10.1007/s11103-014-0207-8 |
| [29] |
ZHU Z S, SUN B M, CAI W, ZHOU X, MAO Y H, CHEN C J, WEI J L, CAO B H, CHEN C M, CHEN G J, LEI J J. Natural variations in the MYB transcription factor MYB31 determine the evolution of extremely pungent peppers[J]. New Phytologist, 2019, 223(2): 922-938. DOI:10.1111/nph.15853 |
| [30] |
ZHANG W, WU D, ZHANG L P, ZHAO C Z, SHU H Y, CHENG S H, WANG Z W, ZHU J, LIU P W. Identification and expression analysis of capsaicin biosynthesis pathway genes at genome level in Capsicum chinense[J]. Biotechnology & Biotechnological Equipment, 2022, 36(1): 232-244. DOI:10.1080/13102818.2022.2071633 |
| [31] |
LIU M J, ARJEN N, CHRISTOF F, SIEZEN R J. Comparative genomics of enzymes in flavor-forming pathways from amino acids in lactic acid bacteria[J]. Applied and Environmental Microbiology, 2008, 74(15): 4590-4600. DOI:10.1128/AEM.00150-08 |
| [32] |
KOCHEVENKO A, KLEE H J, FERNIE A R, ARAUJO W L. Molecular identification of a further branched-chain aminotransferase 7 (BCAT7) in tomato plants[J]. Journal of Plant Physiology, 2012, 169(5). DOI:10.1016/j.jplph.2011.12.002 |
| [33] |
吴鹏, 黄思远, 郭茜茜, 王丽, 丁楚琦, 范明玉. 辣椒素3个积累时期miRNA分析[J/OL]. 分子植物育种: 1-10[2022-07-29]. http://kns.cnki.net/kcms/detail/46.1068.S.20220524.2020.011.html. WU P, HUANG S Y, GUO Q Q, WANG L, DING C Q, FAN M Y. Analysis of relation miRNA in three accumulation periods of capsaicin[J/OL]. Molecular Plant Breeding, 1-10[2022-07-29]. http://kns.cnki.net/kcms/detail/46.1068.S.20220524.2020.011.html. |
| [34] |
ZHANG B P, HU F, CAI X T, CHENG J W, ZHANG Y, LIN H, HU K L, WU Z M. Integrative analysis of the metabolome and transcriptome of a cultivated pepper and its wild progenitor Chiltepin (Capsicum annuum L. var. glabriusculum) revealed the loss of pungency during capsicum domestication[J]. Frontiers in Plant Science, 2022, 12: 783496. DOI:10.3389/FPLS.2021.783496 |
(责任编辑 张辉玲)
 2022, Vol. 49
2022, Vol. 49