文章信息
基金项目
- 广西中烟工业有限公司项目(2020450000340022)
作者简介
- 张纪利(1980 -),男,硕士,高级农艺师,研究方向为烟叶生产技术与品质,E-mail:zhangjili2009@163.com.
通讯作者
- 颜健(1978 -),男,博士,教授,研究方向为植物次生代谢产物生物合成及开发利用,E-mail:yanjian78@scau.edu.cn.
文章历史
- 收稿日期:2021-09-30
2. 华南农业大学资源环境学院/农业农村部华南热带农业环境重点实验室/广东省生态循环农业重点实验室/广东省现代生态农业与循环农业工程技术研究中心,广东 广州 510642
2. College of Natural Resources and Environment, South China Agricultural University/Key Laboratory of Agro-Environment in the Tropics, Ministry of Agriculture and Rural Affairs/Guangdong Key Laboratory of Eco-Circular Agriculture/Guangdong Engineering Research Centre for Modern Eco-Agriculture, Guangzhou 510642, China
【研究意义】众所周知,植物病原微生物在植株根际定殖的数量是决定能否侵染植株的关键,所以土传病害的发生是与土壤中病原菌数量变化呈一定关系的[1-2]。一般认为,土传病原菌存在于土壤中,当土壤中病原菌数量激增对植株的侵染就会越发严重,待病原菌突破植株的自身防御体系便可以引发土传病害。因此,在种植初期和发病早期对潜伏在土壤中的病原菌数量进行定量检测,有助于监测田间病害的发生,并针对性的选择化学或者生物等防控技术手段,将病原菌数量控制在发病阈值内,从而减小经济损失[3]。
【前人研究进展】目前,常用的病原菌检测方法主要包括分离培养法、免疫学技术、流式细胞术和荧光定量聚合酶链式反应(PCR)和LAMP技术等[4-6]。相对于普通PCR,荧光定量PCR(qPCR)灵敏度更高,具有实时监测、假阳性低、可量化等优点。此外,qPCR可以检测到土壤中无法分离培养的微生物,从而克服传统检测方法的局限性。qPCR是在普通PCR反应体系中加入特定的荧光结合物或荧光探针,然后通过特定的荧光识别仪器,实时检测荧光信号的变化,得到模板基因通过扩增达到荧光检测阈值所需的循环数(Ct值),再根据已建立的标准曲线确定模板中的基因表达量,推导出在目标样本内病原菌的含量,实现对病原体的定量[7]。该技术在植物病害检测中已经得到广泛的应用,如王倩等[8]建立了qPCR分子检测技术应用于土壤中早疫病菌茄链格孢(Alternaria solani)的检测;陈清清等[9]利用qPCR方法检测小麦枯萎病菌索氏平脐蠕孢(Bipolaris sorokiniana);Maud等[10]建立了引起麦瘟病的稻瘟病菌(Pyricularia Oryzae)的qPCR检测方法;Eduardo等[11]建立了一种精确检测土壤和草莓植株中的茄病镰刀菌(Fusarium solani)方法用于预测土传病害枯萎病的发生。
【本研究切入点】枯萎病和烟草黑胫病是植烟土壤中最为常见的主要土传病害,其病原菌分别是尖孢镰刀菌(Fusarium oxysporum)和烟草疫霉(Phytophthora parasitica var. nicotianae)。尖孢镰刀菌是一种土传病原真菌,能引起植物枯萎病和根腐病,该菌能侵染茄科、芭蕉科、蔷薇科、葫芦科、十字花科和豆科等100种具有重要经济价值的作物。尖孢镰刀菌在植株根部维管束中定殖,导致导管堵塞,地上部分枯萎,根表皮产生褐色坏死斑,后期根部腐烂甚至整株植株死亡,严重影响植物的生长发育、产量以及品质[12]。烟草疫霉引起的真菌性病害,该病广泛分布于我国各大烟区,是我国烟草上最具毁灭性的病害之一。该病多数发生于烟草成株期,少数发生于苗床期。该病原菌寄主广泛,除烟草外还可侵染辣椒、黄瓜、番茄等多种植物的根、茎和叶,侵染后植株出现根系坏死、叶片黄化、植株萎蔫甚至枯死等症状[13]。可见,土传病害由于具有很强的传染性,很难根治,提前检测及事先预防极为重要。【拟解决的关键问题】本研究利用PCR预扩增,qPCR后扩增定量的思路,建立同时检测两种病原菌的技术,该检测技术为烟草种植过程中枯萎病和烟草黑胫病的病害发生和防控提供技术支持。
1 材料与方法 1.1 试验材料1.1.1 供试土壤 发病土壤与健康土壤于2020年6-7月采集自广西百色植烟区植烟土壤和广东韶关烟区植烟土壤,田间烟草病害发生情况按《烟草病虫害分级及调查方法》(GB/23222-2008) 国家标准调查。每个样地按照五点取样法,其中烟草疫霉菌土样33份,镰刀菌土样9份,健康土样22份,土壤取样后装入无菌自封袋中,放入液氮中冷藏,最后放于-80 ℃冰箱保存。室内分析试验于2020年6月至2021年3月在华南农业大学完成。
1.1.2 供试病原菌及培养条件 枯萎病菌尖孢镰刀菌(F. oxysporum,菌种编号3.18025)购于中国普通微生物菌种保藏管理中心CGMCC;烟草黑胫病病原菌寄生疫霉烟草致病变种(P. parasitica var. nicotianae,BNCC354348)购于北京北纳创联微生物技术研究所。购买的菌种均按照对应所购公司提供的操作步骤说明书和培养条件进行复苏和扩繁,其中尖孢镰刀菌使用麦芽汁琼脂培养基培养,寄生疫霉烟草致病变种使用马铃薯葡萄糖琼脂(PDA)培养基培养。保藏方法:尖孢镰刀菌和寄生疫霉烟草致病变种均通过打孔器取平板菌种生长边缘的菌饼于25% 甘油中贮存于-80 ℃冰箱内。
1.1.3 培养基和主要耗材 PDA培养基购于广东环凯微生物科技有限公司。麦芽汁琼脂培养基:葡萄糖10 g/L,蛋白胨10 g/L,酵母提取物5 g/L,琼脂20 g/L。真菌基因组DNA快速抽提试剂盒和细菌基因组DNA快速抽提试剂盒均购于上海生工生物工程股份有限公司。
1.1.4 主要设备 LRH系列生化培养箱(上海一恒科学仪器有限公司);ZHWY-103D恒温培养箱(上海智城分析仪器制造有限公司);垂直流超净工作台(上海智城分析仪器制造有限公司);高压灭菌器(日本Hirayama Manufacturing公司);电子天平(上海梅特勒- 托利多仪器有限公司);离心机(德国Eppendorf);UV- 2450紫外分光光度计(日本岛津公司);酶标仪(美国Molecular Devices公司);恒温培养震荡器(天津欧诺仪器股份有限公司);DK-8D型电热恒温水浴锅(上海精宏实验设备有限公司);NanoDrop One微量紫外可见分光光度计(赛默飞世尔科技有限公司);C1000 Touch PCR仪/96孔梯度PCR仪(美国Bio-rad伯乐有限公司);Applied BiosystemsqPCR仪(北京新阳创业科技发展有限公司)。
1.2 试验方法1.2.1 病原微生物特异性引物的筛选 病原微生物基因组DNA提取:烟草疫霉和尖孢镰刀菌取菌丝100 mg于离心管中,按照上海生工细菌基因组DNA快速抽提试剂盒提取。DNA提取结果通过Nanodrop One检测DNA浓度和质量。
引物特异性筛选:针对烟草疫霉菌和尖孢镰刀菌的ITS序列,通过查阅文献[14-15]获得多对引物(烟草疫霉:N I C (F: C C A C C A C G C A G C A A A C T G C G G C, R: C A T T G A G T A G C C A G A G T C C G T C,P n i c (F: A A C C G A A G C T G C C A C C T A C, R: GAACAATGCAACTTATTGGACGTTT),P n 3(F: G A C A A A C C A G T C G C C A A T T T, R: TGAACGCATATTGCACTTCC);镰刀菌引物YD (F: GCAGCGAGACCGCCACTAGATTT, R: T G C C T G T T C G A G C G T C A T T T C A),J B (F: C A T A C C A C T T G T T G T C T C G G C, R: G A A C G C G A A T T A A C G C G A G T C),AFP308 (F: CTTGGTCATTTAGAGGAAGTAA, R: CGAATTAACGCGAGTCCCAAC),分别以3种病原菌基因组DNA和空白(水)对照为模板验证引物的特异性,建立PCR和qPCR扩增的反应体系及反应条件如下:
PCR反应体系:20 μL:2 × Taq PCR Master Mix 10 μL,上、下游引物(10 μmol/L)各0.25 μL,模板DNA浓度为100 ng,剩余用ddH2O补足至20 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,15个循环;72 ℃延伸8 min,4 ℃保存。
qPCR反应体系:15 μL:3 × Taq qPCR Master Mix 5 μL,ROX Reference Dye(50×)0.3 μL,上、下游引物(10 μmol/L)各0.6 μL,模板DNA (PCR反应产物) 1 μL,剩余用ddH2O补足至15 μL。qPCR反应程序:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火45 s,72 ℃延伸30 s,40个循环;72 ℃延伸8 min。
1.2.2 病原菌荧光定量PCR标准曲线建立 通过试剂盒提取的烟草疫霉和镰刀菌基因组DNA,按照模板浓度100、10、1、0.1、0.01、0.001、0.0001 ng加入qPCR体系中,按照引物筛选特异性方法中的反应体系和程序进行qPCR扩增,通过仪器检测到的Ct值绘制标准曲线。
1.2.3 土壤DNA提取方法优化 随机选择8份土壤样本,在Omega Bio-tek Soil DNA Kit D5625试剂盒的基础上进行操作优化。优化主要是通过改变单因素变量,然后用NanoDrop One测定DNA浓度和质量作为评价指标。具体如下:针对样本土壤干湿度程度,将土样平分为两份,其中一份置于60 ℃烘箱中烘干2 h,另一份作为对照。针对研磨程度,将土样平分为两份,其中一份置于研钵中研磨细,肉眼看不到块状颗粒为止,另一份作为对照。洗脱次数,以30 μL的洗脱溶剂洗脱第一次,然后再吸取上次洗脱液进行二次洗脱,得到的DNA,都用NanoDrop One测定DNA浓度和质量。
1.2.4 土样PCR预扩增和qPCR扩增反应体系及条件 以植烟土壤中提取的土壤微生物DNA为模板,其余的PCR预扩增和qPCR反应体系和条件与验证引物特异性方法的相同。
试验数据采用WPS2019和office进行整理和作图,采用SPSS17.0进行多重比较,使用邓肯式新复极差检验法进行差异显著性测验。
2 结果与分析 2.1 病原菌引物特异性筛选各取100 ng烟草疫霉菌、尖孢镰刀菌,然后分别与一组非靶标病原菌(水、青枯菌、镰刀菌或者水、青枯菌、烟草疫霉菌)的基因组DNA进行PCR扩增并结合PCR的目标条带(图 1)及qPCR的溶解曲线(图 2)与Ct值结果,筛选出两对引物,分别为烟草疫霉菌Pn3(正向引物:GACAAACCAGTCGCCAATTT;反向引物:TGAACGCATATTGCACTTCC)、尖孢镰刀菌JBR(正向引物:CATACCACTTGTTGTCTCGGC;反向引物:GAACGCGAATTAACGCGAGTC)。
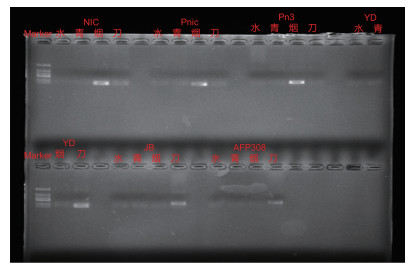
|
| Merker: DL2000,水:纯水,青:青枯菌DNA,烟:烟草疫霉菌DNA,刀:尖孢镰刀菌DNA 图 1 引物特异性烟草疫霉菌(NIC, Pnic,Pn3)和尖孢镰刀菌(YD,JB,AFP308)PCR产物电泳图谱 Fig. 1 Electrophoregram of PCR products of primers specificity Phytophthora parasitica var. nicotianae (NIC, Pnic, Pn3) and Fusarium oxysporum (YD, JB, AFP308) |
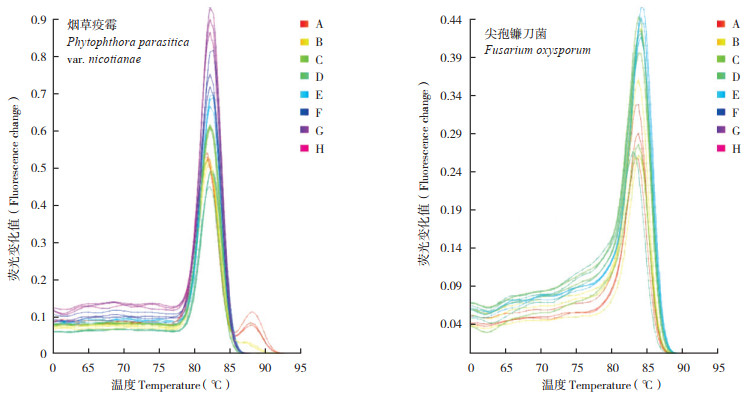
|
| 图 2 两种病原菌引物(Pn3, JBR) 特异性验证qPCR产物溶解曲线 Fig. 2 Melting curves of qPCR products of two primers (Pn3, JBR) specificity validation |
2.2 两种病原菌荧光定量PCR标准曲线制作
以10倍浓度梯度稀释的病原菌DNA为模板进行qPCR反应,反应结束后,以模板浓度的对数为x轴,以Ct值为y轴作回归曲线,获得荧光定量检测2种病原菌的标准曲线。检测在模板浓度1×102~1×10-4ng之间具有良好的线性关系(图 3),线性范围可达6个数量级。烟草疫霉相关系数R2为0.9972、斜率为-3.6038,截距为18.588,最终得出模板浓度与循环阈值之间的线性关系曲线公式为:y= -3.6038x + 18.588。镰刀菌相关系数R2为0.9447、斜率为-3.8693,截距为26.25,最终得出模板浓度与循环阈值之间的线性关系曲线公式为:y= -3.8693x+ 26.25。溶解曲线(图 2)分析表明,两种病原菌溶解曲线均是单一峰,无明显杂峰,扩增产物Tm值均一,烟草疫霉82.5(±0.5)℃,镰刀菌83.5(±0.5)℃,表明换扩增产物单一,无非特异性扩增。
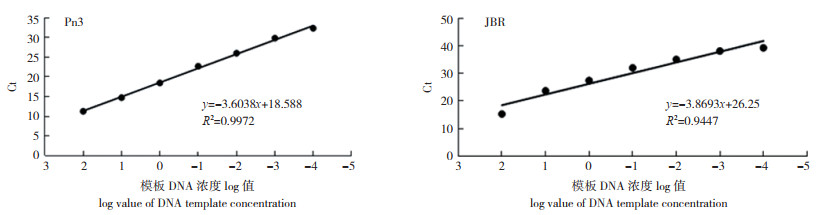
|
| 图 3 10倍梯度稀释的烟草疫霉和尖孢镰刀菌DNA的qPCR标准曲线 Fig. 3 qPCR standard curves of DNA of Phytophthora parasitica var. nicotianae and Fusarium oxysporum with 10-fold serial dilutions |
2.3 土壤DNA提取方法优化
在按照Omega Bio-tek Soil DNA Kit D5625试剂盒的基础上针对样品土壤的干燥、研磨、洗脱次数分别进行优化处理,结果见图 4。相较于潮湿的土壤,风干后的土壤提取的DNA浓度明显更高(图 4A)。相对于未研磨的样品,研磨后的样品提取的DNA浓度明显更高(图 4B),可能是因为研磨后的土壤与裂解酶的接触面积更大,更利于细胞破壁使更多DNA释放出来,得到DNA数量自然就更多。最后因为本研究建立的二次荧光定量PCR方法所需的DNA模板体积较小,所以通过30 μL的Elution Buffer进行二次洗脱可以明显增加DNA浓度(图 4C),以达到体系中所需的DNA模板量。
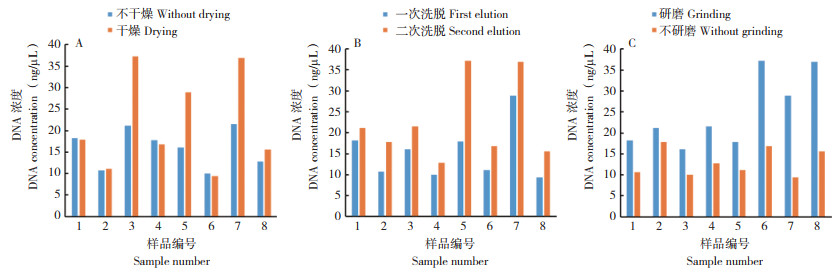
|
| 图 4 土壤DNA提取方法优化 Fig. 4 Optimization of soil DNA extraction method |
2.4 土传病害土壤采集及二次荧光定量PCR检测结果
从广西百色植烟区采集健康和发病土壤样本,从中选出具有一定代表性的土壤作为测试对象,检测结果见图 5。
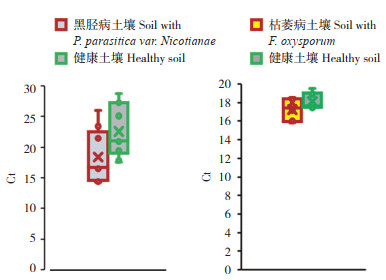
|
| 图 5 植烟土壤中2种病原菌数量检测结果 Fig. 5 Detection results of the quantities of Fusarium oxysporum and Phytophora parasitica var. nicotianae in tobacco planting soil |
采集的土壤按照已建立的检测方法进行检测,从图 5可以看出,烟草疫霉菌在黑胫病发病土壤和健康土壤中差异不显著,可能是因为烟草疫霉寄生在宿主植物中,在烟秆还田前土壤中病原菌数量较健康土壤差异不明显,尖孢镰刀菌同样在发病和健康土壤中不明显。
3 讨论土壤是作物生长的根本,也是微生物生长的沃土,土壤中存在数量巨大、种类繁多的微生物,它们中的绝大部分是有益的,在土壤发育、物质转化、结构形成、提高作物养分有效性、抑制病原菌活性等方面发挥着不可替代的作用[16]。但是,土壤中也存在着另一类引起作物病害的有害微生物,通称为病原微生物。土传病害的发生与土壤中病原微生物的数量及种类的致病力息息相关。
分子生物学检测是实验室进行植物病原菌检测的重要手段[17]。土壤中微生物DNA提取的质量关系到微生物数量,土壤基因组DNA包括土壤中的微生物和动植物遗体等的总DNA,而且传统的DNA提取方法[18-19]很难有效除去土壤中的腐殖质等抑制因子。这种抑制因子在聚合酶链式反应PCR中会影响酶的活力及反应体系,使最终的结果误差较大。传统的DNA提取方法所需土壤样品量大、操作繁琐、费时费力,不利于大批量的DNA提取[20-21],所以本实验选择通过试剂盒法进行DNA提取[22],且在试剂盒的方法上进行优化,操作方便,适合大批量提取,提取的DNA完全能够满足本实验的要求。
随着烟草集约化种植程度的提高,化肥和农药的大量施用,管理不善、单一作物连续种植、烟秆还田等因素使得土壤微生物区系紊乱,导致农作物土传病害日益严重,我们调查及文献调研得知枯萎病和烟草黑胫病是烟草中最常见、危害最严重的病害种类。土传病害的发生除了与土壤中病原菌的数量正相关外,病原菌的致病力的不同也是造成病害差异的重要因素。尖孢镰刀菌具有遗传多样性,存在不同菌株专化型和生理小种等,而且不同生理小种对不同寄主的致病力不同[23]。该实验由病原菌ITS区序列设计引物,通过qPCR扩增分析烟草疫霉菌和尖孢镰刀菌在植烟土样中的数量,可以在一定程度上反映烟草疫霉菌和尖孢镰刀菌对烟株的致病力,但不能绝对辨别两个菌株转化型和生理小种。土传病害的发生还有一些重要的外部因素,温度、pH值和光照对烟草疫霉菌和尖孢镰刀菌的生物学特性都有影响[13-24],高温和高湿有利于土传病害的发生[25]。本研究针对染病和健康土壤的病原菌数量,以植烟土样中两种常见病原菌(烟草疫霉菌和尖孢镰刀菌)为参考进行定量检测,从Ct值可以看出染病土壤Ct值小于健康土壤,可见染病土壤中的2种病原菌的数量高于健康土壤,为这两类土传病害的发生提供一定的预警效果,为后期利用土壤灭菌和生物防治土壤中病原菌提供技术参考。
目前对于这两类病原菌引起的土传病害的防治,往往是施用大量的化学药剂,从而环境污染、药物残留、破坏生态平衡等缺点已经不符合农业健康、可持续发展的要求。因此,在检测烟草疫霉菌和尖孢镰刀菌数量的基础上,针对轻度、中度的染病植烟土壤可以采用土壤微生态调节剂为生物修复策略,而对于重度污染的植烟土壤,应实施高效无污染熏蒸等土壤消毒剂。该研究为测土喷施调节剂或消毒剂防控土传病害提供一定技术依据,完全符合当今烟叶绿色发展要求。
4 结论本研究以植烟土壤中常见的病原菌烟草疫霉菌和尖孢镰刀菌为研究对象,以染病和健康土壤中的病原菌DNA为检测目标,优化植烟土壤中病原微生物DNA提取方法,建立烟草疫霉菌和尖孢镰刀菌的PCR和qPCR反应体系,筛选出特异性的两对引物,研究结果表明PCR和qPCR联用技术能够快速地分辨和检测植烟土壤中尖孢镰刀菌和烟草疫霉菌DNA的浓度,能够一定程度上反应出植烟土壤中两种病原菌的数量。该研究对枯萎病和烟草黑胫病实时监测和前期预警具有重要作用,可以为烟草土传病害的防控策略提供参考价值。
| [1] |
黄新琦. 生物有机肥防控黄瓜土传立枯病效果及防控机理[D]. 南京: 南京农业大学; 2012. HUANG X Q. The effects and mechanisms of bio-organic fertilizers on biological control of cucumber rhizoctonia damping-off disease[D]. Nanjing: Nanjing Agricultural University, 2012. |
| [2] |
张炳欣, 张平. 植物根围外来微生物定殖的检测方法[J]. 浙江大学学报(农业与生命科学版), 2000, 26(6): 624-628. ZHANG B X, ZHANG P. Detection of introduced microorganisms to rhizosphere[J]. Journal of Zhejiang Universtiy (Agricultural and Life Science), 2000, 26(6): 624-628. |
| [3] |
韦中, 王佳宁, 江高飞, 王孝芳, 徐阳春, 沈其荣. 土传病原细菌的生存与致病权衡[J]. 土壤学报, 2021, 1-11. DOI:10.11766/trxb202008310399 WEI Z, WANG J, JIANG G F, WANG X F, XU Y C, SHEN Q R. Survival-virulence trade-off of soil-borne pathogenic bacteria[J]. Acta Pedologica Sinica, 2021, 1-11. DOI:10.11766/trxb202008310399 |
| [4] |
仝铁铮, 吴舒旭, 李丹, 何苗, 杨天, 施汉昌. 基于PMA- 定量PCR选择性检测技术的病原菌消毒特性研究[J]. 环境科学, 2011, 32(4): 1120-1126. DOI:10.13227/j.hjkx.2011.04.005 TONG T Z, WU S X, LI D, HE M, YANG T, SHI H C. Evaluation of pathogen disinfection efficacy by chlorine and monochloramine disinfection based on quantitative PCR combined with propidium monoazide(PMA-qPCR)[J]. Environmental Science, 2011, 32(4): 1120-1126. DOI:10.13227/j.hjkx.2011.04.005 |
| [5] |
薛超. 植物病毒检测技术研究进展分析[J]. 农业与技术, 2020, 40(16): 48-50. DOI:10.19754/j.nyyjs.20200830017 XUE C. Progress in plant virus detection analysis[J]. Agriculture and Techology, 2020, 40(16): 48-50. DOI:10.19754/j.nyyjs.20200830017 |
| [6] |
单长林, 周圆, 李孝军. 玉米细菌性枯萎病菌荧光重组酶介导等温扩增检测方法的建立与应用[J]. 广东农业科学, 2021, 48(1): 111-118. DOI:10.16768/j.issn.1004-874X.2021.01.014 SHAN C L, ZHOU Y, LI X J. Establishment and application of fluorescent recombinase-aided amplification method for Pantoea stewartii subsp. stewarii detection[J]. Guangdong Agricultural Sciences, 2021, 48(1): 111-118. DOI:10.16768/j.issn.1004-874X.2021.01.014 |
| [7] |
LIEVENS B, BROUWER M, VANACHTER A C R C, CAMMUE B P A, THOMMA B P H J. Real-time PCR for detection and quantification of fungal and oomycete tomato pathogens in plant and soil samples[J]. Plant Science, 2006, 171(1): 155-165. DOI:10.1016/j.plantsci.2006.03.009 |
| [8] |
王倩. 土壤中茄链格孢半巢式和实时荧光定量PCR检测方法的建立[D]. 保定: 河北农业大学; 2014. WANG Q. Establishment of seminested-PCR and real-time quantitative PCR for the detection of Alternaria solani in soil[D]. Baoding: Agricultural University of Hebei, 2014. |
| [9] |
陈清清, 孙炳剑, 袁虹霞, 施艳, 李洪连. 小麦根腐病菌索氏平脐蠕孢SYBR Green I实时荧光定量PCR检测技术研究[J]. 菌物学报, 2014, 33(3): 690-696. DOI:10.13346/j.mycosystema.130075 CHEN Q Q, SUN B J, YUAN H X, SHI Y, LI H L. Quantitative detection of Bipolaris sorokiniana in winter wheat based on SYBR green I real-time PCR[J]. Mycosystema, 2014, 33(3): 690-696. DOI:10.13346/j.mycosystema.130075 |
| [10] |
THIERRY M, GLADIEUX P, FOURNIE E, THARREAU D, IOOS R. A genomic approach to develop a new qPCR test enabling detection of the Pyricularia Oryzae lineage causing wheat blast[J]. Plant Disease, 2020, 104(1): 60-70. DOI:10.1094/PDIS-04-19-0685-RE |
| [11] |
EDUARDO D-L L, MARÍA J B-U, BERTA D-S S, LUIS M, MARIA D V-D, NIEVES Capote. A taqMan real-time polymerase chain reaction assay for accurate detection and quantification of Fusarium solani in strawberry plants and soil[J]. Scientia Horticulturae, 2018, 237: 128-134. DOI:10.1016/j.scienta.2018.04.007 |
| [12] |
董超, 方香玲. 植物病原真菌尖孢镰刀菌检测与定量研究进展[J]. 草地学报, 2021, 29(7): 1599-1604. DOI:10.11733/j.issn.1007-0435.2021.07.030 DONG C, FANG X L. Rearch progress on detection and quantification of plant pathogenic fungi fusarium[J]. Acta Agrestia Sinica, 2021, 29(7): 1599-1604. DOI:10.11733/j.issn.1007-0435.2021.07.030 |
| [13] |
刘畅, 向立刚, 汪汉成, 曾陨涛, 何永福, 余知和. 温度对烟草黑胫病菌致病力及代谢表型的影响[J]. 植物保护学报, 2021, 48(3): 669-678. DOI:10.13802/j.cnki.zwbhxb.2021.2020091 LIU C, XIANG L C, WANG H C, ZENG Y T, HE Y F, YU Z H. Effects of temperature on pathogenicity and metabolic phenotype of tobacco black shank pathogen Phytophthora nicotianae[J]. Journal of Plant Protection, 2021, 48(3): 669-678. DOI:10.13802/j.cnki.zwbhxb.2021.2020091 |
| [14] |
刘芳, 宋纪真, 范艺宽, 牟文君, 奚家勤, 胡利伟. 基于锁核苷酸(LNA) 增敏的植烟土壤中烟草黑胫病菌定量PCR检测方法[J]. 烟草科技, 2015, 48(12): 14-19. DOI:10.16135/j.issn1002-0861.20151203 LIU F, SONG J Z, FAN Y K, MOU W J, XI J Q, HU L W. A quantitative PCR method for detecting Phytophthora parasitica var nicotianae in tobacco planting soil based on LNA sensitization[J]. Tobacco Science & Technology, 2015, 48(12): 14-19. DOI:10.16135/j.issn1002-0861.20151203 |
| [15] |
洒荣波, 晁强, 王晓辉, 隋君康, 刘训理. 杨树枯萎病菌实时荧光定量PCR检测方法的建立及应用[J]. 山东农业科学, 2019, 51(2): 131-135. DOI:10.14083/j.issn.1001-4942.2019.02.026 SA R B, CHAO Q, WANG X H, SUI J K, LIU X L. Establishment and application of a real - time fluorescent quantitative PCR method for detection of poplar wilt pathogen[J]. Shandong Agricultural Sciences, 2019, 51(2): 131-135. DOI:10.14083/j.issn.1001-4942.2019.02.026 |
| [16] |
HOSSAIN MI, SADEKUZZAMAN M, HA S D. Probiotics as potential alternative biocontrol agents in the agriculture and food industries: A review[J]. Food Research International, 2017, 100(Part 1): 63-73. DOI:10.1016/j.foodres.2017.07.077 |
| [17] |
陈霞, 崔一平, 彭埃天, 宋晓兵, 程保平, 凌金锋. 仁化县贡柑主要病害的调查与检测[J]. 广东农业科学, 2021, 48(2): 92-99. DOI:10.16768/j.issn.1004-874X.2021.02.012 CHEN X, CUI Y P, PENG A T, SONG X B, CHENG B P, LING J F. Investigation and detection of main diseases on gonggan in Renhua county[J]. Guangdong Agricultural Sciences, 2021, 48(2): 92-99. DOI:10.16768/j.issn.1004-874X.2021.02.012 |
| [18] |
REBECCA E H, RICHARD J S, ALAN C Mc, DIANA H, HANS L, KATHY O K, SUE W H, IAN T R, ALAN E R. Direct measurement of roots in soil for single and mixed species using a quantitative DNAbased method[J]. Plant and Soil, 2011, 348(1-2): 123-137. DOI:10.1007/s11104-011-0846-3 |
| [19] |
JAMES W W, KATHRYN M W, PATRICIA M G, IAN P A, JEFF C P, GILES E B, NEIL B. A new large scale soil DNA extraction procedure and real-time PCR assay for the detection of Sclerotium cepivorum in soil[J]. European Journal of Plant Pathology, 2012, 134(3): 467-473. DOI:10.1007/s10658-012-0025-2 |
| [20] |
熊明华, 曹焰晖, 杨芮, 王光利, 束良佐, 朱继荣. 一种改良的可直接用于PCR扩增的土壤DNA提取方法[J]. 基因组学与应用生物学, 2019, 38(4): 1643-1648. DOI:10.13417/j.gab.038.001643 XIONG M H, CAO Y H, YANG R, WANG G L, SHU L Z, ZHU J R. An improved soil DNA extraction method for dire ct PCR amplification[J]. Genomics and Applied Biology, 2019, 38(4): 1643-1648. DOI:10.13417/j.gab.038.001643 |
| [21] |
陈弟, 李可增, 吴琼, 何应对, 殷晓敏. 火龙果根际土壤微生物2种DNA提取方法的比较[J]. 热带生物学报, 2019, 10(2): 184-189. DOI:10.15886/j.cnki.rdswxb.2019.02.014 CHEN D, LI K Z, WU Q, HE Y D, YIN X M. Comparison of two extraction methods in extraction of tota l DNA from soil microbes in the rhizosphere of pitaya[J]. Journal of Tropocal Biology, 2019, 10(2): 184-189. DOI:10.15886/j.cnki.rdswxb.2019.02.014 |
| [22] |
黄怀冬, 肖姬玲, 张屹, 阮万辉, 魏林, 梁志怀. 一种改进的尖孢镰刀菌的实时荧光定量PCR检测方法[J]. 植物保护, 2017, 43(4): 129-133, 144. HUANG H D, XIAO Y L, ZHANG Y, RUAN W H, WEI L, LIANG Z H. An improved real-time flurescence quantitative PCR method for detecting fusarium[J]. Plant and Crop, 2017, 43(4): 129-133+144. |
| [23] |
王泽华, 方香玲. 尖孢镰刀菌遗传多样性研究进展[J]. 中国草地学报, 2021, 43(5): 106-114. DOI:10.16742/j.zgcdxb.20200275 WANG Z H, FANG X L. The research on genetic diverstiy of Fusarium oxysporum[J]. Chinese Journal of Grassland, 2021, 43(5): 106-114. DOI:10.16742/j.zgcdxb.20200275 |
| [24] |
沈会芳, 林壁润, 孙光明, 蒲小明, 陆新华, 张景欣, 何衍彪, 詹儒林. 海南菠萝心腐病菌烟草疫霉的生物学特性研究[J]. 广东农业科学, 2014, 41(2): 92-95. DOI:10.16768/j.issn.1004-874X.2014.02.017 SHEN H F, LIN B R, SUN G M, PU X M, LU X H, ZHANG J X, HE Y B, ZHAN R L. Research on the biological characteristics of Phytophthora nicotianae, a pathogen of heart rot of pineapple in Hainan[J]. Guangdong Agricultural Sciences, 2014, 41(2): 92-95. DOI:10.16768/j.issn.1004-874X.2014.02.017 |
| [25] |
曹坳程, 刘晓漫, 郭美霞, 王秋霞, 李园, 欧阳灿彬, 颜冬冬. 作物土传病害的危害及防治技术[J]. 植物保护, 2017, 43(2): 6-16. CAO A C, LIU X M, GUO M X, WANG Q X, LI Y, OUYANG C B, YAN D D. Incidences of soil-bor ne disease and control measure[J]. Plant Protection, 2017, 43(2): 6-16. |
 2022, Vol. 49
2022, Vol. 49




