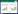文章信息
作者简介
- 张璞(1997—),男,在读硕士生,研究方向为动物疫病防控,E-mail:1400486243@qq.com.
通讯作者
- 齐冬梅(1974—),女,博士,研究员,研究方向为动物生物制品研发与应用,E-mail:qidongmei07@163.com.
文章历史
- 收稿日期:2022-01-10
2. 广东永顺生物制药股份有限公司,广东 广州 511356
2. Guangdong Winsun Bio-phamaceutical Co., Ltd, Guangzhou 511356, China
猪瘟(Classical Swine Fever,CSF) 是危害养猪业最严重的病毒性疾病之一。自CSF出现以来,对养猪业造成了重大的经济损失。在自然条件下,猪瘟病毒(Classical Swine Fever Virus,CSFV)经鼻侵入猪体内,有时通过眼结膜、生殖道黏膜或皮肤伤口进入体内,也可以经口腔和非肠道途径感染猪。CSF在临床上表现为死亡率很高的急性型或死亡率变化不定的亚急性型、慢性型、隐性型及持续感染型,症状主要为发病猪高热稽留和小血管壁变性引起各器官、组织广泛出血、梗死和坏死等病变。世界动物卫生组织(World Organization for Animal Health,OIE)将CSF列为最重要的法定报告传染病之一,在我国被列为一类传染病。所有OIE成员国有义务向OIE通报疾病、感染和任何相关的重要流行病学事件。
第一份CSF报告可追溯至1810年美国田纳西州发生的CSF疫情;19世纪上半叶,美国有10个州暴发CSF疫情。欧洲第一份CSF报告可追溯至1862年的英国,之后传播到瑞典、法国和丹麦。从20世纪60年代开始,CSF呈世界性传播。近30年来,很多国家先后采取了消灭CSF的综合防制措施,取得了显著成效。目前,无CSF的国家和地区共38个,包括整个北美洲、大洋洲,以及法国、葡萄牙、瑞典等大部分欧盟国家。CSF在亚洲和中、南美洲,加勒比地区仍然流行。除马达加斯加和南非有CSF暴发的报道外,该病在非洲的情况知之甚少[1-2]。近年该病在韩国、哥伦比亚、俄罗斯、巴西和日本CSF均有暴发。特别是日本在时隔26年无CSF病例后的2018年再次在家猪和野猪中暴发CSF疫情[3]。由此可见,CSF仍然是一种地方性和可复发性病毒病,持续威胁全球猪肉生产和人类的食品安全。20世纪50年代以前,CSF在我国的流行极为普遍,造成重大的经济损失。50年代后期起,我国采取了以疫苗免疫为主的综合防控措施,有效控制了CSF的流行。目前,我国的CSF主要以地方性和散发性流行。现代养猪业以集约化和规模化养殖为主要发展趋势,群发性疾病尤其是传染病是阻碍养猪业健康发展的主要因素。以预防为主的CSF防控策略明确了CSF疫苗、CSFV抗原和抗体诊断技术不可或缺的重要作用。本文从CSFV抗原和抗体诊断技术、CSFV疫苗开发进展和前景等方面进行综述,以期为更好地防控CSF提供参考。
1 CSF病原学CSFV属于黄病毒科瘟病毒属,是近似球型的单股正链RNA病毒,病毒粒子平均直径为44 nm,内有20面体立体对称的核衣壳,其直径为24~30 nm,外有脂蛋白囊膜包裹,囊膜表面有6~8 nm的囊膜糖蛋白纤突[4]。
1.1 CSFV基因组CSFV基因组全长约12.3 kb,包含1个开放阅读框(Open Reading Frame,ORF),编码含3 898个氨基酸的多聚蛋白,分子量大小约438 ku。两侧分别携带1个内部核糖体进入位点的5'- 端非编码区(5'-UTR,长度约360~374 bp)和富含尿苷的3'- 端非编码区(3'-UTR,长度为272~243 bp)。CSFV是瘟病毒中相对稳定的病毒,现有3个基因群(Group 1、Group 2、Group 3),其中Group 1分为1.1、1.2、1.3等基因亚群,Group 2分为2.1、2.2、2.3等基因亚群。目前国内主要流行株为2.1、2.2和1.1基因型[4]。
1.2 CSFV蛋白质CSFV多聚蛋白在病毒和宿主细胞的蛋白酶作用下,逐步裂解为C、Erns、E1、E2等4种结构蛋白和Npro、p7、NS2、NS3、NS4A、NS4B、NS5A、NS5B等8种非结构蛋白。C蛋白是由99个氨基酸组成的带大量碱性电荷的衣壳蛋白。C蛋白的主要区域相对保守,与其他瘟病毒的同源性大于91%。Erns蛋白是由227个氨基酸组成的分子量约44~48 ku的囊膜糖蛋白,通过分子间的二硫键形成同源二聚体。Erns糖蛋白具有RNase活性,能抑制双链RNA合成,导致免疫抑制,引起动物的淋巴和上皮细胞凋亡。E1蛋白是由195个氨基酸组成的分子量约31 ku的囊膜糖蛋白,不能诱导机体产生中和抗体。E2蛋白是由373个氨基酸组成的分子量约51~55 ku的囊膜糖蛋白,为I型跨膜蛋白,能诱导机体产生中和抗体,是猪瘟的主要保护性抗原蛋白。
猪瘟病毒的8种非结构蛋白,Npro蛋白是属内特有的蛋白,比较保守。Npro蛋白通过调节病毒复制过程中产生的双链RNA中间体水平干扰CSFV细胞免疫应答。p7、NS2、NS3、NS4A、NS4B、NS5A、NS5B等其他几个非结构蛋白与CSFV病毒复制、感染性病毒颗粒形成、致细胞病变生物型、病毒毒力及持续感染有关[4]。
2 CSFV抗原/抗体检测技术中等毒力和低毒力的CSFV不会引起典型的临床症状,但可以在猪群中缓慢传播。与非洲猪瘟(African Swine Fever,ASF)、猪呼吸和繁殖综合征(Porcine Respiratory and Reproductive Syndrome,PRRS)、副猪嗜血杆菌病(Haemophilus parasuis,Hps)等一种或多种病原混合感染时,难以通过临床症状或剖检病变来确诊CSFV病例,需要通过实验室检测确诊[5]。快速准确的实验室和临床检测技术对于CSF防控具有极其重要的作用。
2.1 CSFV抗原检测技术对于CSFV的分离、病毒抗原和核酸的检测,可以使用血清和动物体液,以及死亡动物的扁桃体、脾脏、淋巴结、胸腺、肠、肾、肺等器官样本[5]。CSFV可以在多种猪源细胞上生长,如猪肾细胞系PK15细胞、SK6细胞,以及猪睾丸细胞系ST细胞。病原分离是CSF确诊的经典方法之一。绝大多数CSFV分离株是非细胞致病性的,在细胞培养中无明显的细胞病变。因此,在CSFV感染细胞后,病毒抗原必须通过免疫过氧化物酶染色试验(Immunoperoxidase Test,IPT)或免疫荧光抗体试验(Fluorescent Antibody Test,FAT)来验证。敏感和快捷的反转录-PCR(RT-PCR)和荧光定量PCR(qRT-PCR)是目前实验室应用更广泛的CSFV核酸检测方法,很多实验室将qRT-PCR作为快速CSFV诊断的首选方法。检测CSFV核酸的新技术在不断发展。高晓龙等[6]建立了CSFV微滴式数字PCR(droplet digital PCR,ddPCR)方法。张雨杭[7]利用CRISP/Casl3a核酸检测技术建立CSF强弱毒鉴别检测技术。如需确诊CSF还需要进行免疫荧光或病原分离鉴定。
2.2 CSFV抗体检测技术国内常用的CSFV抗体检测方法有病毒中和试验(Virus Neutralization Test,VNT)、胶体金免疫层析法(Gold Immunochromatography Assay,GICA)、酶联免疫吸附试验(Enzyme-Linked Immunsorbent Assay,ELISA)等。VNT方法灵敏度高、特异性好、准确性高,是CSFV抗体检测的金标准,可以用于非免疫猪的CSF临床病例确诊、流行病学调查和免疫猪疫苗免疫效果评价等。CSFV同属的牛病毒性腹泻粘膜病病毒(Bovine Viral Diarrhoea Virus,BVDV)、边界病毒(Border Disease Virus,BDV)等瘟病毒感染可能会干扰CSFV抗体诊断,VNT方法可以区分CSFV特异性抗体和BVDV、BDV以及其他反刍动物瘟病毒感染产生的抗体。因此,VNT可以复核在ELISA抗体检测中的阳性样品或可疑样品,并确定这些抗体是否为CSFV特异性抗体。但VNT检测费时、费力,而且检测成本高,目前还未能实现高通量和自动化检测,不适用于处理大量的临床样品。
GICA技术具有使用方便,对操作人员要求不高,无需特殊仪器设备和试剂,并可以直接判断等优点,因此特别适合应用于基层试验室和CSFV临床批量筛查。近年来,GICA技术也在不断向多靶标、高敏感性方向发展,如量子点、磁颗粒等新材料被用于试剂条的制备[8]。李华玮等[9]首次在国内建立了可以区分强弱毒CSFV抗体的双抗原夹心法免疫层析试纸条。尹清清[10]以胶体金标记和量子点耦联重组CSFV E2蛋白,研制了检测CSFV抗体免疫层析试纸条。万颖等[11]制备CSFV E2蛋白抗体检测的胶体金免疫层析试纸条,检测用时更短(5~10 min)。
ELISA是一种快速、简便、应用广泛的血清学诊断技术,突出优点是可以在短时间内检测大量样本。其在CSF血清学调查中起到非常重要的作用。国内外已开发出多种CSFV抗体检测试剂盒产品并商品化。国外常用商业化试剂盒包括美国爱德士公司(IDEXX Laboratories)、荷兰百测公司(Biocheck)、德国勃林格殷格翰制药公司(Boehringer Ingelheim)、赛默飞世尔科技公司(Thermo Fisher Scientific)等生产的试剂盒。国内注册的CSFV抗体检测试剂盒有猪瘟病毒间接ELISA抗体检测试剂盒、猪瘟病毒阻断ELISA抗体检测试剂盒、猪瘟病毒化学发光ELISA抗体检测试剂盒等3种,进口注册1个猪瘟病毒ELISA抗体检测试剂盒(表 1)。上述CSFV抗体检测试剂盒的产品类型主要是间接ELISA、竞争性ELISA或阻断ELISA等,针对CSFV全病毒、E2或Erns/E0蛋白产生的抗体。近年来,更多的新技术和新思路应用到CSFV抗体ELISA试剂盒开发中,如Wang等[12]利用有中和能力的单克隆抗体建立竞争ELISA检测C株CSF疫苗免疫产生的抗体。李元曦等[13]建立了可以快速鉴别CSFV野毒和疫苗毒的可视化基因芯片检测技术。王丽等[14]建立了CSFV Erns/E2融合蛋白间接ELISA抗体检测技术。徐璐等[15]等建立的化学发光竞争ELISA抗体检测方法与荧光抗体病毒中和试验(Fluorescent Antibody Virus Neutralization Test,FAVN)方法检测的中和抗体效价更接近。麻园等[16]建立了CSFV化学发光ELISA抗体检测技术,敏感性、特异性、重复性良好。不断提高ELISA试剂盒的敏感性、特异性和稳定性,更好地应对当前多病原混合感染的复杂猪病现状,设计和优化适用于CSF标记疫苗的ELISA抗体检测试验盒,可靠地区分受感染和接种疫苗动物(Discrimination of Infected from Vaccinated Animals,DIVA)仍然是猪瘟血清学诊断技术的主要挑战。
3 CSF疫苗
从历史上看,一些国家将大规模减毒活疫苗免疫接种作为一项强制性CSF防控措施,并辅以其他生物安全措施,成功应对CSF疫情。目前,西方发达国家已不再使用疫苗接种而直接采取扑杀的方法来防制CSF。但疫苗接种仍然是世界上大多数国家特别是发展中国家控制CSF的主要手段。随着生物技术特别是分子生物学技术的不断发展,更多的CSF新型疫苗被开发和批准使用。
3.1 减毒活疫苗减毒活疫苗多是通过兔体或细胞连续传代获得的适应性突变减毒株。减毒活疫苗最常用的毒株是我国的猪霍乱兔化弱毒HCLV株〔亦称中国疫苗株(C株)〕、俄罗斯的LK-VNIVViM株、日本的GPE-株、法国的Thiverval株、墨西哥的PAV株等[2]。这些疫苗的共同优点是使用方便、成本低、易于生产、安全性良好,特别是对仔猪和怀孕母猪安全。上述减毒疫苗已在全世界广泛应用。
3.1.1 C株 C株兔化弱毒疫苗是目前国际上应用最广泛、国内唯一应用的CSF疫苗,也是控制CSF最有效的疫苗之一。该疫苗毒株于1954— 1958年由中国兽药监察所等单位成功培育,具有无血毒症、不排毒、不通过怀孕母猪胎盘屏障的优点,而且毒力返强的可能性很小,在猪体内传30代后仍安全[4]。C株疫苗不但有突出的安全性和有效性[17],而且疫苗的生产工艺技术简单,成本低廉,易于临床使用和推广。不同国家已经开发了多种源自猪瘟C株的疫苗,如匈牙利的SUVAC疫苗、美国的VADIMUN疫苗、德国的Duvaxin和Riems疫苗、墨西哥的Norden和Porcivac疫苗、巴西的PS Poreo疫苗、斯洛伐克的Tipest疫苗、捷克共和国的TVM-1疫苗、俄罗斯的LK疫苗等[2]。
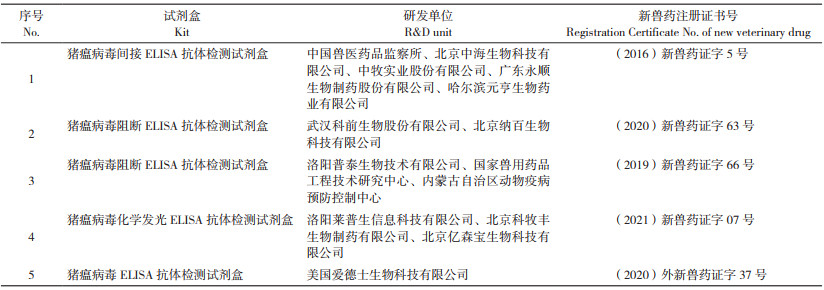
我国C株兔化弱毒疫苗的研制和应用主要有以下几个阶段:1958年研制出牛体反应苗;1964年研制出乳兔苗;后来由中国兽医药品监察所等单位研制出猪瘟兔化弱毒同源原代细胞苗(1973—1978年)、乳猪肾细胞苗(1978—1980年)、绵羊肾细胞苗(1980年)、奶山羊肾细胞苗(1982年)、犊牛睾丸原代细胞苗(1985年)等,其中犊牛睾丸原代细胞苗目前仍有生产和应用;2004年中国兽医药品监察所和广东永顺生物制药股份有限公司联合开展了猪睾丸传代细胞系(ST细胞)生产猪瘟疫苗的研究,并在2008年成功研制出ST细胞系生产的猪瘟活疫苗(传代细胞源),现在由国内19个兽用生物制品生产厂家生产并广泛应用[4];2020年华威特(江苏)生物制药有限公司与硕腾生物制药有限公司等企业共同研制了猪瘟活疫苗(C株,悬浮培养),同年军事科学院军事医学研究院军事兽医研究所与江苏勃林格殷格翰生物制品有限公司等公司联合开发了猪瘟活疫苗(C株,PK/WRL传代细胞源)。2010年以来在国内注册的猪瘟活疫苗相关信息见表 2。
3.1.2 LOM株 LOM株是1956年由日本分离的低毒力Miyagi株通过牛肾细胞连续传代致弱获得。1968—1969年,韩国兽医研究所(Institute of Veterinary Research,IVR)首次将LOM株疫苗作为候选疫苗进行田间试验,并于1974年在韩国广泛推广使用。LOM株疫苗在韩国使用了几十年,充分证明了该疫苗的安全性和有效性,但仍存在毒力返强的风险。韩国济州岛原本并无猪瘟病例,实行不接种疫苗政策10年后,在2014年接种了LOM株疫苗,导致济州岛发生了CSF地方性暴发,给养猪场造成巨大损失[18]。
3.1.3 GPE-株 GPE-株(Guinea-pig Exaltation-negative strain,GPE-)疫苗是1969年由日本东京国立动物卫生研究所(National Institute of Animal Health,NIAH)研制的。该疫苗株来源于野生型ALD株,经猪睾丸细胞、牛睾丸细胞和原代豚鼠肾细胞等多次传代致弱获得。GPE-株疫苗对怀孕母猪和仔猪安全,在亚洲和大洋洲广泛应用。研究表明,在猪体连续传代11次后,GPE-毒株毒力返强,这与E2蛋白上的T830A、NS4B蛋白上的V2475A和A2563V 3个氨基酸被取代有关[19]。
3.1.4 Thiverval株 Thiverval株是由CSF强毒Alfort株在猪肾原代细胞上传代后转到胎牛肌肉细胞,29~30 ℃低温下经170多代次的细胞传代培养选育出的低温变异株,1971年在法国获得专利。该疫苗遗传稳定性和安全性好,可应用于免疫抑制的动物[2]。数十年的应用结果表明,Thiverval株疫苗对怀孕母猪和仔猪安全有效,可防止猪瘟垂直传播。
3.1.5 PAV-250株 PAV-250株是由CSFV A株经PK15细胞连续传代250次获得。自1979年以来,该疫苗在墨西哥的CSF防控和根除计划中起到非常重要的作用。PAV-250株疫苗安全性、免疫原性、遗传稳定性良好,可以抵御猪瘟不同强毒株的攻击[20]。
3.2 标记疫苗CSF减毒活疫苗安全有效,但在临床实践中难以与野毒感染区分,因此新型标记疫苗的研发越来越受关注。目前CSF标记疫苗主要包括亚单位疫苗、嵌合疫苗等。
3.2.1 E2蛋白亚单位疫苗 E2蛋白是CSFV的主要结构糖蛋白,具有高度免疫原性,可以诱导机体产生中和抗体[4],因此E2蛋白常作为CSF亚单位疫苗的理想候选蛋白。欧洲共同体药物评审委员会(European Agency for the Evaluation of Medicinal Products,EMEA)批准了两种杆状病毒表达的E2蛋白亚单位疫苗,即德国拜耳公司的Bayovac® CSF Marker和荷兰英特威公司的Porcilis® pesti。大量的免疫攻毒试验证实,上述疫苗具有较高的安全性[21],但存在免疫产生期长和保护作用不完全等问题。这些疫苗无法完成垂直保护,病毒依然有可能通过怀孕母猪胎盘传播导致猪只持续感染。为了提供完全保护,免疫猪需要接种两次疫苗[22]。由于这些标记蛋白疫苗不能在猪体内繁殖,因此不适合口服接种,特别是对野猪群的免疫[23]。
我国第一个猪瘟E2蛋白亚单位疫苗为天康生物股份有限公司研制的猪瘟病毒E2蛋白重组杆状病毒灭活疫苗(Rb-03株),2017年获得新兽药证书,并于2018年获得生产许可。该疫苗是基于杆状病毒表达的猪瘟病毒C株1.1基因亚型E2糖蛋白的亚单位疫苗,经两次免疫接种后,猪群可产生较强的免疫力,能抵御CSF强毒石门株的攻击。接种该疫苗的猪E2蛋白中和抗体滴度升高,可以抵御CSFV两种基因型(1型和2型)的强毒攻击[24],二免后14 d时达到免疫高峰期[25]。2020年,由华中农业大学与武汉科前生物股份有限公司等公司共同研发的猪瘟病毒E2蛋白重组杆状病毒灭活疫苗(WH-09株)获得新兽药证书和生产许可。国内注册的猪瘟灭活疫苗见表 3。
亚单位疫苗无毒力返强风险,而且兼具DIVA特性。但与减毒活疫苗相比较还存在一些弱点,如细胞免疫反应弱、免疫产生期长、免疫持续期短、一次免疫不能提供完全保护等,因此亚单位疫苗需要多次免疫以增加或保持抗体滴度[26]。
3.2.2 嵌合疫苗 鉴于瘟病毒属内BVDV、BDV、CSFV之间的亲缘关系,设计改进猪瘟标记疫苗,开发出系列嵌合瘟病毒疫苗。代表性产品是欧盟批准的第一个针对CSF的标记活疫苗——美国硕腾公司研制的Suvaxyn® CSF Marker疫苗。该产品的抗原CP_E2alf以BVDV CP7株作为骨架,表达猪瘟病毒Alfort/187株E1和E2糖蛋白[27]。此疫苗对家猪和野猪肌肉注射免疫,安全性和有效性良好,并可用于口服,能抵御强毒和中等毒力毒株的攻击;肌肉注射免疫1次,1周后可产生较强的保护力,免疫持续期至少6个月[28]。
2016年,由5家韩国兽用疫苗公司联合研制的猪瘟嵌合活疫苗Flc-LOM-BErns株通过了韩国的生产许可。Flc-LOM-BErns是CSF LOM株去除全长Erns基因和衣壳蛋白3' 端的52个碱基后,以BVDV相应部分替代获得的Flc-LOM-BErns感染性克隆。该疫苗可对怀孕母猪产生完全保护[29]。但由于对家猪和野猪口服该疫苗的临床应用刚开始,因此对其安全性等还不清楚。
明确CSFV的毒力影响因素对设计CSFV标记活疫苗非常重要。在CSFV基因组中引入基因突变,减少1个或多个毒力影响因素,通过感染性克隆可能会创造出更安全、有效的具有DIVA特性的疫苗。Holinka等[30]通过将两个独立的基因修饰引入CSFV Brescia株的基因组中,构建了带有两个抗原标记的猪瘟减毒活疫苗毒株FlagT4v株。在E1基因中引入Flag®抗原表位作为阳性抗原标记;去掉E2基因上单克隆抗体WH303株识别表位(829TAVSPTTLR837),因该突变可以干扰对病毒表位的识别,因此作为阴性抗原标记。为了改善FlagT4v株的基因稳定性,避免毒力返强,继而开发了FlagT4Gv株。FlagT4Gv株免疫猪可以抵抗亲本毒的攻击;并且免疫后猪体内的IFN-α水平增加。其缺点是尚无与该候选疫苗配套的DIVA检测技术。
为了开发具有DIVA特性的C株标记疫苗,Han等[31]利用反向遗传操作技术制备了缺失E2糖蛋白HQ06单抗识别位点上117F、119G、122P氨基酸的突变体rHCLV-E2F117A、rHCLV-E2G119A、rHCLV-E2P122A。经静脉免疫兔,所有突变体均能引起兔体产生定型热,并能在兔脾脏中复制。其中rHCLV-E2P122A在兔和猪体内均能诱导抗猪瘟中和抗体,但不能诱导抗猪瘟hq06识别表位的抗体,可以与C株诱导的抗体相区分。
3.3 复制子疫苗正链RNA病毒的自我复制RNA(复制子)正逐步成为哺乳动物细胞中基因表达和新型疫苗开发的有力工具。复制子即至少1个结构基因部分或完全缺失而导致功能缺陷,无法产生感染性子代病毒但具有复制能力的病毒基因组。复制子可以被包装到病毒囊膜中,利用细胞生成病毒复制子颗粒(Virus Replicon Particles,VRP)。VRP疫苗主要优点包括:VRP与亲代病毒感染细胞的效率相同;安全性良好,不会造成水平或垂直传播;不产生感染性子代病毒,无毒力返强隐患;可诱导细胞毒性T细胞应答;可通过检测VRP中缺失的蛋白或抗原表位的抗体,区分VRP疫苗接种的动物与感染的动物[32]。
Semliki Forest病毒复制载体标记疫苗rAdV-SFV-E2株是基于复制缺陷的腺病毒5型(Ad5)载体,表达CSFV E2基因的Semliki Forest病毒复制子。rAdV-SFV-E2株可以刺激猪产生细胞和体液免疫反应。二免后,可以抵御CSFV强毒株的攻击,效果与C株相当。该候选疫苗效力不会受猪体内存在的相关抗体(如CSFV和BVDV抗体)的影响,也不会受到其他猪用活疫苗联合使用的影响[33]。仔猪的母源抗体能对CSF强毒攻击提供一定的保护[34]。
3.4 病毒载体疫苗3.4.1 猪痘病毒载体疫苗 猪痘病毒(Swinepox Virus,SPV)只感染猪,且通常感染轻微,偶尔伴有局部皮肤损伤,可自然愈合。SPV拥有双链DNA基因组,可以携带和表达大量外源基因,可以刺激机体产生细胞和体液免疫。Lin等[35]以SPV基因组为骨架,插入E2基因构建了重组rSPV-E2候选疫苗株。rSPV-E2肌肉注射免疫可诱导机体产生CSFV特异性中和抗体,为CSF免疫提供临床保护。
3.4.2 伪狂犬载体疫苗 伪狂犬病病毒(Pseudorabies Virus,PRV)的gE、gI、TK和PK等蛋白已被证实与PRV的毒力相关。相应的基因可以用外源基因替代而不影响病毒的感染和复制。因此,PRV常被用作表达其他病原体主要免疫原的载体以研制多价疫苗。仇华吉研究团队利用猪PRV TJ株研制了两种重组PRV病毒,即rPRVTJ-delgE和rPRVTJ-delgE/gI/TK,其对易感动物安全,可以抵抗猪PRV强毒攻击;创制了表达CSFV E2基因的重组PRV载体病毒rPRVTJ-delgE/gI-E2,研究表明,rPRVTJ-delgE/gI-E2对猪安全,可诱导产生猪PRV抗体和CSFV中和抗体,可抵抗猪PRV TJ株和CSFV石门株的强毒攻击,可作为抗CSFV和猪PRV感染的二价DIVA候选疫苗[36]。
Tong等[37]开发了一种双价PRV/CSFV DIVA候选疫苗JS-2012- gE/gI-E2,将E2基因插入缺失型PRV变异株JS-2012- gE/gI中,获得重组候选疫苗。研究表明,JS-2012- gE/gI-E2单次接种足以对CSFV和猪PRV强毒攻击提供完全保护,且对仔猪安全。
目前,CSFV和猪PRV感染仍然是我国养猪业的最大威胁。CSFV和猪PRV双价疫苗可简化疫苗接种程序,降低接种成本。因此,含有E2基因的重组猪PRV二价DIVA疫苗有望在CSFV和猪PRV的控制和根除中发挥重要作用。CSFV C株和PRV Bartha-K61株在我国广泛使用,几乎所有仔猪都携带CSFV和猪PRV的母源抗体。JS-2012-gE/gI-E2评价表明,PRV母源抗体可严重干扰体液免疫反应,是PRV病毒载体疫苗实际应用的主要障碍[37]。
3.4.3 猪繁殖与呼吸综合征病毒载体疫苗 Gao等[39-40]以高致病性猪繁殖与呼吸综合征病毒(Highly Pathogenic Porcine Reproductive and Respiratory Syndrome Virus,HP-PRRSV)弱毒疫苗株HuN4-F112株的基因组为骨架,插入CSFV E2编码基因,通过反向遗传技术构建了rPRRSV-E2株。初步研究表明,单次接种rPRRSV-E2可诱导产生PRRSV和CSFV特异性抗体,充分保护猪免受PRRSV和CSFV的强毒攻击。PRRSV或CSFV的母源抗体均不干扰rPRRSV-E2的免疫[38]。rPRRSV-E2对HP-PRRSV和CSFV的免疫持续期至少为20周[39]。PRRSV母源抗体不干扰rPRRSV-E2的免疫,这可能由于PRRSV母源抗体对rPRRSV-E2的中和效价较低[40]。此外,rPRRSV-E2免疫期可达到18~26周。rPRRSV-E2是一种很有前途的双价DIVA候选疫苗,只需要1次接种即可同时对抗PRRSV和CSFV感染[38-39]。
3.4.4 腺病毒载体疫苗 重组腺病毒载体在兽用疫苗的研发中应用广泛。Sun等[40]开发了腺病毒AdV5型载体CSF疫苗株rAdV-SFV-E2。研究表明,该疫苗对小鼠、家兔和猪安全;双剂量免疫(抗原含量为6.25×105 TCID50)或单剂量免疫(抗原含量为107 TCID50)对强毒攻击具有完全保护作用;rAdV-SFV-E2效力与C株一样不会受到母源抗体影响;接种rAdV-SFV-E2不会引发抗载体免疫干扰;与PRV活疫苗共同免疫对疫苗效力无影响;新生仔猪可以通过免疫母猪获得母源抗体。
3.4.5 新城疫病毒载体疫苗 新城疫病毒(Newcastle Disease Virus,NDV)可用作载体进行CSF载体疫苗的构建。重组新城疫病毒(rNDV)可使用鸡胚进行大量生产,是一种有效和经济的生产方法。NDV可以通过滴鼻和点眼等途径接种,从而可改变以NDV为载体的疫苗接种途径。Kumar等[41]利用反向遗传技术构建了表达CSFV E2和Erns蛋白的rNDV毒株,经鼻内接种该疫苗的猪只可产生高滴度的CSFV中和抗体,表明NDV是一种有效的载体,可用于开发针对CSF和其他猪病的疫苗。
4 展望CSF持续威胁全球养猪业,虽然已有很多适用于试验室和临床诊断的成熟方法,也研发了大量CSFV抗原/抗体检测商品化试剂盒,但诊断方法的敏感性、特异性、可重复性、现场实时检测技术(Point-of-Care Diagnostics,POCD)等仍有较大的进步空间。特别是当前CSF临床症状复杂,多种疫病混合感染,继续致力于开发新型、快捷、可靠的诊断方法和试剂产品以促进CSF疫病的监测和控制非常必要。
几十年来,很多国家一直采用安全高效的减毒活疫苗接种来控制CSF,一些国家成功根除了CSF。减毒活疫苗在免疫产生期和免疫持续期方面具有突出优势,但缺乏DIVA特性,不能区分免疫和野毒感染。E2亚单位疫苗作为第一代商品化的DIVA疫苗,安全性良好但有效性还需提升,而且不可用于口服。尽管在CSFV病原、基因组和蛋白、抗原/抗体诊断技术、减毒活疫苗、病毒载体疫苗和亚单位疫苗等方面已有很多研究基础,但CSFV仍然有许多问题有待解决,如CSF免疫发病机制、病毒与宿主间互作机制、CSFV毒力决定因素等,攻克CSF和CSFV相关的难题才能研制出能满足抗原高效呈递、多价、安全、成本低、易于产业化且兼具DIVA特性和市场需求的CSFV疫苗。
| [1] |
GANGES L, CROOKE H R, BOHORQUEZ J A, POSTEL A, SAKODA Y, BECHER P, RUGGLI N. Classical swine fever virus: the past, present and future[J]. Virus Research, 2020, 289: 198151. DOI:10.1016/j.virusres.2020.198151 |
| [2] |
CORONADO L, PERERA C L, RIOS L, FRÍAS M T, PÉREZ L J. A critical review about different vaccines against classical swine fever virus and their repercussions in endemic regions[J]. Vaccines, 2021, 9: 154-186. DOI:10.3390/vaccines9020154 |
| [3] |
POSTEL A, NISHI T, KAMEYAMA K, MEYER D, SUCKSTORFF O, FUKAI K, BECHER P. Reemergence of classical swine fever, Japan, 2018[J]. Emerging Infectious Diseases, 2019, 25: 1228-1231. DOI:10.3201/eid2506.181578 |
| [4] |
夏业才, 陈光华, 丁家波. 兽医生物制品学[M]. 北京: 中国农业出版社, 2018. XIA Y C, CHEN G H, DING J B. Science of veterinary biologicals[M]. Beijing: China Agriculture Press, 2018. |
| [5] |
POSTEL A, AUSTERMANN-BUSCH S, PETROV A, MOENNIG V, BECHER P. Epidemiology, diagnosis and control of classical swine fever: recent developments and future challenges[J]. Transboundary and Emerging Diseases, 2018, 65: 248-261. DOI:10.1111/tbed.12676 |
| [6] |
高晓龙, 王英超, 李月, 沈光年, 刘晓冬, 周德刚, 梅力, 冯小宇. 猪瘟病毒微滴式数字PCR方法的建立[J]. 中国动物传染病学报, 2021, 29(2): 28-33. GAO X L, WANG Y C, LI Y, SHEN G N, LIU X D, ZHOU D G, MEI L, FENG X Y. Development of droplet digital PCR method for detection of classical swine fever virus[J]. Chinese Journal of Animal Infectious Diseases, 2021, 29(2): 28-33. |
| [7] |
张雨杭. 基于CRISPR/Cas猪瘟与非洲猪瘟病毒核酸检测技术研究[D]. 郑州: 河南农业大学, 2021. ZHANG Y H. Development of CRISP/Cas-based nucleic acid detection technique for Classical Swine Fever Virus and African Swine Fever Virus[D]. Zhengzhou: Henan Agricultural University, 2021. |
| [8] |
唐迪, 刘迪, 刘林, 王众, 郑宁, 郑业鲁. 非洲猪瘟检测技术研究进展[J]. 广东农业科学, 2019, 46(11): 104-111. DOI:10.16768/j.issn.1004-874X.2019.11.015 TANG D, LIU D, LIU L, WANG Z, ZHENG N, ZHENG Y L. Research progress of African Swine Fever detection[J]. Guangdong Agricultural Sciences, 2019, 46(11): 104-111. DOI:10.16768/j.issn.1004-874X.2019.11.015 |
| [9] |
李华玮, 郑鸣. 胶体金免疫层析法检测猪瘟(强弱毒区分)抗体研究[J]. 广东农业科, 2012(7): 130-133. DOI:10.16768/j.issn.1004-874X.2012.07.044 LI H W, ZHENG M. Study on gold immunochromatography assay for detection of hog cholera antibody[J]. Guangdong Agricultural Sciences, 2012(7): 130-133. DOI:10.16768/j.issn.1004-874X.2012.07.044 |
| [10] |
尹清清. 基于猪瘟E2蛋白胶体金和量子点免疫层析试验研究[D]. 成都: 四川农业大学, 2019. YIN Q Q. Detection of Classical Swine Fever Virus antibody based on E2 protein colloidal gold and quantum dot immunochromatographic strip[D]. Chengdu: Sichuan Agricultural University, 2019. |
| [11] |
万颖, 罗俊聪, 石正旺, 麻园, 王丽娟, 杨波, 宋锐, 周改静, 曹丽艳, 田宏, 郑海学. 猪瘟病毒抗体胶体金免疫层析试纸条的研制及初步应用[J]. 中国兽医科学, 2022, 52(1): 1-5. DOI:10.16656/j.issn.1673-4696.2021.0197 WAN Y, LUO J C, SHI Z W, MA Y, WANG L J, YANG B, SONG R, ZHOU G J, CAO L Y, TIAN H, ZHENG H X. Development and application of colloidal gold immunochromatography strip for detecting Classical Swine Fever Virus antibodies[J]. Chinese Veterinary Science, 2022, 52(1): 1-5. DOI:10.16656/j.issn.1673-4696.2021.0197 |
| [12] |
WANG L H, MI S J, MADERA R, GANGES L, BORCA M V, REN J Q, CUNNINGHAM C, CINO-OZUNA A, LI H W, TU C C, GONG W J, SHI J S. A neutralizing monoclonal antibody-based competitive ELISA for Classical Swine Fever C-strain post-vaccination monitoring[J]. BMC Veterinary Research, 2020, 16: 14. DOI:10.1186/s12917-020-2237-6 |
| [13] |
李元曦, 夏应菊, 徐璐, 邹兴启, 李翠, 王兆, 徐嫄, 万建青, 赵启祖, 王琴, 胡永浩, 张乾义. 可视化猪瘟病毒基因芯片鉴别检测方法的建立[J]. 中国预防兽医学报, 2021, 43(3): 274-279. DOI:10.3969/j.issn.1008-0589.202003046 LI Y X, XIA Y J, XU L, ZOU X Q, LI C, WANG Z, XU Y, WAN J Q, ZHAO Q Z, WANG Q, HU Y H, ZHANG Q Y. Development of a visual method for differential detection of Classical Swine Fever Virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2021, 43(3): 274-279. DOI:10.3969/j.issn.1008-0589.202003046 |
| [14] |
王丽, 冯丽丽, 张雨杭, 孙亚宁, 杨继飞, 赵东, 王瑞宁, 李学伍, 郭军庆, 张改平. 猪瘟病毒Erns/E2融合蛋白间接ELISA抗体检测方法的建立及评价[J]. 河南农业科学, 2021, 50(4): 154-161. DOI:10.15933/j.cnki.1004-3268.2021.04.020 WANG L, FENG L L, ZHANG Y H, SUN Y N, YANG J F, ZHAO D, WANG R N, LI X W, GUO J Q, ZHANG G P. Establishment and evaluation of Erns/E2 fusion protein-based indirect ELISA for detection of Classical Swine Fever Virus antibody[J]. Journal of Henan Agricultural Sciences, 2021, 50(4): 154-161. DOI:10.15933/j.cnki.1004-3268.2021.04.020 |
| [15] |
徐璐, 张乾义, 夏应菊, 任雪健, 李翠, 邹兴启, 徐嫄, 王兆, 赵启祖, 王琴. 猪瘟病毒化学发光竞争ELISA抗体检测试剂盒的应用研究[J]. 中国兽医杂志, 2020, 56(11): 31-34. XU L, ZHANG Q Y, XIA Y J, REN X J, LI C, ZOU X Q, XU Y, WANG Z, ZHAO Q Z, WANG Q. Application study of CLIA competition ELISA kit to detect antibody against Classical Swine Fever Virus[J]. Chinese Journal of Veterinary Medicine, 2020, 56(11): 31-34. |
| [16] |
麻园, 石正旺, 罗俊聪, 杨波, 王丽娟, 万颖, 宋锐, 曹丽艳, 周改静, 田宏, 郑海学, 陈轶霞. 猪瘟病毒化学发光抗体检测方法的建立与应用[J]. 畜牧兽医学报, 2021, 52(6): 1744-1752. DOI:10.11843/j.issn.0366-6964.2021.06.029 MA Y, SHI Z G, LUO J C, YANG B, WANG L J, WAN Y, SONG R, CAO L Y, ZHOU G J, TIAN H, ZHENG H X, CHEN Y X. Establishment and application of chemiluminescence detection method for antibody against Classical Swine Fever Virus[J]. Acta Veterinaria Zootechnica Sinica, 2021, 52(6): 1744-1752. DOI:10.11843/j.issn.0366-6964.2021.06.029 |
| [17] |
刘新平, 黄继冶, 高琳, 张水印, 徐玲, 顾兵. 猪瘟脾淋苗阻断多种基因亚群带毒母猪的垂直传播[J]. 广东农业科学, 2011(5): 165-167. DOI:10.16768/j.issn.1004-874X.2011.05.070 LIU X P, HUANG J Y, GAO L, ZHANG S Y, XU L, GU B. Classical Swine Fever spleen vaccine blocked the vertical transmission of multiple subtypes of Classical Swine Fever Virus in sows[J]. Guangdong Agricultural Sciences, 2011(5): 165-167. DOI:10.16768/j.issn.1004-874X.2011.05.070 |
| [18] |
JANG G, KIM J A, YOO H, YANG K, YANG H S, PARK C, JEONG K, PARK C K, LYOO Y S, LEE C. Genomic characterization of Classical Swine Fever Virus LOM variants with 30-UTR INDELs from pigs on Jeju Island, South Korea[J]. Archives of Virology, 2020, 165(7): 1691-1696. DOI:10.1007/s00705-020-04651-1 |
| [19] |
KADEN V, LANGE E, KÜSTER H, MÜLLER T, LANGE B. An update on safety studies on the attenuated "RIEMSER Schweinepestoralvakzine" for vaccination of wild boar against Classical Swine Fever[J]. Veterinary Microbiology, 2010, 143: 133-138. DOI:10.1016/j.vetmic.2009.11.020 |
| [20] |
GONZALEZ C, PIJOAN C, CIPRIAN A, CORREA P, MENDOZA S. The effect of vaccination with the PAV-250 strain Classical Swine Fever(CSF) Virus on the airborne transmission of CSF Virus[J]. Journal of Veterinary Medical Science, 2001, 63: 991-996. DOI:10.1292/jvms.63.991 |
| [21] |
DORTMANS J C, LOEFFEN W L, WEERDMEESTER K, VAN DER POEl W H, DE BRUIN M G. Efficacy of intradermally administrated E2 subunit vaccines in reducing horizontal transmission of Classical Swine Fever Virus[J]. Vaccine, 2008, 26: 1235-1242. DOI:10.1016/j.vaccine.2007.12.039 |
| [22] |
MADERA R F, WANG L, GONG W, BURAKOVA Y, BUIST S, NIETFELD J, CINO-OZUNA A G, TU C, SHI J, HENNINGSON J. Toward the development of a one-dose Classical Swine Fever subunit vaccine: antigen titration, immunity onset, and duration of immunity[J]. Journal of Veterinary Science, 2018, 19: 393-405. DOI:10.4142/jvs.2018.19.3.393 |
| [23] |
MOENNIG V. The control of Classical Swine Fever in wild boar[J]. Frontiers in Microbiology, 2015, 6: 1211. DOI:10.3389/fmicb.2015.01211 |
| [24] |
王遵宝, 李俊辉, 豆智华, 郑侃, 李森江, 寇春, 贺笋. 猪瘟E2亚单位疫苗攻毒保护效力研究[J]. 中国动物传染病学报, 2018, 26(4): 18-23. WANG Z B, LI J H, DOU Z H, ZHENG K, LI S J, KOU C, HE S. Protective efficacy of the Classical Swine Fever E2 subunit vaccine in experimentally infected pigs[J]. Chinese Journal of Animal Infectious Diseases, 2018, 26(4): 18-23. |
| [25] |
GONG W, LI J, WANG Z, SUN J, MI S, XU J, CAO J, HOU Y, WANG D, HUO X. Commercial E2 subunit vaccine provides full protection to pigs against lethal challenge with 4 strains of Classical Swine Fever Virus genotype 2[J]. Veterinary Microbiology, 2019, 237: 108403. DOI:10.1016/j.vetmic.2019.108403 |
| [26] |
XU H, WANG Y, HAN G, FANG W, HE F. Identification of E2 with improved secretion and immunogenicity against CSFV in piglets[J]. BioMed Central Microbiology, 2020, 20: 1-13. DOI:10.1186/s12866-020-1713-2 |
| [27] |
BLOME S, WERNIKE K, REIMANN I, KÖNIG P, MOß C, BEER M. A decade of research into Classical Swine Fever marker vaccine CP7_ E2alf (Suvaxyn® CSF Marker): A review of vaccine properties[J]. Veterinary Research, 2017, 48: 10. DOI:10.1186/s13567-017-0457-y |
| [28] |
GABRIEL C, BLOME S, URNIZA A, JUANOLA S, KOENEN F, BEER M. Towards licensing of CP7 E2alf as marker vaccine against Classical Swine Fever-Duration of immunity[J]. Vaccine, 2012, 30: 2928-2936. DOI:10.1016/j.vaccine.2012.02.065 |
| [29] |
CHOE S, SHIN J, KIM K S, SONG S, CHA R M, JUNG B I, HYUN B H, PARK B K, AN D J. Protection of piglets with maternally derived antibodies from sows inoculated with an attenuated live marker Classical Swine Fever vaccine (Flc-LOM-BErns)[J]. Pathogens, 2020, 9: 608. DOI:10.3390/pathogens9080608 |
| [30] |
HOLINKA L G, O'DONNELL V, RISATTI G R, AZZINARO P, ARZT J, STENFELDT C, VELAZQUEZ-SALINAS L, CARLSON J, GLADUE D P, BORCA M V. Early protection events in swine immunized with an experimental live attenuated Classical Swine Fever marker vaccine, FlagT4G[J]. Public Library of Science One, 2017, 12: e0177433. DOI:10.1371/journal.pone.0177433 |
| [31] |
HAN Y, XIE L, YUAN M, MA Y, SUN H, SUN Y, LI Y, QIU H J. Development of a marker vaccine candidate against Classical Swine Fever based on the live attenuated vaccine C-strain[J]. Veterinary Microbiology, 2020, 247: 108741. DOI:10.1016/j.vetmic.2020.108741 |
| [32] |
WEI Q, LIU Y C, ZHANG G P. Research progress and challenges in vaccine sevelopment against Classical Swine Fever Virus[J]. Viruses, 2021, 13: 445. DOI:10.3390/v13030445 |
| [33] |
XIA S L, XIANG G T, LEI J L, DU M L, WANG Y M, ZHOU M, LIU Y, JI S W, WANG Y L, LUO Y Z, SUN Y, QIU H J. Efficacy of the marker vaccine rAdV-SFV-E2 against Classical Swine Fever in the presence of maternally derived antibodies to rAdV-SFV-E2 or C-strain[J]. Veterinary Microbiology, 2016, 196: 50-54. DOI:10.1016/j.vetmic.2016.10.001 |
| [34] |
XIA S L, DU M, LEI J L, LIU Y, WANG Y, JI S, XIANG G T, LI L F, CONG X, LUO Y. Piglets with maternally derived antibodies from sows immunized with rAdV-SFV-E2 were completely protected against lethal CSFV challenge[J]. Veterinary Microbiology, 2016, 190: 38-42. DOI:10.1016/j.vetmic.2016.05.007 |
| [35] |
LIN H, MA Z, CHEN L, FAN H. Recombinant swinepox virus expressing glycoprotein E2 of Classical Swine Fever Virus confers complete protection in pigs upon viral challenge[J]. Frontiers in Veterinary Science, 2017, 4: 81. DOI:10.3389/fvets.2017.00081 |
| [36] |
WANG Y, YUAN J, CONG X, QIN H Y, WANG C H, LI Y, LI S, LUO Y, SUN Y, QIU H J. Generation and efficacy evaluation of a recombinant Pseudorabies Virus variant expressing the E2 protein of Classical Swine Fever Virus in pigs[J]. Clinical Vaccine Immunol, 2015, 22(10): 1121-1129. DOI:10.1128/CVI.00383-15 |
| [37] |
TONG W, ZHENG H, LI G X, GAO F, SHAN T L, ZHOU Y J, YU H, JIANG Y F, YU L X, LI L W, KONG N, TONG G Z, LI J C. Recombinant Pseudorabies Virus expressing E2 of Classical Swine Fever Virus (CSFV) protects against both virulent Pseudorabies Virus and CSFV[J]. Antiviral Research, 2020, 173: 104652. DOI:10.1016/j.antiviral.2019.104652 |
| [38] |
GAO F, JIANG Y, LI G, LI L, ZHANG Y, YU L, ZHENG H, TONG W, ZHOU Y, LIU C. Evaluation of immune efficacy of recombinant PRRSV vectored vaccine rPRRSV-E2 in piglets with maternal derived antibodies[J]. Veterinary Microbiology, 2020, 248: 108833. DOI:10.1016/j.vetmic.2020.108833 |
| [39] |
GAO F, JIANG Y F, LI G X, ZHANG Y J, ZHAO K, ZHU H J, LI L W, YU L X, ZHENG H, ZHOU Y J, TONG W, TONG G Z. Immune duration of a recombinant PRRSV vaccine expressing E2 of CSFV[J]. Vaccine, 2020, 38: 7956-7962. DOI:10.1016/j.vaccine.2020.10.057 |
| [40] |
SUN Y, TIAN D Y, LI S, MENG Q L, ZHAO B B, LI Y, LI D, LING L J, LIAO Y J, QIU H J. Comprehensive evaluation of the adenovirus/alphavirus-replicon chimeric vector-based vaccine rAdV-SFV-E2 against Classical Swine Fever[J]. Vaccine, 2013, 31: 538-544. DOI:10.1016/j.vaccine.2012.11.013 |
| [41] |
KUMAR R, KUMAR V, KEKUNGU P, BARMAN N N, KUMAR S. Evaluation of surface glycoproteins of Classical Swine Fever Virus as immunogens and reagents for serological diagnosis of infections in pigs: A recombinant Newcastle disease virus approach[J]. Archives of Virology, 2019, 164: 3007-3017. DOI:10.1007/s00705-019-04425-4 |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49