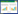文章信息
基金项目
- 建设广东省科学院分支机构项目(2017-2019)
作者简介
- 罗艺(1988—), 女, 壮族, 硕士, 农艺师, 研究方向为作物育种及栽培技术推广, E-mail: 354800412@qq.com.
通讯作者
- 杨俊贤(1962—), 男, 研究员, 研究方向为作物遗传育种与有害生物防治, E-mail: siriyjx@163.com.
文章历史
- 收稿日期:2022-05-17
2. 崇左市江州区农业技术推广站,广西 崇左 532200
2. Agricultural Technology Extension Station of Jiangzhou District, Chongzuo 532200, Chin
【研究意义】千里香(Murraya paniculata)是一种芸香科九里香属小乔木或灌木的药用植物,主要生于疏林或干燥的坡地中,大多分布于广东、海南、广西、湖南、福建等华南以及西南地区[1],属于热带亚热带植物[2]。千里香具有行气止痛、活血散瘀、降血糖、抗生育以及抗肿瘤等多种功效,有利于治疗感冒、风湿骨痛、胃痛和跌打肿痛等症状[3-6],是中成药的主要原料之一,近年来市场需求量逐年增加。目前千里香繁殖的主要方法为自然播种繁殖,但在野生状态下难以开花,致使种子数量少[7],且种子的萌发成功率较低,种子萌动前的贮藏天数较多,完成萌发过程需要较长时间,部分种子存在休眠状态[8],经过自然播种达到的丛芽繁殖系数与生根率较小,难以满足大面积生产种植需求。构建千里香离体再生繁殖体系,可满足千里香种植的种苗需求,为我国三九集团等药企提供可靠的原材料及提供技术保障。
【前人研究进展】近十几年来,关于千里香化学成分和药理方面的研究较多。从千里香中分离鉴定出黄酮类化合物、生物碱、香豆素等物质,发现千里香含有的磷脂酶A抑制剂能够治疗蛇毒引起的肌肉损伤[9-10];叶片的乙醇提取物具有镇痛作用[11];《中国植物信息》记载千里香的根还可用作口腔黏膜表皮的麻醉剂;提取的挥发油也具有抗炎镇痛的作用[12]。这些化合物的发现为千里香的药用价值和应用提供了新的思路[13-16]。在千里香种苗繁育方面,蒋健林等以四数九里香种子为材料研究种子萌发,使用最佳的IBA激素处理萌芽率只能达50%[17]。千里香在诱根方面存在生根数较少和生根率较低的问题,蒋烨用千里香无菌苗进行生根培养,结果表明千里香的出根数和生根率都低[7]。由此可知,千里香的高效繁殖有待进一步提高。
【本研究切入点】以千里香成熟种子所诱导的丛生芽作为增殖材料,利用植物离体培养技术繁殖速度快、系数高的优点,筛选出种子萌发、增殖、壮苗、生根等阶段适宜的培养基配方,以解决其种苗大量增殖与生根的问题,建立千里香离体再生体系。【拟解决的关键问题】本研究利用植物生长调节剂及不同培养基种类,对其再生体系建立的各环节进行探索优化,以期获得高效的离体再生体系,为千里香组培种苗的工厂化生产奠定基础。
1 材料与方法 1.1 试验材料供试材料千里香种子由三九集团提供,试验于2021年9月至2022年5月在广东省科学院南繁种业研究所湛江研究中心完成。成熟千里香果实的果皮为黄绿色或者黄褐色,按照果实种子含胚数可分为单胚果实和双胚果实,本试验使用的是单胚果实的种子。挑选形状大小一致、籽粒饱满的种子进行预处理。
1.2 试验方法1.2.1 材料预处理 外植体处理:在超净工作台中,种子用75%酒精处理30 s,无菌水冲洗2次,再用0.1%升汞处理10 min,无菌水冲洗5次,用无菌滤纸吸干水分,种子剥去种皮,接种于萌发培养基上。置于组织培养室进行培养,培养温度为23(±2)℃,平均光照强度为1 200 lx左右,光照时间10 h/d。
试验培养基中蔗糖均为30 g/L,卡拉胶7.0 g/L, pH值在5.8~6.2。马铃薯汁配制方法:市售马铃薯,削皮,切块,称取200 g煮软,使用榨汁机榨成汁液,加水定容至1 L配制成200 g/L浓度。香蕉汁配制方法:市售香蕉,剥皮,称取200 g香蕉加水榨汁,加水定容至1 L配制成200 g/L浓度。
1.2.2 种子萌发培养基的筛选 以MS为基本培养基,设置5种培养基(表 1)进行种子萌发的诱导试验。统计萌发率,获得适宜种子萌发的培养基。
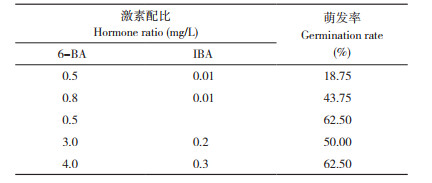
1.2.3 增殖与壮苗基本培养基筛选 根据千里香种胚在芽诱导培养基的发芽情况,分别设置3/2MS、MS、3/4MS、1/2MS 4种培养基(表 2)进行比较试验。每种培养基接种4瓶,每瓶接种6丛。每3 d观察一次生长情况,40 d后观测生长势、色泽、茎粗、落叶、褐化和死亡等指标。
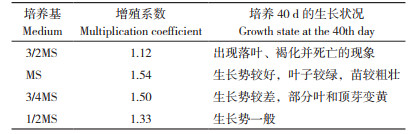
1.2.4 增殖培养基的筛选 以1.2.3筛选的最佳培养基为基本培养基,添加不同浓度6-BA、NAA和IBA(表 3)。将诱导的无菌芽苗顶芽或带腋芽的茎段作为增殖材料,接种到增殖培养基上,每个培养基配方接种4瓶,每瓶接种6株种苗,每株种苗带有2~3个丛生芽。40 d后统计增殖系数(增殖系数=新增殖苗数/接种苗数)与生长势、色泽、茎粗、落叶、褐化和死亡等指标。
 |
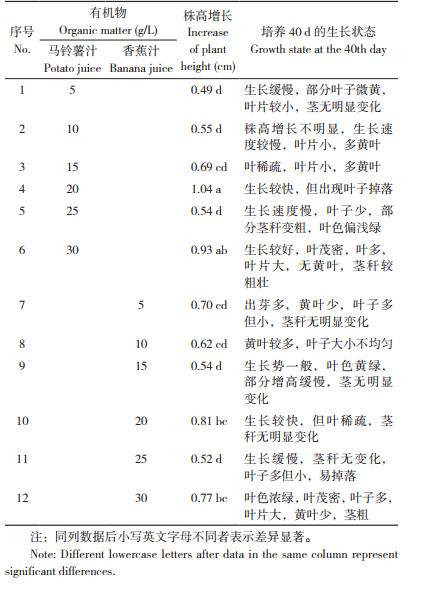
1.2.5 壮苗培养基的筛选 以1.2.3筛选的最佳培养基为基本培养基,通过添加马铃薯汁和香蕉汁进行生根前的壮苗培养,将增殖培养获得的丛芽分6个处理组合(表 4),每个处理接种3瓶,每瓶接种6丛。40 d后观察生长状况和测量植株增长高度,筛选出最适宜的壮苗培养基。
 |
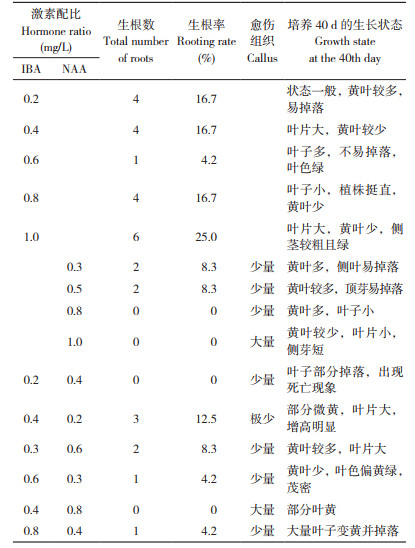
1.2.6 生根培养基的筛选 以1/2MS为基本培养基,添加活性炭0.1 g/L,分别添加不同浓度IBA、NAA、IBA+NAA,设置15个处理(表 5)。挑选生长一致的芽苗,切除基部及近基部1~2片叶子,切取长度为2 cm左右、生长健壮的不定芽进行生根培养。每个处理接种4瓶,每瓶接种6株。40 d后统计生根率[生根率(%)=(生根的组培苗数/接种苗数)×100]。
 |
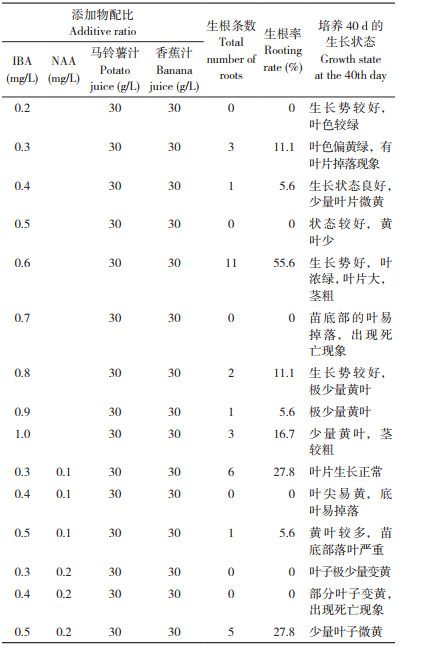
根据以上生根结果对生根培养基进行优化,分别设置不同激素浓度IBA、IBA与NAA组合,并添加马铃薯汁与香蕉汁进行提纯复壮(表 6)。每个处理接种3瓶,每瓶接种6株丛苗。40 d后计算生根率。
 |
1.2.7 炼苗移栽 将生根良好健壮的植株移到温室中进行闭瓶炼苗2~3 d。用镊子夹出,清洗根部的培养基,在植株水分蒸腾量处于较低水平时移植,将其移栽至泥炭土∶黄心土∶珍珠岩∶钙镁磷肥(3∶2∶1∶0.2)的混合基质中,洒上浓度0.4 mg/L的生根水使其定根[17],观察统计成活率[成活率(%)=(成活的移栽苗数量/总移栽数量)×100]和苗的生长状况。
试验数据采用Excel进行方差分析,F测验显著后使用新复极差法(SSR)进行多重比较。
2 结果与分析 2.1 种子萌发培养基的筛选由表 1可知,MS+0.5 mg/L 6-BA和MS+4.0 mg/L 6-BA+0.3 mg/L IBA培养基种子萌发速度最快,萌发率最高。为节约成本,本试验筛选出最适合种子萌发的培养基配方为MS+6-BA0.5 mg/L,萌发率可达62.5%。
2.2 增殖与壮苗基本培养基的筛选由表 2可知,MS培养基的增殖系数最高,生长势较好,表现最佳,1/2MS培养基生长势一般,3/4MS培养基表现较差,而3/2MS培养基出现落叶、褐化和死亡的现象,与其他3种培养基相比,MS培养基组培苗生长状态最好。
2.3 增殖培养基的筛选由表 3可知,在培养基MS添加6-BA+NAA不同配比中,培养基MS+6-BA 0.5 mg/L+NAA 0.15 mg/L的丛生芽增殖系数达到2.37,生长势较好,茎秆较粗,芽苗健壮,叶片多且大。培养基MS+6-BA0.6 mg/L+NAA 0.2 mg/L增殖系数出现下降的情况,继续加大6-BA和NAA浓度,增殖系数逐渐提高但其组培苗的生长势一般,黄叶多且叶片稀疏。培养基6-BA 1.0 mg/L+NAA 0.40 mg/L芽苗的增殖系数急降,生长势弱且出现死亡现象。在培养基MS添加6-BA+IBA不同配比中,其组培苗增殖系数相对比添加同浓度6-BA+NAA培养基的增殖系数低,所有处理增殖系数 < 2,其中培养基MS+6-BA 0.8 mg/L+IBA 0.30 mg/L的增殖系数最低,仅为1.01,生长势也一般,可知添加IBA对千里香的增殖效果比NAA差。对处理间增殖系数进行方差分析表明,各处理间的增殖系数差异显著。因此,筛选出千里香增殖适宜培养基为MS+6-BA 0.5mg/L+NAA 0.15 mg/L。
2.4 壮苗培养基的筛选如表 4所示,培养基中添加有机物马铃薯汁的浓度在20 g/L时,组培苗的生长速度最快,植株增长高度大于1 cm,但叶色偏黄,叶片少,茎秆较细,出现叶子掉落现象。添加马铃薯汁30 g/L培养基中组培苗长势较好,植株高度0.93 cm,叶子较浓密,叶片大,茎秆粗壮挺直,且与马铃薯汁浓度为20 g/L相比两组处理间差异不显著。培养基中添加有机物香蕉汁的浓度为20g/L时,组培苗的生长速度最快,但植株生长表现和增长高度不如添加马铃薯汁20 g/L和30 g/L处理,且植株增长高度对比达到显著差异。因此筛选出千里香最佳壮苗培养基配方为MS+马铃薯汁30 g/L。
2.5 生根培养基的筛选由表 5可知,添加IBA的培养基中,生根条数最多的培养基配方为1/2 MS+IBA 1.0 mg/L+活性炭0.1 g/L,生根率为25.0%,但无愈伤组织产生;添加NAA的培养基中,各处理均有愈伤组织产生,但生根效果不理想,其中添加NAA 0.8、1.0 mg/L的培养基中无根系产生,且出现黄叶现象,表明添加NAA对生根的效果不理想;添加IBA+NAA不同配比的培养基中,IBA 0.4 mg/L+NAA 0.2 mg/L配比生根率最高,但仅为12.5%,愈伤组织也极少。
由表 6可知,与只添加不同配比激素的培养基组培苗相比较,增添有机物的培养基组培苗多数长势较好。在不同浓度IBA的培养基中,1/2MS+IBA 0.6 mg/L+马铃薯汁30 g/L+香蕉汁30 g/L+活性炭0.1 g/L的培养基组培苗根系较粗且长,根生长速度较快,叶色较浓绿,生根率最高,达55.6%;在IBA+NAA不同配比培养基中,1/2MS+马铃薯汁30 g/L+香蕉汁30 g/L+活性碳0.1g/L+IBA 0.3 mg/L+NAA 0.1 mg/L或IBA 0.5 mg/L+NAA 0.2 mg/L培养基的组培苗生根率较高,达到27.8%。因此,筛选出适合千里香生根培养的培养基配方为1/2 MS+IBA 0.6 mg/L+马铃薯汁30 g/L+香蕉汁30 g/L+活性炭0.1 g/L。
2.6 移栽炼苗种苗经炼苗移栽至泥炭土:黄心土:珍珠岩:钙镁磷肥(3∶2∶1∶0.2)的混合基质中,前期萎蔫严重,注意喷水保湿,3~4 d后开始恢复生长,千里香生根瓶苗移栽成活率达85%,叶片变大,茎秆变粗,除1株叶片变黄之外,其余叶色较绿,后移植于A100杯继续生长,茎叶较为浓绿,茎秆健壮且木质化(图 1)。

|
| A: 千里香种子;B: 种子萌发成植株;C: 增殖培养;D: 壮苗培养;E: 生根培养 A: Seeds of the Murraya paniculata; B: Seeds germinate into plants; C: Proliferation culture; D: Strong seedling cultivation; E: Rooting culture 图 1 千里香组培过程示意图 Fig. 1 Diagram of tissue culture process of Murraya paniculata |
3 讨论
在种子萌发培养的研究中,其中生长素的种类及含量对外植体的生长具有重要作用[8],不同培养基对同品种不同部位外植体的诱导也有较大差异[18]。本研究通过诱导促使千里香种子萌发率达62.5%。蒋健林等以四数九里香种子为材料研究不同质量浓度的6-BA、NAA、GA3、IBA对外植体生长的影响,利用IBA处理萌芽率最高,达50%[17]。本研究同样是以千里香种子诱导萌芽,较前人研究萌芽率有所提高。这可能与千里香基因类型不同,诱导所用的培养基和培养条件不同,从而影响了萌芽率。
增殖培养为后期大规模的工厂化育苗关键阶段,基本培养基和香蕉汁对组培苗的增殖影响明显[19],在不同浓度范围内,不同的植物生长调节剂组合对芽的增殖分化有不同影响[20-22]。本研究得出最佳增殖与壮苗的基本培养基为MS培养基,生长状态最好;最佳的增殖培养基其增殖系数为2.37。蒋烨以千里香大田苗诱导出的无菌丛生芽的最佳培养基为MS+6-BA 0.5 mg/L+KT 0.5 mg/L+NAA 0.5 mg/L,配方6-BA∶KT∶NAA=1∶1∶1时增殖效果最好,增殖系数达到了9.63[7]。但在本研究中千里香的芽增殖系数仅为2.37,使用NAA处理时,大多数组培苗产生愈伤组织与褐化现象,导致芽无法继续扩繁,而使用IBA处理时相对增殖系数较高。与上述报道相比较,本研究的增殖系数相对较低,上述报道采用的是千里香茎段作为外植体培养,而本研究使用的是成熟种子所诱导的丛生芽作为增殖材料,这可能与试验材料的基因型不同及用作外植体的部位不同有关。
本试验壮苗培养的最佳培养基为MS+马铃薯汁30 g/L,此时芽苗平均高度增长可达1 cm,芽苗长势较好;千里香生根的适宜培养基为1/2 MS+IBA 0.6 mg/L+马铃薯汁30 g/L+香蕉汁30 g/L+活性炭0.1 g/L,生根率达55.6%,以培养的千里香无菌生根苗为材料,通过炼苗移栽后存活率达85%以上。蒋烨使用无菌苗进行生根培养得到的最高生根率为52%[7]。根据本试验观察,千里香的生根培养条件较高,与增殖阶段丛芽生长状态关系较大,本试验结果在千里香种子胚芽诱导、增殖及壮苗阶段获得了较好的结果,可为生产实践提供技术参考,且55.6%的生根率较前人研究有所提高,能满足实际生产的部分需求但仍有提升空间,有待进一步研究。
4 结论本研究结果表明,不同激素及浓度对千里香种子萌发和丛芽增殖过程影响显著,添加马铃薯汁和香蕉汁利于壮苗和生根培养。适宜千里香种子萌发的培养基配方为MS+6-BA 0.5 mg/L,萌发率可达62.5%;最佳千里香增殖与壮苗的基本培养基为MS培养基,生长状态最好;最佳的千里香增殖培养基配方为MS+6-BA 0.5 mg/L+IBA 0.15 mg/L,增殖系数为2.37;最佳的千里香壮苗培养基配方为MS+马铃薯汁30 g/L,此时芽苗平均高度增长可达1 cm,芽苗长势较好;适宜千里香组培苗生根的培养基配方为1/2 MS+IBA 0.6 mg/L+马铃薯汁30 g/L+香蕉汁30 g/L+活性炭0.1 g/L,生根率达55.6%;以培养的千里香无菌生根苗为材料,通过炼苗移栽至泥炭土∶黄心土∶珍珠岩∶钙镁磷肥(3∶2∶1∶0.2)的混合基质中成活率达85%以上。
| [1] |
余世孝. 千里香生长区的气候要素分析与分区-应用模糊相似优先比方法[J]. 生态科学, 1990(2): 117-121. YU S X. Climate factor analysis and zoning–application of fuzzy similarity priority ratio method in the growth area of Thymus mongolicus[J]. Ecological Science, 1990(2): 117-121. |
| [2] |
易绮斐. 九里香[J]. 热带亚热带植物学报, 2020, 28(2): 111-112. YI Q F. Jiulixiang[J]. Journal of Tropical and Subtropical Botany, 2020, 28(2): 111-112. |
| [3] |
ZHU C H, LEI Z L, LUO L Y. Studies on antioxidative activities of methanol extract from Murraya paniculata[J]. Food Science and Human Wellness, 2015, 4(3): 7. |
| [4] |
SHARMA P, BATRA S, KUMAR A, SHARMA A. In vivo antianxiety and antidepressant activity of Murraya paniculata leaf extracts[J]. Journal of Integrative Medicine, 2017, 15(4): 320-325. DOI:10.1016/S2095-4964(17)60352-2 |
| [5] |
全国中草药汇编编写组. 全国中草药汇编(上册)[M]. 第2版. 北京: 人民卫生出版社, 1996: 10. National Compilation Group of Chinese Herbal Medicines. National Compilation of Chinese Herbal Medicines(Volume I)[M]. 2nd Edition. Beijing: People's Health Press, 1996: 10. |
| [6] |
庞雅琼. 九里香黄酮类化合物抗肿瘤转移作用及机制的研究[D]. 福州: 福州大学, 2015. PANG Y Q. Study on the anti-tumor metastasis effect and mechanism of flavonoids from Jiulixiang[D]. Fuzhou: Fuzhou University, 2015. |
| [7] |
蒋烨. 千里香的组织培养研究[D]. 广州: 广州中医药大学, 2017. DOI: 10.27044/d.cnki.ggzzu.2017.000044. JIANG Y. Study on tissue culture of Murraya paniculata L. chinensis [D]. Guangzhou: Guangzhou University of Traditional Chinese Medicine, 2017. DOI: 10.27044/d.cnki.ggzzu.2017.000044. |
| [8] |
徐红红, 潘永玖, 梁丽敏, 李姗姗. 千里香植物组织培养的优化[J]. 科学与财富, 2017(3): 274-275. DOI:10.3969/j.issn.1671-2226.2017.03.259 XU H H, PAN Y J, LIANG L M, LI S S. Optimization of tissue culture of Murraya paniculata[J]. Science and Wealth, 2017(3): 274-275. DOI:10.3969/j.issn.1671-2226.2017.03.259 |
| [9] |
杨熙, 李瑞, 周美, 邓颖娇, 张欢, 王萍, 崔欢欢, 巩江, 倪士峰. 千里香药学研究概况[J]. 安徽农业科学, 2013, 41(33): 12978-12979. DOI:10.13989/j.cnki.0517-6611.2013.33.067 YANG X, LI R, ZHOU M, DENG Y J, ZHANG H, WANG P, CUI H H, GONG J, NI S F. Overview of pharmaceutical research on thyme[J]. Anhui Agricultural Sciences, 2013, 41(33): 12978-12979. DOI:10.13989/j.cnki.0517-6611.2013.33.067 |
| [10] |
TATLANA L E, PEREANEZ J A, ACOSTA K Z, GUTIERREZ P A, LONDONO M, NUNEZ V, ROJANO B A. Inhibitory activity of Murraya paniculata Against Myotoxic Phospholipases A2[J]. Vitae-Revista De Quimice Farmaceutica, 2010, 17(3): 291-298. |
| [11] |
邹联新, 杨崇仁, 郑汉臣. 九里香属植物镇痛作用研究//全国中医药科研与教学改革研讨会论文集[C]. 2000: 306-308. ZOU L X, YANG C R, ZHENG H C. Analgesic effect of plants belonging to the genus Jiulixiang//Papers of National Symposium on Scientific Research and Teaching Reform of Traditional Chinese Medicine[C]. 2000: 306-308. |
| [12] |
毛长智, 黄蓓, 庾志斌. 四数九里香挥发油抗炎及镇痛作用研究[J]. 云南中医中药杂志, 2011, 32(8): 74-75. DOI:10.3969/j.issn.1007-2349.2011.08.045 MAO C Z, HUANG B, YU Z B. Study on anti-inflammatory and analgesic effects of volatile oil from Sijiulixiang[J]. Yunnan Journal of Traditional Chinese Medicine, 2011, 32(8): 74-75. DOI:10.3969/j.issn.1007-2349.2011.08.045 |
| [13] |
向方桃, 陈封政, 陈建明, 田冲, 杨孝蓉, 李书华. 千里香中黄酮类成分的分离鉴定及抗氧化活性研究[J]. 天然产物研究与开发, 2020, 32(10): 1683-1687. DOI:10.3969/j.issn.1007-2349.2011.08.045 XIANG F T, CHEN F Z, CHEN J M, TIAN C, YANG X R, LI S H. Separation, identification and antioxidant activity of flavonoids from Murraya paniculata[J]. Research and development of natural products, 2020, 32(10): 1683-1687. DOI:10.3969/j.issn.1007-2349.2011.08.045 |
| [14] |
邹联新, 郑汉臣, 杨崇仁. 九里香属植物研究进展[J]. 药学实践杂志, 1997(4): 214-219. ZOU L X, ZHENG H C, YANG C R. Advances in the studies on plants of the genus Sinense[J]. Journal of Pharmaceutical Practice, 1997(4): 214-219. |
| [15] |
吕海宁, 周颖, 曾克武, 卫宁宁, 王克威, 屠鹏飞, 姜勇. 九里香属植物化学成分和生物活性研究//中国化学会第十届全国天然有机化学学术会议论文集——第一分会场: 天然产物分离和结构鉴定[C]. 2014: 7. LYU H N, ZHOU Y, ZENG K W, WEI N N, WANG K W, TU P F, JIANG Y. Study on chemical constituents and biological activities of Thymus//The Proceedings of the Tenth National Natural Organic Chemistry Conference of the Chinese Chemical Society-First Session: Separation and Structure Identification of Natural Products[C]. 2014: 7. |
| [16] |
冯小飞, 徐宏懿, 杨明明, 邵林, 张敏敏, 艾明雄, 黄荣, 杨靖华, 汪云松. 小叶九里香香豆素类化合物研究//中国化学会第八届有机化学学术会议暨首届重庆有机化学国际研讨会论文摘要集[C]. 2013: 5. FENG X F, XU H Y, YANG M M, SHAO L, ZHANG M M, AI M X, HUANG R, YANG J H, WANG Y S. Research on coumarins from Jiulixiaoye//Summarized papers of the 8th Organic Chemistry Conference of the Chinese Chemical Society and the first Chongqing International Symposium on Organic Chemistry[C]. 2013: 5. |
| [17] |
蒋建林, 王森, 李畅, 郭红艳. 四数九里香种子自然萌发和离体萌发条件筛选[J]. 经济林研究, 2017, 35(3): 93-101. DOI:10.14067/j.cnki.1003-8981.2017.03.013 JIANG J L, WANG S, LI C, GUO H Y. Screening of natural germination and in vitro germination conditions of Sijiulixiang seeds[J]. Study on Economic Forest, 2017, 35(3): 93-101. DOI:10.14067/j.cnki.1003-8981.2017.03.013 |
| [18] |
赵秀娟, 张华通, 林秀灵, 麦任娣, 张煜林. 石蒜属植物无性繁殖技术的应用研究[J]. 广东农业科学, 2021, 48(4): 47-54. DOI:10.16768/j.issn.1004-874X.2021.04.007 ZHAO X J, ZHANG H T, LIN X L, MAI R D, ZHANG Y L. Applied research on asexual reproduction technology of Lycoris plants[J]. Guangdong Agricultural Sciences, 2021, 48(4): 47-54. DOI:10.16768/j.issn.1004-874X.2021.04.007 |
| [19] |
韩吉思, 方小荣, 申礼凤, 李建波, 姚茜, 杨梅. 红心杉组培苗增殖培养基的优化[J]. 广东农业科学, 2018, 45(4): 63-69. DOI:10.16768/j.issn.1004-874X.2018.04.010 HAN J S, FANG X R, SHEN L F, LI J B, YAO Q, YANG M. Optimization of proliferation medium for tissue culture seedlings of Taxus chinensis[J]. Guangdong Agricultural Science, 2018, 45(4): 63-69. DOI:10.16768/j.issn.1004-874X.2018.04.010 |
| [20] |
吴雅露, 王颖, 陈梦涛, 应鹏飞, 蒋玉蓉, 陆国权. 彩叶芋组织快速繁殖技术研究[J]. 广东农业科学, 2019, 46(3): 31-36. DOI:10.16768/j.issn.1004-874X.2019.03.005 WU Y L, WANG Y, CHEN M T, YING P F, JIANG Y R, LU G Q. Study on tissue rapid propagation technology of taro[J]. Guangdong Ag r icultural Science, 2019, 46(3): 31-36. DOI:10.16768/j.issn.1004-874X.2019.03.005 |
| [21] |
陈绍煌. 台湾过山香组培快繁技术研究[J]. 现代农业科技, 2014(15): 89-91. CHEN S H. Research on tissue culture and rapid propagation technology of Taiwan Passiflora[J]. Modern Agricultural Science and Technology, 2014(15): 89-91. |
| [22] |
潘继兰. 微型九里香繁殖栽培技法[J]. 花木盆景(花卉园艺), 2010(10): 7. PAN J L. Micro Jiulixiang breeding and cultivation techniques[J]. Bonsai(Flower Gardening), 2010(10): 7. |
(责任编辑 杨贤智)
 2022, Vol. 49
2022, Vol. 49