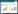文章信息
基金项目
- 广东省现代农业产业技术体系创新团队建设项目(2019KJ136-06,2020KJ136-06,2021KJ136-06,2022KJ136-06)
作者简介
- 魏欣莹(1997—),女,在读硕士生, 研究方向为植物病害生物防治,E-mail:826391136@qq.com.
通讯作者
- 喻国辉(1976—),男,博士,教授,研究方向为植物病害生物防治,E-mail:ygh76411@zhku.edu.cn.
文章历史
- 收稿日期:2022-12-07
2. 罗定市农产品质量安全监督检测站,广东 罗定 527299;
3. 罗定市船步镇基础综合服务中心,广东 罗定 527225
2. Luoding Agricultural Products Quality and Safety Supervision and Testing Station, Luoding 527299, China;
3. Basic Integrated Service Center in Chuanbu Town, Luoding City, Luoding, 527225 China
【研究意义】花生果腐病(Peanut pod rot),又称“烂果病”,受害植株地上部分与正常植物无异,地下果荚腐烂严重,是世界范围内普遍发生的花生土传病害之一。花生果腐病危害严重,难于治理,发病田轻者产量损失15%,重者绝收[1-2]。目前花生果腐病已在我国广东、河北、河南、山东、海南等地发生[3-7],对花生产业造成严重损失。【前人研究进展】引起花生果腐病的病原菌主要有茄病镰刀菌(Fusarium solani)、群结腐霉菌(Pythium myriotylum)[2, 4]、Neocosmospora vasinfecta[8]、N. striata[9]和尖孢镰刀菌(F. oxysporum)[3]。目前国内花生果腐病的防控措施主要包括化学防控[10]、抗性育种[11]和生物防治[12-13]等,其中解淀粉芽胞杆菌(Bacillus amyloliquefaciens)[12]和贝莱斯芽胞杆菌(B. velezensis)[13]对不同病原菌引起的花生果腐病都表现出较好防效,具有良好的应用前景。果腐病的防控包括抗病品种选育、农业防治、生物防治和化学防治,生产上主要采用化学防治的方法。但长期使用化学农药容易引起病原菌产生抗药性,造成环境污染,因此需要寻找一种有效且绿色环保的防治途径。【本研究切入点】贝莱斯芽胞杆菌种名于2005年确立,2007年将解淀粉芽胞杆菌和贝莱斯芽胞杆菌认定为同物异名而失去细菌命名法中的地位[14]。2010年,解淀粉芽胞杆菌被划分为两个亚种:解淀粉芽胞杆菌亚种和解淀粉芽胞杆菌植物亚种。2015年后确认贝莱斯芽胞杆菌不是解淀粉芽胞杆菌的同物异名,而甲基营养型芽胞杆菌和解淀粉芽胞杆菌植物亚种是贝莱斯芽胞杆菌的同物异名,因此2015年以前被鉴定为甲基营养型芽胞杆菌和解淀粉芽胞杆菌植物亚种的菌株均为贝莱斯芽胞杆菌[14-15]。例如,贝莱斯芽胞杆菌FZB42菌株,之前被鉴定为解淀粉芽胞杆菌植物亚种,是极具生防潜力的芽胞杆菌,被广泛应用在微生物肥料中,对多种病原具有广谱的拮抗活性,研究该菌株的学术论文多达300多篇[15]。贝莱斯芽胞杆菌Hsg1949菌株对引起花生果腐病的3株镰刀菌F. spp. 病原菌表现出良好的拮抗活性,其抑菌率为77.0%、69.7%、61.9%,田间施用Hsg1949菌悬液后可显著降低花生果腐病的发病率[13],表现出较好的防控效果,值得开发应用于花生土传病害的防控。【拟解决的关键问题】本研究从实验室保存的芽胞杆菌菌株中筛选出一株对果腐病具有良好抑菌效果的菌株ZKY01,并进行分子鉴定和生物学特性研究,利用该菌株制备的可湿性粉剂开展田间防效试验,为今后研发芽胞杆菌制剂防控广东花生重大土传病害提供理论依据。
1 材料与方法 1.1 试验材料1.1.1 供试病原菌 花生果腐病病原菌R4-2菌株(F. solani)、R5菌株(F. oxysporum)和G15菌株(F. spp.),均由仲恺农业工程学院植物健康创新研究院于2019年从韶关市曲江区樟市镇患果腐病的腐烂花生果荚中分离获得,并经过致病性回接试验确定为果腐病病原菌[3]。
1.1.2 供试菌株 供试生防菌株ZKY01,由仲恺农业工程学院植物健康创新研究院分离保存。ZKY01可湿性粉剂委托华中农业大学微生物农药生物工程中心加工,芽胞含量2×1010 CFU/g。
1.1.3 供试培养基 供试培养基为LB培养基、PDA培养基、MSgg培养基[16]、BGM1培养基[17]、BGDM培养基[17]、厌氧培养基[18]。
1.2 试验方法1.2.1 生防菌活化 将-80℃甘油保藏的菌株ZKY01在LB培养基平板上划线,置于37℃静置培养过夜备用。
1.2.2 病原菌活化 将4℃保藏的果腐病病原菌琼脂块接种到PDA培养基平板上,27℃静置培养,培养5 d后备用。
1.2.3 平板拮抗效果测定 将LB固体培养基和PDA培养基用微波炉加热融化,等体积混合均匀,制备平板备用。用1 mL无菌蓝色吸头在培养5 d的病原菌培养皿上沿菌落边缘打孔获得菌饼,然后将菌饼接种到混合平板中央,每个平板上接种1个菌饼,在距离病原菌接种中心3 cm的位置,接种活化的ZKY01单菌落,并涂布成直径约0.5 cm的菌苔,以不接种ZKY01单菌落的病原菌平板为对照。28℃,培养皿倒置培养。5 d后,采用十字交叉法测量对照和处理病原菌菌落直径,采用菌丝生长速率法[13]计算抑菌率。抑菌率(%)=[(对照菌落半径-处理菌落半径)/对照菌落半径]×100。
1.2.4 菌株ZKY01的分子鉴定 使用FastPure Bacteria DNA Isolation Mini Kit(南京诺唯赞生物科技股份有限公司) 试剂盒提取菌株ZKY01基因组DNA,16S rDNA、gyrA和gyrB扩增所用引物如表 1所示。扩增产物送上海生工生物股份有限公司进行测序。PCR采用50 μL反应体系:2×Taq PCR Mix 25 μL,正反向引物(10 μmol/L)各2 μL,DNA模板2.0 μL,ddH2O补足至50 μL。PCR反应体系:95 ℃预变性3 min,95 ℃变性10 s,56℃退火40 s,72 ℃延伸30 s,28次循环,72 ℃保持5 min,4 ℃保存。将测序所得的16S rDNA、gyrA、gyrB基因序列分别在NCBI中的核酸数据进行BLAST分析,并用MEGA7.0软件构建系统发育树,其中利用16S rDNA构建系统发育树时,选择Alicyclobacillus acidocaldarius DSM 446(AJ496806)作为外群,利用gyrA构建发育树时以Klebsiella pneumoniae SB3432(FO203501)作为外群,利用gyrB构建发育树时以E.coli(X04341)为外群。
1.2.5 菌株ZKY01的理化性质测定 参考文献[18]方法测定菌株最适生长温度、厌氧生长能力、耐盐能力以及溶菌酶、接触酶、氧化酶反应、苯丙氨酸脱氨酶产生能力,并对菌株的代谢能力开展测定,如葡萄糖及阿拉伯糖发酵、V.P. 实验、淀粉水解、柠檬酸盐利用、丙酸盐利用、硝酸盐还原亚硝酸盐、木糖、甘露醇、半乳糖、吲哚、硫化氢、二羟基丙酮、酪蛋白、尿素、吐温80利用能力测定。
样品送往广东省微生物分析检测中心,利用Biolog细菌鉴定系统测定的碳源对ZKY01菌株进行Biolog鉴定。
1.2.6 菌株ZKY01的生物被膜形成能力测定 参考文献[17]开展菌株生物被膜形成能力测定。将ZKY01菌株接种于LB固体培养基划线活化,挑取单菌落至5 mL LB液体培养基中,37 ℃、180 r/min震荡培养过夜至OD600为0.8~1.0。按照1% 接种量,取50 µL菌液接种至新的5 mL LB液体培养基中,37℃、180 r/min震荡培养4 h,稀释菌液至OD600为0.02。取9 µL菌液分别加入到MSgg、BGM1、BGDM液体培养基中,取2 µL菌液分别加入至MSgg、BGM1、BGDM固体培养基中,30 ℃静置培养4 d后,观察生物被膜形成情况。观察并拍照记录。
1.2.7 菌株ZKY01田间防效验证 2019年秋在韶关市曲江区樟市镇新民村开展ZKY01可湿性粉剂防控花生果腐病的田间试验。试验田上茬种植水稻,水稻收割后,重新起垄播种花生(农户自留种,品种名未知)。花生出苗10 d后,用1 000倍稀释的ZKY01可湿性粉剂对花生种苗喷淋,每株50 mL左右。以不喷淋上述可湿性粉剂为对照,对照区仅防控其他病虫害。对照区和处理区面积均为266.4 m2。花生收获时,在处理区和对照区随机选择3个样点,每个样点10株花生,统计单株花生果荚总数、腐烂果荚总数和花生果荚鲜重。

|
1.2.8 数据分析方法 使用DPS(2010)数据分析软件,采用单因素方差分析和邓肯氏新复极差法开展多重比较。
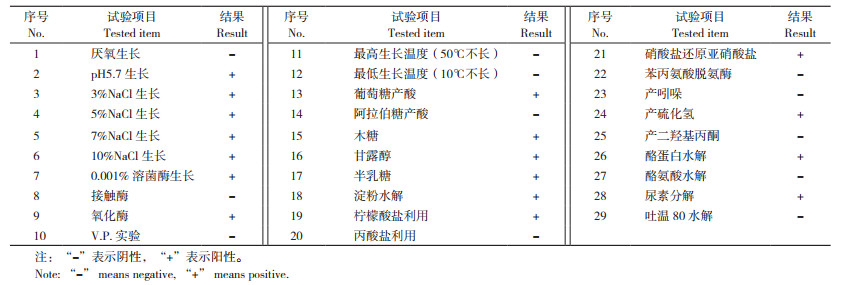
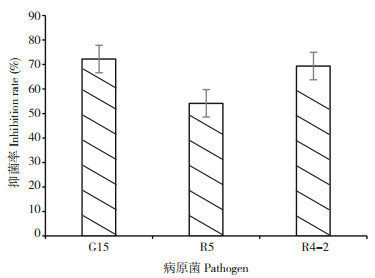
2 结果与分析 2.1 菌株ZKY01对花生果腐病病原菌的平板拮抗活性测定平板拮抗试验结果显示,菌株ZKY01对引起花生果腐病的G15、R5、R4-2病原菌具有很强的拮抗活性。静置培养5 d后,对照的病原菌已经长满整个平板,但是接种ZKY01的平板上,病原菌的菌丝被限制在平板中间(图 1A、B、C)。其中ZKY01对G15菌株的抑制率达到72.23(±3.36)%,对R5菌株的抑制率达到54.14(±10.33)%,对R4-2菌株的拮抗活性达到69.37(±2.17)%(图 2)。
|
| 图 1 菌株ZKY01对3株病原真菌的拮抗效果 Fig. 1 Antagonistic effect of ZKY01 strain against three strains of pathogenic fungi |
|
| 图 2 菌株ZKY01对花生果腐病的平板抑菌率 Fig. 2 Plate inhibition rate of ZKY01 strain against the pathogens of peanut pod rot |
2.2 菌株ZKY01的分子鉴定
为明确菌株ZKY01的分类地位,将菌株ZKY01的16S rDNA序列于NCBI中进行BLAST分析,结果显示,菌株ZKY01与贝莱斯芽胞杆菌VCN56(OM349135)、贝莱斯芽胞杆菌TK2 (OM401682)等菌株的16S rDNA同源性达到99.86%。系统发育分析显示,ZKY01与贝莱斯芽胞杆菌、枯草芽胞杆菌、莫海威芽胞杆菌处于同一分支(图 3A)。进一步利用gyrA、gyrB序列于NCBI中进行BLAST分析,结果显示,ZKY01的gyrA(图 3B)、gyrB序列(图 3C)均与贝莱斯芽胞杆菌处于同一分支。

|
| 图 3 基于菌株ZKY01 16S rDNA(A)、gyrA(B)和gyrB(C)序列构建的系统发育树 Fig. 3 Phylogenetic tree constructed based on 16S rDNA (A), gyrA (B) and gyrB (C) sequences of ZKY01 strain |
2.3 菌株ZKY01理化性质测定
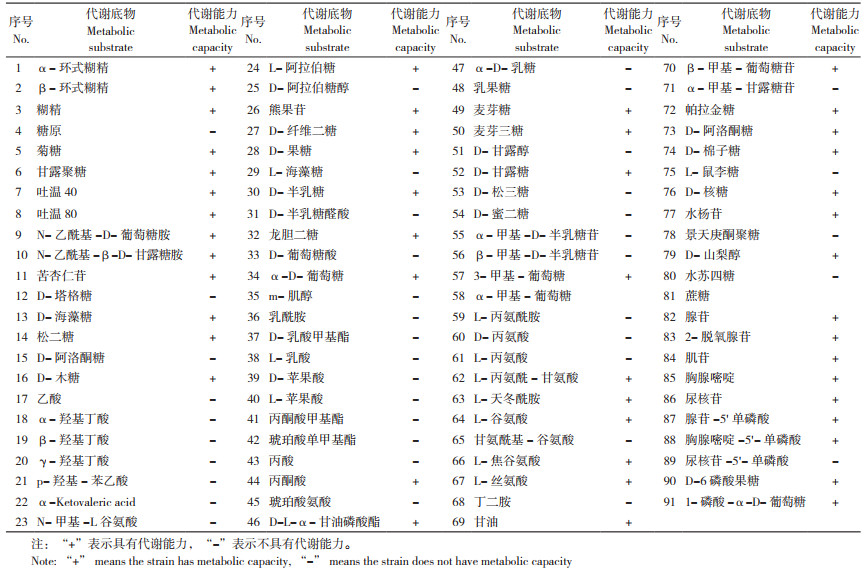
生理生化测定结果表明,菌株ZKY01能在3%~10%NaCl中正常生长,生长温度为10~50 ℃,0.001% 溶菌酶、氧化酶、淀粉水解反应、柠檬酸盐利用、硝酸盐还原亚硝酸盐、酪蛋白水解、尿素分解均为阳性。V.P. 实验、丙酸盐利用、苯丙胺酸脱氢酶、吐温80水解为阴性。菌株ZKY01能利用葡萄糖、木糖、甘露醇、半乳糖,无法利用阿拉伯糖;该菌株可产硫化氢,无法产吲哚和二羟基丙酮(表 2)。Biolog细菌鉴定系统中Biolog-GN板碳源测定的ZKY01碳源利用结果见表 3,ZKY01可以利用α- 环式糊精等50种碳源。
|
2.4 菌株ZKY01的生物被膜形成能力测定
ZKY01在MSgg、BGM1、BGDM液体培养基上均能形成漂浮的薄皮,在MSgg固体培养基上能够形成具有多重褶皱的菌落,在BGM1固体培养基上形成分支菌落,在BGDM固体培养基上也能形成具有褶皱的菌落(图 4)。

|
| 图 4 菌株ZKY01在不同培养基上的生物被膜形成情况 Fig. 4 Biofilm formed on the different media of ZKY01 strain |
2.5 菌株ZKY01对花生果腐病田间防效
田间防治试验结果显示,对照区花生的果腐病发病率为27.79(±5.19)%,处理区花生果腐病发病率为1.35(±0.51)%,两者差异显著,ZKY01可湿性粉剂苗期喷淋1次的果腐病防控效率95.14%。对照和处理区各采集30株花生,花生果腐病发生情况如图 5所示,对照区的花生果腐病发生严重,处理区花生果腐病极少。对照区单株果荚质量69.00(±6.37) g,处理区单株果荚质量73.86(±3.99) g,两者差异不显著,可见ZKY01单次喷淋不具备增产效果。

|
| 图 5 ZKY01喷淋对花生果实果腐病的防控效果 Fig. 5 Control effect of ZKY01 sprayed on peanut pod rot |
3 讨论
本研究鉴定菌株ZKY01为贝莱斯芽胞杆菌。贝莱斯芽胞杆菌ZKY01可在3%~10%NaCl、pH 5条件下生长,而温度超过50℃无法生长,这与已报道的贝莱斯芽胞杆菌特性一致[19-20]。已报道的贝莱斯芽胞杆菌19742-1、19742-2与ZKY01均无法利用水苏糖、α-D-乳糖、D-海藻糖、D-阿拉伯醇,但ZKY01能利用19742-1、19742-2无法利用的D-松二塘、N-乙酰基-β-D甘露糖胺、D-半乳糖、肌苷[21]。与报道的菌株相比,贝莱斯芽胞杆菌ZKY01能在环境中利用更多的碳源。
芽胞杆菌的生物被膜形成能力与其定殖能力有关[22-23]。贝莱斯芽胞杆菌5YN8生物被膜增强型突变体与野生型相比在叶片定殖量显著增多[23],贝莱斯芽胞杆菌ZKY01能在Msgg、BGM1以及生物被膜形成缺陷培养基BGDM上形成薄皮,说明该菌株具有很强的生物被膜形成能力。芽胞杆菌的生物被膜形成能力越强,越能增强其对环境胁迫的抗逆性及生物防治能力[24-25]。
从花生根际土壤分离的解淀粉芽胞杆菌(B.amyloliquefaciens)GF-3和GF-22制备的生物有机肥能降低侵脉新赤壳菌(N.vasinfecta)引起的花生果腐病,防效分别达到32.35% 和79.41%,且增产显著[12]。从花生根际分离的贝莱斯芽胞杆菌(B. velezensis)Hsg1949对引起花生果腐病的镰刀菌具有拮抗活性,在2×108 CFU/mL和5×108 CFU/mL施用时对镰刀菌引起的花生果腐病防效分别为66.54% 和71.27%,与多菌灵防效(75.11%)相当[13],而使用ZKY01可湿粉苗期喷淋1次田间防效可以达到95.14%,在花生苗期采用可湿性粉剂喷淋1次(芽胞杆菌用量为2×107CFU/mL)的防控方式,可以显著减少花生果腐病的发生,防效达到95.14%,具有良好的应用前景。芽胞杆菌主要通过产生丰富的脂肽类抗生素来抑制病原菌,如表面活性素(Surfactins)、伊枯草菌素(Iturins)和芬芥素(Fengycins)[22]等。贝莱斯芽胞杆菌ZKY01对不同的病原真菌表现出广谱的拮抗活性,还需要对其产生的抗生类物质进一步研究,以揭示其防治防治花生果腐烂的机制。
4 结论本研究筛选到1株对花生果腐病具有拮抗活性的生防芽胞杆菌ZKY01,经16S rDNA、gyrA、gyrB基因序列发育分析鉴定其为贝莱斯芽胞杆菌。ZKY01能在MSgg、BGM1、BGDM液体培养基上形成薄皮,在MSgg固体培养基形成多重褶皱的菌落,在BGM1固体培养基上能形成分支的菌落,但在BGDM固体培养基上却只形成圆形的光滑菌落,表明ZKY01具有很强的生物被膜形成能力,更容易定殖于植物根系。ZKY01能够利用50种碳源,具有很强的环境适应性。利用ZKY01的可湿性粉剂在大田对花生果腐病进行防控,其防效达到95.14%。贝莱斯芽胞杆菌ZKY01对花生果腐病表现出良好的防控效果,可用于花生土传病害的防控,但防控机制还有待深入研究。
| [1] |
王传堂, 禹山林, 于洪涛, 王秀贞, 唐月异, 崔凤高, 陈殿绪, 张建成, 李术臣. 花生果腐病病原分子诊断[J]. 花生学报, 2010, 39(1): 1-4. DOI:10.3969/j.issn.1002-4093.2010.01.001 WANG C T, YU S L, YU H T, WANG X Z, TANG Y Y, CUI F G, CHEN D X, ZHANG J C, LI S C. Molecular diagnosis of peanut pod rot pathogens[J]. Journal of Peanut Science, 2010, 39(1): 1-4. DOI:10.3969/j.issn.1002-4093.2010.01.001 |
| [2] |
李术臣, 陈丹, 贾海民, 赵聚莹, 康海燕, 张根启. 花生果腐病研究进展[J]. 河北农业科学, 2010, 14(9): 74-75. DOI:10.3969/j.issn.1088-1631.2010.09.027 LI S C, CHEN D, JIA H M, ZHAO J Y, KANG H Y, ZHANG G Q. Research progress of peanut rot[J]. Journal of Hebei Agricultural Sciences, 2010, 14(9): 74-75. DOI:10.3969/j.issn.1088-1631.2010.09.027 |
| [3] |
邢珏珺, 许毓钊, 苏钰彤, 魏欣莹, 江海琪, 喻国辉, 尹艳. 广东花生果腐病病原菌鉴定及药剂筛选试验[J]. 广东农业科学, 2022, 49(8): 73-80. DOI:10.16768/j.issn.1004-874X.2002.08.009 XING J J, XU Y Z, SU Y T, WEI X Y, JIANG H Q, YU G H, YIN Y. Identification of peanut pod rot pathogens in Guangdong Province and screening of fungicides[J]. Guangdong Agricultural Sciences, 2022, 49(8): 73-80. DOI:10.16768/j.issn.1004-874X.2002.08.009 |
| [4] |
李术臣, 贾海民, 赵聚莹, 陈丹. 河北省花生果腐病病原鉴定及致病性研究[J]. 河北农业科学, 2011, 15(5): 37-39. DOI:10.3969/j.issn.1088-1631.2011.05.013 LI S C, JIA H M, ZHAO J Y, CHEN D. Pathogens identification and pathogenicity pod rot in Hebei Province[J]. Journal of Hebei Agricultural Sciences, 2011, 15(5): 37-39. DOI:10.3969/j.issn.1088-1631.2011.05.013 |
| [5] |
张成玲, 张田田, 吴翠霞, 路兴涛. 花生果腐病病菌鉴定及生物学特性[J]. 花生学报, 2010, 45(3): 27-31. DOI:10.14001/j.issn.1002-4093.2016.03.005 ZHANG C L, ZHANG T T, WU C X, LU X T. Identification and biological characteristics of fungal isolates causing peanut pod rot pathogen[J]. Journal of Peanut Science, 2010, 45(3): 27-31. DOI:10.14001/j.issn.1002-4093.2016.03.005 |
| [6] |
刘小玉, 付登强, 余凤玉, 杨伟波, 尹欣幸. 海南花生果腐病菌的分离、鉴定及生物学特性研究[J]. 江苏农业科学, 2020, 48(6): 104-107. DOI:10.15889/j.issn.1002-1302.2020.06.021 LIU X Y, FU D Q, YU F Y, YANG W B, YIN X X. Isolation, identification and biological characteristics of peanut fruit rot pathogen in Hainan Province[J]. Jiangsu Agricultural Sciences, 2020, 48(6): 104-107. DOI:10.15889/j.issn.1002-1302.2020.06.021 |
| [7] |
刘晓光, 范燕, 赵雪飞, 陈志, 陈胜萍. 冀东地区花生果腐病发生动态及致病因子研究[J]. 花生学报, 2021, 50(3): 55-60. DOI:10.14001/j.issn.1002-4093.2021.03.008 LIU X G, FAN Y, ZHAO X F, CHEN Z, CHEN S P. Study on the occurrence dynamics and pathogenic factors of pod rot in easter Hebei[J]. Journal of Peanut Science, 2021, 50(3): 55-60. DOI:10.14001/j.issn.1002-4093.2021.03.008 |
| [8] |
SUN W M, FENG L N, GUO W, LIU D Q, LI Y N, RAN L X. First report of peanut pod rot caused by Neocosmospora vasinfecta in northern China[J]. Plant Disease, 2012, 96(3): 455. DOI:10.1094/PDIS-03-11-0240 |
| [9] |
SUN W M, FENG L N, GUO W, LIU D Q, YANG Z H, LIU L F, RAN L X, MENG Q F. First report of Neocosmospora striata causing peanut pod rot in China[J]. Plant Disease, 2012, 96(1): 146. DOI:10.1094/PDIS-06-11-0461 |
| [10] |
杨富军, 王绍伦, 张丽, 李春洁, 朱统国, 刘海龙, 周玉萍, 孙晓苹, 高华援. 吉林省高纬度地区花生果腐病药剂防治效果[J]. 安徽农业科学, 2015, 43(5): 140-141. DOI:10.13989/j.cnki.0517-6611.2015.05.053 YANG F J, WANG S L, ZHANG L, LI C J, ZHU T G, LIU H L, ZHOU Y P, SUN X P, GAO H Y. Control effects of agent against peanut pod rot at high latitudes[J]. Journal of Anhui Agricultural Sciences, 2015, 43(5): 140-141. DOI:10.13989/j.cnki.0517-6611.2015.05.053 |
| [11] |
于静, 李莹, 许曼琳, 张霞, 郭志青, 吴菊香, 迟玉成. 花生品种对花生果腐病的抗性鉴定[J]. 中国油料作物学报, 2020, 42(4): 681-686. DOI:10.19802/j.issn.1007-9084.2020015 YU J, LI Y, XU M L, ZHANG X, GUO Z Q, WU J X, CHI Y C. Evaluation of resistance of different peanut varieties to peanut pod rot[J]. Chinese Journal of Oil Crop Sciences, 2020, 42(4): 681-686. DOI:10.19802/j.issn.1007-9084.2020015 |
| [12] |
孙伟明, 时晨, 张梦涛, 赵丹, 陈璇, 冯丽娜, 罗永松, 郭巍. 花生侵脉新赤壳菌果腐病生防芽胞杆菌的分离鉴定及防病效果[J]. 微生物学报, 2018, 58(9): 1573-1581. DOI:10.13343/j.cnki.wsxb.20170528 SUN W M, SHI C, ZHANG M T, ZHAO D, CHEN X, FENG L N, LUO Y S, GUO W. Isolation and identification of Bacillus spp. controlling Neocosmospora pod rot of peanut[J]. Acta Microbiologica Sinica, 2018, 58(9): 1573-1581. DOI:10.13343/j.cnki.wsxb.20170528 |
| [13] |
曹伟平, 陆晴, 鹿秀云, 臧卫平, 宋健. 花生果腐病拮抗菌贝莱斯芽胞杆菌Hsg1949鉴定与防效[J]. 中国生物防治学报, 2021, 37(4): 761-770. DOI:10.16409/j.cnki.2095-039x.2021.04.005 CAO W P, LU Q, LU X Y, ZANG W P, SONG J. Identification of antagonistic bacterium Bacillus velezensis Hsg1949 and its biocontrol effect on peanut pod rot[J]. Chinese Journal of Biological Control, 2021, 37(4): 761-770. DOI:10.16409/j.cnki.2095-039x.2021.04.005 |
| [14] |
刘洋, 刘晓昆, 陈文浩. 贝莱斯芽胞杆菌(Bacillus velezensis)物种名称的"前世今生"[J]. 生物技术通报, 2019, 35(7): 230-232. DOI:10.13560/j.cnki.biotech.bull.1985.2019-0600 LIU Y, LIU X K, CHEN W H. "Past and present" species name of Bacillus velezensis[J]. Biotechnology Bulletin, 2019, 35(7): 230-232. DOI:10.13560/j.cnki.biotech.bull.1985.2019-0600 |
| [15] |
张文博, 李昱龙, 周蕾, 沈东霞, 朱丽华, 樊奔. 植物根际益生细菌代表性菌株贝莱斯芽胞杆菌FZB42对松材线虫的抑杀性[J]. 微生物学报, 2021, 61(5): 1287-1298. DOI:10.13343/j.cnki.wsxb.20200372 ZHANG W B, LI Y L, ZHOU L, SHEN D X, ZHU L H, FAN B. Inhibition of pine wood nematode Bursaphelenchus xylophilus by rhizobacterium Bacillus velezensis FZB42[J]. Acta Microbiologica Sinica, 2021, 61(5): 1287-1298. DOI:10.13343/j.cnki.wsxb.20200372 |
| [16] |
BRANDA, STEVEN, GONZÁLEZ-PASTOR, ETIENNE D S, DUSKO E, RICHARD L, ROBERTO K. Genes involved in formation of structured multicellular communities by Bacillus subtilis[J]. Journal of Bacteriology, 2004, 186(12): 3970-3979. DOI:10.1128/JB.186.12.3970-3979.2004 |
| [17] |
李一平, 沈汉国, 喻国辉, 王燕, 李驰, 叶志文, 周东辉, 吴绪波. 一种芽胞杆菌生物被膜形成缺陷培养基的研究[J]. 广东农业科学, 2016, 43(9): 98-104. DOI:10.16768/j.issn.1004-874X.2016.09.015 LI Y P, SHEN H G, YU G H, WANG Y, LI C, YE Z W, ZHOU D H, WU X B. Study on bacillus biofilm growth defective culture medium[J]. Guangdong Agricultural Sciences, 2016, 43(9): 98-104. DOI:10.16768/j.issn.1004-874X.2016.09.015 |
| [18] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. DONG X Z, CAI M Y. Handbook for identification of common bacterial systems[M]. Beijing: Science Press, 2001. |
| [19] |
陶永梅, 潘洪吉, 张小利, 黄健, 李鹏, 卢志军. 贝莱斯芽胞杆菌NSZ-YBGJ001的鉴定及其生物学特性[J]. 植物保护学报, 2020, 47(2): 324-331. DOI:10.13802/j.cnki.zwbhxb.2020.2019115.j.cnki.zwbhxb.2020.2019115 TAO Y M, PAN H J, ZHANG X L, HUANG J, LI P, LU Z J. Identification and biological characteristics of Bacillus velezensis NSZ-YBGJ001[J]. Journal of Plant Protection, 2020, 47(2): 324-331. DOI:10.13802/j.cnki.zwbhxb.2020.2019115.j.cnki.zwbhxb.2020.2019115 |
| [20] |
赵昱榕, 李磊, 谢学文, 石延霞, 柴阿丽, 孙广玉, 李宝聚. 贝莱斯芽胞杆菌ZF2对多主棒孢病菌防治效果[J]. 中国生物防治学报, 2019, 35(2): 217-225. DOI:10.16409/j.cnki.2095-039x.2019.02.018 ZHAO Y R, LI L, XIE X W, SHI Y X, CHAI A L, SUN G Y, LI B J. Biocontrol effect of Bacillus velezensis strain ZF2 against Corynespora cassiicola[J]. Chinese Journal of Biological Control, 2019, 35(2): 217-225. DOI:10.16409/j.cnki.2095-039x.2019.02.018 |
| [21] |
郭鹤宝, 王星, 何山文, 张晓霞. 表型特征结合基因组分析鉴定不同菌落形态Bacillus velezensis ACCC 19742[J]. 生物技术通报, 2020, 36(2): 142-148. DOI:10.13560/j.cnki.biotech.bull.1985.2019-0750 GUO H B, WANG X, HE S W, ZHANG X X. Phenotypic characteristics combined with genomic analysis to identify different colony morphology Bacillus velezensis ACCC 19742[J]. Biotechnology Bulletin, 2020, 36(2): 142-148. DOI:10.13560/j.cnki.biotech.bull.1985.2019-0750 |
| [22] |
MASAAKI M. Beneficial biofilm formation by industrial bacteria Bacillus subtilis and related species[J]. Journal of Bioscience and Bioengineering, 2006, 101(1): 1-8. |
| [23] |
司方洁, 任金瑶, 黄涛祥, 俞仪阳, 郭坚华, 蒋春号. 贝莱斯芽胞杆菌5YN8生物被膜在防治番茄灰霉病过程中的功能研究[J]. 中国生物防治学报, 2022, 38(5): 1223-1230. DOI:10.16409/j.cnki.2095-039x.2022.06.010 SI F J, REN J Y, HUANG T X, YU Y Y, GUO J H, JIANG C H. The function of Bacillus velezensis 5YN8 biofilm in controlling of botrytis cinerea in tomato[J]. Chinese Journal of Biological Control, 2022, 38(5): 1223-1230. DOI:10.16409/j.cnki.2095-039x.2022.06.010 |
| [24] |
凡肖, 束长龙, 关雄, 黄天培. 细菌生物被膜在生物防治中的作用[J]. 中国生物防治学报, 2018, 34(5): 791-801. DOI:10.16409/j.cnki.2095-039x.2018.05.019 FAN X, SHU C L, GUAN X, HUANG T P. Progress in the application of bacterial biofilm on biological control[J]. Chinese Journal of Biological Control, 2018, 34(5): 791-801. DOI:10.16409/j.cnki.2095-039x.2018.05.019 |
| [25] |
李生樟, 陈颖, 杨瑞环, 张翠萍, 刘昭, 李逸朗, 陈涛, 陈功友, 邹丽芳. 一株拮抗黄单胞菌的贝莱斯芽孢杆菌的分离和鉴定[J]. 微生物学报, 2019, 59(10): 1969-1983. DOI:10.13343/j.cnki.wsxb.20180513 LI S Z, CHEN Y, YANG R H, ZHANG C P, LIU Z, LI Y L, CHEN T, CHEN G Y, ZOU L F. Isolation and identification of a Bacillus velezensis strain against plant pathogenic Xanthomonas spp.[J]. Acta Microbiologica Sinica, 2019, 59(10): 1969-1983. DOI:10.13343/j.cnki.wsxb.20180513 |
(责任编辑 陈丽娥)
 2023, Vol. 50
2023, Vol. 50