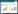文章信息
基金项目
- 四川省科技计划重点研发项目(20212YFN0035)
作者简介
- 何紫梅(1999—),女,在读硕士生,研究方向为环境生态与环境生物效应,E-mail:hezimeistc@163.com.
通讯作者
- 张宇(1978—),女,博士,副教授,研究方向为环境生态与环境生物效应,E-mail:zhangyu@swust.edu.cn.
文章历史
- 收稿日期:2022-12-22
2. 生物质材料教育部工程研究中心,四川 绵阳 621010;
3. 广元市科学技术局,四川 广元 628010;
4. 四川佳猕沃农业科技有限公司,四川 广元 628000
2. Engineering Research Center of Material Materials, Ministry of Education, Mianyang 621010, China;
3. Science and Technology Bureau of Guangyuan City, Sichuan Province, Guangyuan 628010, China;
4. Sichuan Jiamiwo Agricultural Technology Co., Ltd., Guangyuan 628000, China
【研究意义】猕猴桃营养丰富,被誉为“水果之王”[1],其药用价值较高,具有预防感冒、白发、高血压及抗衰老等作用[2]。猕猴桃细菌性溃疡病是由革兰氏阴性菌丁香假单胞杆菌猕猴桃致病变种(Pseudomonas syringae pv. Actinidiae,Psa)引起的病害,该病害于1984年第一次发现于日本静冈县[3],随后陆续在意大利[4]、法国[5]、新西兰[6]等国家出现。猕猴桃细菌性溃疡病是一种严重威胁猕猴桃生产的毁灭性细菌性病害,具有发病范围广、传播快、致病力强等特点,可在短期内引起大面积猕猴桃树体死亡,造成严重的经济损失[7-8],是国内森林植物的重点检疫对象[9]。【前人研究进展】Psa具有较强的生态适应性,极大增加了防治难度。关于猕猴桃溃疡病的防治有较多报道[10-12],但当猕猴桃溃疡病大面积暴发时,仍缺乏有效的治愈方法。由于缺乏高抗品种,目前主要依赖农业措施和化学制剂,主要是铜制剂(如硫酸铜、氢氧化铜、氧化亚铜等)进行猕猴桃细菌性溃疡病害的防治[13-14]。因此,亟需找到环境友好型药剂对猕猴桃溃疡病进行高效、绿色防控。农业中利用杀菌剂对植物病虫害进行防治已有多篇报道[15-17]。噻霉酮水乳剂是一种新型、广谱杀菌剂,具有高效低毒、使用安全等特点,其杀菌作用机理主要包括破坏病菌细胞核结构使其衰竭死亡,干扰病菌细胞新陈代谢,使其生理紊乱,最终导致死亡[18]。姚廷山等[19]通过室内毒力测定表明噻霉酮对柑桔溃疡病菌的抑制作用最大;曾荣等[20]研究发现噻霉酮对西瓜果斑病具有良好的防控效果;刘原等[21]研究表明噻霉酮对猕猴桃溃疡病有较好的防治作用;王晓敏等[22]等研究发现1.6% 噻霉酮水乳剂1 000倍液对芒果叶片炭疽病防效最好,防治芒果果实炭疽病的最佳浓度为3 000倍液。【本研究切入点】虽然已有学者研究了噻霉酮对猕猴桃溃疡病的防控效果[21, 23],但目前就噻霉酮对Psa的抑菌机理研究较少。【拟解决的关键问题】本研究测定经不同浓度噻霉酮处理后的猕猴桃溃疡病菌的生长、蛋白质含量和过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide dismutase,SOD)的活性,通过荧光显微镜和扫描电镜观察Psa细胞膜结构的变化,通过流式细胞术进行细胞周期的检测,揭示噻霉酮对Psa的抑菌机理,为噻霉酮防控猕猴桃溃疡病提供理论依据,促进猕猴桃产业的可持续发展。
1 材料与方法 1.1 试验材料供试植株为中华猕猴桃红阳,由四川省广元市苍溪县猕猴桃基地提供。噻霉酮水乳剂购自陕西西大华特科技实业有限公司。UV-1200型紫外分光光度计购自上海美谱达仪器有限公司,高速低温组织研磨机购自武汉赛维尔生物科技有限公司,供试的检测试剂盒均购自南京建成生物工程研究所。
1.2 试验方法1.2.1 致病菌分离与鉴定 于2022年3月下旬在广元猕猴桃生产基地采集具有猕猴桃溃疡病典型症状的感病枝条及叶片,采用鄢明峰等[24]的方法进行致病菌分离,分离获得的菌株纯化后进行致病性测定,接种枝条为长势一致的一年生嫩叶,以无菌水接种作为对照,每个处理3次重复。参照《伯杰氏细菌鉴定手册》和《植病研究方法》,测定病菌生理生化反应;并将提取的菌株DNA送至北京擎科生物科技有限公司进行测序。将测得的16S rRNA原始序列用DNAStar分析软件进行数据处理,运用NCBI中Blast工具在GenBank中搜索同源DNA序列并进行比较分析,利用MEGA6软件构建系统发育树,根据同源性大小和系统发育关系确定菌株的种类归属。
1.2.2 生长曲线测定 参照侯温甫等[25]的方法,将培养12 h的Psa接种至100 mL液体LB培养基中,使培养液中的细菌浓度达106 ~107 CFU/mL,分别向培养液加1 mL经无菌水稀释10倍的噻霉酮水乳剂,使菌液中噻霉酮浓度达1 μL/mL(记为X10);加入原液噻霉酮水乳剂,使菌液中噻霉酮浓度达10 µL/mL(记为Y);加入1 mL无菌水为对照(CK),置于28 ℃条件下培养,每隔2 h于紫外分光光度计测定OD600的光密度。
1.2.3 AO/PI染色观察 参照原红艳等[26]的方法并进行改良,预先配置含50 μg/mL PI、10 μg/mL AO的染色预混液,将处理Y及CK培养6 h的菌液用0.2 mmol/L PBS清洗2次后,离心,弃去上清液,吸取10 μL细菌样本至EP管中,加入等体积的AO/PI预混染色液(终浓度25 μg/mL PI,5 μg/mL AO),吹打混匀后孵育5 min,在荧光显微镜下观察。
1.2.4 扫描电子显微镜观察 扫描电镜样品的制备采用Gao等[27]的方法,将处理Y及CK培养6 h的菌液在4 ℃下静置固定12 h,用0.2 mmol/L PBS清洗3次,每次15 min。用30%、50%、75%、90%、95%、100% 乙醇逐级脱水,每级脱水20 min。进行冷冻干燥4 h后,在离子溅射仪中进行金属镀膜,然后将样品置于TM-3000台式扫描电子显微镜下观察细菌的细胞形态。
1.2.5 噻霉酮对病原菌生理生化的影响 在LB液体培养基中培养Psa,用PBS稀释后得到约106 CFU/mL的菌液,将处理X10、Y、CK各加入1 mL至100 mL 106 CFU/mL菌悬液中,在摇床中以120 r/min、28 ℃条件培养。参照吴美艳等[28]的方法,分别于2、4、6、8、10、12、24 h后测定CAT、SOD活性和可溶性蛋白含量。其中CAT、SOD活性采用酶活检测试剂盒测定,可溶性蛋白含量采用考马斯亮蓝染色法测定。每个处理3次重复。
1.2.6 流式细胞术测定噻霉酮对Psa的影响 菌液处理同1.2.5,取培养24 h的X10、Y、CK菌液以8 000 r/min离心5 min,弃上清,加入1× PBS清洗后加入75% 乙醇进行固定。固定后送至四川杨克斯特科技有限公司进行细胞周期的检测。荧光灵敏度:1 000;测度速度:low;颗粒数:3 000。每个处理3次重复。
1.2.7 数据处理与分析 采用SPSS V.20.0(SPSS Inc., Chicago, IL, USA)软件对数据进行单因素方差分析和LSD多重比较。采用Origin 9.0(Origin Lab. Corporation,Northampton,MA,USA)作图;采用Adobe Illustrator CS6进行图像排版。
2 结果与分析 2.1 致病菌鉴定本研究从多个感病组织中均可分离出形态一致的菌落;将菌株挑出,纯化,制成浓度为106 ~107 CFU/mL的菌液,用针刺法对猕猴桃新鲜健康叶片进行接种,叶片出现褐色病斑(图 1B),而接种无菌水的猕猴桃叶片正常(图 1A),说明该菌株(命名为H01)有致病性;H01菌落在LB固体培养基上呈乳白色、圆形、光滑、半透明、表面湿润黏稠且生长缓慢(图 1C);革兰氏染色为阴性。H01菌株的生理生化测定结果如表 1所示,其能利用葡萄糖、蔗糖,不能利用麦芽糖;甲基红、淀粉水解、KB培养基产荧光实验均表现为阴性,接触酶实验表现为阳性,能产生果聚糖。

|
| A:接种无菌水;B:接种H01;C:纯化后的H01菌落 A: Sterile water inoculation; B: H01 inoculation; C: Colony of purified H01 图 1 H01菌株致病性试验 Fig. 1 Pathogenicity tests of H01 stains |

|
将H01菌株的16S rDNA序列递交至GenBank数据库中,获得的登录号为OP784219。经Blast分析显示,H01菌株属于假单胞杆菌属。由图 2可见,H01菌株与登录号为AB001439.1和JN378726.1的Psa亲缘关系较近,同源性相对较高,结合取样寄主和致病性检测结果,可以确定本试验分离的猕猴桃溃疡病病原菌株为Psa。

|
| 图 2 基于16Sr DNA序列构建的系统发育树 Fig. 2 Phylogenetic tree based on 16Sr DNA sequences |
2.2 不同浓度噻霉酮对Psa生长曲线的影响
由图 3可知,CK的生长曲线与X10、Y的生长曲线有较大差异。CK的细菌活性整体高于X10、Y的细菌活性,CK与X10都在24 h内呈对数增长,随后进入稳定期,但X10的菌体数量整体低于CK,说明X10抑制了Psa的生长。而处理Y的Psa生长受到显著抑制,在前4 h缓慢生长,随后提前进入稳定期,与CK相比,对数生长期显著缩短,细胞死亡量增加,且最终的菌体量仅为CK的5.5%。
|
| 图 3 不同浓度噻霉酮对Psa生长曲线的影响 Fig. 3 Effects of different concentrations of benzothiazolinone on the growth curves of Psa |
2.3 噻霉酮处理后细菌形态观察
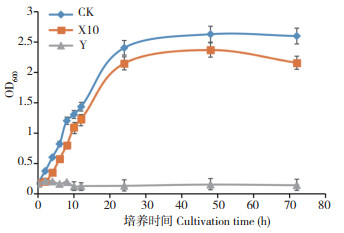
CK培养6 h后的AO/PI染色图中可见大量绿色荧光的菌体(图 4A),Y培养6 h后的AO/PI染色图中,红色荧光强度显著高于绿色荧光(图 4B),说明经Y处理后H01菌体大量死亡,即噻霉酮对Psa有显著的抑制作用。由图 4C可以看出,CK的Psa分散均匀,呈现出完整的杆状,并且彼此间无粘黏;Y处理6 h后,Psa开始聚集成堆且细胞膜破损,导致细胞内容物泄露,菌体黏附在一起,细胞发生了明显的变形(图 4D)。从以上结果可知,噻霉酮对Psa的生长具有抑制作用,其可使Psa细胞膜破损,导致细胞不能正常生长而死亡。
|
| 图 4 噻霉酮水乳剂处理后Psa的AO/PI染色图(A、B)及扫描电子显微镜图像(C、D) Fig. 4 AO/PI staining (A、B) and scanning electron microscope images (C、D) of Psa after benzothiazolinone aqueous emulsion treatment |
2.4 噻霉酮对Psa生理生化的影响
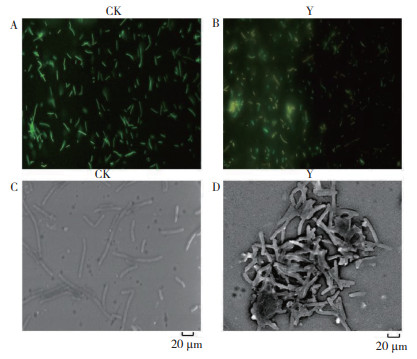
由图 5可知,经过不同浓度噻霉酮处理,前4 h内Y处理Psa的CAT活性显著高于X10及CK,到达峰值73.964 U/mg,但随培养时间增长,其CAT活性逐渐降低至CK水平;而X10处理Psa的CAT活性增加,且在10 h时到达峰值118.795 U/mg,10 h后活性开始下降。Y处理的SOD活性与CAT活性变化趋势一致,在4 h时达到峰值1 060.452 U/mg,显著高于X10及CK;而X10在6 h达到峰值906.67 U/mg,随着培养时间的延长,X10的SOD活性始终显著高于Y及CK。X10及Y的菌体可溶性蛋白含量显著低于CK,在12 h时可溶性蛋白含量差异最大:X10为0.245 mg/mL,Y为0.123 mg/mL,与CK的0.463 mg/mL相比分别降低47.1% 和73.4%。
|
| 小写英文字母不同者表示处理间差异显著(P < 0.05,n=3) Different lowercase letters indicate significant differences between treatments (P < 0.05, n=3) 图 5 不同浓度噻霉酮对Psa生理生化的影响 Fig. 5 Effect of different concentrations of benzothiazolinone on the physiology and biochemistry of Psa |
2.5 噻霉酮对Psa细胞周期的影响
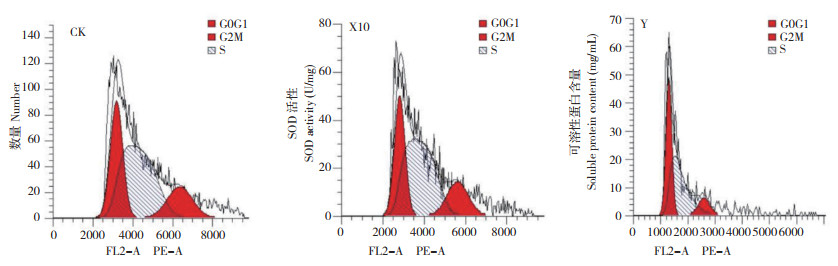
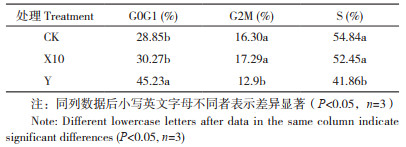
经CK、X10、Y处理20 h后的细胞周期如图 6所示,不同噻霉酮浓度处理各细胞周期的细胞百分比见表 2。G0G1期细胞比例随着噻霉酮浓度的增加而增加,G2M期与S期比例随着噻霉酮浓度的增加逐渐减少。且X10各细胞周期的百分比与CK相比均无显著差异,而Y各细胞周期的百分比与X10及CK差异显著(P<0.05)。
|
| 图 6 不同浓度噻霉酮对Psa细胞周期的影响 Fig. 6 Effect of different concentrations of benzothiazolinone on the cell cycle of Psa |
|
3 讨论
研究表明,噻霉酮对猕猴桃溃疡病菌有较好的抑菌效果,其杀菌机理包括干扰病菌细胞的新陈代谢,使其生理紊乱,最终导致死亡[18],这与本研究结果一致。经噻霉酮水乳剂处理后能明显观察到Psa生长和繁殖能力受到抑制,对数生长期缩短,提前进入稳定期。处理后的Psa经AO/PI染色后在荧光显微镜下明显观察到红色荧光,但红色荧光强度较低,可能是因为细胞处于早期凋亡状态,凋亡细胞在进入最终溶解阶段前,胞膜通透性无明显改变[29]。且通过扫描电子显微镜观察到Psa经噻霉酮处理后细胞膜破裂,细胞内容物外泄,导致菌体粘连并堆积,这与Das等[30]研究结果相同。
通常生物体在受到生物或非生物胁迫时,会上调其抗氧化酶系统进行应对[31]。经噻霉酮水乳剂处理后,Psa抗氧化酶SOD、CAT活性升高,说明Psa对噻霉酮存在氧化应激反应,这与潘佳亮[32]的研究结果相似,经苦参碱处理后,葡萄座腔菌丝体内MDA、活性氧含量和保护酶(SOD、POD、CAT)的活性显著增加,表明苦参碱可以使真菌氧化应激水平升高,细胞膜发生脂质过氧化过程。而Y的CAT、SOD活性在10 h后均与CK无差异,可能是噻霉酮浓度过高,致使Psa细胞膜受损,菌体死亡,活菌数量少,氧化应激能力弱。而噻霉酮处理后可溶性蛋白含量显著低于CK,这与万惠一[33]的研究结果相反,其在加入菲律宾蛤仔抑菌酶解物组分Ⅱ后,金黄色葡萄菌和枯草芽孢杆菌2种细菌培养液中可溶性蛋白含量增加。菌体蛋白水平降低,推测噻霉酮是通过抑制菌体蛋白质的合成或者导致菌体的蛋白质变性,进而影响细胞的能量代谢,导致菌体死亡。本研究通过流式细胞术检测发现随着噻霉酮浓度的增加,G0G1期细胞堆积越多,Y比CK高出56.8%,而Y的S期细胞减少,比CK低23.7%。G0G1期为DNA合成前期,S期为DNA合成期,表明噻霉酮可能通过抑制菌体细胞的DNA合成达到抑菌效果,这与蛋白水平下降结果一致。
本研究从噻霉酮处理后的Psa生长情况、结构形态、生理生化反应及细胞周期影响揭示噻霉酮对Psa的抑菌机理,为噻霉酮作为有机酮制剂防控猕猴桃溃疡病提供了理论依据。后续研究可通过测定组学分析抑菌过程中代谢物上调或下调情况,从分子水平探究噻霉酮对Psa的抑菌机制。
4 结论本研究结果表明,噻霉酮能使菌体细胞膜破裂,导致Psa生长和繁殖能力下降,Y处理后菌体量仅为CK的5.5%。噻霉酮处理后会引起Psa的氧化应激,具体表现为SOD、CAT的活性均呈先上升后下降的趋势,显著高于对照组(P<0.05)。而可溶性蛋白含量随噻霉酮浓度的增加而降低,在处理12 h时差异最大,分别降低47.1%、73.4%;且周期测定细胞百分比发现Y处理的G0G1期细胞比CK高出56.8%,S期细胞比CK低23.7%。表明噻霉酮处理后,细胞堆积在DNA合成前期,通过抑制菌体细胞的DNA合成抑制Psa生长,有效防控猕猴桃细菌性溃疡病。
| [1] |
张迪, 高小宁, 赵志博, 秦虎强, 黄丽丽. 不同猕猴桃品种对溃疡病的抗性差异及其机制研究[J]. 果树学报, 2019, 36(11): 1549-1557. DOI:10.13925/j.cnki.gsxb.20190166 ZHANG D, GAO X N, ZHAO Z B, QIN H Q, HUANG L L. Differences in resistance to Pseudomonas syringae pv.actinidiae and acting mechanism of different kiwifruit varieties[J]. Journal of Fruit Science, 2019, 36(11): 1549-1557. DOI:10.13925/j.cnki.gsxb.20190166 |
| [2] |
贾照志, 曾海. 猕猴桃的药用价值[J]. 中国中医药现代远程教育, 2012, 10(4): 118. DOI:10.3969/j.issn.1672-2779.2012.04.081 JIA Z Z, ZENG H. The medicinal value of kiwifruit[J]. Chinese Medicine Modern Distance Education of China, 2012, 10(4): 118. DOI:10.3969/j.issn.1672-2779.2012.04.081 |
| [3] |
SERIZAWA S, ICHIKAWA T, TAKIKAWA Y, TSUYUMU S, GOTO M. Occurrence of bacterial canker of kiwifruit in Japan: description of symptoms, isolation of the pathogen and screening of bactericides[J]. Annals of the Phytopathological Society of Japan, 1989, 55(4): 427-436. DOI:10.3186/jjphytopath.55.427 |
| [4] |
FERRANTE P, SCORTICHINI M. Identification of Pseudomonas syringae pv. actinidiae as causal agent of bacterial canker of yellow kiwifruit (Actinidia chinensis planchon) in central Italy[J]. Journal of Phytopathology, 2019, 157(11-12): 768-770. DOI:10.1111/j.1439-0434.2009.01550.x |
| [5] |
VANNESTE J L, POLIAKOFF F, AUDUSSEAU C, CORNISH DA, PAILLARD S, RIVOAL C, YU J. First report of Pseudomonas syringae pv. actinidiae, the causal agent of bacterial canker of kiwifruit in France[J]. Journal of Plant Pathology, 2011, 96(1): 169-175. DOI:10.4454/JPP.V96I1.040 |
| [6] |
EVERETT K R, TAYLOR R K, ROMBERG M K, RSSE-GEORGE J, MANNING M A. First report of Pseudomonas syringae pv.actinidiae causing kiwifruit bacterial canker in New Zealand[J]. Australasian Plant Disease Notes, 2011, 6(1): 67-71. DOI:10.1007/s13314-011-0023-9 |
| [7] |
NAROUEI KHANDAN H. Predicting the potential global distribution of Pseudomonas syringae pv.actinidiae (Psa)[M]. New Zealand: Plant Protection Confernce, 2013. DOI:10.30843/nzpp.2013.66.5601
|
| [8] |
钟彩虹, 李黎, 潘慧, 邓蕾, 陈美艳. 猕猴桃细菌性溃疡病的发生规律及综合防治技术[J]. 中国果树, 2020(1): 9-18. DOI:10.16626/j.cnki.issn1000-8047.2020.01.002 ZHONG C H, LI L, PAN H, DENG L, CHEN M Y. Occurrence rule and comprehensive control of kiwifruit bacterial canker disease[J]. China Fruits, 2020(1): 9-18. DOI:10.16626/j.cnki.issn1000-8047.2020.01.002 |
| [9] |
游雨欣, 戴德江, 罗金燕, 朱洁, 李斌. 猕猴桃溃疡病防治策略的研究现状与展望[J]. 浙江农业科学, 2022, 63(6): 1322-1328, 1331. DOI:10.16178/j.issn.0528-9017.20212933 YOU Y X, DAI D J, LUO J Y, ZHU J, LI B. Current status and perspectives of research on control strategies for kiwifruit ulcer disease[J]. Journal of Zhejiang Agricultural Sciences, 2022, 63(6): 1322-1328, 1331. DOI:10.16178/j.issn.0528-9017.20212933 |
| [10] |
赵贵丽, 柏松, 李向阳, 罗永高, 刘仕琴. 噬菌体生物防治猕猴桃细菌性溃疡病研究进展[J]. 农药, 2022, 61(11): 781-788, 794. DOI:10.16820/j.nyzz.2022.1032 ZHAO G L, BAI S, LI X Y, LUO Y G, LIU S Q. Research progress on phage-based biocontrol of kiwifruit bacterial canker[J]. Agrochemicals, 2022, 61(11): 781-788, 794. DOI:10.16820/j.nyzz.2022.1032 |
| [11] |
PEREIRA C, COSTA P, PINHEIRO L, BALCAO V M, ALMEIDA A. Kiwifruit bacterial canker: an integrative view focused on biocontrol strategies[J]. Planta, 2021, 253(2): 49. DOI:10.1007/s00425-020-03549-1 |
| [12] |
贺富胤, 石浩, 李凤华, 郭阳, 崔丽红, 王仁才. 湖南猕猴桃溃疡病致病菌的鉴定及植物源防治药剂的筛选[J]. 植物检疫, 2022, 36(2): 7-14. DOI:10.19662/j.cnki.issn1005-2755.2022.02.001 HE F Y, SHI H, LI F H, GUO Y, CUI L H, WANG R C. Identification of pathogenic bacteria of kiwifruit canker in Hunan and evaluation of botanical bactericides[J]. Plant Quarantine, 2022, 36(2): 7-14. DOI:10.19662/j.cnki.issn1005-2755.2022.02.001 |
| [13] |
秦虎强, 赵志博, 高小宁, 王强, 杜培龙, 黄丽丽. 四种杀菌剂防治猕猴桃溃疡病的效果及田间应用技术[J]. 植物保护学报, 2016, 43(2): 321-328. DOI:10.13802/j.cnki.zwbhxb.2016.02.021 QIN H Q, ZHAO Z B, GAO X N, WANG Q, DU P L, HUANG L L. Bactericidal activities of four bactericides and their field application against Pseudomonas syringae pv. actinidiae[J]. Journal of Plant Protection, 2016, 43(2): 321-328. DOI:10.13802/j.cnki.zwbhxb.2016.02.021 |
| [14] |
秦虎强, 赵志博, 高小宁, 杨彪, 徐国信, 黄丽丽. 猕猴桃细菌性溃疡病菌对17种杀菌剂的敏感性及不同药剂田间防效[J]. 西北农业学报, 2015, 24(9): 145-151. DOI:10.7606/j.issn.1004-1389.2015.09.022 QIN H Q, ZHAO Z B, GAO X N, YANG B, XU G X, HUANG L L. Bactericidal activities of seventeen bactericides and their field applications against Pseudomonas syringae pv. actinidiae[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2015, 24(9): 145-151. DOI:10.7606/j.issn.1004-1389.2015.09.022 |
| [15] |
邝瑞彬, 杨敏, 周陈平, 杨护, 黄柄雄, 魏岳荣. 7种生物药剂对百香果茎基腐病菌的抑菌效果试验[J]. 广东农业科学, 2022, 49(10): 104-111. DOI:10.16768/j.issn.1004-874X.2022.10.012 KUANG R B, YANG M, ZHOU C P, YANG H, HUANG B X, WEI Y R. Antifungal effects of seven biological fungicides against the pathogen causing stem rot disease in passion fruits[J]. Guangdong Agricultural Sciences, 2022, 49(10): 104-111. DOI:10.16768/j.issn.1004-874X.2022.10.012 |
| [16] |
蓝国兵, 何自福, 于琳, 汤亚飞, 李正刚, 邓铭光, 佘小漫. 16种杀菌剂对火龙果褐腐病菌抑菌持效期及田间防效试验[J]. 广东农业科学, 2019, 46(12): 95-101. DOI:10.16768/j.issn.1004-874X.2019.12.013 LAN G B, HE Z F, YU L, TANG Y F, LI Z G, DENG M G, SHE X M. Effective inhibition duration and field control effects of 16 fungicides against Neoscytalidium dimidiatum[J]. Guangdong Agricultural Sciences, 2019, 46(12): 95-101. DOI:10.16768/j.issn.1004-874X.2019.12.013 |
| [17] |
沈会芳, 蒲小明, 杨祁云, 张景欣, 孙大元, 林壁润. 香蕉细菌性软腐病防治药剂筛选试验[J]. 广东农业科学, 2020, 47(1): 98-104. DOI:10.16768/j.issn.1004-874X.2020.01.014 SHEN H F, PU X M, YANG Q Y, ZHANG J X, SUN D Y, LIN B R. Selection of bactericides for controlling bacterial soft rot of banana[J]. Guangdong Agricultural Sciences, 2020, 47(1): 98-104. DOI:10.16768/j.issn.1004-874X.2020.01.014 |
| [18] |
宋根苗, 蒋家珍, 邱立红. 噻霉酮和苯醚甲环唑混配对4种不同病原菌的增效作用[J]. 植物保护, 2012, 38(4): 171-175. DOI:10.3969/j.issn.0529-1542.2012.04.038 SONG G M, JIANG J Z, QIU L H. Synerg istic activity of benziothiazolinone/difenoconazole complex against four different fungi[J]. Plant Protection, 2012, 38(4): 171-175. DOI:10.3969/j.issn.0529-1542.2012.04.038 |
| [19] |
姚廷山, 周常勇, 胡军华, 冉春, 李鸿筠, 刘浩强, 肖田. 3种杀菌剂对柑桔溃疡病菌的室内毒力测定[J]. 江西农业大学学报, 2009, 31(6): 1026-1029. DOI:10.13836/j.jjau.2009200 YAO T S, ZHOU C Y, HU J H, RAN C, LI H J, LIU H Q, XIAO T. Toxicity of three fungicides to Xanthomonas axonopodis pv. citri[J]. Acta Agriculturae Universitatis Jiangxiensis, 2009, 31(6): 1026-1029. DOI:10.13836/j.jjau.2009200 |
| [20] |
曾荣. 噻霉酮防治西瓜细菌性果斑病和梨火疫病研究[D]. 南京: 南京农业大学, 2020. DOI: 10.27244/d.cnki.gnjnu.2020.002038. ZENG R. Control of bacterial fruit spot of watermelon and pear fire blight with benzothiazolinone[D]. Nanjing: Nanjing Agricultural University, 2020. DOI: 10.27244/d.cnki.gnjnu.2020.002038. |
| [21] |
刘原. 2种昆虫抗菌肽粗提物对猕猴桃溃疡病菌抑菌作用及猕猴桃溃疡病药剂防治试验[D]. 雅安: 四川农业大学, 2016. LIU Y. The bacteriostasis effect of two species of insect antimicrobial peptides crude extract on Pseudomonas syringae pv. actinidiae and the agent control experiments on kiwifruit bacterial canker[D]. Ya'an: Sichuan Agricultural University, 2016. |
| [22] |
王晓敏, 刘清国, 龚德勇. 新农药噻霉酮对芒果炭疽病的防治效果[J]. 贵州农业科学, 2013, 41(1): 90-92. DOI:10.3969/j.issn.1001-3601.2013.01.027 WANG X M, LIU Q G, GONG D Y. Control effect of benziothiazolinone on mango anthracnose[J]. Guizhou Agricultural Sciences, 2013, 41(1): 90-92. DOI:10.3969/j.issn.1001-3601.2013.01.027 |
| [23] |
曹凡, 高贵田, 雷玉山, 杜莹琳, 朱丹, 徐雅芬, 张晓萍, 李朝政, 张鑫. 3种药剂对猕猴桃花粉溃疡病菌灭菌及果实产量的影响[J]. 食品与机械, 2018, 34(1): 121-125. DOI:10.13652/j.issn.1003-5788.2018.01.024 CAO F, GAO G T, LEI Y S, DU Y L, ZHU D, XU Y F, ZHANG X P, LI Z Z, ZHANG X. Effect of three agents on the sterilization of kiwifruit pollen ulcer fungus and fruit yield[J]. Food and Machinery, 2018, 34(1): 121-125. DOI:10.13652/j.issn.1003-5788.2018.01.024 |
| [24] |
鄢明峰, 李诚, 王园秀, 赵尚高, 李帮明, 涂贵庆, 蒋军喜. 奉新县猕猴桃溃疡病病原菌鉴定[J]. 江西农业大学学报, 2019, 41(2): 243-248. DOI:10.13836/j.jjau.2019029 YAN M F, LI C, WANG Y X, ZHAO S G, LI B M, TU G Q, JIANG J X. Pathogen identification of kiwifruit bacterial canker in fengxin county of Jiangxi province[J]. Acta Agriculturae Universitatis Jiangxiensis, 2019, 41(2): 243-248. DOI:10.13836/j.jjau.2019029 |
| [25] |
侯温甫, 欧阳何一, 吴忌, 韩千慧, 周敏, 王宏勋. 曲酸对冷鲜鸭肉中优势腐败菌的抑制作用及其抑菌机理[J]. 食品科学, 2019, 40(1): 278-285. DOI:10.7506/spkx1002-6630-20180613-226 HOU W F, OUYANG H Y, WU J, HAN Q H, ZHOU M, WANG H X. Inhibitory effect of kojic acid on dominant spoilage bacteria in chilled duck meat and its mechanism[J]. Food Science, 2019, 40(1): 278-285. DOI:10.7506/spkx1002-6630-20180613-226 |
| [26] |
原红艳, 张淑香, 李兴启, 李树华. 丫啶橙- 碘化丙啶双染色法观察大鼠耳蜗基底膜毛细胞活性[J]. 听力学及言语疾病杂志, 2006, 24(5): 337-339. DOI:10.3969/j.issn.1006-7299.2006.05.018 YUAN H Y, ZHANG S X, LI X Q, LI S H. Observation of the role of acridine orange- propidium iodide in the identification of hair cell status in a laboratory condition[J]. Journal of Audiology and Speech Pathology, 2006, 24(5): 337-339. DOI:10.3969/j.issn.1006-7299.2006.05.018 |
| [27] |
GAO L Y, CHEN H M, CHEN W X, CHEN W J, JIAN H Y, ZHONG Q P, ZHANG M. Linalool against Hafnia alvei, its antibacterial mechanism revealed by metabolomic analyses[J]. Food Bioscience, 2023, 51: 102316. DOI:10.1016/j.fbio.2022.102316 |
| [28] |
吴美艳, 罗兴录, 樊铸硼, 刘继忠, 金相宇. 木薯抗细菌性枯萎病生理特性研究[J]. 南方农业学报, 2020, 51(6): 1353-1359. DOI:10.3969/j.issn.2095-1191.2020.06.015 WU M Y, LUO X L, FAN Z P, LIU J Z, JIN X Y. Physiological characteristics of cassava against bacterial blight[J]. Journal of Southern Agriculture, 2020, 51(6): 1353-1359. DOI:10.3969/j.issn.2095-1191.2020.06.015 |
| [29] |
朱斌, 叶铁虎, 牛浩. 原代培养大鼠海马细胞随培养时间早期凋亡和死亡增加[J]. 基础医学与临床, 2005, 25(2): 179-180. DOI:10.3969/j.issn.1001-6325.2005.02.018 ZHU B, YE T H, NIU H. Studies on early apoptosis and death of primary cultured neurons from hippocampi of newborn rat[J]. Basic & Clinical Medicine, 2005, 25(2): 179-180. DOI:10.3969/j.issn.1001-6325.2005.02.018 |
| [30] |
DAS G, BAEK K H, PATRA J K. Biofabrication of streptomycin-conjugated calcium phosphate nanoparticles using red ginseng extract and investigation of their antibacterial potential[J]. PLoS ONE, 2019, 14(6): e0217318. DOI:10.1007/s00425-020-03549-1 |
| [31] |
JAKUBOVICS N S, SMITH A W, JENKINSON H F. Oxidative stress tolerance is manganese (Mn) regulated in Streptococcus gordonii[J]. Microbiology (Reading), 2002, 148(10): 3255-3263. DOI:10.1099/00221287-148-10-3255 |
| [32] |
潘佳亮. 苦参碱对山核桃干腐病病原真菌(Botryosphaeria dothidea) 抑菌机制研究[D]. 哈尔滨: 东北林业大学, 2018. PAN J L. Antifungal mechanism of matrine to Botryosphaeria dothidea[D]. Harbin: Northeast Forestry University, 2018. |
| [33] |
万慧一. 菲律宾蛤仔(Ruditapes philippinarum)抑菌酶解物的制备与作用机理研究[D]. 青岛: 青岛大学, 2012. WAN H Y. Preparation and mechanism of action of clam inhibition enzymes in the Ruditapes philippinarum[D]. Qingdao: Qingdao University, 2012. |
(责任编辑 陈丽娥)
 2023, Vol. 50
2023, Vol. 50