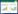文章信息
基金项目
- 国家重点研发计划项目(2021YFD1301205);河南省科技攻关项目(212102110378);河南省农业科学院自主创新项目(2023ZC055)
作者简介
- 王治方(1978—),男,副研究员,研究方向为畜禽疫病快速诊断与防控,E-mail:645843634@qq.com.
通讯作者
- 徐引弟(1974—),女,博士,副研究员,研究方向为动物病原微生物学,E-mail:445177674@qq.com.
文章历史
- 收稿日期:2023-02-21
【研究意义】副猪格拉菌(Glaesserella parasuis,GPS),原名副猪嗜血杆菌(Haemophilus parasuis, HPS),是一种革兰氏阴性、长短不一的多形态细小杆菌,属于巴氏杆菌科巴氏杆菌属,是引起猪革拉泽氏病的病原体[1-2]。GPS在全世界范围内广泛存在,可长期定殖于健康猪的上呼吸道,一般情况下不引起猪只发病,但当断奶、转群等应激因素导致机体抵抗力降低时,可作为原发病原或继发病原感染任何年龄、品种的猪,临床发病率一般为10%~15%,严重时死亡率可达50%以上。发病猪群主要表现为精神沉郁、食欲不振、被毛粗乱、四肢末端发绀、跛行、呼吸困难、颤抖、共济失调等;典型病例的剖检变化主要在腹膜、心包膜、胸膜,或关节面出现浆液-纤维素性或纤维素性化脓性炎症,胸腔、腹腔和心包积液增多,严重时可形成“绒毛心”,已成为当前养猪场最常见的细菌性病原之一[3-5]。【前人研究进展】GPS血清型较多,不同国家或地区的流行菌株血清型不同,菌株致病力和临床表现也不尽相同。菌株毒力与血清型有较大关联,普遍认为血清1、5、10、12、13、14型为高毒力菌株,血清2、4、15为中等毒力菌株;血清3、6、7、8、9、11型为无毒力菌株[6-7]。但近年来也有研究表明,GPS临床菌株毒力与血清型并不完全相关,同一血清型不同菌株的毒力不同甚至存在明显差异。不同地区GPS临床菌株耐药表型不同,同一地区菌株耐药性也呈现动态变化,大都表现出耐药增强趋势,导致GPS临床防控更加复杂[8-9]。【本研究切入点】目前有关GPS血清2型的报道较少,在河南地区的报道更少,而本实验室近年来不时从临床病例中分离到GPS血清2型,表明血清2型的危害越来越严重。【拟解决的关键问题】本试验对河南省焦作某规模化猪场的疑似GPS病例进行细菌病原分离培养、纯化,获得1株可疑病原菌,经形态观察、PCR鉴定、分型,证实该菌株为猪GPS血清2型;同时对该分离菌株的致病性、耐药性、毒力基因和耐药基因携带等部分生物学特性进行研究,旨在为GPS的临床防控提供参考。
1 材料与方法 1.1 试验材料1.1.1 病料 病料来源于2022年7月河南省焦作某规模化猪场保育猪群临床表现有发热、消瘦、被毛粗乱、喘气、部分猪关节肿大、跛行等症状的疑似病例,剖检症状典型的病猪,采集肺脏、肝脏、气管、心血和关节液等病料。
1.1.2 主要试剂 胰蛋白大豆琼脂(TSA)、胰蛋白大豆肉汤(TSB),购自美国BD Difco公司;细菌总DNA提取试剂盒、新生牛血清,购自生工生物工程(上海) 股份有限公司;烟酰胺腺嘌呤二核苷酸(辅酶Ⅰ,NAD),购自Hoffmann-La Roche有限责任公司;革兰氏染液试剂盒,购自珠海贝索生物技术有限公司;抗生素药敏纸片,购自杭州滨和微生物试剂有限公司;DL2000 DNA Marker、Premix TaqTM Mix等PCR试剂,均购自宝生物工程(大连)有限公司;相关引物均由生工生物工程(上海)股份有限公司合成。
1.1.3 试验动物 10只体质量250 g左右的健康豚鼠,购自郑州大学实验动物中心。
1.2 试验方法1.2.1 细菌分离、纯化 将无菌采集的发病猪气管、肺脏、心血等病料,分别接种于TSA平板(含5% 新生牛血清、0.001%NAD)上,37 ℃培养24~36 h;挑选无色透明针尖状可疑菌落于TSA平板上划线培养纯化,37 ℃培养24~36 h;挑取单个菌落涂片,革兰氏染色,镜检,通过扫描电子显微镜观察形态;分离菌于10 mL TSB(含5%新生牛血清、0.001%NAD)液体培养基中培养过夜,6 000 r/min离心5 min,PBS洗脱3次,用1.5 mL 2.5%戊二醛4 ℃固定4 h以上,送武汉赛维尔生物科技有限公司进行电镜观察。
1.2.2 菌株鉴定和分型 参照文献[10-12]设计扩增GPS 16S rRNA基因和GPS血清2型wzx基因的特异性引物(表 1)。挑取分离菌株于37 ℃培养30 h的培养物,按照DNA提取试剂盒说明书提取菌株DNA,用16S rRNA基因特异性引物和wzx基因引物对分离株DNA进行PCR扩增鉴定和分型。PCR扩增体系25 μL:2×Premix TaqTM Mix13 μL,上、下游引物各1 μL,ddH2O 8 μL,模板DNA 2 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性1 min、退火(退火温度见表 1)1 min、72 ℃延伸30 s,共35个循环;最后72 ℃延伸5 min。取5 μL PCR扩增产物,用1.0%琼脂糖凝胶电泳检测,凝胶成像系统下观察结果。回收PCR阳性产物送至北京擎科生物科技有限公司测序。
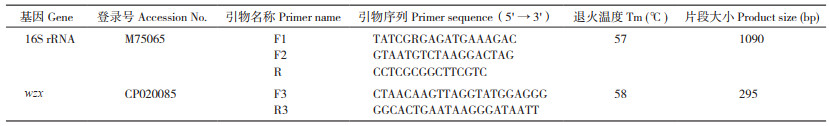
1.2.3 毒力基因检测 参照文献[13-14]设计扩增GPS部分毒力基因的引物(表 2),以分离菌株DNA为模板进行PCR扩增,检测分离菌株毒力基因携带情况,PCR扩增体系和扩增条件参照1.2.2。
1.2.4 致病性试验 将实验豚鼠随机分为试验组和对照组,每组5只。将分离菌株接种于TSB液体培养基中,37 ℃振荡培养18 h后测定菌体浓度,连续10倍稀释,选取合适滴度涂布TSA固体平板,每个滴度3个平板,每个平板100 μL,37 ℃培养36 h后活菌计数,计算原液菌体浓度,调整菌体浓度至1×109 CFU/mL备用。试验组豚鼠腹腔注射菌液1 mL/只;对照组豚鼠腹腔注射生理盐水1 mL/只。观察记录每组发病情况,连续观察5 d,对发病死亡豚鼠进行病理解剖、细菌分离鉴定。
1.2.5 药敏试验 采用琼脂扩散法(K-B法)[15],将分离菌株接种于TSA培养基平板,37 ℃培养30 h后挑取菌落,用灭菌PBS液调整成浓度为0.5麦氏单位菌悬液,用灭菌棉拭子将菌悬液均匀涂于TSA平板表面,挑取临床上常用的抗生素药敏片均匀贴于涂有菌液的平板上,37 ℃培养36 h后测量、记录药敏片抑菌圈直径,结果判断方法参照药敏片说明书。
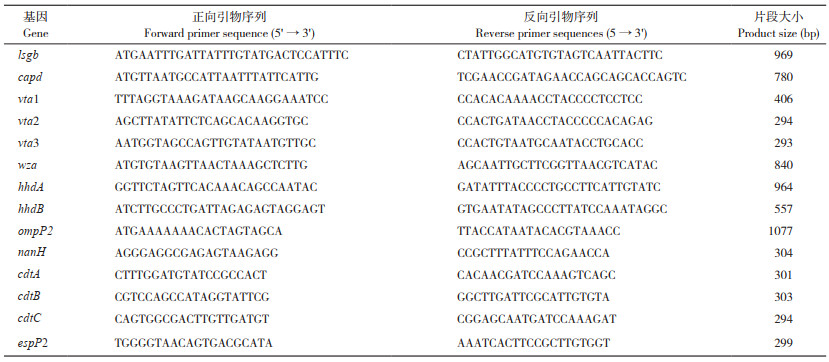
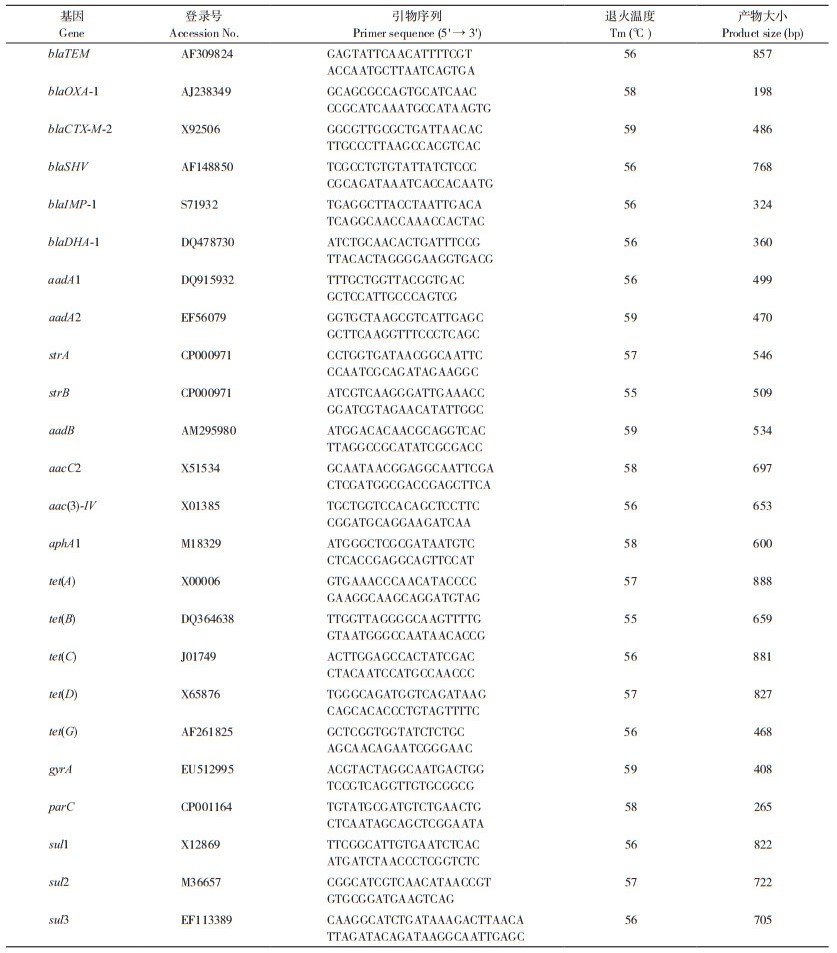
1.2.6 耐药基因检测 参照文献[16-17]设计引物(表 3),扩增β内酰胺类(blaTEM、blaOXA-1、blaCTX-M-2、blaSHV、blaIMP-1、blaDHA-1)、氨基糖甙类〔aadA1、aadA2、strA、strB、aadB、aacC2、aac(3)-IV、aphA1〕、四环素类〔tet(A)、tet(B)、tet(C)、tet(D)、tet(G)〕、喹诺酮类(gyrA、parC)和磺胺类(sul1、sul2、sul3)的耐药基因。以分离菌株DNA为模板进行PCR扩增,检测分离菌株携带耐药基因情况,PCR扩增体系和扩增条件参照1.2.2。
2 结果与分析 2.1 细菌分离培养纯化结果
通过细菌分离培养、纯化,在猪肺脏组织样品中分离获得1株疑似副猪格拉菌。该株细菌生长较缓慢,培养30 h后的菌落针尖大小,形态明显,呈圆形,表面光滑湿润,边缘整齐,半透明、略带蓝色荧光;接种于不含NAD的TSA平板,37 ℃培养均不能生长。挑取单个菌落涂片,革兰氏染色镜检,该菌株为革兰氏阴性球杆状、短杆状,有少量长丝状等多形态菌体(图 1A);扫描电镜下,菌体表面粗糙,呈短绳状(图 1B)。
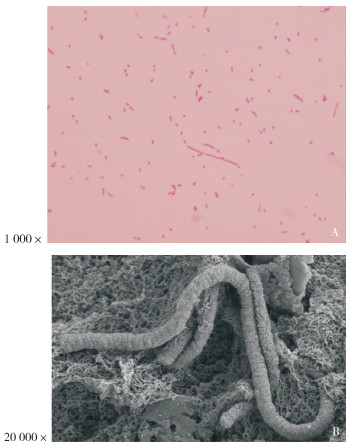
|
| 图 1 副猪格拉菌形态 Fig. 1 Morphology of Glaesserella parasuis |
2.2 菌株鉴定和血清型检测结果
通过PCR扩增鉴定,分离菌株扩增出大小分别为1 090、295 bp的产物带(图 2),条带和GPS、血清2型目的条带大小一致。PCR扩增产物的测序结果利用BLAST软件进行同源性比较发现,该菌株与GPS 2型CL120103菌株(CP020085.1)的同源性为100%,证明分离的菌株为副猪格拉菌,血清型为2型,暂命名为HN1553。
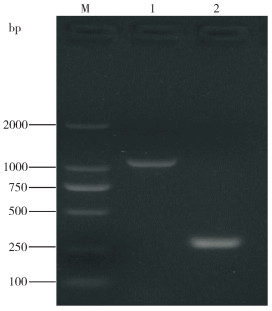
|
| M: DL2000 DNA Marker;1: 16S rRNA基因扩增产物;2: wza基因扩增产物 M: DL2000 DNA Marker; 1: 16S rRNA PCR product; 2: wza PCR product 图 2 菌株血清型PCR鉴定结果 Fig. 2 Identification and typing of strains by PCR |
2.3 毒力基因测定结果
PCR扩增检测HN1553菌株的毒力基因,结果(图 3)显示,vta1、vta2、vta3、wza、ompP2、nanH、cdtA、cdtB、cdtC、espP2毒力基因为阳性。
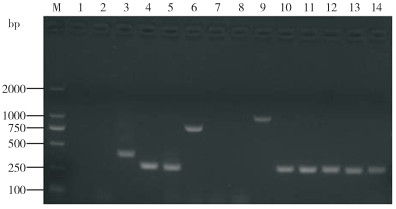
|
| M: DL-2000 DNA Marker;1: Lsgb;2: capd;3: vta1;4: vta2;5: vta3;6: wza;7: hhdA;8: hhdB;9: ompP2;10: nanH;11: cdtA;12: cdtB;13: cdtC;14: espP2 图 3 副猪格拉菌毒力基因PCR检测结果 Fig. 3 PCR results of virulence genes of Glaesserella parasuis |
2.4 致病性试验结果
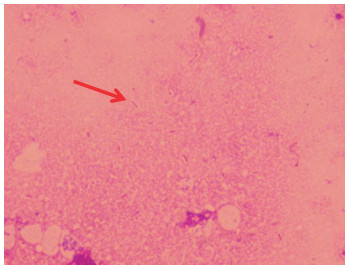
注射菌液3 h后,试验组的5只豚鼠先后出现食欲减退、被毛蓬乱、蜷缩扎堆、颤抖等症状;攻毒18~36 h,豚鼠先后死亡4只。对死亡豚鼠剖检,发现胸腔、腹腔少量积液,腹腔粘膜有新鲜出血斑点(图 4A),肝脏、脾脏有少量纤维性渗出物附着(图 4B)。用腹水、心血、肝脏、脾脏触片,革兰氏染色镜检均发现有革兰氏阴性细小杆菌(图 5)。无菌采集死亡豚鼠的心血、肝脏、脾脏、腹水、脑分别接种TSA平板,37 ℃培养30 h后,培养基平板均长出均一的针尖大小菌落,经鉴定均为GPS血清2型。试验组未死亡的发病豚鼠攻毒72 h后,被毛粗乱、扎堆等症状减轻,食欲好转;攻毒5 d后,症状消失,剖检豚鼠发现腹腔粘膜有少量陈旧性出血,肝脏、脾脏、腹腔有少量纤维素性渗出物,脾脏肿大;采集心血、肝脏、脾脏分别接种TSA平板,37 ℃培养48 h均未见细菌生长。试验期间,对照组豚鼠生长状态良好,未出现任何临床症状。
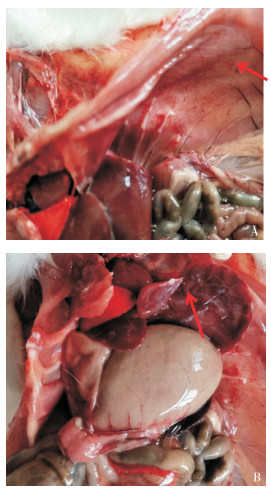
|
| A: 腹壁粘膜出血斑点;B: 肝脏纤维素性渗出物 A: Blemishes of mucous membrane in abdominal wall; B: Cellulose exudate in liver 图 4 死亡豚鼠剖检症状 Fig. 4 Necropsy symptoms of dead cavy |
|
| 图 5 肝脏的副猪格拉菌形态 Fig. 5 Morphology of Glaesserella parasuis in liver |
2.5 药敏试验结果
药敏试验结果(表 4)显示,菌株HN1553对头孢噻呋、头孢他啶、阿莫西林、氨苄西林、左氟沙星、氧氟沙星、恩诺沙星、环丙沙星敏感;对新霉素、强力霉素、诺氟沙星的敏感性处于敏感和耐药之间;对青霉素G、卡那霉素、阿米卡星、链霉素、四环素、土霉素、复方新诺明表现耐药。
2.6 耐药基因检测结果
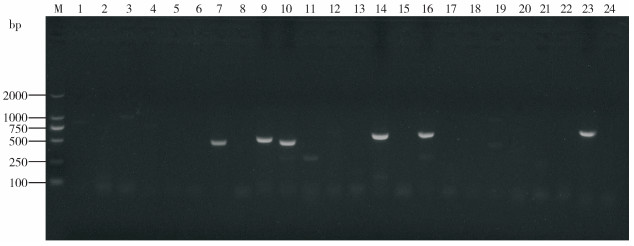
PCR扩增检测HN1553菌株的耐药基因,结果(图 6)显示,aadA1、strA、strB、aphA1、tet(B)、sul2基因扩增出现目的条带,与预期条带大小一致,证明HN1553菌株携带氨基糖苷类耐药基因aadA1、strA、strB、aphA1,四环素类耐药基因tet(B)和磺胺类耐药基因sul2。
|
| M: DL-2000 DNA Marker;1: blaTEM;2: blaOXA-1;3: blaCTX-M-2;4: blaSHV;5: blaIMP-1;6: blaDHA-1;7: aadA1;8: aadA2;9: strA;10: strB;11: aadB;12: aacC2;13: aac(3)-IV;14: aphA1;15: tet(A);16: tet(B);17: tet(C);18: tet(D);19: tet(G);20: gyrA;21: parC;22: sul1;23: sul2;24: sul3 图 6 副猪格拉菌耐药基因PCR检测结果 Fig. 6 PCR results of drug-resistant genes of Glaesserella parasuis |
3 讨论
副猪格拉菌是当前养猪业的主要细菌性病原之一,可长期定植于健康猪的上呼吸道,一旦机体抗体下降,就可突破机体防御体系,大量繁殖侵入机体不同脏器,引起局部病变或全身症状,给养猪生产造成不同程度的危害。本研究在河南焦作某猪场的疑似副猪格拉菌病例中,通过细菌分离、纯化、形态观察、PCR鉴定等技术手段,获得1株副猪格拉菌血清2型菌株HN1553。
细菌感染机体发病是细菌所有毒力基因共同参与的复杂动态过程,包括细菌粘附、侵入宿主、逃避防御、体内繁殖、组织损伤等[18]。副猪格拉菌毒力因子多,致病机理复杂,对HN1553菌株扩增检测14个常见毒力基因,其中10个毒力基因为阳性,说明该菌株携带有较多的毒力基因,多个毒力基因的协同作用使该菌株表现出较强的致病性。本研究利用豚鼠试验分析了菌株HN1553的毒力强弱,1×109 CFU/mL浓度菌悬液能使豚鼠100%发病,80%死亡,与贺云霞等[8]的试验结果一致。试验过程中,发病豚鼠均表现明显的临床症状,死亡豚鼠有较明显脏器病变,脏器触片染色能发现细菌,且能从肝脏、脾脏、脑等器官中分离出感染菌株,表明HN1553菌株对豚鼠有较强的致病性,且能够突破豚鼠的血脑屏障引起脑部感染。
疫苗免疫和抗生素使用是防控副猪格拉菌病的有效途径,但由于副猪格拉菌血清型之间交叉保护差,流行菌株和疫苗菌株血清型不一致,导致疫苗临床防疫效果不佳;同时养殖过程中长期不规范使用抗生素,导致细菌耐药性越来越严重,使得药物抗菌效果越来越差[19]。本研究利用纸片法筛选了菌株HN1553的敏感药物,发现该菌株对头孢噻呋、头孢他啶、头孢氨苄、阿莫西林头孢类药物敏感,与先前大部分研究结果相同;对左氟沙星、氧氟沙星、环丙沙星、恩诺沙星喹诺酮类药物敏感,与王治方等[20]、万世平等[21]报道结果相同,与王同兆等[22]试验结果不同。该菌株对青霉素G、阿米卡星、卡那霉素、链霉素、土霉素、四环素耐药;对复方新诺明完全耐药,与朱孟玲等[23]、史开志等[24]的研究结果一致。细菌耐药表型与其携带的耐药基因有一定关联性,利用PCR扩增技术对菌株HN1553进行耐药基因检测,发现该菌株携带有氨基糖苷类耐药基因aadA1、strA、strB、aphA1,四环素类耐药基因tet(B)和磺胺类耐药基因sul2,菌株耐药表型和耐药基因携带基本吻合。规模化猪场发生副猪格拉菌感染病时,应及时分离细菌,筛选敏感药物,是提高治疗效果和降低细菌耐药性的关键。此外,对细菌进行分型鉴定,有针对性地选择血清型相同的疫苗进行免疫接种,是防控该病的首选策略。
4 结论本试验对河南某猪场临床疑似副猪格拉菌病例猪只进行病原菌分离鉴定、敏感药物筛选及临床药物治疗预防效果分析,证实该猪场保育仔猪的临床症状是由副猪格拉菌血清2型菌株引起的。对该分离菌株HN1553的部分生物学特性进行研究,结果表明该菌株毒力较强,携带多个毒力基因和耐药基因,对头孢类药物和喹诺酮类药物敏感,对氨基糖苷类、四环素类和磺胺类药物耐药,表现出严重的多重耐药现象。本研究为副猪格拉菌血清2型流行病学、致病机制研究提供参考,为副猪格拉菌病的临床综合防控提供依据。
| [1] |
NI H B, GONG Q L, ZHAO Q, LI X Y, ZHANG X X. Prevalence of Haemophilus parasuis "Glaesserella parasuis" in pigs in China: a systematic review and meta-analysis[J]. Preventive Veterinary Medicine, 2020, 182: 105083. DOI:10.1016/j.prevetmed.2020.105083 |
| [2] |
张昆丽, 李春玲. 副猪嗜血杆菌病研究进展[J]. 广东农业科学, 2020, 47(12): 166-174. DOI:10.16768/j.issn.1004-874X.2020.12.017 ZHANG K L, LI C L. Research progress of Haemophilus parasuis[J]. Guangdong Agricultural Sciences, 2020, 47(12): 166-174. DOI:10.16768/j.issn.1004-874X.2020.12.017 |
| [3] |
LIU H, XUE Q, ZENG Q, ZHAO Z. Haemophilus parasuis vaccines[J]. Veterinary Immunology and Immunopathology, 2016, 180: 53-58. DOI:10.1016/j.vetimm.2016.09.002 |
| [4] |
李忍, 郭芳芳, 郭杰, 崔一芳, 曹晓亚, 徐福洲. 副猪嗜血杆菌血清4型和13型的分子血清分型研究[J]. 动物医学进展, 2021, 42(2): 6-11. DOI:10.16437/j.cnki.1007-5038.2021.02.002 LI R, GUO F F, GUO J, CUI Y F, CAO X Y, XU F Z. Molecular serotyping of Haemophilus parasuis serovar 4 and serovar 13[J]. Progress in Veterinary Medicine, 2021, 42(2): 6-11. DOI:10.16437/j.cnki.1007-5038.2021.02.002 |
| [5] |
黄润标, 李小军, 叶广胜, 吴寿军. 副猪嗜血杆菌的流行病学及预防保护研究进展[J]. 广东农业科学, 2010, 37(8): 175-177. DOI:10.16768/j.issn.1004-874X.2010.08.092 HUANG R B, LI X J, YE G S, WU S J. Progress in epidemiology, prevention and protection of Haemophilus parasuis[J]. Guangdong Agricultural Sciences, 2010, 37(8): 175-177. DOI:10.16768/j.issn.1004-874X.2010.08.092 |
| [6] |
王迪, 陈章, 邢刚, 何长生, 刘晓露, 魏建忠, 孙裴, 刘雪兰, 李郁. 89株副猪嗜血杆菌临床分离株血清型、基因型鉴定与分析[J]. 畜牧兽医学报, 2020, 51(11): 2802-2811. DOI:10.11843/j.issn.0366-6964.2020.22.019 WANG D, CHEN Z, XING G, HE C S, LIU X L, WEI J Z, SUN P, LIU X L, LI Y. Identification and analysis of serotype and genotype of 89 clinical isolates of Haemophilus parasuis[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(11): 2802-2811. DOI:10.11843/j.issn.0366-6964.2020.22.019 |
| [7] |
陶伟杰, 段笑笑, 赵辉, 刘佳卉, 赵远, 单虎, 张传美. 血清7型副猪嗜血杆菌的分离鉴定及生物学特性研究[J]. 动物医学进展, 2021, 42(12): 14-19. DOI:10.16437/j.cnki.1007-5038.2021.12.003 TAO W J, DUAN X X, ZHAO H, LIU J H, ZHAO Y, SHAN H, ZHANG C M. Isolation, identification and biological characteristics of a serotype 7 Haemophilus parasuis[J]. Progress in Veterinary Medicine, 2021, 42(12): 14-19. DOI:10.16437/j.cnki.1007-5038.2021.12.003 |
| [8] |
贺云霞, 徐慧, 叶飞, 孙慧玲, 王宏俊, 龚玉梅, 张莉, 黄秀芬, 张培君. 副猪嗜血杆菌15个血清型标准分离株对小鼠毒力的研究[J]. 黑龙江畜牧兽医, 2011, 17: 90-91. DOI:10.13881/j.cnki.hljxmsy.2011.17.060 HE Y X, XU H, YE F, SUN H L, WANG H J, GONG Y M, ZHANG L, HUANG X F, ZHANG P J. Study on the toxicity of 15 standard strains of Haemophilus parasuis serotypes to mice[J]. Heilongjiang Animal Science and Veterinary Medicine, 2011, 17: 90-91. DOI:10.13881/j.cnki.hljxmsy.2011.17.060 |
| [9] |
李飞跃, 陈坤鹏, 丁文文, 薛云, 王臣, 司丽芳, 赵战勤. 副猪嗜血杆菌小鼠毒力和仔猪毒力的相关性分析[J]. 畜牧兽医学报, 2020, 51(6): 1408-1418. DOI:10.11843/j.issn.0366-6964.2020.06.024 LI F Y, CHEN K P, DING W W, XUE Y, WANG C, SI L F, ZHAO Z Q. Correlation between virulence of Haemophilus parasuis in mice and piglet[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(6): 1408-1418. DOI:10.11843/j.issn.0366-6964.2020.06.024 |
| [10] |
徐引弟, 鲁杨超, 王治方, 张青娴, 朱文豪, 焦文强, 郎利敏, 王克领. 4型副猪嗜血杆菌的分离鉴定与生物学特性研究[J]. 黑龙江畜牧兽医, 2018(13): 131-134, 246. DOI:10.13881/j.cnki.hljxmsy.2017.06.0159 XU Y D, LU Y C, WANG Z F, ZHANG Q X, ZHU W H, JIAO W Q, LANG L M, WANG K L. Isolation, identification and biological characteristics of Haemophilus parasuis type 4[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(13): 131-134, 246. DOI:10.13881/j.cnki.hljxmsy.2017.06.0159 |
| [11] |
MA L, WANG L, CHU Y, LI X, CUI Y, CHEN S, ZHOU J, LI C, LU Z, LIU J, LIU Y. Characterization of Chinese Haemophilus parasuis isolates by traditional serotyping and molecular serotyping methods[J]. PLoS One, 2016, 11(12): e0168903. DOI:10.1371/journal.pone.0168903 |
| [12] |
ANGEN O, OLIVEIRA S, AHRENS P, AHRENS P, SVENSMARK, LESER T. Development of an improved species specific PCR test for detection of Haemophilus parasuis[J]. Veterinary Microbiology, 2007, 119(2/4): 266-276. DOI:10.1016/j.vetmic.2006.10.008 |
| [13] |
CHAO N VAN, TAM V T, ZOU G, ZOU G, JIA M, WANG Q, ZHANG L, DING W, HUANG Q, ZHOU R. Characterization of serotypes and virulence genes of Haemophilus parasuis isolates from Central Vietnam[J]. Veterinary Microbiology, 2019, 230: 117-122. DOI:10.1016/j.vetmic.2019.02.008 |
| [14] |
张青娴, 徐引弟, 王治方, 朱文豪, 焦文强, 李海利. 副猪嗜血杆菌河南分离株的优势血清型和毒力基因研究[J]. 养猪, 2020(6): 89-93. DOI:10.13257/j.cnki.21-1104/s.2020.06.028 ZHANG Q X, XU Y D, WANG Z F, ZHU W H, JIAO W Q, LI H L. Study on dominant serotypes and virulence genes of Haemophilus parasuis isolated in Henan[J]. Swine Production, 2020(6): 89-93. DOI:10.13257/j.cnki.21-1104/s.2020.06.028 |
| [15] |
谭美芳, 谭佳, 李海琴, 曾艳兵, 季华员, 方绍培, 杨群. 江西部分地区临床健康猪群中副猪嗜血杆菌的血清型鉴定及耐药性调查[J]. 江西农业大学学报, 2020, 42(5): 953-959. DOI:10.13836/j.jjau.2020107 TAN M F, TAN J, LI H Q, ZENG Y B, JI H Y, FANG S P, YANG Q. Serotyping and drug resistance investigation of Haemophilus parasuis in clinical healthy pigs in some areas of Jiangxi Province[J]. Acta Agriculturae Universitatis Jiangxiensis, 2020, 42(5): 953-959. DOI:10.13836/j.jjau.2020107 |
| [16] |
王庆云. 安阳地区副猪嗜血杆菌分离株的耐药性与耐药基因检测[J]. 动物医学进展, 2021, 42(4): 131-134. DOI:10.16437/j.cnki.1007-5038.2021.04.027 WANG Q Y. Drug resistance and drug resistance gene detection of Haemophilus parasuis isolates in Anyang area[J]. Progress in Veterinary Medicine, 2021, 42(4): 131-134. DOI:10.16437/j.cnki.1007-5038.2021.04.027 |
| [17] |
王治方, 徐引弟, 张青娴, 朱文豪, 焦文强, 李海利, 白红杰, 许峰, 王克领. 副猪嗜血杆菌4型分离株耐药表型及耐药基因分析研究[J]. 养猪, 2020(6): 97-101. DOI:10.13257/j.cnki.21-1104/s.2020.06.030 WANG Z F, XU Y D, ZHANG Q X, ZHU W H, JIAO W Q, LI H L, BAI H J, XU F, WANG K L. Analysis of drug resistance phenotype and gene of Haemophilus parasuis type 4 isolate[J]. Swine Production, 2020(6): 97-101. DOI:10.13257/j.cnki.21-1104/s.2020.06.030 |
| [18] |
张艳禾, 李婷, 谢芳, 李刚, 刘伟石, 王春来. 副猪嗜血杆菌相关毒力因子的研究进展[J]. 中国预防兽医学报, 2016, 38(10): 835-838. DOI:10.3969/j.issn.1008-0425.2016.10.17 ZHANG Y H, LI T, XIE F, LI G, LIU W S, WANG C L. Research progress of virulence factors related to Haemophilus parasuis[J]. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(10): 835-838. DOI:10.3969/j.issn.1008-0425.2016.10.17 |
| [19] |
黄啸, 张鹤营, 刘春贝, 潘源虎, 黄玲利, 刘振利, 郝海红. 副猪嗜血杆菌耐药流行性和耐药机制研究进展[J]. 动物医学进展, 2020, 41(9): 87-91. DOI:10.16437/j.cnki.1007-5038.2020.09.018 HUANG X, ZHANG H Y, LIU C B, PAN Y H, HUANG L L, LIU Z L, HAO H H. Progress on epidemic and molecular mechanism of antimicrobial resistance of Haemophilus parasuis[J]. Progress in Veterinary Medicine, 2020, 41(9): 87-91. DOI:10.16437/j.cnki.1007-5038.2020.09.018 |
| [20] |
王治方, 徐引弟, 朱文豪, 张青娴, 焦文强, 李海利, 许峰, 王克领. 副猪嗜血杆菌流行优势菌株调查和耐药性分析[J]. 中国兽医学报, 2019, 39(10): 1942-1946. DOI:10.16303/j.cnki.1005-4545.2019.10.10 WANG Z F, XU Y D, ZHU W H, ZHANG Q X, JIAO W Q, LI H L, XU F, WANG K L. Investigation and drug resistance analysis of predominant strains of Haemophilus parasuis[J]. Chinese Journal of Veterinary Science, 2019, 39(10): 1942-1946. DOI:10.16303/j.cnki.1005-4545.2019.10.10 |
| [21] |
万世平, 王建, 葛菲菲, 徐峰, 沈丽萍, 刘佩红, 费荣梅. 副猪嗜血杆菌上海株的分离鉴定及耐药特性的研究[J]. 广东农业科学, 2010, 37(8): 201-203. DOI:10.16768/j.issn.1004-874X.2010.08.095 WANG S P, WANG J, GE F F, XU F, SHEN L P, LIU P H, FEI R M. Isolation, identification and drug sensitivity research of Haemophilus parasuis Shanghai strains[J]. Guangdong Agricultural Sciences, 2010, 37(8): 201-203. DOI:10.16768/j.issn.1004-874X.2010.08.095 |
| [22] |
王同兆, 张付贤, 雷连成. 1株副猪嗜血杆菌血清4型的分离鉴定及耐药性分析[J]. 中国畜牧兽医, 2022, 49(3): 1096-1105. DOI:10.16431/j.cnki.1671-7236.2022.03.032 WANG T Z, ZHANG F X, LEI L C. Isolation, identification and drug resistance analysis of a strain of Haemophilus parasuis serotype 4[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(3): 1096-1105. DOI:10.16431/j.cnki.1671-7236.2022.03.032 |
| [23] |
朱孟玲, 刘庆新, 孙智远, 徐云明, 章琰, 王永娟. 镇江地区副猪嗜血杆菌分离鉴定血清型及耐药性检测[J]. 中国兽医杂志, 2019, 55(9): 43-46. ZHU M L, LIU Q X, SUN Z Y, XU Y M, ZHANG Y, WANG Y J. Isolation, identification, serotype and drug resistance of Haemophilus parasuis isolated from Zhenjiang area[J]. Chinese Journal of Veterinary Medicine, 2019, 55(9): 43-46. |
| [24] |
史开志, 杜春林, 王婧, 张静, 杨茂生, 李永明. 2013-2019年贵州省副猪嗜血杆菌分离株耐药性及其演变[J]. 中国畜牧兽医, 2020, 47(10): 3343-3350. DOI:10.16431/j.cnki.1671-7236.2020.10.034 SHI K Z, DU C L, WANG J, ZHANG J, YANG M S, LI Y M. Drug resistance and evolution of Haemophilus parasuis isolates from Guizhou province during 2013 to 2019[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(10): 3343-3350. DOI:10.16431/j.cnki.1671-7236.2020.10.034 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50