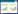文章信息
基金项目
- 国家自然科学基金青年基金(31601679)
作者简介
- 李英(1995-),女,在读硕士生,研究方向为微生物分子生物学,E-mail:1440776155@qq.com.
通讯作者
- 王允(1982-),男,博士,讲师,研究方向为微生物与植物互作,E-mail:1wangyun@yangtzeu.edu.cn.
文章历史
- 收稿日期:2021-04-19
【研究意义】植物多酚是广泛存在于植物体内的具有大量酚羟基结构单元的植物次生代谢产物,在传统工业中具有多种用途。近年来多酚的结构已被深入揭示[1]。多酚主要包括阿魏酸、水杨酸、咖啡酸等小分子酚酸类物质、黄酮类物质以及单宁类大分子物质,在谷类、蔬菜、水果、茶和红酒等日常食品中广泛存在膳食多酚。膳食多酚中最常见的酚酸类物质主要包括咖啡酸和阿魏酸,咖啡酸主要存在于蔬菜、水果中,而阿魏酸则主要存在于麦麸等谷类物质中[2]。阿魏酸是桂皮酸的衍生物,在植物细胞壁中与多糖和蛋白质结合,虽然含量很大,但不容易释放,需要经过消化或微生物水解后才可以被利用,因此膳食中的阿魏酸并没有被充分利用。研究表明,膳食多酚具有抗氧化、促进损伤修复、消炎、解毒、增强免疫功能等多种生物学活性,摄入富含多酚类的食物可降低多种慢性疾病的发生[3-5]。
【前人研究进展】肠道微生物能够合成人体生长发育所必需的维生素,并参与糖类、蛋白质和脂肪的代谢。菌群组成在体内维持平衡,一旦失衡会引起多种疾病[6-8]。研究表明,肠道微生物与动物及人类的健康关系密切,与肥胖、炎症反应、免疫调节和癌症治疗甚至与婴儿的智商和精神类疾病相关[9-11]。在不同条件下,肠道菌群的组成存在微妙的变化。研究发现,过度肥胖患者的肠道中壁厚菌门与变形菌门的丰度比显著提高[12-13]。而肠炎患者、肠易激综合征患者的肠道微生物总量升高,多样性显著降低,壁厚菌门与变形菌门的丰度比明显降低[14-15]。IIllumina测序方法确保了高精确度和真实的单碱基连续测序,为同重复序列的测定提供了很好的解决方案,能够在不同水平上对环境微生物的组成进行分析[16]。
肠道菌群维持在一种动态平衡状态,抗生素滥用会破坏种群平衡,增加炎症性疾病风险。酚类物质因其复杂的结构和聚合度,在小肠吸收量非常小,大部分多酚类物质会在结肠内微生物的作用下被消化并被机体吸收[17]。不同多酚类物质对不同菌群增殖有促进或抑制作用,从而对肠道菌群的结构和数量产生影响。果蔬多酚、茶多酚中的儿茶素以及蛋白核小球藻的活性生长因子均能促进益生菌生长,抑制类杆菌、葡萄球菌等有害菌生长,调节肠道菌群平衡,从而对人体的健康起调节作用[18]。【本研究切入点】多酚与肠道微生物存在相互促进作用,一方面膳食多酚可促进益生菌生长,抑制有害菌增殖,另一方面益生菌产生的益生元又能促进多酚在结肠中的吸收。目前,关于多酚与肠道微生物的相互作用研究比较多,但有关多酚对抗生素应激状态下动物的肠道微生物影响还未见报道。【拟解决的关键问题】本试验主要通过各种试剂盒检测小鼠血清中的生化和氧化相关酶类指标,并利用高通量测序分析其肠道微生物群落,研究了谷类多酚的主要物质阿魏酸对抗生素应激小鼠的血清抗氧化性及其肠道微生物群落多样性的影响。
1 材料与方法 1.1 试验材料阿魏酸、土霉素、红霉素、头孢羟氨苄,购自上海Macklin生化科技有限公司(中国);血清总蛋白试剂盒、丙二醛(MDA)试剂盒、过氧化氢酶(CAT)试剂盒、总超氧化物歧化酶(T-SOD)试剂盒、谷胱甘肽(GSH-PX)试剂盒、抗氧化活性(T-AOC)试剂盒、一氧化氮合酶(T-NOS)试剂盒、诱导型一氧化氮合酶(I-NOS)试剂盒,购自南京建成生物工程研究所。QIAamp DNA Stool Mini Kit,购自Qiagen公司(德国);其他试剂为国产分析纯。30只42日龄KM雄性小鼠,体重20(±2)g,由广东省动物实验中心提供。
1.2 试验方法1.2.1 试验分组处理 试验于2020年11月在湖北省长江大学生命科学学院进行。30只KM雄性小鼠在温度20~22 ℃、湿度45%~55% 的无菌洁净环境中适应喂养1周后,随机分为对照组、抗生素组、抗生素+ 阿魏酸组。每天灌喂对照组和抗生素组小鼠去离子水500 mg/kg,灌喂抗生素+ 阿魏酸组小鼠阿魏酸500 mg/kg,持续灌喂4周,每天保持正常饮水与进食。第5周开始在给予抗生素+ 阿魏酸组小鼠阿魏酸的同时,给抗生素组、抗生素+ 阿魏酸组灌喂混合抗生素,小鼠每天摄入的混合抗生素包含头孢羟氨苄100 mg/kg、土霉素300 mg/kg、红霉素300 mg/kg,每天灌喂1次,连续灌喂7 d,每天保持正常饮水与进食。
1.2.2 样品采集 试验35 d后剪掉小鼠胡须,摘除眼球采血,颈椎脱臼处死小鼠,并解剖取肝脏、脾脏、盲肠及其内容物。用1.5 mL离心管从小鼠左右眼眶处接取原血,冷冻离心机3 500 r/min离心10 min后取上清液即为血清。解剖取出小鼠脾脏,立即放入0.9% 生理盐水中洗净,并分别放进5 mL离心管中置于冰上备用。新鲜取出的盲肠立即用5 mL离心管盛装并置于冰上,取出内容物放入锡箔纸,并装入5 mL离心管,液氮速冻,置于-80 ℃冰箱中保存,备用。
1.2.3 生化指标和抗氧化指标测定 测定小鼠的血清总蛋白、T-AOC、CAT、T-SOD、GSH-PX、MDA、T-NOS、I-NOS,严格按照各试剂盒说明操作,并计算各指标值。
1.2.4 小鼠肠道菌群鉴定 每组各取5只小鼠的盲肠,将待测样品交派森诺生物科技有限公司(中国)进行肠道菌群鉴定分析。流程如下:首先提取样品细菌总DNA,然后以微生物核糖体RNA目标序列为靶点,设计16S rDNA的V3~V4区的特异性引物,等温扩增构建文库。构建好的文库经梯度稀释,利用Illumina MiSeq测序平台进行高通量测序,每组做4次重复。
1.2.5 高通量测序数据分析处理 测序数据先通过QIIME软件识别疑问序列,剔除不合格的序列。随后用USEARCH软件检查并剔除嵌合体序列。通过UCLUST软件对获得的合格序列以97% 的序列相似度进行操作分类单位(Operational taxonomic unit,OTU)划分,获得每个OTU分类学信息[19]。并利用R软件进行样本的Alpha多样性分析及基于UniFrac距离的PCoA主坐标分析,对小鼠肠道微生物进行菌群比较和关键物种筛选。
1.3 数据分析所有试验进行3次平行试验。试验数据利用SPSS13.0软件进行方差分析,并通过Tukey's进行多重比较。当P < 0.05则认为具有统计学显著差异。
2 结果与分析 2.1 阿魏酸对小鼠体重的影响经过适应性喂养1周后,各组小鼠的摄食量和平均体重如图 1所示。试验期间,各组小鼠的摄食量无明显差异,体重呈现稳步增长的趋势。与对照组相比,灌喂膳食多酚阿魏酸的小鼠体重无明显差异,说明在正常饮食的情况下,多酚对小鼠体重无显著影响。在第5周开始对抗生素组和抗生素+ 阿魏酸组小鼠灌喂抗生素,抗生素组小鼠体重略微下降,但与对照组和抗生素+ 阿魏酸组小鼠的体重无显著差异。脾脏是重要的免疫器官,免疫器官指数是评价动物免疫状况的关键指标之一,本研究参考甘霓等[20]的方法计算对照组、抗生素组、抗生素+ 阿魏酸组小鼠的脾脏指数,分别为5.38±0.18、4.28±0.22、5.54±0.63 mg/g。抗生素应激小鼠的脾脏指数显著低于对照组,说明抗生素对小鼠免疫系统产生了一定影响,而加入阿魏酸饲喂,小鼠的脾脏指数得到了一定程度的恢复。
|
| 图 1 不同处理小鼠的摄食量和平均体重变化 Fig. 1 Changes of food intake and average body weight of mice in different groups |
2.2 阿魏酸对小鼠血清抗氧化性的影响
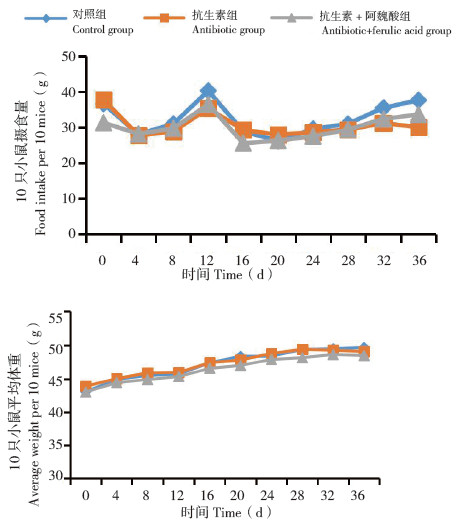
试验35 d后分别取对照组、抗生素组和抗生素+ 阿魏酸组小鼠的血清测定血清总蛋白、T-AOC、CAT、T-SOD、GSH-PX、MDA、T-NOS和I-NOS等指标。血清总蛋白来自食物吸收和肝脏合成,其功能是维持血液渗透压,并与物质运输,尤其是脂类转运功能相关。本研究3个处理组小鼠的血清总蛋白含量没有显著差异(图 2A)。由图 2B可知,抗生素组小鼠的总抗氧化能力相比于对照显著下降,而抗生素+ 阿魏酸组与对照无显著差异,相比抗生素组提高了56.36%。为明确具体哪些抗氧化因子与总抗氧化性的恢复相关,进一步测定CAT、T-SOD、GSH-PX、MDA(图 2C~F)。CAT在不同处理中无显著差异,而T-SOD和GSH-PX在抗生素组中的活性明显降低,阿魏酸对小鼠抗生素的负荷起到显著的改善效果,而且相比对照组,抗生素+ 阿魏酸组的T-SOD和GSH-PX活性还分别提高20.50% 和26.27%。此外,相比对照组,抗生素组小鼠血清中的MDA含量提升87.76%。
|
| 图 2 阿魏酸对抗生素应激小鼠血清抗氧化性的影响 Fig. 2 Effect of ferulic acid on serum antioxidation in antibiotic stressed mice 小写英文字母不同表示组间差异显著 Different lowercase letters represent significant differences between different groups |
T-NOS有3种亚型同功酶,分别为神经元型一氧化氮合酶(N-NOS)、内皮型一氧化氮合酶(E-OS)和诱导型一氧化氮合酶(I-NOS)。I-NOS仅在损伤后诱导表达,激活后可诱导动物持续大量释放过量的一氧化氮,活性氮氧增多引起脂质过氧化,诱发炎症反应[21]。由图 2G、H可知,无论T-NOS还是I-NOS在不同处理组中均表现出相同趋势,相对于对照组,抗生素组两种酶的活性分别提高了32.36% 和85.89%,而抗生素+ 阿魏酸组能够显著消除抗生素所带来的影响,与对照组无显著差异。
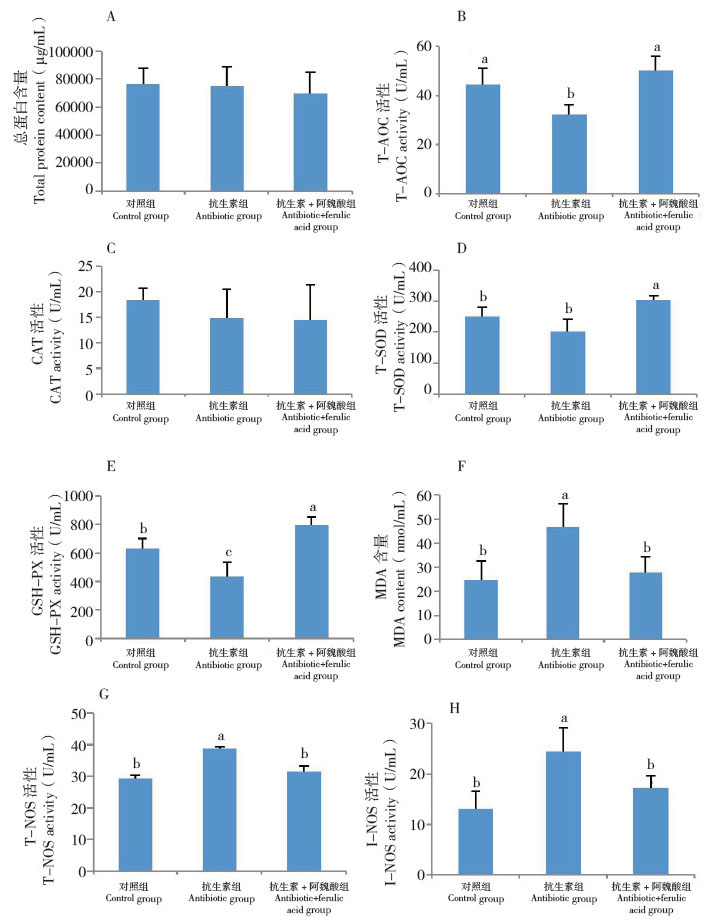
2.3 小鼠肠道菌群的Alpha多样性分析本试验分别随机选取了对照组、抗生素组和抗生素+ 阿魏酸组小鼠盲肠内容物通过Illumina MiSeq测序平台进行高通量测序。ACE估计指数和Chao1估计指数侧重于描述群落的丰富度,指数越高表明群落的丰富度越高。Simpson指数和Shannon指数更侧重于描述群落的多样性,指数越高表明其多样性越高。而本研究得到对照组、抗生素组和抗生素+ 阿魏酸组的Chao1指数分别为1 362.44、333.75和299.01,Shannon指数分别为7.71、3.70和4.41。可见,抗生素组相对于对照组的Chao1指数和Shannon指数均显著降低,且抗生素+ 阿魏酸组与抗生素组无显著差异。结果表明,抗生素应激小鼠的肠道微生物的丰度和多样性均下降,而添加阿魏酸并未能改善抗生素应激的影响。由图 3可见,抗生素组和抗生素+ 阿魏酸组的OUT受抗生素影响,且相比于对照组有明显降低,抗生素组和抗生素+ 阿魏酸组仍然具有259、215个独有的OUT,这揭示了抗生素和阿魏酸可能对小鼠肠道微生物群落的具体组成产生影响。
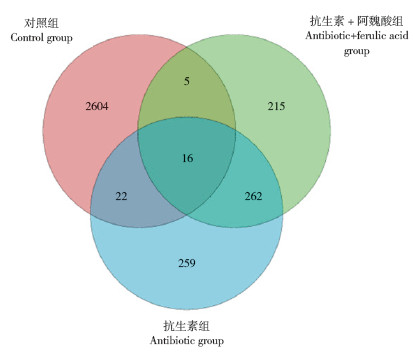
|
| 图 3 小鼠肠道菌群OTU的Venn图 Fig. 3 Venn map of intestinal microflora in mice |
2.4 小鼠肠道菌群的Beta多样性分析
为分析不同样本之间的群落结构相似性,对小鼠肠道菌群进行Beta多样性分析,通过比较群落各自独有OTU之间的系统发育关系,反映微生物群落之间的相似度。UniFrac距离有Unweighted和Weighted两种,Unweighted仅表示OTU在样本中是否存在,而Weighted则兼顾群落组分之间的系统发育关系和丰度。由图 4可见,肠道菌群结构相近的样本有聚集的倾向,说明群落成员组成和丰度均存在显著性差异。

|
| 图 4 小鼠肠道菌群Unweighted UniFrac距离(A)和Weighted UniFrac距离(B)的PCoA主坐标分析 Fig. 4 PCoA plots of Unweighted UniFrac distance values(A)and Weighted UniFrac distance values(B)of intestinal microflora in mice |
2.5 小鼠肠道微生物菌群结构分析
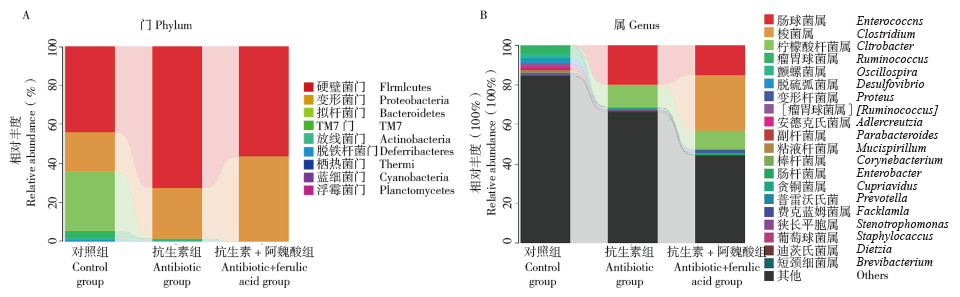
在门水平上,硬壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和TM7门微生物占微生物总量的98.6%。抗生素组的拟杆菌门、TM7门微生物在抗生素的作用下几乎消失,抗生素+ 阿魏酸组相比于抗生素组,硬壁菌门、变形菌门的丰度比值发生了变化(图 5)。在属水平上,由于Illumina MiSeq测序长度的限制,导致很多肠道微生物不能鉴定至属,因此大量的属被归类在其他组内。由图 5可以看出,对照组的群落组成具有多样性,而抗生素组和抗生素+ 阿魏酸组则较为单一,优势属分别为肠球菌属(Enterococcus)、梭菌属(Clostridium)和柠檬酸杆菌属(Citrobacter),相比于抗生素组,抗生素+ 阿魏酸组的梭菌属丰度显著提升。
|
| 图 5 小鼠肠道微生物在门(A)和属(B)水平上的相对丰度 Fig. 5 Relative abundance of intestinal microflora in mice at the phylum (A) and genus (B) level |
2.6 小鼠肠道微生物菌群差异物种比较
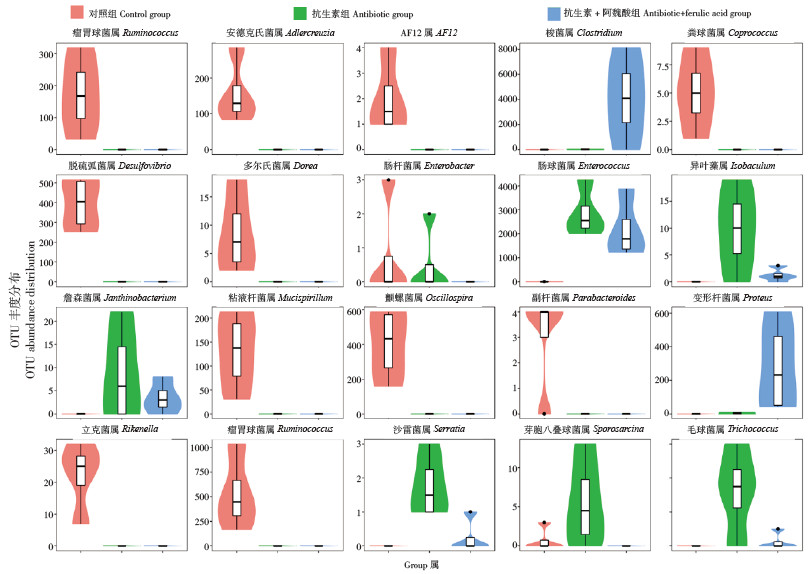
采用Metastats算法[22],分别在门和属水平上对OTU的组间绝对丰度差异进行两两比较,结果(表 1)显示,在门水平上,对照组与抗生素组有4个门存在差异,对照组与抗生素+ 阿魏酸组有5个门存在差异,而抗生素组与抗生素+ 阿魏酸组间无差异;在属水平上,对照组与抗生素组有16个属存在差异,对照组与抗生素+ 阿魏酸组有20个属存在差异,抗生素组与抗生素+ 阿魏酸组有14个属存在差异。图 6所示为属水平上对照组、抗生素组和抗生素+ 阿魏酸组之间差异最显著的前20个OTU的小提琴图。抗生素组和抗生素+ 阿魏酸组有存在显著差异的14个属包括梭菌属(Clostridium)、肠球菌属(Enterococcus)、沙雷菌属(Serratia)、毛球菌属(Trichococcus)、变形杆菌属(Proteus)、异叶藻属(Isobaculum)、污水菌属(Aquamicrobium)、鞘脂菌属(Sphingobium)、肠杆菌属(Enterobacter)、不动杆菌属(Acinetobacter)、费克蓝姆菌属(Facklamia)、短杆菌属(Brevibacterium)、芽胞八叠球菌属(Sporosarcina)和棒杆菌属(Corynebacterium)。
|
|
| 图 6 小鼠肠道微生物菌群组间属水平差异最显著的前20个OTU丰度分布 Fig. 6 Abundance distribution of 20 OTU with the most significant difference at genus level among different groups of intestinal microflora in mice |
3 讨论 3.1 阿魏酸对抗生素应激小鼠生长和抗氧化能力的影响
本研究供试的3组小鼠在体重变化趋势上无明显差异,进行抗生素灌喂前小鼠活跃好动,有互相打架现象,饮食量各组间无显著差异,粪便呈黑色、较硬。抗生素灌喂后,抗生素组出现嗜睡、懒动的症状,粪便呈米黄色、软糯;抗生素+ 阿魏酸组可能由于有膳食多酚的干预,相比抗生素组更为活跃。
自由基的过氧化效应与基因突变、色素形成、组织硬化、细胞损伤有关。动物机体具有氧化还原酶及防护系统,在终止过氧化的同时修复组织和细胞。机体的抗氧化系统是一个复杂且完善的系统,而抗生素滥用会破坏肠道微生物种群平衡,进而影响机体的抗氧化性及其他机能,增加各类疾病风险。T-AOC可直接反映机体抗氧化能力。CAT是生物体内主要的抗氧化酶之一,能够催化过氧化氢分解生成氧气和水,T-SOD对机体的氧化与抗氧化平衡起至关重要的作用,能清除氧离子自由基,从而保护细胞免受氧离子的伤害。GSH-PX蛋白具有清除脂质过氧化物的功能,可以通过其酶活性降低脂质过氧化物的毒性,维持膜脂质双分子层的稳态。本研究抗生素组小鼠连续1周混合抗生素饲喂后,小鼠的总抗氧化能力T-AOC减弱,说明抗生素会导致小鼠脂质氧化进而影响其代谢功能,而使用膳食多酚阿魏酸能够使其血液脂质氧化水平维持在对照组相近水平,降低抗生素所带来的部分负面影响。抗生素+ 阿魏酸组的T-SOD和GSH-PX活性与对照组相近,说明摄入一定时间阿魏酸后小鼠可以通过提高T-SOD和GSH-PX活性显著提高其血液的抗氧化能力。机体在逆境下往往发生膜脂过氧化反应,MDA是膜脂过氧化的最终分解产物,其含量可以反映损伤程度。MDA从膜上产生,改变膜的通透性,使得细胞膜结构和功能受到损伤,释放后可以使体内活性物质丧失功能,包括抑制蛋白质合成。抗生素使小鼠体内的MDA含量提升了87.76%,这种负面影响能够通过多酚阿魏酸的摄入恢复至对照水平。
3.2 阿魏酸对NO信号的影响NO是细胞中的抑制性信号分子之一,作用于肠道平滑肌,能够抑制肠道的收缩蠕动[23-24]。作为信使分子,NO在动物体内的功能多样,包括促进血管扩张、抑制血小板聚集、抑制细胞增殖,对细胞凋亡具有双重影响,还与糖尿病、心血管疾病、癌症等相关[25]。在氧化应激或炎症等情况下,细胞内的一氧化氮合酶(NOS)可持续催化合成大量的NO,高浓度的NO参与氧化应激、炎症反应以及免疫信号传导,在不同浓度下能够对机体产生多方面影响[26]。王建民等[27]研究显示,通过特定的药物可使大鼠血清中的NO、NOS水平显著提升,而通过中药益气健脾干预治疗后,大鼠的排泄症状得到明显改善,相应的信号分子NO的含量及NOS的活性显著降低。本研究结果与该结论相符,受抗生素影响,T-NOS和I-NOS的水平明显上升,膳食多酚阿魏酸干预能够降低小鼠受抗生素的影响,粪便由米黄色、软糯转变为黑色、较硬的正常状态,且小鼠运动活力明显恢复,与对照小鼠无明显差异。
3.3 阿魏酸对小鼠肠道微生物群落组成的影响肠道菌群微生态失衡会引起机体出现免疫性疾病、代谢性疾病和消化性疾病,多酚对维持肠道微环境的稳态有较大作用[28-29]。小鼠的胃和小肠细菌相对较少,盲肠内空物中主要以兼性厌氧菌为主,是微生物最丰富的位置,微生物的构成和粪便微生物的组成更接近,在肠道群落的分析方面具有一定代表性。本研究对小鼠肠道微生物的16S rDNA进行高通量测序,Alpha多样性分析表明,抗生素的使用使小鼠肠道微生物的丰度和多样性显著降低,阿魏酸的摄入并未改变样品的丰度和多样性,进一步的Beta多样性分析显示,肠道菌群结构相近的样本有聚集的倾向,说明群落成员在样品组成上存在差异。抗生素的使用导致拟杆菌门和TM7门的微生物基本消失,阿魏酸的摄入使抗生素应激小鼠体内的厚壁菌门与变形菌门的丰度比显著降低。Méndez-Salazar等[30]也发现,厚壁菌门与变形菌门的丰度比与糖脂代谢和炎症反应相关,该丰度比值高时表明肠道菌群丰度较低,反之菌群丰度较高,且与脂代谢相关。TM7是发现于自然环境中的革兰氏阳性不可培养细菌的一个亚群,据报道TM7的增殖与炎症反应具有重要关联[31]。本研究在属水平上可明显观察到,阿魏酸使抗生素应激小鼠的梭菌属丰度显著增加。贾增增[32]研究发现,梭菌属能够通过调节肠道内5-羟色胺的含量进而对消化过程起促进作用。
本研究样品组间差异性分析结果展示了在属水平上样本组间差异最显著的前20个OTU的丰度分布结果。芽胞八叠球菌属能够产生甘露聚糖酶、果胶酶等多种酶,并有报道其与白云石晶体形成相关[33]。本研究发现抗生素+ 阿魏酸组相对于抗生素组对菌群物种组成有明显的调节作用。肠球菌属是肠道内常见的一种条件致病菌,适量的菌体能发酵乳糖产乳酸,但当机体免疫缺陷时会引起化脓感染[34]。由于其对多种抗生素表现出固有耐药性,抗生素组和抗生素+ 阿魏酸组的肠球菌属丰度相比于对照均显著提高,且抗生素+ 阿魏酸组的丰度又显著低于抗生素组,说明阿魏酸可能通过抑制肠球菌属的过度增殖达到抑制肠道感染的作用。抗生素+ 阿魏酸组的变形杆菌属丰度相对其他两组均有显著提高,变形杆菌属为肠道正常菌群,一般情况不致病,在无氧环境下能够发酵纤维素和低聚寡糖产生短链脂肪酸,其丙酸、丁酸等能够对肠道的代谢和炎症反应产生积极影响[35]。
4 结论阿魏酸能够显著消除抗生素所带来的部分负面影响,包括上调多种与抗氧化活性相关的基因,使小鼠总抗氧化性水平相比抗生素组提高了56.36%,降低体内脂质氧化水平,并通过NOS调控NO的合成,刺激肠道收缩蠕动而促进消化。抗生素使小鼠的脾脏指数降低(4.28±0.22 mg/g),而阿魏酸使脾脏指数恢复至与对照组相近的水平(5.54±0.63 mg/g),说明阿魏酸对免疫器官起一定的正调节作用。抗生素对小鼠的肠道微生物群落结构产生较大影响,导致肠道微生物群落的丰度和多样性均显著降低,阿魏酸能够通过提高变形菌门与厚壁菌门的丰度比例,显著提高梭菌属并降低芽胞八叠球菌属和肠杆菌属丰度等多种方式,对肠道代谢、肠道微生态平衡和炎症反应等进行调控。本研究结果为阿魏酸作为改善因抗生素导致机体抗氧化能力降低及菌群失调的微生态制剂提供了理论基础。
| [1] |
宋立江, 狄莹. 植物多酚研究与利用的意义及发展趋势[J]. 化学进展, 2000, 12(2): 161-170. DOI:10.3321/j.issn:1005-281X.2000.02.005 SONG L J, DI Y. The significance and development trend in research of plant polyphenols[J]. Progress in Chemistry, 2000, 12(2): 161-170. DOI:10.3321/j.issn:1005-281X.2000.02.005 |
| [2] |
SHU B, WU G X, WANG Z N, WANG J M, HUANG F, DONG L H, ZHANG R F, WANG Y, SU D X. The effect of microwave vacuum drying process on citrus: drying kinetics, physicochemical composition and antioxidant activity of dried citrus(Citrus reticulata Blanco)peel[J]. Journal of Food Measurement and Characterization, 2020, 14: 2443-2452. DOI:10.1007/s11694-020-00492-3 |
| [3] |
万坤, 郭珍妮, 李思杰, 李英, 閤春梅, 苏东晓, 吴庆华, 王允. 体外消化对高粱壳酚类物质含量及其抗氧化活性的影响[J]. 食品科技, 2017, 42(3): 180-185. DOI:10.13684/j.cnki.spkj.2017.03.036 WAN K, GUO Z N, LI S J, LI Y, XIA C M, SU D X, WU Q H, WANG Y. Effects of simulated digestion on contents and antioxidants of phenolics of sorghum hull[J]. Food Science and Technology, 2017, 42(3): 180-185. DOI:10.13684/j.cnki.spkj.2017.03.036 |
| [4] |
陈建华, 谢艳颖. 茶多酚对壬基酚所致白鲫鱼胚胎发育毒性的改善作用[J]. 广东农业科学, 2019, 46(9): 135-141. DOI:10.16768/j.issn.1004-874X.2019.09.019 CHEN J H, XIE Y Y. Improvement of nonylpheol-induced embryonic development toxicity in Carassius auratus cuvieri by tea polyphenols[J]. Guangdong Agricultural Sciences, 2019, 46(9): 135-141. DOI:10.16768/j.issn.1004-874X.2019.09.019 |
| [5] |
谭琳, 周兆禧, 王甲水, 马伏宁, 康由发. 海南山竹果实不同部位多酚提取物抗氧化活性、乙酰胆碱酯酶和α-葡萄糖苷酶抑制活性研究[J]. 广东农业科学, 2018, 45(1): 102-107. DOI:10.16768/j.issn.1004-874X.2018.01.017 TAN L, ZHOU Z X, WANG J S, MA F N, KANG Y F. Antioxidant activity, acetylcholine esterase and α-Glucosidase inhibitory activity of the poly-phenol extractives from peel and pulp of Garcinia mangostana fruit grown in Hainan province[J]. Guangdong Agricultural Sciences, 2018, 45(1): 102-107. DOI:10.16768/j.issn.1004-874X.2018.01.017 |
| [6] |
DESBONNET L, CLARKE G, SHANAHAN F, DINAN T G, CRYAN J F. Microbiota is essential for social development in the mouse[J]. Molecular Psychiatry, 2014, 19(2): 146-148. DOI:10.1038/mp.2013.65 |
| [7] |
LOZUPONE C A, STOMBAUGH J I, GORDON J I, JANSSON J K, KNIGHT R. Diversity, stability and resilience of the human gut microbiota[J]. Nature, 2012, 489(7415): 220-230. DOI:10.1038/nature11550 |
| [8] |
曹战江, 于健春, 康维明, 马志强. 肥胖症肠道菌群与炎症的研究进展[J]. 中国医学科学院学报, 2013, 35(4): 462-465. DOI:10.3881/j.issn.1000-503X.2013.04.020 CAO Z J, YU J C, KANG W M, MA Z Q. Research advances in the gut microbiota and inflammation in obesity[J]. ACTA Academiae Medicinae Sinicae, 2013, 35(4): 462-465. DOI:10.3881/j.issn.1000-503X.2013.04.020 |
| [9] |
NGUYEN T T, ZHANG X, WU T-C, LIU J, LE C, TU X M, KNIGHT R, JESTE D V. Association of loneliness and wisdom with gut microbial diversity and composition: An exploratory study[J]. Frontiers in Psychiatry, 2021, 12(395): 648475. DOI:10.3389/fpsyt.2021.648475 |
| [10] |
HEYM N, HEASMAN B C, HUNTER K, BLANCO S R, WANG G Y, SIEGERT R, CLEARE A, GIBSON G R, KUMARI V, SUMICH A L. The role of microbiota and inflammation in self-judgement and empathy: implications for understanding the brain-gut-microbiome axis in depression[J]. Psychopharmacology, 2019, 236(5): 1459-1470. DOI:10.1007/s00213-019-05230-2 |
| [11] |
RASTMANESH R. High polyphenol, low probiotic diet for weight loss because of intestinal microbiota interaction[J]. Chemico-Biological Interactions, 2011, 189(1-2): 1-8. DOI:10.1016/j.cbi.2010.10.002 |
| [12] |
FABRICE A, MIREILLE H, BERNARD V, DENIS R, DIDIER R, RATNER A J. Monitoring bacterial community of human gut microbiota reveals an increase in Lactobacillus in obese patients and methanogens in anorexic patients[J]. PLOS ONE, 2009, 4(9): e7125. DOI:10.1371/journal.pone.0007125 |
| [13] |
TURNBAUGH P J, HAMADY M, YATSUNENKO T, CANTAREL B L, LEY R E. A core gut microbiom in obese and lean twins[J]. Nature, 2009, 457(7228): 480-484. DOI:10.1038/nature07540 |
| [14] |
MARKOWITZ J. Early inflammatory bowel disease: different treatment response to specific or all medications[J]. Digestive Diseases, 2009, 27(3): 358-365. DOI:10.1159/000228574 |
| [15] |
CUCCHIARA S, IEBBA V, CONTE M P. The microbiota in inflammatory bowel disease in different age groups[J]. Digestive Diseases, 2009, 27(3): 252-258. DOI:10.1007/s00535-015-1064-1 |
| [16] |
秦楠, 栗东芳, 杨瑞馥. 高通量测序技术及其在微生物学研究中的应用[J]. 微生物学报, 2011(4): 445-457. DOI:10.13343/j.cnki.wsxb.2011.04.013 QIN N, LI D F, YANG R F. Next-generation sequencing technologies a nd t he application in microbiolog y-A review[J]. Acta Microbiologica Sinica, 2011(4): 445-457. DOI:10.13343/j.cnki.wsxb.2011.04.013 |
| [17] |
APPELDOORN M M, VINCKEN J P, GRUPPEN H, HOLLMAN P. Procyanidin dimers A1, A2, and B2 are absorbed without conjugation or methylation from the small intestine of rats[J]. Journal of Nutrition, 2009, 139(8): 1469-1473. DOI:10.3945/jn.109.106765 |
| [18] |
田力, 邱丹缨, 温扬敏. 蛋白核小球藻对小鼠抗氧化及肠道细菌的影响[J]. 广东农业科学, 2021, 48(2): 138-145. DOI:10.16768/j.issn.1004-874X.2021.02.018 TIAN L, QIU D Y, WEN Y M. Effect of Chlorella pyrenoidosa on antioxidant and intestinal bacterial in mice[J]. Guangdong Agricultural Sciences, 2021, 48(2): 138-145. DOI:10.16768/j.issn.1004-874X.2021.02.018 |
| [19] |
EDGAR R C. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [20] |
甘霓, 许海林, 吴小勇, 尹辉, 黄延盛, 宁初光. 黑木耳多糖AAP-10对免疫抑制小鼠的免疫调节作用[J]. 食品科学, 2018, 39(19): 196-200. DOI:10.7506/spkx1002-6630-201819030 GAN N, XU H L, WU X Y, YIN H, HUANG Y S, NING C G. Auricularia auricula-judae polysaccharide AAP-10 and its immunoregulatory activity on immunosuppressed mice[J]. Food Science, 2018, 39(19): 196-200. DOI:10.7506/spkx1002-6630-201819030 |
| [21] |
黄业保. 六磨汤治疗慢传输型便秘的疗效及对肠道酶活性与NOS表达的影响[D]. 南宁: 广西中医药大学, 2019. DOI: 10.27879/d.cnki.ggxzy.2019.000115. HUANG Y B. The effect of Liumo Decoction on slow transit constipation and its effect on intestinal digestive enzyme activities and NOS expression[D]. Nanning: Guangxi University of Traditional Chinese Medicine, 2019. DOI: 10.27879/d.cnki.ggxzy.2019.000115. |
| [22] |
WHITE J R, NAGARAJAN N, POP M. Statistical methods for detecting differentially abundant features in clinical metagenomic samples[J]. Plos Computational Biology, 2009, 5(4): e1000352. DOI:10.1371/journal.pcbi.1000352 |
| [23] |
张文杰, 刘冬岩. 灯盏花素联合三七总苷对急性脑梗死大鼠模型tNOS, iNOS的影响[J]. 中国中医急症, 2011, 20(4): 603-604. DOI:10.3969/j.issn.1004-745X.2011.04.051 ZHANG W J, LIU D Y. Effects of breviscapine combined with Panax Notoginseng on tNOS and iNOS in rats with acute cerebral infarction[J]. Emergency of Traditional Chinese Medicine in China, 2011, 20(4): 603-604. DOI:10.3969/j.issn.1004-745X.2011.04.051 |
| [24] |
郝秀春, 李丽秋, 张晓波, 王春敏, 杨景云, 杨利敏. 双歧杆菌对菌群失调大鼠血清NO及NOS的影响[J]. 中国微生态学杂志, 2011, 23(2): 101-103. DOI:10.13381/j.cnki.cjm.2011.02.011 HAO X C, LI L Q, ZHANG X B, WANG C M, YANG J Y, YANG L M. The effect of Bifidobacterium on NO and NOS in dysbacteriosis rats serum[J]. Chinese Journal of Microecology, 2011, 23(2): 101-103. DOI:10.13381/j.cnki.cjm.2011.02.011 |
| [25] |
李依芃, 梁红霞, 胡桑. 一氧化氮在人体生理、病理过程中的作用及研究进展[J]. 河南大学学报(医学版), 2016, 35(2): 143-147. DOI:10.15991/j.cnki.41-1361/r.2016.02.021 LI Y P, LIANG H X, HU S. Development of the role of nitric oxide in physiological and pathological processes in the human body[J]. Journal of Henan University(Medical Science), 2016, 35(2): 143-147. DOI:10.15991/j.cnki.41-1361/r.2016.02.021 |
| [26] |
EUGSTER A, MURMANN P, KAENZIG A, BREITENMOSER A. Development and validation of a P-35S, T-NOS, T-35S and P-FMV tetraplex real-time pcr screening method to detect regulatory genes of genetically modified organisms in food[J]. Chimia, 2014, 68(10): 701-704. DOI:10.2533/chimia.2014.701 |
| [27] |
王建民, 王培森, 唐冉. 益气健脾通便方对慢传输型便秘大鼠Cajal间质细胞及一氧化氮、一氧化氮合酶的影响[J]. 安徽中医药大学学报, 2018, 37(1): 58-62. DOI:10.3969/j.issn.2095-7246.2018.01.018 WANG J M, WANG P S, TANG R. Effect of qi-tonifying, spleen-strengthening, an bowel-relaxing prescription on Cajal interstitial cells, nitric oxide, and nitric oxide synthase in rats with slow transit constipation[J]. Journal of Anhui Traditional Chinese Medical College, 2018, 37(1): 58-62. DOI:10.3969/j.issn.2095-7246.2018.01.018 |
| [28] |
FRICK J S, AUTENRIETH I B. The gut microflora and its variety of roles in health and disease[J]. Current Topics in Microbiology & amp; Immunology, 2013, 358: 273-289. DOI:10.1007/82_2012_217 |
| [29] |
刘冬敏, 黄建安, 刘仲华. 肠道微生物与茶及茶多酚的相互作用在调节肥胖及并发症中的作用[J]. 天然产物研究与开发, 2018(9): 1640-1648. DOI:10.16333/j.1001-6880.2018.9.028 LIU D M, HUANG J A, LIU Z H. The regulation effect of interaction between gut microbiota and tea and tea polyphenols in obesity and comorbidity[J]. Nat Prod Res Dev, 2018(9): 1640-1648. DOI:10.16333/j.1001-6880.2018.9.028 |
| [30] |
M & Eacute; NDEZ-SALAZAR E O, ORTIZ-L & Oacute; PEZ M G, GRANADOS- SILVESTRE M L & Aacute;, PALACIOS-GONZ & Aacute; LEZ B, MENJIVAR M. Altered gut microbiota and compositional changes in firmicutes and proteobacteria in mexican undernourished and obese children[J]. Frontiers in Microbiology, 2018, 9: 2494. DOI:10.3389/fmicb.2018.02494 |
| [31] |
KUEHBACHER T, REHMAN A, LEPAGE P, HELLMIG S, FOLSCH U R, SCHREIBER S, OTT S J. Intestinal TM7 bacterial phylogenies in active inflammatory bowel disease[J]. Journal of Medical Microbiology, 2008, 57(12): 1569-1576. DOI:10.1099/jmm.0.47719-0 |
| [32] |
贾增增. 梭菌属在运动改善功能性便秘中的作用研究[D]. 太原: 山西医科大学, 2019. JIA Z Z. Study on the function of Clostridium in improving functional constipation by exercise[D]. Taiyuan: Shanxi Medical University, 2019. |
| [33] |
宋泉颖, 徐俊, 张宇. 球形赖氨酸芽孢杆菌(Lysinibacillus sphaericus)和嗜冷芽孢八叠球菌(Sporosarcina psychrophila)介导形成白云石晶体[J]. 微生物学通报, 2014, 41(10): 2155-2165. DOI:10.13344/j.microbiol.china.140026 SONG Q Y, XU J, ZHANG Y. Dolomite precipitation mediated by Lysinibacillus sphaericus and Sporosarcina psychrophila[J]. Microbiol. China, 2014, 41(10): 2155-2165. DOI:10.13344/j.microbiol.china.140026 |
| [34] |
YERLIKAYA O, AKBULUT N. Some new approaches on biochemical and biotechnological properties of Enterococcus genus: a review[J]. Current Opinion in Biotechnology, 2011, 22: 93. DOI:10.1016/j.copbio.2011.05.290 |
| [35] |
刘松珍, 张雁, 张名位, 孙远明, 魏振承. 肠道短链脂肪酸产生机制及生理功能的研究进展[J]. 广东农业科学, 2013, 40(11): 99-103. DOI:10.16768/j.issn.1004-874X.2013.11.025 LIU S Z, ZHANG Y, ZHANG M W, SUN Y M, WEI Z C. Research progress on producing mechanism and physiological functions of intestinal short chain fatty acids[J]. Guangdong Agricultural Sciences, 2013, 40(11): 99-103. DOI:10.16768/j.issn.1004-874X.2013.11.025 |
 2021, Vol. 48
2021, Vol. 48