文章信息
基金项目
- 国家自然科学基金(31500045);广东省农业科学院高水平农科院建设-科技创新战略专项(R2021YJ-YB1004,R2020PY-JX019)
作者简介
-
吴绍文,博士,副研究员,硕士研究生导师。复旦大学化学生物学博士,美国宾夕法尼亚大学分子生物物理学博士后,现任中国农业科技华南创新中心公共实验室党支部书记。长期从事蛋白质动态变化和功能关系、作物质量安全控制与营养品质评价研究及计算代谢组学技术研发。主持或参与国家重点研发计划、国家自然科学基金面上项目、广东省“海外名师”、广州市基础与应用基础研究项目等10余项。研发了多项研究蛋白质与蛋白质及底物小分子相互作用机制的方法和策略,并将这些方法和策略应用于无序蛋白、ABC转运体底物结合蛋白等多种蛋白的功能机制研究中,揭示了多种类型的蛋白质构象运动和功能关系的详细信息,为靶向蛋白质的分子设计、基于蛋白构象变化的代谢工程提供了重要理论基础和新的思路。以第一作者(含并列)在《Angewandte Chemie International Edition》《Chemical Science》、《Communications Biology》等领域内重要期刊发表高水平论文8篇;参编专著1部;获授权国家发明专利2项。
吴绍文(1992—),男,博士,副研究员,研究方向为真菌毒素合成调控机理和检测技术,E-mail:wushaowen@agrogene.ac.cn; 晏石娟,博士,研究员,硕士研究生导师。现任广东省农业科学院农业生物基因研究中心副主任,作物品质控制与多组学技术创新团队的负责人。德国马普植物分子生理研究所和康奈尔大学生物技术研究所访问学者。先后获广东省特支计划科技创新青年拔尖人才、广东省农科院“青年研究员”“金颖之星”等人才称号。主要从事代谢组与蛋白质组学技术研发、作物品质性状形成机理与调控研究。主持承担国家自然科学基金、省重点研发计划等科研项目18项;研究成果发表学术论文共84篇,其中以第一作者或通讯作者(含并列)在《Plant Cell》《Trends in Plant Science》《Green Chemistry》等领域内重要期刊发表论文41篇;获授权专利12项。参编著作1部.
通讯作者
- 晏石娟(1983—),女,博士,研究员,研究方向为作物品质控制与多组学技术,E-mail:shijuan@agrogene.ac.cn.
文章历史
- 收稿日期:2022-09-30
真菌毒素是由曲霉属(Aspergillus)、青霉属(Penicillium)、镰刀霉菌属(Fusarium)、麦角菌属(Claviceps)等真菌产生的一类天然次生代谢产物。这些产毒真菌能够污染含油量高的种子(如花生、玉米)、谷物和坚果等,而这些农作物及其加工而成的农产品是人类与畜禽的主要食物来源,被食用真菌毒素污染的食物会导致癌症、免疫缺陷等多种疾病,危害人类生命健康[1-2]。目前,已经有数百种不同的真菌毒素被鉴定出来,其中对人类健康和牲畜造成严重危害的真菌毒素主要包括黄曲霉毒素(Aflatoxin,AF)、赭曲霉毒素(Ochratoxin,OT)、伏马菌素B(Fumonisin B,FB)、玉米赤霉烯酮(Zearalenone,ZEN)和脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)等。产毒真菌的生长可能发生在农作物及农产品收获前后、加工、运输和存储等过程中,而其产生的大多数真菌毒素的化学性质稳定,可以在食物链中残留[3]。在农产品贸易全球化和全球气候变暖的背景下,农产品存储和运输时间长、环境差异大等因素促使真菌毒素污染概率增加,从而导致国际贸易中的巨大经济损失。
由于真菌毒素是食品安全风险的常见因素,许多国家和组织都制定了农产品中真菌毒素的限量标准。例如,欧盟委员会规定,未加工谷物中黄曲霉毒素B1(AFB1)、赭曲霉毒素A(OTA)、FB、DON和ZEN的限量分别为2、5、4 000、1 250、100 μg/kg[4]。因此,真菌毒素高灵敏检测方法的研发对于防控真菌毒素污染至关重要。目前,常用的真菌毒素检测方法包括高效液相色谱法、色谱-质谱联用法和免疫测定法[5-7]。其中,免疫测定法基于抗原和抗体特异性结合的原理,具有低成本、高通量和高灵敏度等特点,且操作简便,对检测设备的要求较低,是真菌毒素大规模筛查的常用检测手段。
抗体是免疫测定法的核心试剂,针对真菌毒素的检测,人们已经研发了大量抗体,包括多克隆抗体、单克隆抗体和重组抗体等多种类型[4, 8]。常规的单克隆抗体和多克隆抗体由两条重链和两条轻链组成,其中重链包含3个恒定区(CH1、CH2、CH3)和1个可变区(VH),而轻链只包含1个恒定区(CL)和1个可变区(VL),重链和轻链的互补性决定区(CDR)有助于形成抗体的抗原结合表位(图 1)。在骆驼科和软骨鱼的血清中,存在一种缺乏轻链和CH1结构域的重链抗体(hcAb),其抗原结合位点由重链的可变区(VHH)形成。这些独特的VHH结构域能够通过重组蛋白表达的方式获得,是目前已知的抗原- 抗体相互作用的最小单元,由于其大小在纳米尺度,因此被称为纳米抗体(Nanobody,Nb)。与抗原结合片段(Fab)、单链可变片段(scFv)等重组抗体片段相比,纳米抗体具有相当或更强的抗原结合能力、优异的物理化学稳定性和折叠能力,且更容易进行遗传改造,这些特性使得纳米抗体成为用于免疫测定的极佳抗体试剂[9-10]。目前,已有许多与真菌毒素检测相关的纳米抗体被报道,这些抗体被广泛应用于真菌毒素检测技术的开发。本文围绕常见真菌毒素检测相关的纳米抗体研发现状进行总结,并分析基于纳米抗体开发的真菌毒素检测技术,以期为进一步开发高灵敏、低成本、易应用的真菌毒素检测方法提供线索和思路。
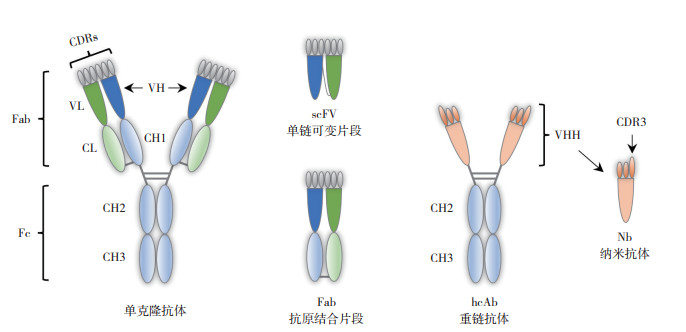
|
| 图 1 单克隆抗体、单链可变片段、抗原结合片段、重链抗体和纳米抗体的结构示意图 Fig. 1 Schematic structures of monoclonal antibody, single-chain variable fragment (scFV), antigen-binding fragment (Fab), heavy-chain-only antibody (hcAb) and nanobody (Nb) |
1 抗不同真菌毒素特异性纳米抗体的研发
用于真菌毒素检测的纳米抗体主要包括抗真菌毒素特异性抗体和抗真菌毒素单克隆抗体的独特型抗体两种类型(图 2),其中抗真菌毒素特异性纳米抗体可直接结合毒素小分子或其偶联的蛋白复合物,而抗独特型纳米抗体则通常结合真菌毒素的单克隆抗体。在已知的真菌毒素中,黄曲霉毒素和赭曲霉毒素由于毒性强、危害大、分布广等特点,被欧盟委员会列为致癌物质,并引起人们的广泛关注,进而在这两种真菌毒素的抗特异性纳米抗体和检测技术的研发上做了大量工作。
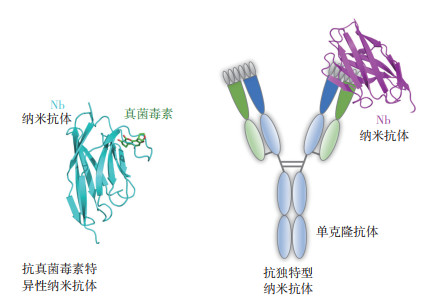
|
| 图 2 抗真菌毒素特异性纳米抗体和抗独特型纳米抗体的结构示意图 Fig. 2 Schematic structures of anti-mycotoxin nanobody and anti-idiotypic nanobody |
1.1 抗黄曲霉毒素纳米抗体
黄曲霉毒素主要由生长在土壤、腐烂植被、干草和谷物中的一些霉菌(特别是黄曲霉菌、寄生曲霉菌等)产生。这些霉菌容易污染谷物(如玉米、高粱、小麦和大米)、油料作物种子(如大豆、花生、向日葵和棉花种子)、香料作物(如辣椒、黑胡椒、芫荽、姜黄和生姜)、坚果(如开心果、杏仁、胡桃和巴西坚果)等及其加工而成的农产品(如陈皮) [1-2, 11]。目前已有20余种黄曲霉毒素被报道,主要包括AFB1、AFB2、AFG1和AFG2等4种类型[12]。此外,在饲喂受污染饲料后动物乳汁中也发现含有AFM1。黄曲霉毒素具有遗传毒性,可以造成DNA损伤,因此食用被黄曲霉毒素污染的食物与癌症的发病率呈正相关性,大剂量的黄曲霉毒素还可导致急性中毒甚至危及生命。
早在20世纪80年代,人们就开始了抗黄曲霉毒素单克隆抗体和多克隆抗体的研发,而抗黄曲霉毒素的纳米抗体则在近10年才取得突破[12]。2014年,He等[12]首次使用牛血清白蛋白BSA偶联的AFB1(AFB1-BSA) 免疫羊驼构建的VHH噬菌体展示文库,筛选得到两种抗AFB1的特异性纳米抗体NB26和NB28。基于这两种纳米抗体的酶联免疫吸附测定(ELISA)实验结果显示,其检测AFB1的半数抑制率(IC50)分别为0.754、1.012 ng/mL,表现出很强的AFB1结合能力。不同黄曲霉毒素的交叉反应实验结果显示,NB26和NB28对AFB2、AFG1、AFG2的交叉反应性均低于10%,而对AFM1的交叉反应性分别为1 0.75% 和32.7%,表明这两种纳米抗体结合AFB1的特异性均较强。进一步试验发现这两种纳米抗体的热稳定性和抗有机溶剂的特性明显优于传统单克隆抗体。在水稻、花生、玉米和饲料等实际样品的检测中,基于NB26的ELISA实验检测的回收率在80%~115%。上述结果表明,这两种抗AFB1的纳米抗体具有优异的检测能力。曹冬梅等[13-14]使用相似方法筛选得到抗AFB1的纳米抗体G8,其结合AFB1的能力比NB26和NB28稍弱,在最优的ELISA实验条件下测定结合的IC50值为4.61 ng/mL。
除上述提到的ELISA方法外,抗黄曲霉毒素特异性的纳米抗体还被广泛应用于不同免疫测定方法的开发,主要包括一步法酶联免疫吸附分析ALP-ELISA、生物发光酶联免疫分析BLEIA和磁性化学发光酶联免疫分析MCLEIA等。使用纳米抗体G8,曹冬梅等[13]开发了一种基于G8- 碱性磷酸酶ALP融合蛋白的ALP-ELISA。使用G8- 纳米荧光素酶NLUC融合蛋白,Ren等[15]开发了一种检测AFB1的BLEIA方法,通过对检测体系进行优化,使用这一方法检测AFB1的IC50值为0.41 ng/mL,低于ALP-ELISA和传统ELISA方法,检测灵敏度更高。使用生物素标记的纳米抗体NB26,Yan等[16]开发了一种基于生物素-链霉亲和素放大检测信号的BA-ELISA方法,该方法检测AFB1的IC50值为0.21 ng/mL,检测灵敏度得到进一步提高。通过筛选与纳米抗体NB28结合的多肽,以多肽模拟人工抗原,Zhao等[17]开发了一种基于磁珠快速定向竞争的MB-dcELISA方法,这一方法检测AFB1的IC50值为0.75 ng/mL。使用相似策略,Zou等[18]建立了一种直接非竞争性磁化学发光酶联免疫分析方法Nc-MCLEIA,将基于NB28免疫测定的IC50值降低至0.089 ng/mL,明显提高了AFB1检测的灵敏度。更为重要的是,He等[19]使用核磁共振和分子对接的方法解析了纳米抗体NB26的三维结构及其结合AFB1的可能机制,并根据NB26与AFB1的结合位点信息设计了NB28的突变体,用于提高其对AFB1的结合能力,其中基于NB28的A50V、S102D两个突变体的免疫分析检测灵敏度分别比野生型提高2.3倍和3.3倍。
近年来,纳米抗体与传感器联用的方法得到广泛关注。例如,Pan等[20]首次筛选了多个抗AFB1的纳米抗体NB30、NB33和NB70,尽管其未对这些纳米抗体结合AFB1的能力进行详细评估,但使用NB70制备的电化学免疫传感器(EC-immunosensor) 测定AFB1的检测限低至0.0033 ng/mL。而Liu等[21]将纳米抗体G8和辣根过氧化物酶HRP串联体修饰的杂交链反应信号放大系统相结合,构建了一种新型电化学竞争免疫传感器(ECC-immunosensor),其检测限低至68 fg/mL,且具有良好的检测特异性和稳定性。这些研究表明,将纳米抗体与其他材料相结合能够进一步拓宽其在真菌毒素检测方面的应用。
1.2 抗赭曲霉毒素纳米抗体赭曲霉毒素是由赭曲霉菌、碳曲霉菌等曲霉菌以及一些青霉菌产生的真菌毒素,主要包括OTA、OTB和OTC等类型,其中OTA是最常见的赭曲霉毒素,主要在谷物、葡萄酒、肉类、奶类和面包等农产品的储藏过程中形成[22]。OTA对人类健康具有多种毒性作用,包括明显的肾脏毒性、免疫毒性、致畸性和致突变性等,会导致肾癌等癌症,被国际癌症研究机构列为2B类致癌物,其对胎儿发育和免疫系统也有影响[23]。因此,许多国家均对农产品和食品中的OTA含量进行严格限定,如我国食品安全国家标准(GB 2761-2017)中规定谷物、豆类和坚果中的OTA限量为5 μg/kg,葡萄酒中的限量为2 μg/kg。
抗OTA纳米抗体的研发最早可以追溯到2014年,Liu等[24]从免疫羊驼获得的VHH文库中筛选得到VHH15、VHH28、VHH32和VHH36等4个抗OTA纳米抗体。其中,VHH28(也称NB28)在噬菌体ELISA实验中测定的IC50值为0.31 ng/mL,交叉反应实验显示其对OTB的交叉反应率为3.5%,表明NB28对OTA具有优异的选择性。基于这一抗体开发的实时免疫PCR(RT-IPCR) 在2.5% 的甲醇-PBS溶液中OTA检测限为3.7 pg/mL、线性范围IC20~80为0.01~1 000 pg/mL,在玉米、小麦和大米等实际样品中检测的回收率为80%~126%,表明基于NB28开发的方法具有优异的OTA检测能力。Sun等[25]开发了一种使用NB28-短肽AviTag融合蛋白检测OTA毒素的BA-ELISA方法,该方法检测OTA的IC50值为0.14 ng/mL、检测限为0.028 ng/mL,在大麦、燕麦和大米等实际样品中的OTA检测限分别为1.40、0.56、0.84 µg/kg。
为简化基于抗OTA纳米抗体的检测方法,Wang等[26]开发了基于Nb28- 碱性磷酸酶融合蛋白的AP-ELISA,该方法检测OTA的IC50值为0.46 ng/mL、检测限为0.12 ng/mL、线性范围为0.20~1.26 ng/mL。Tang等[27]开发了一种非竞争性的荧光共振能量转移免疫测定法(FRET immunoassay),实现了对OTA和OTB两种毒素的同时检测,这一方法对OTA和OTB的检测限分别为0.06、0.12 ng/mL;该作者还进一步搭建了基于FRET的免疫传感器(NbFRET immunosensor),这一传感器的检测限为5 pg/mL[28]。Li等[29]研发了一种基于纳米抗体和Au/CaCO3的新型电化学发光免疫测定法(ECIimmunosensor),该方法的检测限为5.7 pg/mL,接近于Nb-FRET immunosensor的检测限,实现了对OTA的超灵敏检测。
2021年以来,研究者们利用蛋白质工程开发了一系列更加简便的OTA检测方法。例如,Su等[30]基于Nb28-SGFP、SGFP-Nb28两种不同荧光蛋白- 纳米抗体融合蛋白,构建了OTA检测的荧光纳米传感器(FN-Nanosens),FN-Nanosens的检测限为5 pg/mL、线性范围为5~5 000 pg/mL。而Xie等[31]开发了一种基于纳米抗体/NanoBiT系统的生物发光免疫传感器(NBL-Immunosens),这一传感器检测OTA的IC50值为0.31 ng/mL、检测限为0.01 ng/mL、线性范围为0.04~2.23 ng/mL。以上两种传感器均可对OTA完成快速高灵敏检测。此外,Wang等[32]使用定向进化和饱和突变的方法获得NB28的双位点突变体G53Q & S102D,不同温度的测试实验显示G53Q & S102D突变体具有良好的耐热性,而使用野生型和这一突变体检测OTA的IC50值分别为0.41、0.29 ng/mL,表明突变体的检测灵敏度相比野生型约提高1.4倍。基于NB28突变体-碱性磷酸酶融合蛋白和MnO2纳米片,Zhang等[33]建立了酶级联放大免疫测定法(ECAIA)用于检测咖啡中的OTA,这一方法检测的IC50值为7.65 ng/mL、检测限为3.38 ng/mL,实现了对咖啡中OTA的高灵敏检测。综合来看,基于抗OTA纳米抗体NB28开发了多种快速、简便且灵敏度高的检测方法,借鉴这些思路开发其他真菌毒素的快速高灵敏检测方法是未来值得开展的研究。
1.3 其他真菌毒素的特异性纳米抗体目前,抗细交链孢菌酮酸(Tenuazonic acid,TeA)、异细交链孢菌酮酸(Iso-tenuazonic acid,ITeA)、DON和15- 乙酰基脱氧雪腐镰刀菌烯醇(15-Acetyldeoxynivalenol,15-AcDON) 等真菌毒素的特异性纳米抗体也有报道。细交链孢菌能够污染谷物和水果等农产品并产生TeA,TeA是一种独特的四酸衍生物,具有强效的真核蛋白质合成抑制活性,可阻止核糖体释放新合成的蛋白质,也是细交链孢菌产生的毒性最强的一种毒素。Wang等[34]使用噬菌体展示文库筛选得到一种抗TeA的特异性纳米抗体Nb-3F9,并基于这一抗体及其与NLUC的融合蛋白分别开发了ELISA、化学发光酶联免疫分析(CLEIA)和BLEIA等TeA检测技术,这些方法中ELISA检测的IC50值为54.8 ng/mL,CLEIA和BLEIA检测的IC50值分别为8.6 ng/mL和9.3 ng/mL,灵敏度比ELISA提高近6倍。ITeA是TeA的同分异构体,化学性质和毒性有所不同。Wang等[35]筛选得到一种抗ITeA的特异性纳米抗体B3G3,基于这一抗体建立的ELISA方法检测ITeA的IC50值为1.3 ng/mL,交叉反应实验结果表明其检测TeA的IC50值为19.8 ng/mL、交叉反应率为6.6%,显示出较好的ITeA结合特异性。
DON及其衍生物3- 乙酰脱氧雪腐镰刀菌烯醇(3-AcDON)和15-AcDON是谷物中常见的真菌毒素,主要由禾谷镰刀菌和亚洲镰刀菌在侵染小麦时产生[36]。动物和人类摄入含有DON的食物会导致恶心、胃肠不适、呕吐和腹泻等症状,乙酰化的DON由于在肠道中的吸收速度更快,故毒性比DON更强[37]。Doyle等[38]克隆、表达并表征了一种抗15-AcDON的特异性纳米抗体NAT-267,但这一抗体结合15-AcDON的能力较弱,荧光偏振分析实验(Fluorescence polarization,FP) 测定其结合的解离常数为1.24 μmol/L(即419.6 ng/mL)。进一步研究发现,将纳米抗体NAT-267在酵母细胞内表达能够明显降低15-AcDON对细胞的毒性[39]。随后,Tu等[40]使用噬菌体展示文库筛选得到抗DON的特异性纳米抗体B10、C8和C15,噬菌体ELISA实验发现B10结合DON的能力更强。上述研发的特异性纳米抗体在真菌毒素的检测方面表现出良好的性能和应用前景(表 1),因此,进一步研发其他常见真菌毒素的特异性纳米抗体并提高其应用性能,是未来值得开展的重要工作。
|
2 抗独特型纳米抗体在真菌毒素检测中的应用
抗独特型纳米抗体是一类可以与抗原竞争结合其一级抗体可变区的第二抗体,能够替代小分子化合物和蛋白偶联物用于免疫测定[41-42]。因此,相比于抗真菌毒素的特异性纳米抗体,抗独特型纳米抗体应用于真菌毒素检测时有一个明显优势,即可代替真菌毒素和蛋白偶联物作为抗原,从而降低检测的潜在风险,更加绿色环保[41]。抗独特型纳米抗体已经被广泛应用于常见真菌毒素的检测。
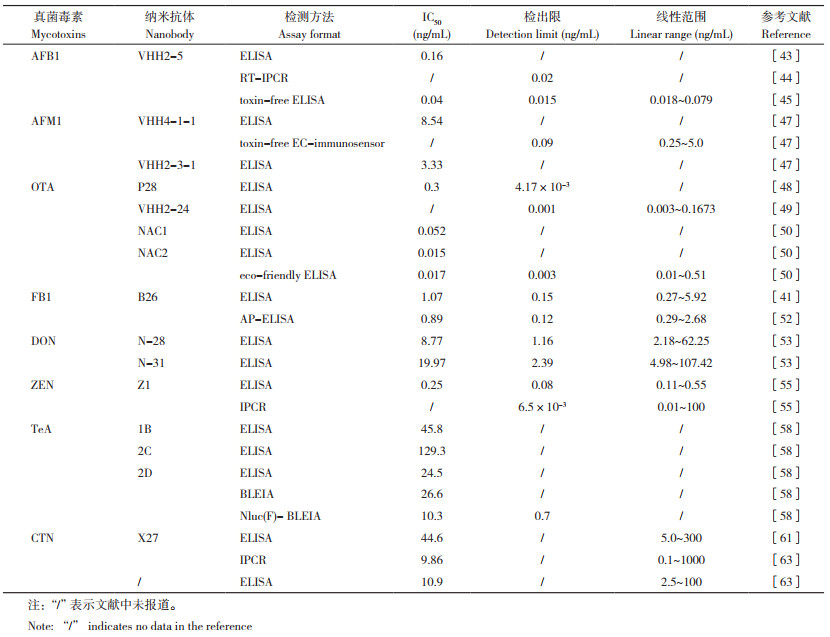
2.1 应用于黄曲霉毒素检测的抗独特型纳米抗体使用抗黄曲霉毒素单克隆抗体1C11免疫羊驼的噬菌体文库,Wang等[43]筛选得到3种抗独特型纳米抗体VHH2-5、VHH2-12和VHH2-29,并将其作为包被抗原应用于黄曲霉毒素的免疫分析。ELISA实验结果表明,单克隆抗体1C11和纳米抗体VHH2-5的组合能够识别AFB1、AFB2、AFG1、AFG2和AFM1等5种黄曲霉毒素,其中识别AFB1的灵敏度最高,检测的IC50值为0.16 ng/mL。基于含有VHH2-5的M13噬菌体及其编码DNA,Lei等[44]建立了一种用于检测农产品中黄曲霉毒素的RT-IPCR方法,这一方法的检测限为0.02 ng/mL,检测灵敏度优于传统的ELISA方法。随后,Wang等[45]通过建立VHH 2-5与AFB1之间的定量转换方程,研发了一种定量测定农产品中AFB1含量的方法(toxinfree ELISA),这一方法的灵敏度进一步提升,其检测限为0.015 ng/mL。此外,Lei等[46]基于VHH2-5 - 噬菌体体系研发了一种免疫环介导等温扩增(iLAMP)检测方法,能够完成对实际样本中黄曲霉毒素的现场检测。
Tang等[47]使用抗AFM1的单克隆抗体2C9筛选得到两种独特型纳米抗体VHH4-1-1和VHH2-3-1,ELIS A方法检测得到这些纳米抗体结合AFM1和2C9的IC50值分别为8.54 ng/mL和3.33 ng/mL;进一步使用纳米抗体VHH4-1-1功能化的丝网印刷碳电极,研发得到一种无毒电化学免疫传感器(Toxin-free EC-immunosensor),用于检测牛奶中的AFM1,结果表明这一传感器检测AFM1的线性范围为0.25~5.00 ng/mL、检测限为0.09 ng/mL,性能优异。
2.2 应用于赭曲霉毒素检测的抗独特型纳米抗体使用抗OTA的单克隆抗体和天然纳米抗体文库,Ji等[48]筛选得到抗独特型纳米抗体P28,基于P28的噬菌体ELISA实验显示其检测OTA的IC50值为0.3 ng/mL。使用抗OTA的单克隆抗体1H2,Zhang等[49]筛选得到其抗独特型纳米抗体VHH2-24,ELISA实验显示VHH2-24能够特异性地识别1H2,而不能结合抗AFB1、DON和ZEN的单克隆抗体,表明其具有良好的抗体结合特异性,基于VHH2-24的ELISA实验显示其检测OTA的线性范围为0.003~0.1673 ng/mL、检测限为0.001 ng/mL。使用相同的单克隆抗体1H2,Zhang等[50]筛选得到两种新的抗独特型纳米抗体NCA1和NCA2,序列分析发现,NCA1和NCA2两种纳米抗体在CDR区域有6个氨基酸不同,它们检测OTA的IC50值分别为0.052、0.015 ng/mL,表明NCA1的检测灵敏度比NCA2低。以上结果表明抗独特型纳米抗体CDR区域的氨基酸变化能够改变其结合亲和力从而提高免疫分析的灵敏度。随后,Zhang等[50]使用纳米抗体NCA2建立了一种环境友好的ELISA方法,用于快速检测谷物中的OTA含量,优化后的IC50值为0.017 ng/mL、检测限为0.003 ng/mL,这一方法在玉米、大米和小麦等实际样品上的平均检测回收率在80.0%~114.8%,具有良好的应用性。
2.3 应用于伏马菌素检测的抗独特型纳米抗体伏马菌素是一类由镰刀菌属和赤霉菌属侵染收获前或存储期间的农产品而产生的真菌毒素,目前已鉴定出10多种结构,其中伏马菌素B1 (FB1)的含量最高、毒性最强,能够引起癌症等多种疾病,并被国际组织列为2B类致癌物[41]。Shu等[41, 52]首先从抗FB1单克隆抗体的噬菌体展示文库中筛选得到其抗独特型纳米抗体B26,ELISA实验测定得到其检测FB1的IC50值为1.07 ng/mL,线性范围为0.27~5.92 ng/mL,其灵敏度约为基于FB1-BSA偶联物的ELISA方法的20倍(IC50值为21.14 ng/mL)。进一步交叉反应实验结果显示,基于纳米抗体B26的ELISA实验检测伏马菌素B2(FB2)的IC50值为27.67 ng/mL、交叉反应率为4.93%,表明B26具有很好的FB1结合特异性。使用玉米、大米和饲料等实际样本检测的结果显示,基于B26的ELISA方法的检测回收率为71.90%~112.15%,表明其适用于实际样品的检测。基于B26- 碱性磷酸酶融合蛋白,Shu等[52]进一步开发了用于FB1检测的AP-ELISA,这一方法检测的IC50值为0.89 ng/mL、线性范围为0.29~2.68 ng/mL,灵敏度略高于传统ELISA。
2.4 应用于脱氧雪腐镰刀菌烯醇检测的抗独特型纳米抗体为建立基于纳米抗体的环境友好型DON免疫分析方法,Qiu等[53]使用抗DON单克隆抗体和天然噬菌体展示文库筛选得到两种抗独特型纳米抗体N-28和N-31,ELISA实验结果表明这两种抗体检测DON的IC50值分别为8.77、19.97 ng/mL,检测灵敏度分别约为传统基于DON-BSA的ELISA方法(IC50值为163.69 ng/mL)的18、8倍;随后,作者又使用饱和诱变技术进行N-28的突变体筛选,并证实T102Y、V103L和Y105F等位点的突变能够进一步提高N-28检测DON的灵敏度[54]。
2.5 应用于玉米赤霉烯酮检测的抗独特型纳米抗体玉米赤霉烯酮(ZEN)是一种由禾谷镰刀菌、木贼镰刀菌和黄色镰刀菌等镰刀菌属合成的非甾体雌激素类真菌毒素,具有致畸性、遗传毒性、致癌性、肝毒性和免疫抑制等多种危害作用,也是谷物中常见的风险因素之一。为建立基于无毒替代试剂的ZEN免疫分析方法,Wang等[55]使用抗ZEN单克隆抗体和VHH噬菌体展示文库筛选得到纳米抗体Z1,这一纳米抗体具有很好的抗ZEN单克隆抗体结合能力;该作者利用纳米抗体Z1建立了间接竞争噬菌体ELISA方法,结果显示该方法检测ZEN的IC50值为0.25 ng/mL、线性范围为0.11~0.55 ng/mL,相比于传统的基于ZENBSA的方法灵敏度提高26倍。而使用这一纳米抗体建立的噬菌体展示介导的IPCR方法检测限更低(6.5 pg/mL)、线性范围为0.01~100 ng/mL,比噬菌体ELISA方法的灵敏度更高、检测范围更宽[55]。此外,Tang等[56]使用两种抗独特型纳米抗体建立了一种能够同时检测AFB1和ZEN的时间分辨荧光免疫层析法,这一方法的最大特点是实现了两种真菌毒素的同时检测,其IC50值分别为0.46、0.86 ng/mL。随后,Ren等[57]又开发了一种双功能噬菌体展示IPCR技术用于同时检测AFB1和ZEN,这一方法检测AFB1和ZEN的IC50值分别为0.43、2.12 ng/mL,检测限为0.03、0.15 ng/mL;试验表明这一方法可以同时检测小麦、大米、玉米和饲料样品中的AFB1和ZEN,拓宽了抗独特型纳米抗体在真菌毒素检测中的应用范围。
2.6 应用于其他真菌毒素检测的抗独特型纳米抗体除上述常见的真菌毒素外,还有一些关于TeA和橘霉素(Citrinin,CTN)的抗独特型纳米抗体的研究。例如,Wang等[58]使用抗TeA的单克隆抗体3F10和噬菌体展示文库筛选得到用于TeA检测的独特型纳米抗体1B、2C和2D,ELISA实验测定其检测TeA的IC50值分别为45.8、129.3、24.5 ng/mL,表明纳米抗体2D的检测灵敏度最高。Wang等[58]进一步使用2D-NLUC和2D- 铁蛋白-NLUC建立了TeA检测的BLEIA方法,其中铁蛋白能够形成24个分子的聚合体,因此被认为能够进一步增强检测灵敏度;结果显示,基于2D-NLUC的BLEIA实验检测的IC50值为26.6 ng/mL,而基于2D- 铁蛋白-NLUC的BLEIA实验检测的IC50值为10.3 ng/mL,灵敏度相比于2D-NLUC提高约2.5倍。
CTN是一种由曲霉属、青霉属和红曲属等多种菌种产生的真菌毒素,主要存在于谷物、豆类、水果、蔬菜、草药和香料以及其他植物中,且通常与其他真菌毒素尤其赭曲霉毒素共存[59]。已有研究表明CTN具有肾毒性,且能够通过氧化应激参与诱导细胞凋亡[60]。为建立基于抗独特型纳米抗体的CTN检测技术,Xu等[61]使用抗CTN的单克隆抗体和天然噬菌体VHH展示文库筛选得到纳米抗体X27,基于这一抗体建立的ELISA方法检测CTN的IC50值为44.6 ng/mL、线性范围为5.0~300.0 ng/mL,其灵敏度是传统ELISA方法的2倍。Xu等[62]还研发了另一种用于CTN检测的抗独特型纳米抗体,其ELISA检测的IC50值为10.9 ng/mL,灵敏度进一步提高。Huang等[63]使用纳米抗体X27建立了CTN检测的IPCR方法,其IC50值为9.86 ng/mL、线性范围为0.1~1 000 ng/mL,该方法检测灵敏度提高、且检测范围更宽。目前已开发出多种常见真菌毒素的抗独特型纳米抗体,这些抗体在多种方法中表现出很好的检测性能(表 2),但是基于抗独特型纳米抗体的新的检测方法开发相对较少,是未来值得开展的研究工作。
|
3 总结与展望
随着我国社会经济的不断发展,人们的食品消费观念正在快速转变,由“吃得饱”向“吃得好”、“吃得营养”、“吃得健康”转变,而要满足人们“吃得健康”的需求则必须加强食品安全监管。根据联合国粮农组织统计,全球每年约有25% 的农产品受到真菌毒素污染。此外,很多中药如柏子仁、槟榔、地龙等也容易受真菌毒素的污染。中药在我国人民群众生命健康和社会经济发展中发挥着特殊作用,近年来国家也加强了对中药中真菌毒素限量的监管,如《中国药典(2015版)》明确了其收载的19味中药中黄曲霉毒素含量的限值,并在《中国药典(2020版)》中将限制的中药品种提高到24味。我国对真菌毒素污染的监管必将进一步加强,因此迫切需要建立快速、灵敏、成本低且适用于多种毒素同时大规模检测的方法。
近年来,在噬菌体展示技术和蛋白质工程等方法的推动下,多种常见真菌毒素相关的纳米抗体和检测方法被成功研发。就特定的真菌毒素而言,黄曲霉毒素和赭曲霉毒素有多种抗特异性和抗独特型纳米抗体及相关的检测方法被开发出来。伏马菌素、玉米赤霉烯酮和脱氧雪腐镰刀菌烯醇的抗独特型纳米抗体研究较多,但其抗特异性纳米抗体的研究很少。抗独特型纳米抗体相比于抗特异性纳米抗体的优势在于其能够替代真菌毒素-蛋白偶联物作为抗原的特性,使得检测体系更环保,但是需要使用单克隆抗体进行检测,考虑到单克隆抗体通常无法体外表达,在检测成本上未必具有优势。目前,还尚未见到基于这两种纳米抗体的检测技术在稳定性、应用性和检测成本等方面的详细比较,值得未来进一步探索。
从检测方法来看,相比于传统的ELISA方法,ALP-ELISA、BLEIA、荧光和免疫传感器以及实时免疫PCR等方法的灵敏度均有提升,检测参数也均能满足实际检测的需求。其中,纳米抗体-ALP、纳米抗体-NLUC融合蛋白均能通过体外表达体系获得,且检测所需的设备简单,适合应用于大规模筛查。其中,NLUC能够在催化底物存在而不需要其他辅助因子的条件下发出高强度荧光,反应条件简单,但催化底物的成本偏高。因此,通过蛋白质工程、小分子设计等方法改造NLUC及其催化底物,从而研发出一套成本更低、灵敏度更高的生物发光体系,有望进一步提升其在一步法酶联免疫分析技术中的应用性。
从检测的真菌毒素种类来看,目前免疫分析测定大多数针对单个真菌毒素,少数方法能够实现两种真菌毒素的同时检测。然而,现实农业生产过程中农产品的污染往往是多种真菌毒素同时存在,建立一种能够实现多种真菌毒素同时检测的免疫分析技术无疑具有重要意义。另外,建立多种真菌毒素同时检测的免疫分析技术依赖于高性能的纳米抗体,而许多常见的真菌毒素仍然没有抗特异性纳米抗体的研究报道,已有报道的纳米抗体也还存在一些应用的缺陷。并且真菌毒素均为小分子化合物,从噬菌体展示文库中筛选理想的纳米抗体具有较高的难度。因此,利用抗体研发的新技术,进一步开发具有高亲和力和稳定性的纳米抗体极具有挑战性,也是拓展纳米抗体在真菌毒素检测中应用能力的重要方向。
近年来,抗体和小分子结合机制分析技术、抗体结合多肽的筛选和设计技术、蛋白质理性设计、定向进化、饱和突变和虚拟筛选等前沿技术迅猛发展,为真菌毒素相关纳米抗体的研发和改造提供了全新思路。已有研究表明,通过突变体筛选和设计的方式能够提高纳米抗体的真菌毒素结合能力和稳定性,因此通过实验和计算方法表征真菌毒素与抗体结合的分子机制、解析参与结合的关键氨基酸和相互作用力,从而得到抗体与真菌毒素的结合界面信息,对抗体的设计和改造具有重要作用。基于抗体和真菌毒素结合界面的信息,一方面,可以指导抗体结合多肽的实验和计算筛选,根据结合界面的氨基酸性质,设计和优化多肽文库,以得到高亲和力和稳定性的多肽,并进一步开发基于抗体-模拟肽的真菌毒素检测方法;另一方面,可以指导纳米抗体的定向进化和饱和突变文库的设计,针对结合界面的氨基酸进行突变,能够更高效地筛选高亲和力的纳米抗体突变体,针对结合界面以外的不稳定氨基酸进行突变,能够进一步筛选高稳定性的突变体甚至研发全新的抗真菌毒素纳米抗体,这些研究是未来非常值得尝试的方向。
| [1] |
CACERES I, KHOURY A A, KHOURY R E, LORBER S, OSWALD I P, KHOURY A E, ATOUI A, PUEL O, BAILLY J D. Aflatoxin biosynthesis and genetic regulation: A review[J]. Toxins (Basel), 2020, 12(3): 150. DOI:10.3390/toxins12030150 |
| [2] |
刘峰良, 赵志辉, 谢晶. 谷物中真菌毒素的研究进展[J]. 广东农业科学, 2012, 39(19): 115-119. DOI:10.16768/j.issn.1004-874X.2012.19.028 LIU F L, ZHAO Z H, XIE J. Research progress of mycotoxins in cereals[J]. Guangdong Agricultural Sciences, 2012, 39(19): 115-119. DOI:10.16768/j.issn.1004-874X.2012.19.028 |
| [3] |
PICKOVA D, OSTRY V, MALIR J, TOMAN J, MALIR F. A review on mycotoxins and microfungi in spices in the light of the last five years[J]. Toxins (Basel), 2020, 12(12): 789. DOI:10.3390/toxins12120789 |
| [4] |
WANG J, MUKHTAR H, MA L, PANG Q, WANG X. VHH antibodies: reagents for mycotoxin detection in food products[J]. Sensors (Basel), 2018, 18(2): 485. DOI:10.3390/s18020485 |
| [5] |
SHUIB N S, MAKAHLEH A, SALHIMI S M, SAAD B. Determination of aflatoxin M1 in milk and dairy products using high performance liquid chromatography-fluorescence with post column photochemical derivatization[J]. Journal of Chromatography A, 2017, 1510: 51-56. DOI:10.1016/j.chroma.2017.06.054 |
| [6] |
TRIPATHI P, UPADHYAY N, NARA S. Recent advancements in lateral flow immunoassays: A journey for toxin detection in food[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(10): 1715-1734. DOI:10.1080/10408398.2016.1276048 |
| [7] |
NUALKAW K, POAPOLATHEP S, ZHANG Z, ZHANG Q, GIORGI M, LI P, LOGRIECO A F, POAPOLATHEP A. Simultaneous determination of multiple mycotoxins in swine, poultry and dairy feeds using ultra high performance liquid chromatography-tandem mass spectrometry[J]. Toxins (Basel), 2020, 12(4): 253. DOI:10.3390/toxins12040253 |
| [8] |
HE T, ZHU J, NIE Y, HU R, WANG T, LI P, ZHANG Q, YANG Y. Nanobody technology for mycotoxin detection in the field of food safety: urrent status and prospects[J]. Toxins (Basel), 2018, 10(5): 180. DOI:10.3390/toxins10050180 |
| [9] |
MUYLDERMANS S, BARAL T N, RETAMOZZO V C, DE BAETSELIER P, DE GENST E, KINNE J, LEONHARDT H, MAGEZ S, NGUYEN V K, REVETS H, ROTHBAUER U, STIJLEMANS B, TILLIB S, WERNERY U, WYNS L, HASSANZADEH-GHASSABEH G, SAERENS D. Camelid immunoglobulins and nanobody technology[J]. Veterinary Immunology and Immunopathology, 2009, 128(1-3): 178-183. DOI:10.1016/j.vetimm.2008.10.299 |
| [10] |
翟艳芳, 岳锋, 王选年. 纳米抗体技术及其在食品安全检测中的应用[J]. 广东农业科学, 2020, 47(5): 112-118. DOI:10.16768/j.issn.1004-874X.2020.05.015 ZHAI Y F, YUE F, WANG X N. Nanobody technology and its application in food safety detection[J]. Guangdong Agricultural Sciences, 2020, 47(5): 112-118. DOI:10.16768/j.issn.1004-874X.2020.05.015 |
| [11] |
王帆, 乙引, 杨占南, 罗世琼, 余正文, 叶俊. 陈皮中黄曲霉毒素测定及其安全评价[J]. 广东农业科学, 2012, 39(3): 84-86. DOI:10.16768/j.issn.1004-874X.2012.03.019 WANG F, YI Y, YANG Z N, LUO S Q, YU Z W, YE J. Determination of aflatoxin from citrus reticulata blanco and its safety evaluation[J]. Guangdong Agricultural Sciences, 2012, 39(3): 84-86. DOI:10.16768/j.issn.1004-874X.2012.03.019 |
| [12] |
HE T, WANG Y, LI P, ZHANG Q, LEI J, ZHANG Z, DING X, ZHOU H, ZHANG W. Nanobody-based enzyme immunoassay for aflatoxin in agro-products with high tolerance to cosolvent methanol[J]. Analytical Chemistry, 2014, 86(17): 8873-8880. DOI:10.1021/ac502390c |
| [13] |
曹冬梅, 许杨, 涂追, 李燕萍, 熊亮, 付金衡. 基于纳米抗体-碱性磷酸酶融合蛋白的一步酶联免疫吸附分析法检测黄曲霉毒素B1[J]. 分析化学, 2016, 44(7): 1085-1091. DOI:10.11895/j.issn.0253-3820.150902 CAO D M, XU Y, TU Z, LI Y P, XIONG L, FU J H. One-step enzyme linked immunosorbent assay for detection of aflatoxin B1 using a nanobody-alkaline phosphatase fusion protein[J]. Chinese Journal of Analytical Chemistry, 2016, 44(7): 1085-1091. DOI:10.11895/j.issn.0253-3820.150902 |
| [14] |
曹冬梅, 许杨, 涂追, 付金衡, 李燕萍, 王显显. 抗黄曲霉毒素B1纳米抗体的原核表达、纯化及活性分析[J]. 食品与发酵工业, 2016, 42(5): 19-24. DOI:10.13995/j.cnki.11-1802/ts.201605004 CAO D M, XU Y, TU Z, FU J H, LI Y P, WANG X X. Prokaryotic expression, purification and bioactivity analysis of nanobody against AFB1[J]. Food and Fermentation Industries, 2016, 42(5): 19-24. DOI:10.13995/j.cnki.11-1802/ts.201605004 |
| [15] |
REN W, LI Z, XU Y, WAN D, BARNYCH B, LI Y, TU Z, HE Q, FU J, HAMMOCK B D. One-step ultrasensitive bioluminescent enzyme immunoassay based on nanobody/nanoluciferase fusion for detection of aflatoxin B1 in cereal[J]. Journal of Agricultural and Food Chemistry, 2019, 67(18): 5221-5229. DOI:10.1021/acs.jafc.9b00688 |
| [16] |
YAN T, ZHU J, LI Y, HE T, YANG Y, LIU M. Development of a biotinylated nanobody for sensitive detection of aflatoxin B1 in cereal via ELISA[J]. Talanta, 2022, 239: 123125. DOI:10.1016/j.talanta.2021.123125 |
| [17] |
ZHAO F, TIAN Y, SHEN Q, LIU R, SHI R, WANG H, YANG Z. A novel nanobody and mimotope based immunoassay for rapid analysis of aflatoxin B1[J]. Talanta, 2019, 195: 55-61. DOI:10.1016/j.talanta.2018.11.013 |
| [18] |
ZOU W, SHI R, WANG G, ZHAO Z, ZHAO F, YANG Z. Rapid and sensitive noncompetitive immunoassay for detection of aflatoxin B1 based on anti-immune complex peptide[J]. Food Chemistry, 2022, 393: 133317. DOI:10.1016/j.foodchem.2022.133317 |
| [19] |
HE T, NIE Y, YAN T, ZHU J, HE X, LI Y, ZHANG Q, TANG X, HU R, YANG Y, LIU M. Enhancing the detection sensitivity of nanobody against aflatoxin B1 through structure-guided modification[J]. International Journal of Biological Macromolecules, 2022, 194: 188-197. DOI:10.1016/j.ijbiomac.2021.11.182 |
| [20] |
PAN D, LI G, HU H, XUE H, ZHANG M, ZHU M, GONG X, ZHANG Y, WAN Y, SHEN Y. Direct Immunoassay for facile and sensitive detection of small molecule aflatoxin B1 based on nanobody[J]. Chemistry, 2018, 24(39): 9869-9876. DOI:10.1002/chem.201801202 |
| [21] |
LIU X, WEN Y, WANG W, ZHAO Z, HAN Y, TANG K, WANG D. Nanobody-based electrochemical competitive immunosensor for the detection of AFB1 through AFB1-HCR as signal amplifier[J]. Mikrochim Acta, 2020, 187(6): 352. DOI:10.1007/s00604-020-04343-2 |
| [22] |
REDDY L, BHOOLA K. Ochratoxins-food contaminants: impact on human health[J]. Toxins (Basel), 2010, 2(4): 771-779. DOI:10.3390/toxins2040771 |
| [23] |
KUMAR P, MAHATO D K, SHARMA B, BORAH R, HAQUE S, MAHMUD M M C, SHAH A K, RAWAL D, BORA H, BUI S. Ochratoxins in food and feed: Occurrence and its impact on human health and management strategies[J]. Toxicon, 2020, 187: 151-162. DOI:10.1016/j.toxicon.2020.08.031 |
| [24] |
LIU X, XU Y, XIONG Y H, TU Z, LI Y P, HE Z Y, QIU Y L, FU J H, GEE S J, HAMMOCK B D. VHH phage-based competitive real-time immuno-polymerase chain reaction for ultrasensitive detection of ochratoxin A in cereal[J]. Analytical Chemistry, 2014, 86(15): 7471-7477. DOI:10.1021/ac501202d |
| [25] |
SUN Z, LV J, LIU X, TANG Z, WANG X, XU Y, HAMMOCK B D. Development of a nanobody-aviTag fusion protein and its application in a streptavidin-biotin-amplified enzyme-linked immunosorbent assay for ochratoxin A in cereal[J]. Analytical Chemistry, 2018, 90(17): 10628-10634. DOI:10.1021/acs.analchem.8b03085 |
| [26] |
WANG X, WANG Y, WANG Y, CHEN Q, LIU X. Nanobody-alkaline phosphatase fusion-mediated phosphate-triggered fluorescence immunoassay for ochratoxin a detection[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2020, 226: 117617. DOI:10.1016/j.saa.2019.117617 |
| [27] |
TANG Z, LIU X, WANG Y, CHEN Q, HAMMOCK B D, XU Y. Nanobody-based fluorescence resonance energy transfer immunoassay for noncompetitive and simultaneous detection of ochratoxin A and ochratoxin B[J]. Environmental Pollution, 2019, 251: 238-245. DOI:10.1016/j.envpol.2019.04.135 |
| [28] |
TANG Z, LIU X, SU B, CHEN Q, CAO H, YUN Y, XU Y, HAMMOCK B D. Ultrasensitive and rapid detection of ochratoxin A in agro-products by a nanobody-mediated FRET-based immunosensor[J]. Journal of Hazardous Materials, 2020, 387: 121678. DOI:10.1016/j.jhazmat.2019.121678 |
| [29] |
LI L, LIU X, HE S, CAO H, SU B, HUANG T, CHEN Q, LIU M, YANG D P. Electrochemiluminescence immunosensor based on nanobody and Au/CaCO3 synthesized using waste eggshells for ultrasensitive detection of ochratoxin A[J]. ACS Omega, 2021, 6(44): 30148-30156. DOI:10.1021/acsomega.1c05213 |
| [30] |
SU B, ZHANG Z, SUN Z, TANG Z, XIE X, CHEN Q, CAO H, YU X, XU Y, LIU X, HAMMOCK B D. Fluonanobody-based nanosensor via fluorescence resonance energy transfer for ultrasensitive detection of ochratoxin A[J]. Journal of Hazardous Materials, 2022, 422: 126838. DOI:10.1016/j.jhazmat.2021.126838 |
| [31] |
XIE X, HE Z, QU C, SUN Z, CAO H, LIU X. Nanobody/NanoBiT system-mediated bioluminescence immunosensor for one-step homogeneous detection of trace ochratoxin A in food[J]. Journal of Hazardous Materials, 2022, 437: 129435. DOI:10.1016/j.jhazmat.2022.129435 |
| [32] |
WANG X, CHEN Q, SUN Z, WANG Y, SU B, ZHANG C, CAO H, LIU X. Nanobody affinity improvement: directed evolution of the anti-ochratoxin A single domain antibody[J]. International Journal of Biological Macromolecules, 2020, 151: 312-321. DOI:10.1016/j.ijbiomac.2020.02.180 |
| [33] |
ZHANG Z, SU B, XU H, HE Z, ZHOU Y, CHEN Q, SUN Z, CAO H, LIU X. Enzyme cascade-amplified immunoassay based on the nanobody-alkaline phosphatase fusion and MnO2 nanosheets for the detection of ochratoxin A in coffee[J]. RSC Advances, 2021, 11(35): 21760-21766. DOI:10.1039/d1ra03615g |
| [34] |
WANG F, LI Z F, YANG Y Y, WAN D B, VASYLIEVA N, ZHANG Y Q, CAI J, WANG H, SHEN Y D, XU Z L, HAMMOCK B D. Chemiluminescent enzyme immunoassay and bioluminescent enzyme immunoassay for tenuazonic acid mycotoxin by exploitation of nanobody and nanobody-nanoluciferase fusion[J]. Analytical Chemistry, 2020, 92(17): 11935-11942. DOI:10.1021/acs.analchem.0c02338 |
| [35] |
WANG F, YANG Y Y, WAN D B, LI J D, LIANG Y F, LI Z F, SHEN Y D, XU Z L, YANG J Y, WANG H, GETTEMANS J, HAMMOCK B D, SUN Y M. Nanobodies for accurate recognition of iso-tenuazonic acid and development of sensitive immunoassay for contaminant detection in foods[J]. Food Control, 2022, 136: 108835. DOI:10.1016/j.foodcont.2022.108835 |
| [36] |
WANG L, YAN Z, ZHOU H, FAN Y, WANG C, ZHANG J, LIAO Y, WU A. Validation of LC-MS/MS coupled with a chiral column for the determination of 3- or 15-acetyl deoxynivalenol mycotoxins from fusarium graminearum in wheat[J]. Toxins (Basel), 2021, 13(9): 659. DOI:10.3390/toxins13090659 |
| [37] |
PINTON P, TSYBULSKYY D, LUCIOLI J, LAFFITTE J, CALLU P, LYAZHRI F, GROSJEAN F, BRACARENSE A P, KOLF-CLAUW M, OSWALD I P. Toxicity of deoxynivalenol and its acetylated derivatives on the intestine: differential effects on morphology, barrier function, tight junction proteins, and mitogen-activated protein kinases[J]. Toxicological Sciences, 2012, 130(1): 180-190. DOI:10.1093/toxsci/kfs239 |
| [38] |
DOYLE P J, ARBABI-GHAHROUDI M, GAUDETTE N, FURZER G, SAVARD M E, GLEDDIE S, MCLEAN M D, MACKENZIE C R, HALL J C. Cloning, expression, and characterization of a single-domain antibody fragment with affinity for 15-acetyl-deoxynivalenol[J]. Molecular Immunology, 2008, 45(14): 3703-3713. DOI:10.1016/j.molimm.2008.06.005 |
| [39] |
DOYLE P J, SAEED H, HERMANS A, GLEDDIE S C, HUSSACK G, ARBABI-GHAHROUDI M, SEGUIN C, SAVARD M E, MACKENZIE C R, HALL J C. Intracellular expression of a single domain antibody reduces cytotoxicity of 15-acetyldeoxynivalenol in yeast[J]. Journal of Biological Chemistry, 2009, 284(50): 35029-35039. DOI:10.1074/jbc.M109.045047 |
| [40] |
TU Z, XU Y, HE Q, FU J, LIU X, TAO Y. Isolation and characterisation of deoxynivalenol affinity binders from a phage display library based on single-domain camelid heavy chain antibodies (VHHs)[J]. Food and Agricultural Immunology, 2012, 23(2): 123-131. DOI:10.1080/09540105.2011.606560 |
| [41] |
SHU M, XU Y, WANG D, LIU X, LI Y, HE Q, TU Z, QIU Y, JI Y, WANG X. Anti-idiotypic nanobody: A strategy for development of sensitive and green immunoassay for fumonisin B1[J]. Talanta, 2015, 143: 388-393. DOI:10.1016/j.talanta.2015.05.010 |
| [42] |
MILLS C, CAMPBELL K. A new chapter for anti-idiotypes in low molecular weight compound immunoassays[J]. Trends in Biotechnology, 2022, 40(9): 1102-1120. |
| [43] |
WANG Y, LI P, MAJKOVA Z, BEVER C R, KIM H J, ZHANG Q, DECHANT J E, GEE S J, HAMMOCK B D. Isolation of alpaca anti-idiotypic heavy-chain single-domain antibody for the aflatoxin immunoassay[J]. Analytical Chemistry, 2013, 85(17): 8298-8303. DOI:10.1021/ac4015885 |
| [44] |
LEI J, LI P, ZHANG Q, WANG Y, ZHANG Z, DING X, ZANG W. Anti-idiotypic nanobody-phage based real-time immuno-PCR for detection of hepatocarcinogen aflatoxin in grains and feedstuffs[J]. Analytical Chemistry, 2014, 86(21): 10841-10846. DOI:10.1021/ac5029424 |
| [45] |
WANG Y, LI P, ZHANG Q, HU X, ZHANG W. A toxin-free enzyme-linked immunosorbent assay for the analysis of aflatoxins based on a VHH surrogate standard[J]. Analytical and Bioanalytical Chemistry, 2016, 408(22): 6019-6026. DOI:10.1007/s00216-016-9370-x |
| [46] |
LEI J, HAN X, TANG X, WANG H, ZHANG Q. Development of anti-idiotypic nanobody-phage based immuno-loop-mediated isothermal amplification assay for aflatoxins in peanuts[J]. Toxins (Basel), 2020, 12(9): 565. DOI:10.3390/toxins12090565 |
| [47] |
TANG X, CATANANTE G, HUANG X, MARTY J L, WANG H, ZHANG Q, LI P. Screen-printed electrochemical immunosensor based on a novel nanobody for analyzing aflatoxin M1 in milk[J]. Food Chemistr y, 2022, 383: 132598. DOI:10.1016/j.foodchem.2022.132598 |
| [48] |
JI Y, HE Q, XU Y, TU Z, YANG H, QIU Y, WANG X, LIU Y. Phage displayed anti-idiotypic nanobody mediated immuno-PCR for sensitive and environmentally friendly detection of mycotoxin ochratoxin A[J]. Analytical Methods, 2016, 8(43): 7824-7831. DOI:10.1039/C6AY01264G |
| [49] |
ZHANG C, ZHANG Q, TANG X, ZHANG W, LI P. Development of an anti-idiotypic VHH antibody and toxin-free enzyme immunoassay for ochratoxin A in cereals[J]. Toxins (Basel), 2019, 11(5): 280. DOI:10.3390/toxins11050280 |
| [50] |
ZHANG C, ZHANG W, TANG X, ZHANG Q, ZHANG W, LI P. Change of amino acid residues in idiotypic nanobodies enhanced the sensitivity ofcompetitive enzyme immunoassay for mycotoxin ochratoxin A in cereals[J]. Toxins (Basel), 2020, 12(4): 273. DOI:10.3390/toxins12040273 |
| [51] |
ZOU L, XU Y, LI Y, HE Q, CHEN B, WANG D. Development of a single-chain variable fragment antibody-based enzyme-linked immunosorbent assay for determination of fumonisin B1 in corn samples[J]. Journal of the Science of Food and Agriculture, 2014, 94(9): 1865-1871. DOI:10.1002/jsfa.6505 |
| [52] |
SHU M, XU Y, LIU X, LI Y, HE Q, TU Z, FU J, GEE S J, HAMMOCK B D. Anti-idiotypic nanobody-alkaline phosphatase fusion proteins: Development of a one-step competitive enzyme immunoassay for fumonisin B1 detection in cereal[J]. Analytica Chimica Acta, 2016, 924: 53-59. DOI:10.1016/j.aca.2016.03.053 |
| [53] |
QIU Y L, HE Q H, XU Y, BHUNIA A K, TU Z, CHEN B, LIU Y Y. Deoxynivalenol-mimic nanobody isolated from a naive phage display nanobody library and its application in immunoassay[J]. Analytica Chimica Acta, 2015, 887: 201-208. DOI:10.1016/j.aca.2015.06.033 |
| [54] |
QIU Y L, HE Q H, XU Y, WANG W, LIU Y Y. Modification of a deoxynivalenol-antigen-mimicking nanobody to improve immunoassay sensitivity by site-saturation mutagenesis[J]. Analytical and Bioanalytical Chemistry, 2016, 408(3): 895-903. DOI:10.1007/s00216-015-9181-5 |
| [55] |
WANG X, HE Q, XU Y, LIU X, SHU M, TU Z, LI Y, WANG W, CAO D. Anti-idiotypic VHH phage display-mediated immuno-PCR for ultrasensitive determination of mycotoxin zearalenone in cereals[J]. Talanta, 2016, 147: 410-415. DOI:10.1016/j.talanta.2015.09.072 |
| [56] |
TANG X, LI P, ZHANG Q, ZHANG Z, ZHANG W, JIANG J. Time-resolved fluorescence immunochromatographic assay developed using two idiotypic nanobodies for rapid, quantitative, and simultaneous detection of aflatoxin and zearalenone in maize and its products[J]. Analytical Chemistry, 2017, 89(21): 11520-11528. DOI:10.1021/acs.analchem.7b02794 |
| [57] |
REN X, ZHANG Q, WU W, YAN T, TANG X, ZHANG W, YU L, LI P. Anti-idiotypic nanobody-phage display-mediated real-time immuno-PCR for sensitive, simultaneous and quantitative detection of total aflatoxins and zearalenone in grains[J]. Food Chemistry, 2019, 297: 124912. DOI:10.1016/j.foodchem.2019.05.186 |
| [58] |
WANG F, LI Z F, WAN D B, VASYLIEVA N, SHEN Y D, XU Z L, YANG J Y, GETTEMANS J, WANG H, HAMMOCK B D, SUN Y M. Enhanced non-toxic immunodetection of alternaria mycotoxin tenuazonic acid based on ferritin-displayed anti-idiotypic nanobody-nanoluciferase multimers[J]. Journal of Agricultural and Food Chemistry, 2021, 69(16): 4911-4917. DOI:10.1021/acs.jafc.1c01128 |
| [59] |
CULIG B, BEVARDI M, BOSNIR J, SERDAR S, LASIC D, RACZ A, GALIC A, KUHARIC Z. Presence of citrinin in grains and its possible health effects[J]. African Journal of Traditional, Complementary and Alternative Medicines, 2017, 14(3): 22-30. DOI:10.21010/ajtcam.v14i3.3 |
| [60] |
SUGIYAMA K, YAMAZAKI R, KINOSHITA M, KAMATA Y, TANI F, MINAI Y, SUGITA-KONISHI Y. Inhibitory effect of citrinin on lipopolisaccharide-induced nitric oxide production by mouse macrophage cells[J]. Mycotoxin Research, 2013, 29(4): 229-234. DOI:10.1007/s12550-013-0175-x |
| [61] |
XU Y, XIONG L, LI Y, XIONG Y, TU Z, FU J, CHEN B. Anti-idiotypic nanobody as citrinin mimotope from a naive alpaca heavy chain single domain antibody library[J]. Analytical and Bioanalytical Chemistry, 2015, 407(18): 5333-5341. DOI:10.1007/s00216-015-8693-3 |
| [62] |
XU Y, XIONG L, LI Y, XIONG Y, TU Z, FU J, TANG X. Citrinin detection using phage-displayed anti-idiotypic single-domain antibody for antigen mimicry[J]. Food Chemistry, 2015, 177: 97-101. DOI:10.1016/j.foodchem.2015.01.007 |
| [63] |
HUANG W, TU Z, NING Z, HE Q, LI Y. Development of real-time immuno-PCR based on phage displayed an anti-idiotypic nanobody for quantitative determination of citrinin in monascus[J]. Toxins (Basel), 2019, 11(10): 572. DOI:10.3390/toxins11100572 |
(责任编辑 张辉玲)
 2022, Vol. 49
2022, Vol. 49




