文章信息
基金项目
- 广东省科技专项资金(“大专项+ 任务清单”)项目(江科〔2020〕182号,江科〔2021〕183号);肇庆市科技计划项目(2021N003)
作者简介
- 张艳彬(1995—),女,在读硕士生,研究方向为农业微生物学应用,E-mail:1186292810@qq.com; 陈庄,研究员,学科带头人,现任广东省农业科技战略专家,国家、广东省和浙江省自然科学基金评审专家。主要从事畜牧胃肠道微生物、畜牧营养调控研究。在农业微生态制剂研究开发和动物基因编辑等方面有深入研究,曾担任畜牧育种国家重点实验室副主任,是业内公认学术造诣高、工作业绩突出的专业技术人员。主持省部级以上科技项目10余项,作为首席科学家主持国家“973”重大项目农业生物技术及农产品加工科学问题,在国内外期刊累计发表论文80余篇,申请发明专利18项。参编广东省第一部动物转基因专著《转基因动物》(1995)。获科技成果多项,其中省部级以上成果奖励4项,包括农业部农业科技创新团队奖、广东省农业技术推广二等奖、广东省自然科学三等奖和广东省科技进步三等奖.
通讯作者
- 陈庄(1963—),男,博士,研究员,研究方向为微生物资源研究,E-mail:chenzh1963@vip.sina.com.
文章历史
- 收稿日期:2022-09-18
2. 广东省农业科学院农业生物基因研究中心/广东省农作物种质资源保存 与利用重点实验室,广东 广州 510640;
3. 江门海关技术中心,广东 江门 529085
2. Agro-biological Gene Research Center, Guangdong Academy of Agricultural Sciences/Guangdong Key Laboratory for Crop Germplasm Resources Preservation and Utilization, Guangzhou 510640, China;
3. Jiangmen Customs Technical Center, Jiangmen 529085, China
【研究意义】抗生素滥用导致的耐药性、人类健康和环境危害问题已经严重影响畜牧业的健康发展。随着过去10年中禁抗替抗力度的加大,作为一种安全有效的抗生素替代品,乳酸菌添加剂已经得到了越来越多的关注[1-3]。乳酸菌是动物肠道中最重要的细菌群之一,具有各种优异的益生性能,可以产生多种抑菌物质抑制病原菌生长定植,在畜禽养殖业中发挥着越来越重要的作用。大多数乳酸菌被归类为“普遍公认安全”的微生物,因为它们是非致病性的[4]。但益生菌的特性和特征具有菌株特异性[5],不同乳酸菌的性能差异很大,而且目前适合在各种不同动物体内环境下发挥作用的乳酸菌资源仍然不多,因此需要进行更多的研究来筛选新型乳酸菌菌株和揭示其益生特性和潜力。【前人研究进展】乳酸菌可以促进动物健康发育、提高畜禽生长性能,预防疾病和提高动物免疫力[6],其作用机制包括维持肠道菌群生态平衡、抑制病原菌生长、形成生物屏障阻止病原菌定植、增加营养物质利用率、改善乳糖耐受性[7]、改善消化[8]和刺激免疫系统[9]等。夏亿[10]研究发现,在鸡日粮中添加发酵乳杆菌和凝结芽孢杆菌可以显著增强鸡肠道屏障作用和调控免疫相关基因表达,促进后肠乳酸菌增殖,减轻肠道损伤。Shin等[11]发现给断奶仔猪饲喂乳酸菌显著增加了肠道微生物群落多样性,并减弱了肠道炎症的发生,促进断奶仔猪肠道发育。乳酸菌作为益生菌添加到动物日粮中可有效抑制病原菌生长,促进动物肠道生长发育,这是乳酸菌益生功能的重要部分。此外,部分乳酸菌分泌的抗菌物质也在动物的健康生长发育中发挥重要作用。最新报道表明,乳酸菌的无细胞上清液可以替代抗生素抑制动物体内的沙门氏菌,具有作为饲料添加剂替抗产品的潜力,可以最大限度减少与抗生素耐药性相关问题[12]。还有研究表明,乳酸菌分泌的细菌素、有机酸和胞外多糖等物质是乳酸菌发挥作用的重要载体[8]。目前对于乳酸菌产生抗菌物质的研究较多,也是乳酸菌益生功能研究的热点之一。【本研究切入点】发酵乳杆菌具有典型的耐酸、耐胆盐、粘附能力强等益生功能,其于2009、2013年分别被欧洲食品安全局、美国食品和药品管理局认定为是安全的。但目前发酵乳杆菌大多从乳制品[13]、酸菜[14]中筛选,而从动物肠道中筛选较少,应用于畜禽养殖中的发酵乳杆菌菌株仍然不多。来源于畜禽动物的益生菌更有利于其在肠道环境中发挥最大的功效,更适合在畜禽动物养殖业中使用。【拟解决的关键问题】本研究以从猪粪便中筛选出的106株菌为材料,根据其在酸性MRS肉汤和胆盐MRS肉汤中的生长情况,选取1株乳杆菌进行深入的耐酸、耐胆盐以及粘附能力、抑菌能力研究,并探究其抑菌作用的机理,以期为其应用于畜禽动物饲料添加剂提供一定的理论基础。
1 材料与方法 1.1 试验材料1.1.1 菌种与细胞 大肠杆菌K88(O149: K91, K88ac)购自中国兽医药品监察所,金黄色葡萄球菌(CAU0225)由华南农业大学动物科学学院赠予,猪野生型链球菌D型和2型由广东省农业科学院动物卫生研究所赠予,仔猪小肠上皮细胞系由美国德州农工大学伍国耀教授惠赠,无乳链球菌GDMCC 1.408和恶臭假单胞GDMCC 554购自广东省微生物保藏中心,大肠杆菌ATCC25922、沙门氏菌ATCC14028、副溶血弧菌V4、创伤弧菌1676-80、霍乱弧菌CH-GX-YL-ZY-R-2021、嗜水气单胞菌CH-GX-GL-GLS5-R-1-2021均为本实验室保藏菌种。
1.1.2 培养基 Rogosa SL培养基、MRS肉汤培养基、酸性MRS肉汤培养基(以1 mol/L盐酸溶液调节MRS肉汤培养基的pH至2.5)、LB培养基、链球菌培养基、细胞完全培养液(DMEM),均为本实验室配制。
1.2 试验方法1.2.1 粪便样品采集 2019年3月在广东省农业科学院白云实验基地选取5头35日龄三元杂(杜洛克×长白×大洛克)健康断奶仔猪,用无菌棉签分别从猪肛门处快速获取约1 g粪便装于无菌采样袋中,迅速冷冻保存。
1.2.2 乳酸菌筛选与纯化 用灭菌的PBS冲洗带有粪便的无菌棉签,冲洗液漩涡震荡40 s,梯度稀释至10-6,吸取200 µL稀释后的样品涂布Rogosa SL固体培养基,以烛缸法进行厌氧培养,37 ℃培养48 h。挑取长出的单菌落进行继续划线纯化,纯化进行两代,取第2代纯化后的菌落进行革兰氏染色。
1.2.3 菌株鉴定 菌株(第2代纯化后的菌株) 采用16S rDNA序列测序鉴定,委托北京三博远志生物技术有限责任公司进行。测序结果在NCBI数据库中进行BLAST比对。
1.2.4 耐酸性能力测定 将菌株培养24 h后的菌液按4% 的接种量(V/V)接种到酸性MRS肉汤培养基(pH 2.5),3次重复,于80 r/min、37 ℃培养。接种后0、3、6 h分别收集1 mL菌液,以10倍梯度稀释,取10-4、10-5的稀释菌液各0.1 mL涂布MRS平板,37 ℃培养48 h后计数菌落数,计算平均存活率。
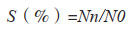
|
式中,S为经过处理后的乳杆菌存活率,N0为处理0 h时每毫升活菌数,Nn为处理n h后每毫升活菌数。
1.2.5 耐胆盐能力测定 将菌株培养24 h后的菌液按4% 的接种量(V/V)接种到质量分数0.3% 胆盐MRS肉汤培养基,于80 r/min、37 ℃培养,3次重复。按耐酸能力测试的方法进行平板菌落计数,计算乳酸菌的平均存活率。
1.2.6 粘附能力测定 在6孔板培养猪小肠上皮细胞贴壁铺满后,弃去培养基,以无菌PBS洗涤1次。然后分别将含有1×108 CFU/mL待测菌的DMEM加入孔中,加入2 mL DMEM培养基,轻轻摇匀。37 ℃培养2 h后弃去培养基,用灭菌PBS洗涤3次后,用细胞刮刀收集细胞并转移到EP管中,4 ℃、8 000 r/min离心10 min,弃上清液,加入1 mL MRS肉汤培养基,震荡混匀。以10倍梯度稀释进行平板菌落计数并计算粘附率,每个稀释度涂3个平板,每个试验重复3次,同时设同体积的未接种菌液为阴性对照一、同体积未接种细胞的菌液为阴性对照二。

|
式中,AR为粘附率,N1为粘附后的活菌数(CFU/mL),N2为粘附前的活菌数(CFU/mL)。
1.2.7 抑菌能力测定 将MRS培养基培养的发酵乳杆菌的发酵液离心,上清以0.22 µm滤膜过滤除菌,得到无菌发酵液。抑菌圈实验选取大肠杆菌K88、金黄色葡萄球菌、猪链球菌D型和2型为指示菌,将18 mL相应培养基与200 µL指示菌菌液混匀后倾注到无菌培养皿中,待其凝固后,放入7.8 mm牛津杯,轻轻加压,使其与培养基表面接触无空隙。在杯中加入无菌发酵液200 µL,设3个平行,于37 ℃培养18 h,观察结果,测定抑菌圈大小,每个试验重复3次,设同体积的未接种上清液为阴性对照。
将无菌发酵液用MRS培养基分别稀释2倍、4倍、20倍、100倍,在96孔深孔板的1~6孔中各加入900 µL菌液浓度为105 CFU/mL的大肠杆菌K88,在1~6孔依次加入100 µL不同浓度的无菌发酵液,浓度依次为10%、5%、2.5%、0.5%、0.1%、0%,每个浓度做3个平行,置于37 ℃、120 r/min培养10 h后,用分光光度计在600 nm处测定吸光值并计算抑制率。依次分别测定无菌发酵液对大肠杆菌ATCC25922、金黄色葡萄球菌25923、沙门氏菌ATCC14028、副溶血弧菌V4、创伤弧菌1676-80、霍乱弧菌CHGX-YL-ZY-R-2021、嗜水气单胞菌CH-GXGL-GLS5-R-1-2021、猪链球菌D型、猪链球菌2型、无乳链球菌GDMCC 1.408、恶臭假单胞菌GDMCC 554的抑制能力。
试验数据以SPSS22. 0进行单因素方差分析与显著性检验。
2 结果与分析 2.1 乳酸菌的分离鉴定本试验从猪粪中分离出的106株乳酸菌的在Rogosa SL培养基上的形态基本一致,均为圆形、乳白色、表面凸起、直径0.5~2.0 mm。经革兰氏染色确定86株为阳性细菌,呈杆状、多排列成长短不一的链状。简单观察在酸性MRS肉汤和胆盐MRS肉汤培养基中的生长情况,选择其中1株进行深入研究,该菌株的菌落形态和革兰氏染色结果如图 1所示。16S r DNA序列测序结果(图 2)显示,该菌株属于发酵乳杆菌(Lactobacillus fermentum),命名为LF1,该菌的细菌形态和革兰氏染色结果如图 1所示,为直杆状革兰氏阳性细菌,无鞭毛,不产芽孢。

|
| 图 1 发酵乳杆菌LF1的菌落形态(A)和革兰氏染色结果(B) Fig. 1 Colony morphology (A) and Gram staining (B) of Lactobacillus fermentum LF1 |

|
| 图 2 以发酵乳杆菌LF1 16S rDNA基因序列构建的系统进化树 Fig. 2 Phylogenetic tree of Lactobacillus fermentum LF1 by 16S rDNA gene sequence |
2.2 发酵乳杆菌耐酸能力
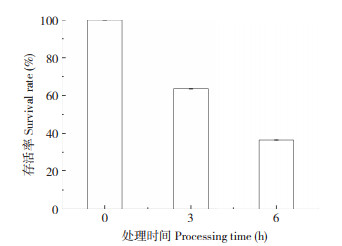
从图 3可以看出,发酵乳杆菌LF1在pH 2.5下处理3 h后存活率达63.64%,处理6 h后存活率下降到36.61%,表明发酵乳杆菌LF1对强酸的耐受能力较强。
|
| 图 3 发酵乳杆菌LF1在pH2.5不同处理时间的存活率 Fig. 3 Survival rate of Lactobacillus fermentum LF1 exposed to pH2.5 treatment at different times |
2.3 发酵乳杆菌耐胆盐能力
从图 4可以看出,发酵乳杆菌LF1在0.3% 胆盐的条件下处理3 h后存活率达87.25%,处理6 h后存活率略微下降到80.16%,表明发酵乳杆菌LF1具有很强的耐胆盐能力。

|
| 图 4 发酵乳杆菌LF1经0.3% 胆盐不同处理时间的存活率 Fig. 4 Survival rate of Lactobacillus fermentum LF1 treated with 0.3% bile salt at different times |
2.4 发酵乳杆菌粘附能力
试验结果显示,发酵乳杆菌LF1对猪小肠上皮细胞具有一定的粘附性能,但粘附率仅为0.18%,表明菌株LF1对肠道上皮细胞的粘附能力并不强。
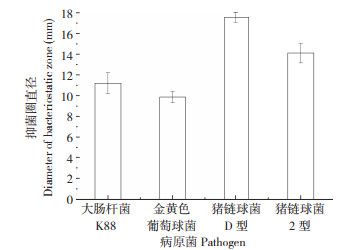
2.5 发酵乳杆菌抑菌能力从图 5可以看出,发酵乳杆菌LF1具有较强的抑制病原菌生长的能力,其中对猪链球菌D型生长的抑制最强、抑菌圈直径达17.56 mm,其次是猪链球菌2型、抑菌圈直径为14.12 mm;对大肠杆菌K88和金黄色葡萄球菌也有很好的抑制作用,抑菌圈直径分别为11.20 mm和9.87 mm。表明发酵乳杆菌LF1对常见的猪病原微生物具有良好的生物拮抗作用。
|
| 图 5 发酵乳杆菌LF1发酵液对4种病原菌的抑制效果 Fig. 5 Antagonistic effects of Lactobacillus fermentum LF1 fermentation broth against four pathogens |
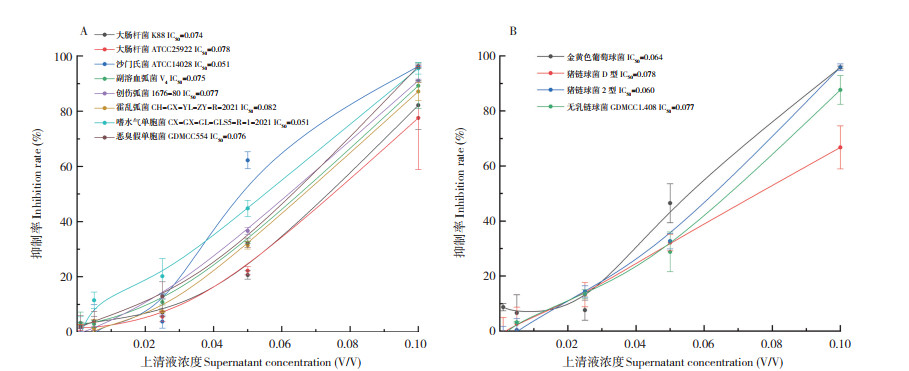
通过抑菌圈发现,发酵乳杆菌LF1发酵液对猪的常见病原菌具有较好的抑菌能力,因此进一步就发酵液对更多病原菌的抑制特性进行研究。由图 6可知,随着发酵乳杆菌LF1上清液浓度的增加,抑制率逐渐上升,当上清液浓度为10% 时,对大部分的菌都有较强的抑制作用,抑制率接近100%;发酵乳杆菌LF1上清液对革兰氏阴性菌和阳性菌的抑制效果无显著差异,其中对沙门氏菌ATCC14028和嗜水气单胞菌CH-GX-GLGLS5-R-1-2021的抑制效果最强,其半数抑制浓度IC50均为0.051。表明发酵乳杆菌LF1发酵液中含有的某些物质对革兰氏阳性菌和革兰氏阴性菌具有很强的拮抗作用。
|
| 图 6 发酵乳杆菌LF1发酵液对革兰氏阴性菌(A) 和革兰氏阳性菌(B) 的抑制曲线 Fig. 6 Inhibition curves of Lactobacillus fermentum LF1 fermentation broth against gram-negative bacteria (A) and gram-positive bacteria (B) |
3 讨论
乳酸菌是仔猪消化道中的重要益生菌,在健康个体中是优势种群。目前已有较多研究从猪肠道中分离得到乳酸菌,而本研究从仔猪肠道中分离出发酵乳杆菌LF1菌株。发酵乳杆菌广泛存在于动物肠道和植物中,Barrow等[15]发现无论在断奶仔猪或不断奶仔猪的肠道中,发酵乳杆菌都是肠道乳酸菌种群中关键且典型的物种。Mach等[16]对仔猪和母猪的肠道微生物进行分析,也发现发酵乳杆菌是机体内重要的乳酸菌,而且可能通过母乳或粪便从母猪垂直传播到仔猪肠道。
耐酸、耐胆盐与粘附能力是乳酸菌发挥益生功效的关键特性,乳酸菌必须具有较强的耐酸、耐胆盐和粘附能力才能顺利通过胃中的酸性环境与小肠中的高胆盐环境而到达特定部位定植并发挥其益生功能。从耐酸、耐胆盐和粘附能力的试验结果可以看出,从仔猪肠道分离出的发酵乳杆菌LF1具有较好的耐酸和耐胆盐的性能,能很好地适应肠道环境,这与韩瑨等[17]的试验结果类似。
对致病菌的抑制作用也是益生菌的一个重要特征,乳酸菌可以产生大量的有机酸、H2O2、细菌素、类细菌素等多种物质来抑制致病菌的生长,从而达到生物拮抗作用[18]。同时,与病原菌竞争粘附在胃肠上皮细胞,形成一层致密性保护膜发挥生物屏障作用。Davoodabadi等[19]从健康婴儿粪便中获得4株发酵乳杆菌,发现它们能有效抑制大肠杆菌、志贺氏菌、沙门氏菌和耶尔森菌等肠道致病菌的生长。Fuochi等[20]研究报道,从消化道分离出的8株发酵乳杆菌对多种病原菌均有较强的抑制作用。本研究发现发酵乳杆菌LF1发酵液对大肠杆菌K88、金黄色葡萄球菌、猪链球菌D型与猪链球菌2型等12种常见病原菌均有较强的抑制作用。有文献报道罗伊氏乳杆菌能够产生多种细菌素和抗菌肽[21],能有效抑制病原微生物的生长,还能产生大量有机酸和肉桂酰酯酶等抑制杀灭肠道中的病原微生物[22]。而本试验中的菌株产生的上清能有效抑制病原菌生长,可能也是通过产生类似的抑菌物质来实现。
综上,发酵乳杆菌LF1具有较强的耐酸和耐胆盐的能力,同时还具有较强的抑菌作用,可以作为畜禽养殖益生菌的候选菌株。但是LF1对肠道的粘附能力并不强,因此仍需不断地筛选出更加优良的益生菌与其进行复配用于畜禽动物的生产养殖。
4 结论本研究通过从健康仔猪粪便中分离纯化,鉴定出1株发酵乳杆菌LF1,并从体外实验中对该发酵乳杆菌的耐酸、耐胆盐、粘附能力和抑菌能力进行测试,结果表明,发酵乳杆菌LF1具有较强的耐酸和耐胆盐的能力,耐酸和耐胆盐的能力使其可以在动物胃肠道内存活,从而更好地发挥其作用。发酵乳杆菌LF1发酵液对大肠杆菌K88、金黄色葡萄球菌、猪链球菌D型与猪链球菌2型等12种常见病原菌均有较强的抑制作用,可以有效抑制动物体内病原菌生长。这表明本研究从健康仔猪粪便中分离出的发酵乳杆菌LF1具有较好的益生特性,可以作为畜禽动物生态健康养殖中的饲料添加剂的益生菌的候选菌株,具有良好的抑菌能力,可以调节动物肠道菌群,从而促进动物健康生长。
| [1] |
CASTELLONE V, BANCALARI E, RUBERT J, GATTI M, NEVIANI E, BOTTARI B. Eating fermented: Health benefits of LAB-fermented foods[J]. Foods, 2021, 10(11): 2639. DOI:10.3390/foods10112639 |
| [2] |
卞立红, 汪洋, 张奕婷, 曲丽娜. 不同原味酸奶中乳酸菌的计数及产酸能力比较[J]. 广东农业科学, 2012, 39(22): 128-130. DOI:10.16768/j.issn.1004-874X.2012.22.011 BIAN L H, WANG Y, ZHANG Y T, QU L N. Counting and production acid ability contrasting of lactic acid bacteria from different originally yogurts[J]. Guangdong Agricultural Sciences, 2012, 39(22): 128-130. DOI:10.16768/j.issn.1004-874X.2012.22.011 |
| [3] |
郭衍彪, 赵亚玲, 蔡俊鹏. 广州市售泡菜乳酸菌的分离及其特性分析[J]. 广东农业科学, 2015, 42(9): 142-148. DOI:10.16768/j.issn.1004-874X.2015.09.011 GUO Y B, ZHAO Y L, CAI J P. Isolation and characterization of lactic acid bacteria from Guangzhou pickles[J]. Guangdong Agricultural Sciences, 2015, 42(9): 142-148. DOI:10.16768/j.issn.1004-874X.2015.09.011 |
| [4] |
冉明宇, 王红伟, 安艳君, 向雪松. 益生菌的历史与定义及其健康作用[J]. 中国食物与营养, 2021, 27(5): 5-8, 29. DOI:10.19870/j.cnki.11-3716/ts.2021.05.001 RAN M Y, WANG H W, AN Y J, XIANG X S. History, definition and health effects of probiotics[J]. Food and Nutrition in China, 2021, 27(5): 5-8, 29. DOI:10.19870/j.cnki.11-3716/ts.2021.05.001 |
| [5] |
RAMAN J, KIM J S, CHOI K R, EUN H, YANG D, KO Y J, KIM S J. Application of lactic acid bacteria (LAB) in sustainable agriculture: Advantages and limitations[J]. International Journal of Molecular Sciences, 2022, 23(14): 7784. DOI:10.3390/ijms23147784 |
| [6] |
VEMURI R, GUNDAMARAJU R, ERI R. Role of lactic acid probiotic bacteria in IBD[J]. Current Pharmaceutical Design, 2017, 23(16): 2352-2355. DOI:10.2174/1381612823666170207100025 |
| [7] |
闵祥博, 汤纯, 矫艳平, 余萍, 赵迪. 动物双岐杆菌乳亚种HCS04-002小鼠体内功能性研究[J]. 食品工业, 2022, 43(4): 180-183. DOI:10.11882/j.issn.0254-5071.2021.09.019 MIN X B, TANG C, JIAO Y P, YU P, ZHAO D. In vivo study on lactose intolerance alleviated by Bifidobacterium animalis subsp. Lactis HC04-002[J]. The Food Industry, 2022, 43(4): 180-183. DOI:10.11882/j.issn.0254-5071.2021.09.019 |
| [8] |
TSAI Y T, CHENG P C, PAN T M. The immunomodulatory effects of lactic acid bacteria for improving immune functions and benefits[J]. Applied Microbiology and Biotechnology, 2012, 96(4): 853-862. DOI:10.1007/s00253-012-4407-3 |
| [9] |
RINGØ E, VAN DOAN H, LEE S H, SOLTANI M, HOSEINIFAR S H, HARIKRISHNAN R, SONG S K. Probiotics, lactic acid bacteria and bacilli: interesting supplementation for aquaculture[J]. Journal of Applied Microbiol, 2020, 129(1): 116-136. DOI:10.1111/jam.14628 |
| [10] |
夏亿. 发酵乳杆菌和凝结芽孢杆菌对感染产气荚膜梭菌的肉鸡生长性能和肠道健康的影响[D]. 武汉: 武汉轻工大学, 2019. DOI: 10.27776/d.cnki.gwhgy.2019.000035. XIA Y. Effects of Lactobacillus fermentans and Bacillus coagulans on growth performance and intestinal health of broilers infected with Clostridium perfringens[D]. Wuhan: Wuhan University of Light Industry, 2019. DOI: 10.27776/d.cnki.gwhgy.2019.000035. |
| [11] |
SHIN D, CHANG S Y, BOGERE P, WON K, CHOI J Y, CHOI Y J, LEE H K, HUR J, PARK B Y, KIM Y, HEO J. Beneficial roles of probiotics on the modulation of gut microbiota and immune response in pigs[J]. The Public Library of Science One, 2019, 14(8): e0220843. DOI:10.1371/journal.pone.0220843.eCollection2019 |
| [12] |
ZIELIŃSKA D, KOLOŻYN-KRAJEWSKA D. Food-origin lactic acid bacteria may exhibit probiotic properties: Review[J]. Biomed Research International, 2018, 2018: 5063185. DOI:10.1155/2018/5063185 |
| [13] |
张奇, 肖会姣, 武丽辉, 贾薇. 驴乳发酵乳源的植物乳杆菌L28鉴定及其对小鼠肠道菌群的影响[J]. 中国乳业, 2022(5): 64-68. DOI:10.12377/1671-4393.22.05.13 ZHANG Q, XIAO H J, WU L H, JIA W. Identification of Lactobacillus plantarum L28 from fermented donkey milk and its effect on intestinal flora of mice[J]. China Dairy, 2022(5): 64-68. DOI:10.12377/1671-4393.22.05.13 |
| [14] |
林谦, 姜康怡, 韦素娟, 郭丹妮, 农石蓉, 高敏. 产GABA发酵乳杆菌的筛选、发酵条件优化及其谷氨酸脱羧酶基因的克隆[J]. 广东农业科学, 2014, 41(8): 192-197. DOI:10.16768/j.issn.1004-874X.2014.08.003 LIN Q, JIANG K Y, WEI S J, GUO D N, NONG S R, GAO M. Screening of GABA producing Lactobacillus fermentans, optimization of fermentation conditions and cloning of glutamate decarboxylase gene[J]. Guangdong Agricultural Sciences, 2014, 41(8): 192-197. DOI:10.16768/j.issn.1004-874X.2014.08.003 |
| [15] |
BARROW P A, FULLER R, NEWPORT M J. Changes in the microflora and physiology of the anterior intestinal tract of pigs weaned at 2 days, with special reference to the pathogenesis of diarrhea[J]. Infect Immun, 1977, 18(3): 586-895. DOI:10.1128/iai.18.3.586-595.1977 |
| [16] |
MACH N, BERRI M, ESTELLÉ J, LEVENEZ F, LEMONNIER G, DENIS C, LEPLAT J J, CHEVALEYRE C, BILLON Y, DORÉ J, ROGEL-GAILLARD C, LEPAGE P. Early-life establishment of the swine gut microbiome and impact on host phenotypes[J]. Environ Microbiology Reports, 2015, 7(3): 554-569. DOI:10.1111/1758-2229.12285 |
| [17] |
韩瑨, 吴燕婷, 万嗣宝, 吴正钧. 发酵乳杆菌B44益生性能的体外评价[J]. 上海大学学报(自然科学版), 2021, 27(6): 1162-1170. DOI:10.12066/j.issn.1007-2861.2207 HAN J, WU Y T, WAN S B, WU Z J. In vitro evaluation of the prebiotic properties for Lactobacillus fermentum B44[J]. Journal of Shanghai University(Natural Science Edition), 2021, 27(6): 1162-1170. DOI:10.12066/j.issn.1007-2861.2207 |
| [18] |
MANI-LÓPEZ E, ARRIOJA-BRETÓN D, LÓPEZ-MALO A. The impacts of antimicrobial and antifungal activity of cell-free supernatants from lactic acid bacteria in vitro and foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2022, 21(1): 604-641. DOI:10.1111/1541-4337.12872 |
| [19] |
DAVOODABADI A, SOLTAN DALLAL M M, RAHIMI FOROUSHANI A, DOURAGHI M, SHARIFI YAZDI M K, AMIN HARATI F. Antibacterial activity of Lactobacillus spp. isolated from the feces of healthy infants against enteropathogenic bacteria[J]. Anaerobe, 2015, 34: 53-58. DOI:10.1016/j.anaerobe.2015.04.014 |
| [20] |
FUOCHI V, VOLTI G L, FURNERI P M. Probiotic properties of Lactobacillus fermentum strains isolated from human oral samples and description of their antibacterial activity[J]. Current Pharmaceutical Biotechnology, 2017, 18(2): 138-149. DOI:10.2174/1389201017666161229153530 |
| [21] |
NAGHMOUCHI K, BELGUESMIA Y, BENDALI F, SPANO G, SEAL B S, DRIDER D. Lactobacillus fermentum: a bacterial species with potential for food preservation and biomedical applications[J]. Critical Reviews in Food Science and Nutrition, 2020, 60(20): 3387-3399. DOI:10.1080/10408398.2019.1688250 |
| [22] |
KIM J H, LEE E S, KIM B M, HAM J S, OH M H. Broad-spectrum antimicrobial activity of cinnamoyl esterase-producing Lactobacilli and their application in fermented rice bran[J]. Journal of the Science of Food and Agriculture, 2022, 102(8): 3130-3139. DOI:10.1002/jsfa.11654 |
(责任编辑 邹移光)
 2022, Vol. 49
2022, Vol. 49




