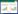文章信息
基金项目
- 广西重点研发计划项目(桂科AB18294026);广西科学院基本业务费项目(2018YJJ909);广西科学院园艺植物种质资源创新及利用创新团队启动经费项目(CQZ-E-1919);广西植物研究所基本业务费项目(桂植业22006)
作者简介
- 吴巧芬(1993—),女,硕士,助理研究员,研究方向为药用植物栽培,E-mail:2547508570@qq.com.
通讯作者
- 仇硕(1977—),男,博士,副研究员,研究方向为园艺植物栽培生理和分子生物学,E-mail:qiushuo001@163.com.
文章历史
- 收稿日期:2022-03-04
2. 桂林理工大学旅游与风景园林学院,广西 桂林 541006
2. College of Tourism & Landscape Architecture, Guilin University of Technology, Guilin 541006, China
【研究意义】华重楼(Paris polyphylla var. chinensis)为百合科重楼属(Paris) 植物七叶一枝花的变种之一,也常叫作七叶一枝花,是著名的传统中药材,其干燥块茎是《中国药典》规定的两个正品之一[1-2],也被划为国家Ⅱ级珍稀濒危保护植物[3]。华重楼有清热解毒、消肿止痛、凉肝定惊等传统功效[2],现代医学药理研究表明华重楼还具有抗肿瘤、抑菌、止血、调节机体免疫力和抗氧化等作用[4-8],以华重楼为原料的中成药已有多种被中国食品药品监督管理局(CFDA)批准用作化妆品原料药[3]。随着华重楼药用成分逐步开发与利用,其药用价值越来越高,市场需求量逐年递增,过度的采挖和生境的破坏导致野生资源骤减[9]。近年来,华重楼种植规模逐渐扩大,导致优良种苗供不应求,价格居高不下,因而,华重楼种苗的组培快繁亟待突破,以满足市场需求的同时保护野生资源。【前人研究进展】研究表明,华重楼喜欢阴凉及土质疏松肥沃的生境,要求水源充足但不能积水,可于毛竹林或杉树林等林下套种或仿野生种植,也可以遮阴种植[10-14]。然而,华重楼大规模种植较少见,基本都是零散或小规模种植,除种植周期过长(7~10年)及种养技术要求高外,种苗稀缺且价格高也是阻碍其规模化发展的重要因素。低温层积结合一定浓度的赤霉素诱导可以打破种子休眠,缩短发芽时间[15-16]。在组培快繁研究方面,华重楼根茎、种子、子叶、子房、芽等常被用作外植体,然而能否诱导出愈伤组织的报道不统一,而且存在污染率高、诱导率低且不稳定、增殖慢以及难分化等问题[17-20]。王跃华等[21]以华重楼子叶为外植体,愈伤组织诱导率只有22.35%。杨丽云等[22]利用云南重楼的嫩芽进行组织培养与植株再生研究,但存在增殖周期过长(210~240 d)以及增殖系数低(1~2倍)的问题。刘银花等[23]以华重楼根茎为外植体,不仅获得了愈伤组织,还诱导出不定芽及生根。徐梅珍等[24]通过无菌播种获得幼苗,再直接壮苗和生根培养,可获得华重楼种苗。国外也有通过非成熟的合子胚建立重楼再生体系的研究报道[25]。【本研究切入点】目前仍未见通过组培规模化繁殖华重楼种苗或推广生产的报道,说明现阶段华重楼组培繁育仍未能满足生产需求。为此,本研究通过探讨华重楼的最佳消毒方式,筛选最适外植体,建立无菌体系,并进一步筛选诱导培养基、增殖培养基以及适宜丛生芽生根和结鳞茎的最优培养基,进而建立华重楼组培快繁技术体系。【拟解决的关键问题】通过系统的试验方案,找到最适合建立华重楼无菌体系的消毒方式和外植体,提高诱导率、丛生芽增殖系数以及生根和结鳞茎率,完善华重楼组培快繁技术体系,为规模化生产优质种苗提供理论支撑。
1 材料与方法 1.1 试验材料2019年9—10月,在湖南省邵阳市新宁县崀山镇采集华重楼自然繁育获得的成熟种子,去掉红色外种皮,清洗干净,挑选外形饱满的种子用50 mg/L GA3溶液浸泡24 h,置于泡沫盒内,细沙层积,沙子深度5 cm左右,湿度保持30%~40%,表面覆盖报纸,于5~10 ℃的环境温度放置3个月,种子露白后转入室温放置1个月,长出根系2~3根,根长1~3 cm;再转入5~10 ℃的环境温度放置3个月,然后转入室温,待种子萌发新芽,至幼苗展开1片叶、高5~10 cm、根长1~3 cm,备用。
1.2 试验方法1.2.1 外植体预处理及消毒 以去掉叶片的华重楼幼苗为外植体,用0.5% 洗洁精清洗表面泥沙,备用。设置3种不同预处理和消毒方式:(1)外植体未经预处理,超净工作台内用75% 无水乙醇浸泡45 s,无菌水冲洗1次,再分别用0.05%、0.1%、0.2% 的HgCl2或2%、4%、8% 的NaClO进行表面消毒10 min,无菌水冲洗5次;(2)外植体分别经预处理A(流水冲洗2 h)、预处理B(0.05% 多菌灵浸泡2 h)或预处理C(0.5% 多菌灵浸泡2 h),转入超净工作台,75% 无水乙醇浸泡45 s,无菌水冲洗1次,再用0.1%HgCl2浸泡10 min;(3)外植体经预处理C(0.5% 多菌灵浸泡2 h),转入超净工作台,75% 无水乙醇浸泡45 s,无菌水冲洗1次,再用0.1%HgCl2分别消毒6、8、12 min。每个处理3次重复,每个重复40~50个外植体,接种至培养基MS+1.5 mg/L 6-BA+ 0.1 mg/L NAA+30 g/L蔗糖进行培养,pH=5.8。培养条件:温度25(±2) ℃,光照强度300~500 lx,光照时间12 h/d。30 d后统计外植体污染情况,定期观察并记录外植体生长情况。
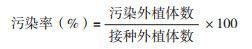
|
1.2.2 外植体的筛选 按照1.2.1的方法,将完整的华重楼幼苗用0.5% 多菌灵预处理2 h,0.1%HgCl2消毒10 min,分别取叶片、叶柄、根、茎段(叶片和幼嫩块茎之间的部位)、幼嫩块茎、去掉茎叶的幼苗(含根和幼嫩块茎)以及幼苗(带根的完整植株)为外植体,接种到诱导培养基MS+0.1 mg/L 6-BA+0.5 mg/L NAA+0.5 mg/L GA3+30 g/L蔗糖中培养,pH=5.8。每个处理3次重复,每个重复20个外植体,培养温度25(±2)℃,光照强度300~500 lx,光照时间12 h/d。定期观察并记录外植体诱导出愈伤或不定芽的情况。
1.2.3 不定芽诱导培养 按照1.2.1的方法,将完整的华重楼幼苗用0.5% 多菌灵预处理2 h,0.1%HgCl2消毒10 min,以去掉茎叶或完整幼苗(含根系)为外植体,接种到不同诱导培养基中:(1)以MS为基本培养基,6-BA浓度分别为0.1、1.0、1.5、2.0 mg/L,NAA浓度为0.25、0.5 mg/L,GA3浓度为0、0.5 mg/L;(2)以WPM为基本培养基,ZT浓度分别为1.0、1.5、2.0、2.5 mg/L,NAA浓度为0.1 mg/L。上述培养基均添加蔗糖30 g/L,pH=5.8;每个处理3次重复,每个重复20个外植体,培养温度25(±2) ℃,光照强度300~500 lx,光照时间12 h/d。定期观察并记录外植体变化情况,30 d后统计不定芽的诱导率。

|
1.2.4 不定芽增殖培养 将1.2.3中诱导出的不定芽继续培养90~120 d,得到分蘖的不定芽或增大的鳞茎,用解剖刀沿分蘖点切割,或将增大的鳞茎平均切割为2~4份,转到不同的增殖培养基:(1)以MS为基本培养基,6-BA浓度分别为0.1、1.0、1.5、2.0 mg/L,NAA浓度为0、0.5 mg/L,GA3浓度分别为0、0.5 mg/L,IAA浓度为0、1.0 mg/L;(2)以WPM为基本培养基,ZT浓度分别为1.0、1.5、2.0 mg/L,NAA浓度为0.1 mg/L。上述培养基均添加蔗糖30 g/L,pH=5.8;每个处理3次重复,每个重复20个不定芽或鳞茎;增殖培养温度25(±2) ℃,光照强度300~500 lx,光照时间12 h/d。定期观察并记录外植体生长情况,90 d后统计增殖系数。

|
1.2.5 不定芽生根和结鳞茎培养 将增殖培养获得的不定芽增殖培养2~4代后,转接到生根和结鳞茎培养基,以WPM为基本培养基,ZT浓度分别为1.0、1.5、2.0 mg/L,NAA浓度为0.1、0.2 mg/L,蔗糖30 g/L,pH=5.8。每个处理3次重复,每个重复20个不定芽,培养温度25(±2) ℃,光照强度300~500 lx,光照时间12 h/d。定期观察并记录植株生长情况,90 d后统计生根数量及生根和结鳞茎率,用直尺测定根长和鳞茎直径。
1.2.6 生根苗移栽驯化 于2021年3—5月和6—8月,把1.2.5获得的生根和结鳞茎的生根苗,移出室外炼苗15 d,洗净根部,晾干水分,移栽到不同基质中,分别为基质Ⅰ(泥炭土∶珍珠岩∶河沙=2 ∶ 1 ∶ 1)、基质Ⅱ(泥炭土∶黄壤土∶珍珠岩=2 ∶ 1 ∶ 1)、基质Ⅲ(泥炭土)及基质Ⅳ(河沙),以上基质配比均为体积比,每个处理20株,3次重复。置于塑料大棚内,夏季采用90% 遮阳网遮阴。移栽驯化30 d后,统计移栽成活率。
试验数据采用Excel 2007进行处理,用SPSS 22进行方差分析。
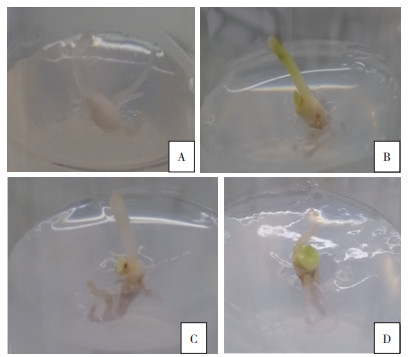
2 结果与分析 2.1 不同预处理和消毒方法对华重楼外植体消毒效果的影响从表 1可以看出,未经预处理的华重楼外植体经过0.05%~0.2%HgCl2消毒后,污染率均高于经2%~8% NaClO消毒的外植体。随着HgCl2或NaClO的浓度升高,污染率明显降低,其中8%NaClO消毒10 min后,外植体污染率为0,但外植体经2%~8%NaClO消毒后均呈不同程度的乳白色,甚至半透明,不能诱导出丛生芽或愈伤组织,说明受到了严重伤害(图 1A)。而经HgCl2消毒处理的外植体能诱导出新芽或愈伤组织,其中0.1%HgCl2消毒处理的污染率为58.17%,萌芽后发育状态较好(图 1B);0.2%HgCl2消毒处理后外植体污染率下降到41.83%,但受伤害较严重,萌芽慢且发育迟缓(图 1C)。
|
|
| A:无预处理,2% NaClO消毒10 min;B:0.5% 多菌灵浸泡2 h,0.1%HgCl2消毒10 min;C:无预处理,0.2%HgCl2消毒;D:0.05% 多菌灵浸泡2 h,0.1%HgCl2消毒10 min A: No pretreatment and sterilized for 10 min with 2% NaClO; B: Pretreated for 2 h with 0.5% carbendazim and sterilized for 10 min with 0.1%HgCl2; C: No pretreatment and sterilized for 10 min with 0.2% HgCl2; D: Pretreated for 2 h with 0.05% carbendazim and sterilized for 10 min with 0.1%HgCl2 图 1 不同预处理和消毒方法对外植体消毒效果的影响 Fig. 1 Effects of different pretreatment and sterilization methods on explants |
当外植体先经过流水冲洗2 h或多菌灵浸泡2 h的预处理后,再依次用75% 乙醇和0.1%HgCl2消毒处理,污染率均下降到20% 以下,其中0.5% 多菌灵浸泡2 h的预处理方式效果最好,污染率仅1.67%(表 1)。而在外植体先经过0.5% 多菌灵浸泡2 h和75% 乙醇浸泡45 s,发现0.1%HgCl2消毒6~8 min,污染率稍有升高,而消毒12 min的污染率也很低,但外植体变化缓慢。综合污染率及诱导后的新芽发育情况,最好的消毒措施为:0.5% 多菌灵浸泡2 h,75% 乙醇浸泡45 s,0.1%HgCl2消毒10 min,污染率控制在1.67%,诱导的新芽长势最好。
2.2 不同外植体对华重楼诱导效果的影响以华重楼幼苗叶片、叶柄和茎段为外植体,能够诱导出愈伤(图 2A、B),但诱导率普遍较低,仅10% 左右,而且容易出现褐化现象;根系不能诱导出愈伤或不定芽;幼嫩块茎能够诱导出不定芽,但诱导率只有25% 左右,而以去掉茎叶的幼苗(仅含根和幼嫩块茎)或幼苗(完整植株)为外植体,容易诱导出不定芽或愈伤(图 2C~G),诱导率均在80% 以上。

|
| A:茎段诱导培养30 d;B:叶片诱导培养60 d;C:含根的幼嫩块茎诱导培养60 d;D:幼苗诱导培养15 d;E:幼苗诱导培养90 d;F: 去掉叶片的幼苗诱导培养30 d;G:去掉茎叶的幼苗诱导培养120 d A: 30 days after induced with stem segments; B: 60 days after induced with leaves; C: 60 days after induced wtih young tubers with roots; D: 15 days after induced with seedlings; E: 90 days after induced with seedlings: F: 30 days after induced with seedlings without leaves; G: 120 days after induced with seedlings without leaves and stems 图 2 不同外植体对华重楼诱导效果的影响 Fig. 2 Effects of different explants on the induction of Paris polyphylla var. chinensis |
2.3 不同培养基对华重楼不定芽诱导效果的影响
以华重楼幼苗或去掉茎叶的幼苗为外植体,不同培养基对不定芽诱导效果(表 2)表明,以MS为基本培养基,添加6-BA 0.1 mg/L、NAA 0.5 mg/L、GA3 0.5 mg/L的激素配比,不定芽诱导率达83.33%;当升高6-BA浓度,降低NAA浓度,不添加GA3,诱导率下降为56.67%~70.00%。从表 2还可以看出,以WPM为基本培养基时,不定芽诱导率均高于90%,其中以添加ZT 2.0 mg/L、NAA 0.1 mg/L激素配比的不定芽诱导率最高,达98.33%,同时芽的发育状态也较好。综上,华重楼不定芽诱导最佳培养基为WPM+2.0 mg/L ZT+0.1 mg/L NAA+30 g/L蔗糖。
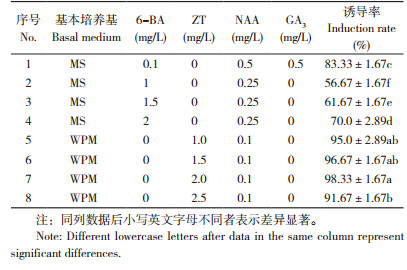
|
2.4 不同培养基对华重楼不定芽增殖效果的影响
从表 3可以看出,增殖效果最好的培养基为4号(MS+2.0 mg/L 6-BA+1.0 mg/L IAA+30 g/L蔗糖,图 3D),增殖产生的不定芽较多,增殖系数达3.75,显著高于其他培养基;其次为2号(MS+0.1 mg/L6-BA+0.5 mg/L NAA+0.5 mg/L GA3+30 g/L蔗糖,图 3A),增殖系数达3.25,不定芽生长整齐、健壮;其他培养基增殖系数相对较低(图 3B、C)。
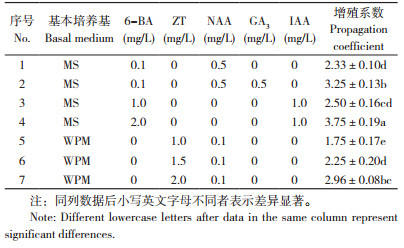
|

|
| A:在2号培养基中培养90 d;B:在5号培养基中培养90 d;C:诱导培养的增大鳞茎继续在6号培养基中培养90 d;D:在4号培养基中培养90 d A: Cultured for 90 days in medium No. 2; B: 90 days in medium No. 5; C: Cultured for 90 days in medium No.6 with single bulb; D: Cultured for 90 days in medium No.4 图 3 不同培养基对华重楼不定芽增殖的影响 Fig. 3 Effects of different media on adventitious buds multiplication of Paris polyphylla var. chinensis |
2.5 不同培养基对华重楼不定芽生根和结鳞茎效果的影响
表 4结果显示,以WPM为基本培养基,NAA浓度为0.1 mg/L,随着ZT浓度的升高,华重楼不定芽生根及结鳞茎率逐渐增大,生根数逐渐增多,根系更长,鳞茎直径也变大,当ZT浓度为2.0 mg/L时,生根及结鳞茎率96.67%,生根数3.84条,根长4.15 cm,鳞茎直径0.86 cm;当ZT浓度为2.0 mg/L,而NAA浓度增加为0.2 mg/L时,生根数4.92条,根长4.75 cm,但生根和结鳞茎率稍有降低(88.33%),鳞茎直径较小,只有0.53 cm。由图 4可知,华重楼不定芽生根和结鳞茎最好的培养基为3号(WPM+2.0 mg/L ZT+ 0.1 mg/L NAA+30 g/L蔗糖,图 4D、E)。观察还发现,丛生芽培养90 d时叶片不能展开,继续培养至150 d左右叶片展开,根系变得粗壮,甚至出现变绿的现象(图 4B、E)。
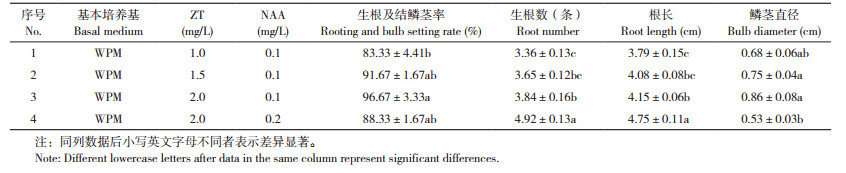
|

|
| A:在1号生根培养基中培养90 d;B:在1号生根培养基中培养150 d;C:在2号生根培养基中培养90 d;D:在3号生根培养基中培养90 d;E:在3号生根培养基中培养150 d;F:在4号生根培养基中培养150 d A: Cultured for 90 days in medium No. 1; B: Cultured for 150 days in medium No.1; C: Cultured for 90 days in medium N0. 2; D: Cultured for 90 days in medium No.3; E: Cultured for 150 days in medium No. 3; F: Cultured for 90 days in medium No. 4 图 4 不同培养基对华重楼不定芽生根和结鳞茎效果的影响 Fig. 4 Effects of different media on adventitious buds rooting and bulb setting of Paris polyphylla var. chinensis |
2.6 移栽基质和移栽时间对华重楼生根苗移栽驯化的影响
从华重楼生根苗移栽到不同基质后30 d的成活率(表 5)可以看出,3—5月或6—8月移栽成活率均较低,其中3—5月生根苗移栽到基质Ⅰ(泥炭土︰珍珠岩∶河沙=2 ∶ 1 ∶ 1)的成活率最高,为30% 左右;而6—8月移栽到室外后,华重楼组培苗均难成活。
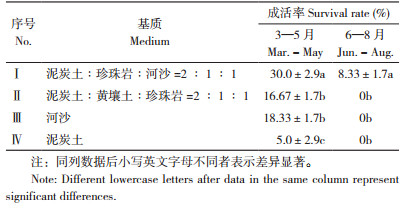
|
3 讨论
组织培养是快速、大量获得药用植物优质种苗的重要方式。重楼属植物组培快繁存在外植体污染率高、诱导率低且不稳定、增殖系数低、瓶内生根困难或者生根率较低等问题。本研究发现,华重楼幼苗或去掉茎叶的幼苗先经过0.5% 多菌灵浸泡2 h的预处理,再用75% 乙醇浸泡45 s、0.1% HgCl2消毒8~10 min,外植体污染率控制在5.0% 左右,筛选出诱导不定芽的最佳培养基为WPM+2.0 mg/L ZT+0.1 mg/L NAA+30 g/L蔗糖,诱导率95% 以上,且诱导出的新芽生长快(15~30 d)、长势较好。熊海浪等[26]发现,滇重楼只有种胚能诱导出愈伤组织,而李群等[27]发现重楼属植物的根和叶片不能诱导出愈伤。罗晓锋等[28]报道,福建七叶一枝花不同外植体的诱导率差异较大,利用幼苗做外植体,既能诱导出愈伤组织也能分化出幼苗,诱导率达到58.33%;徐梅珍等[24]也利用重楼幼苗成功诱导出组培苗。这些研究结果说明,以幼苗为外植体可能是研究华重楼组培快繁的最适外植体,其原因可能是保留的根系有利于吸收营养成分,而保留的鳞茎(块茎)部位保留了生长点,有利于萌发新芽。本研究还发现,诱导的华重楼不定芽基部形成明显膨大的鳞茎,把该鳞茎切割增殖,能增殖出不定芽,增殖系数可达3.75;或直接转接到生根培养基,能长出根系,鳞茎发育迅速,远大于同时期移栽室外的幼苗,但叶片展开则需要120~150 d,这可能与其先生根后长叶片的发育习性有关。但这一增殖系数相对大多数植物的增殖系数仍较低[29-31],仍需要开展提高增殖系数的研究。
组培瓶苗的移栽驯化也是组培快繁技术的关键步骤,对大部分植物而言,春季移栽比较适宜萌发新芽,有利于提高移栽成活率。杨丽云等[19]把云南重楼组培苗移栽到腐殖质土,成活率为65%。本研究于3—5月多次移栽驯化结果表明,华重楼的生根苗移栽成活率均较低,极易引起茎腐病或根腐病,成活率不足30%;而6—8月移栽均难成活,这可能与桂林地区该季节多雨潮湿有关。据报道,重楼属植物即使成苗也很容易于多雨潮湿的春季发生病害[27-28]。此外,由于华重楼属于带芽越冬休眠,第二年春季再发芽,秋季9—10月可能更适宜其组培苗的移栽驯化。
4 结论本研究建立了适合华重楼外植体预处理及消毒的方法以及适宜不定芽诱导、增殖及生根和结鳞茎的组培快繁体系:首先将华重楼幼苗材料经过0.5% 多菌灵浸泡2 h,75% 乙醇浸泡45 s,0.1% HgCl2消毒10 min,晾干水分后接种至最佳诱导培养基WPM+2.0 mg/L ZT+0.1 mg/L NAA+30 g/L蔗糖中,培养至鳞茎增大或不定芽增多;其次,将鳞茎或不定芽切割成2~4份,移植到增殖培养基MS+2.0 mg/L 6-BA+1.0 mg/L IAA+30 g/L蔗糖培养90 d;然后用WPM+2.0 mg/L ZT+0.1 mg/L NAA+30 g/L蔗糖培养90 d后生根及结鳞茎;最后可移至室外驯化。整个组培快繁体系可使外植体污染率降至1.67%,诱导率达98.33%,丛生芽增殖系数3.75,生根及结鳞茎率96.67%,根系数3.84条,根长4.15 cm,鳞茎直径0.86 cm,3—5月移栽成活率达到30%。
| [1] |
中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1978: 92. Editorial Committee of Flora of China. Flora Reipublicae Popularis Sinicae[M]. Beijing: Science Press, 1978: 92. |
| [2] |
国家药典委员会. 中华人名共和国药典一部[M]. 北京: 中国医药科技出版社, 2020: 260. Chinese pharmacopoeia Commission. Pharmacopeia of the People's Republic of China(Part Ⅰ)[M]. Beijing: China Medical Science Press, 2020: 260. |
| [3] |
赵飞亚, 陶爱恩, 夏从龙. 基于国内专利结合资源、应用与开发现状的重楼发展策略探讨[J]. 中国中药杂志, 2018, 43(2): 404-409. DOI:10.19540/j.cnki.cjcmm.2018.0008 ZHAO F Y, TAO A E, XIA C L. Development strategy of Paris based on combination of domestic patent and current resource application and development[J]. China Journal of Chinese Materia Medica, 2018, 43(2): 404-409. DOI:10.19540/j.cnki.cjcmm.2018.0008 |
| [4] |
FENG F F, CHENG P, SUN C, WANG H, WANG W. Inhibitory effects of polyphyllins Ⅰ and Ⅶ on human cisplatin-resistant NSCLC via p53 upregulation and CIP2A/AKT/mTOR signaling axis inhibition[J]. Chinese Journal of Natural Medicines, 2019, 17(10): 768-777. DOI:10.1016/S1875-5364(19)30093-7 |
| [5] |
李洪梅, 孙建辉, 康利平, 霍海如, 李小芹, 黄圆圆, 陈敏, 黄璐琦. 重楼同属植物南重楼的药理研究[J]. 中国中药杂志, 2017, 42(18): 3465-3468. DOI:10.19540/j.cnki.cjcmm.20170814.002 LI H M, SUN J H, KANG L P, HUO H R, LI X Q, HUANG Y Y, CHEN M, HUANG L Q. Pharmacodynamics study on Paris vietnamensis[J]. China Journal of Chinese Materia Medica, 2017, 42(18): 3465-3468. DOI:10.19540/j.cnki.cjcmm.20170814.002 |
| [6] |
ZHANG C, LI C Y, JIA X J, WANG K, TU Y B, WANG R C, LIU K C, LU T, HE C W. In vitro and in vivo anti-inflflammatory effects of polyphyllin Ⅶ through downregulating MAPK and NF-κB pathways[J]. Molecules, 2019, 24(5): 875. DOI:10.3390/molecules24050875 |
| [7] |
CAI X Q, GUO L L, PEI F, CHANG X, ZHANG R. Polyphyllin G exhibits antimicrobial activity and exerts anticancer effects on human oralcancer OECM-1 cells by triggering G2/M cell cycle arrest by inactivating cdc25C-cdc2[J]. Archives of Biochemistry and Biophysics, 2018, 644: 93-99. DOI:10.1016/j.abb.2018.01.008 |
| [8] |
SHEN S, CHEN D J, LI X, LI T, YUAN M, ZHOU Y H, DING C B. Optimization of extraction process and antioxidant activity of polysaccharides from leaves of Paris polyphylla[J]. Carbohydrate Polymers, 2014, 104(1): 80-86. DOI:10.1016/j.carbpol.2014.01.006 |
| [9] |
杨光义, 胡培, 叶方. 重楼资源分布与可持续利用研究进展[J]. 中国药师, 2016, 19(1): 159-162. DOI:10.3969/j.issn.1008-049X.2016.01.049 YANG G Y, HU P, YE F. Research progress in resources distribution and sustainable utilization of Rhizoma paridis[J]. China Pharmacist, 2016, 19(1): 159-162. DOI:10.3969/j.issn.1008-049X.2016.01.049 |
| [10] |
DEB C R, JAMIR S L, JAMIR N S. Studies on vegetative and reproductive ecology of Paris polyphylla Smith: A vulnerable medicinal plant[J]. American Journal of Plant Sciences, 2015, 6(16): 2561-2568. DOI:10.4236/ajps.2015.616258 |
| [11] |
戴兴福. 林分类型和郁闭度对林下套种七叶一枝花的影响[J]. 林业勘察设计, 2021(4): 56-58. DAI X F. Effects of stand type and canopy density on understory interplanting of Paris polyphylla[J]. Forestry Prospect and Design, 2021(4): 56-58. |
| [12] |
苏海兰, 郑梅霞, 陈宏, 江保东, 何桂强, 刘祥凤, 朱育菁. 七叶一枝花林下仿生态栽培关键技术[J]. 福建农业科技, 2020(4): 67-70. DOI:10.13651/j.cnki.fjnykj.2020.04.012 SU H L, ZHENG M X, CHEN H, JIANG B D, HE G Q, LIU X F, ZHU Y J. Key techniques of the underwood imitative ecological cultivation of Paris polyphylla[J]. Fujian Agricultural Science and Technology, 2020(4): 67-70. DOI:10.13651/j.cnki.fjnykj.2020.04.012 |
| [13] |
GONG Z, GONG F W, PENG J, LUO X Q. Different understory cultivation techniques of Paris polyphylla Smith[J]. Agricultural Science & Technology, 2016, 17(2): 353-357. |
| [14] |
鲍英杰, 许梅, 范祥祯, 华俊, 周紫球. 华重楼在不同海拔杉木林下栽培试验[J]. 南方农业, 2021, 15(20): 19-21. DOI:10.19415/j.cnki.1673-890x.2021.20.009 BAO Y J, XU M, FAN X Z, HUA J, ZHOU Z Q. Cultivation experiment of Paris polyphylla under Chinese fir forest at different elevations[J]. South China Agriculture, 2021, 15(20): 19-21. DOI:10.19415/j.cnki.1673-890x.2021.20.009 |
| [15] |
李晓冬. 华重楼种子快速萌发研究[D]. 杨凌: 西北农林科技大学, 2018. LI X D. Study on the rapid germination of seed of Paris polyphylla var. chinensis[D]. Yangling: Northwest A & F University, 2018. |
| [16] |
姜美杰. 华重楼种子后熟萌发生理及人工干预措施研究[D]. 雅安: 四川农业大学, 2017. JIANG M J. Research on after-ripening, germination physiology and artificial intervention of Paris seed[D]. Yaan: Sichuan Agricultural University, 2017. |
| [17] |
臧薇. 华重楼组织培养体系建立的研究[D]. 雅安: 四川农业大学, 2013. ZANG W. A reserarch onbuilding tissue culture syetem Paris polyphylla var. chinensis[D]. Yaan: Sichuan Agricultural University, 2013. |
| [18] |
周玲, 姚振, 郭永兵, 周存宇. 重楼属植物组织培养研究进展[J]. 北方园艺, 2017(20): 184-189. ZHOU L, YAO Z, GUO Y B, ZHOU C Y. Progress on tissue culture of Paris spp[J]. Northern Horticulture, 2017(20): 184-189. |
| [19] |
郝长琦. 重楼组织培养及甾体皂苷生物合成关键OSC酶鉴定[D]. 哈尔滨: 东北林业大学, 2021. DOI: 10.27009/d.cnki.gdblu.2021.000304. HAO C Q. Preliminary study on tissue culture system of Paris polyphylla and identification of key OSC enzymes for Sterodidal Saponin biosynthesis[D]. Harbin: Northeast Forestry University, 2021. DOI: 10.27009/d.cnki.gdblu.2021.000304. |
| [20] |
YANG H, LIU F, AN W, TIAN M L. Control study on contamination rate of tissue culture of Paris polyphylla[J]. Advanced Materials Research, 2014, 926-930: 975-980. DOI:10.4028/www.scientific.net/amr.926-930.975 |
| [21] |
王跃华, 刘银花, 陈燕, 唐旭, 何新友, 何诗红. 华重楼种子休眠解除及愈伤组织诱导[J]. 江苏农业科学, 2015, 43(6): 223-225. DOI:10.15889/j.issn.1002-1302.2015.06.073 WANG Y H, LIU Y H, CHEN Y, TANG X, HE X Y, HE S H. Seed dormancy release and callus induction of Paris polyphylla var. chinensis[J]. Jiangsu Agricultural Sciences, 2015, 43(6): 223-225. DOI:10.15889/j.issn.1002-1302.2015.06.073 |
| [22] |
杨丽云, 陈翠, 吕丽芬, 袁理春. 云南重楼的组织培养与植株再生[J]. 植物生理学通讯, 2008, 44(5): 947-948. YANG L Y, CHEN C, LYU L F, YUAN L C. Tissue culture and plantlet regeneration of Paris polyphylla Smith var. yunnanensis (Franch.) Hand.-Mazz[J]. Plant Physiology Communications, 2008, 44(5): 947-948. |
| [23] |
刘银花, 王跃华, 唐旭, 陈燕, 黄鹏, 梅英. 华重楼植株的快速繁殖研究[J]. 中草药, 2015, 46(19): 2925-2931. DOI:10.7501/j.issn.0253-2670.2015.19.018 LIU Y H, WANG Y H, TANG X, CHEN Y, HUANG P, MEI Y. Rapid propagation of Paris polyphylla var. chinensis[J]. Chinese Traditional and Herbal Drugs, 2015, 46(19): 2925-2931. DOI:10.7501/j.issn.0253-2670.2015.19.018 |
| [24] |
徐梅珍, 毕云慧, 王文艳, 刘旋, 闫怡新, 王德富. 重楼组织培养和快繁体系的建立[J]. 山西农业科学, 2017, 45(9): 1412-1414. DOI:10.3969/j.issn.1002-2481.2017.09.05 XU M Z, BI Y H, WANG W Y, LIU X, YANG Y X, WANG D F. Establishment of tissue culture and rapid propagation system of Rhizoma paridis[J]. Journal of Shanxi Agricultural Sciences, 2017, 45(9): 1412-1414. DOI:10.3969/j.issn.1002-2481.2017.09.05 |
| [25] |
RAOMAI S, KUMARIA S, TANDON P. Plant regeneration through direct somatic embryogenesis from immature zygotic embryos of the medicinal plant, Paris polyphylla Sm[J]. Plant Cell Tissue and Organ Culture, 2014, 118(3): 445-455. DOI:10.1007/s11240-014-0496-2 |
| [26] |
熊海浪, 易继财, 张宗申. 滇重楼种子萌发及组织培养研究[J]. 广东农业科学, 2011, 38(21): 47-49. DOI:10.16768/j.issn.1004-874X.2011.21.058 XIONG H L, YI J C, ZHANG Z S. Studies on the seed germination and tissue culture of Paris polyphylla var.yunnanensis[J]. Guangdong Agricultural Sciences, 2011, 38(21): 47-49. DOI:10.16768/j.issn.1004-874X.2011.21.058 |
| [27] |
李群, 陈丽萍, 葛方兰. 重楼属植物愈伤组织的诱导和培养[J]. 四川师范大学学报(自然科学版), 2006, 29(1): 120-122. LI Q, CHEN L P, GE F L. Callus tissue induction and culture of Pairs[J]. Journal of Sichuan Normal University(Natural Science), 2006, 29(1): 120-122. |
| [28] |
罗晓锋, 周建金, 叶炜, 乔锋, 廖承树. 福建七叶一枝花组织培养及主效成分测定[J]. 浙江农业科学, 2021, 62(7): 1398-1401. DOI:10.16178/j.issn.0528-9017.20210741 LUO X F, ZHOU J J, YE W, QIAO F, LIAO C S. Tissue culture and determination of main components of Paris polyphylla in Fujian[J]. Journal of Zhejiang Agricultural Sciences, 2021, 62(7): 1398-1401. DOI:10.16178/j.issn.0528-9017.20210741 |
| [29] |
程雨飞, 朱向涛, 季雯, 洪尔蔓, 林芯, 范贞, 张俊丽. 牡丹愈伤组织增殖及褐化研究[J]. 广东农业科学, 2019, 46(6): 30-36. DOI:10.16768/j.issn.1004-874X.2019.06.005 CHENG Y F, ZHU X T, JI W, HONG E M, LIN X, FAN Z, ZHANG J L. Study on proliferation and browning of Peony callus[J]. Guangdong Agricultural Sciences, 2019, 46(6): 30-36. DOI:10.16768/j.issn.1004-874X.2019.06.005 |
| [30] |
仇硕, 赵志国, 赵健, 夏科, 熊亚兰, 唐凤鸾. 翅萼石斛组织培养及快繁技术研究[J]. 广东农业科学, 2018, 45(9): 48-52, 173. DOI:10.16768/j.issn.1004-874X.2018.09.008 QIU S, ZHAO Z G, ZHAO Z, XIA K, XIONG Y L, TANG F L. Tissue culture and rapid propagation of Dendrobium cariniferum[J]. Guangdong Agricultural Sciences, 2018, 45(9): 48-52, 173. DOI:10.16768/j.issn.1004-874X.2018.09.008 |
| [31] |
吴雅露, 王颖, 陈梦涛, 应鹏飞, 蒋玉蓉, 陆国权. 彩叶芋组织快速繁殖技术研究[J]. 广东农业科学, 2019, 46(3): 31-36. DOI:10.16768/j.issn.1004-874X.2019.03.005 WU Y L, WANG Y, CHEN M T, YING P F, JIANG Y R, LU G Q. Study on rapid propagation technology for Caladium bicolor tissue[J]. Guangdong Agricultural Sciences, 2019, 46(3): 31-36. DOI:10.16768/j.issn.1004-874X.2019.03.005 |
(责任编辑 邹移光)
 2022, Vol. 49
2022, Vol. 49