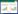文章信息
基金项目
- 河南省重点研发与推广专项(科技攻关)(222102110091,222102110050);河南科技学院师资队伍博士化计划建设项目(103020222001/014)
作者简介
- 张怀胜(1986—),男,博士,讲师,研究方向为玉米C型恢复基因的发掘与应用,E-mail:zhanghuaisheng1106@126.com.
文章历史
- 收稿日期:2022-03-07
玉米(Zea mays L.)为禾本科(Gramineae)玉蜀黍属1年生草本植物,有玉蜀黍、苞谷、棒子等俗名。玉米起源于南美洲墨西哥地区,从北纬58°的加拿大到南纬40°的阿根廷都有种植,相比水稻和小麦而言,玉米已成为全世界范围种植最广的农作物,为全球粮食安全提供了重要保障[1-3]。
雄性不育是高等植物中普遍的生物学现象,指植物在生长发育过程中由于受到环境条件和自身遗传基因的影响所导致的雄花不能产生裂开的花药、有功能的花粉但植株的雌性生殖系统发育正常,可以接受外来的花粉而受精的一种生物学现象[4-6]。雄性不育普遍存在于开花植物中,1763年德国植物学家Joseph Gottlieb Kölreuter首先发现雄性不育现象以来,已经在主要农作物如玉米、水稻、小麦、棉花、高梁、油菜及其他作物如甜菜、向日葵、洋葱、辣椒、菜豆、萝卜等在内的43科162属617个种或种间杂种中发现了雄性不育现象[7-8]。植物雄性不育根据其表型主要有5种类型:(1)雄花退化或畸形导致产生花粉的功能丧失;(2)花药里的孢子囊退化导致败育的花药虽然与正常花药外形相似但不能产生有功能的花粉;(3)花药内部小孢子退化,引起产生畸形花粉与败育花粉;(4)花药中的花粉存在功能缺陷,授粉后不能正常萌发;(5)花药中的花粉虽然有活力但花药不开裂[9-10]。
玉米为异花授粉作物,雌花和雄花分开的特征使其成为最早利用杂种优势的作物并取得了巨大成功,杂种优势的利用使杂交种的产量比自交系提高15% ~50%[11]。在玉米杂交种子生产过程中,利用雄性不育制种不但可以省去大量劳动力,节约制种成本,而且可以避免母本去雄不彻底带来种子纯度下降而导致的产量降低[12]。此外,质-核互作雄性不育的不育机理与恢复机理涉及到线粒体基因和细胞核基因,使其成为研究核-质互作的理想模型[13-14]。因此,对玉米细胞质雄性不育进行研究,不但在生产上可以促进杂种优势利用,而且对解析质-核互作分子机制具有重要参考价值[15-17]。本文阐述了玉米细胞质雄性不育的特征、分类和恢复基因与不育基因的研究进展,以及玉米细胞质雄性不育利用过程中的问题与展望,以期为玉米细胞质雄性不育在生产上应用提供理论参考。
1 雄性不育的分类雄性不育现象的发生是内部基因与外部环境条件综合影响的结果。早在1947年Sears把自然界中发现的雄性不育现象划分为3种类型:一是细胞核雄性不育(genic male sterility,GMS),其不育性状受植株的细胞核基因控制且表现出典型的孟德尔遗传;二是细胞质雄性不育(cytoplasmic male sterility,CMS),其不育性状受细胞质(线粒体)基因控制遗传方式为非孟德尔遗传,属母系遗传;三是细胞核-细胞质互作不育(genic-cytoplasmic male sterility),其不育性状由细胞核基因和细胞质基因两者共同来决定[18]。后来对植物雄性不育的深入研究,发现单一的细胞质雄性不育是不存在的,1956年Edwardson将雄性不育重新划分为两种类型:细胞核不育类型和细胞质-核互作不育类型即现在所讲的细胞质雄性不育(CMS)[19]。
玉米是利用其进行杂交制种最早的作物之一。1933年首次在秘鲁玉米群体中发现了细胞质雄性不育材料,1950年细胞质雄性不育开始应用于玉米杂交种生产[20]。Beckett依据育性恢复专效性原理,首次把28个不同来源的玉米细胞质雄性不育材料划分为S型、C型和T型3种细胞质类型[21]。1982年郑用琏通过不育系与恢复系测交筛选出一套测验方法进行玉米细胞质雄性不育材料的胞质分类:用待测不育材料作母本与恢313进行杂交观察后代的育性表现,育性恢复的材料划分为S型;被保持的材料做母本再与自凤1杂交,被恢复的材料划分为C型;被保持的划分为T型[22]。T型和C型均属于孢子体不育类型,育性受孢子体(植株)基因型决定,与花粉自身基因型无关,败育发生在减数分裂期,败育彻底且育性较为稳定。S型属于配子体不育类型,育性受花粉自身基因决定;败育发生在减数分裂后的单核期与二核期,多数不育材料出现育性不稳定现象。
2 玉米细胞质雄性不育与杂种优势的利用杂种优势(Hybrid vigor/Heterosis)指两个遗传组成存在差异的亲本杂交后代,在营养生长(生活力、生长势等)、生殖生长(产量、品质、营养等)、抗胁迫(生物胁迫、非生物胁迫)能力方面,均明显高于亲本的生物学现象。杂种优势的利用是人类利用遗传规律提高产量最成功的技术手段,早在19世纪60年代,查尔斯达尔文就描述了玉米中的杂种优势,但直到20世纪20年代,玉米的杂种优势才开始被利用,并成为了第一个商业化应用的杂交作物[23]。近年来随着科研工作者的不断探索与努力,目前已经在除了玉米以外的水稻、小麦、油菜等作物上实现了杂种优势利用[9, 24-25]。在玉米、水稻、小麦等农作物的杂交制种过程中,需要进行人工去雄阻止自身花粉的自交结实导致制种的纯度下降。去雄过程中消耗大量的人力、物力与财力,而利用“三系”配套制种技术可以很好解决上述问题。
在农业生产中雄性不育材料的发掘与利用是作物利用杂种优势的基础,生产上雄性不育材料只有在细胞核基因组携带的恢复基因为隐性时才表现出雄性不育现象,如果细胞核所包含的恢复基因为显性时,细胞质虽然含有不育基因但仍然表现可育[26-27]。玉米细胞质雄性不育系在“三系”杂交制种中的应用如图 1所示,包括1个细胞质雄性不育系(细胞核基因为隐性不含恢复基因与胞质基因为不育),1个保持系(细胞核基因不育而细胞质基因正常)用来保持不育系的繁育,1个恢复系(细胞核基因为显性含有恢复基因)。由于不育系不能产生正常的花粉,在制种过程中用来做母本通过与保持系杂交繁殖不育系。细胞质雄性不育保持系与恢复系均可以产生有生殖功能的花粉,两者均通过自交获得后代。由于恢复系可以恢复不育系的育性,不育系与恢复系杂交产生的F1代种子可育即生产上利用的杂交种。

|
| N:正常胞质;S:不育胞质 N: Normal cytoplasm; S: Sterile cytoplasm 图 1 玉米细胞质雄性不育在“三系”杂交制种中的应用模式 Fig. 1 Application model of cytoplasmic male sterility in three-line hybrid seed production of maize |
关于玉米细胞质雄性不育的研究,前期的工作主要是对S型和T型不育材料开展。20世纪50年代,T型不育材料开始应用于玉米杂交种的生产,种植面积曾经达到美国玉米种植面积的80%,由于T型材料高感玉米小斑病,这也引发了玉米小斑病在美国的暴发,导致农业生产遭受巨大经济损失[28]。S型不育性不稳定,容易受到环境因素影响导致败育不彻底,生产应用过程中存在较大风险。C型不育系来源于巴西玉米品种Churny,不育性稳定,败育彻底,生产上有较大的应用价值。然而魏建昆研究发现存在对C型不育材料专化侵染的小斑病生理小种,使C型不育系在生产上得利用蒙上了阴影;进一步研究发现小斑病C小种只对C Ⅰ亚组不育胞质专化侵染,不侵染C Ⅱ和C Ⅲ亚组的不育胞质,这就为利用C Ⅱ与C Ⅲ亚组不育材料提供了依据[29]。然而在C型不育化制种利用过程中最关键的问题是缺少强有力的恢复系材料,这一问题一直是限制C型材料应用的关键问题。因此发现或创造新的细胞质不育类型与具有强恢复能力的恢复系材料,并对其进行详尽的分类是解决玉米细胞质雄性不育应用问题的有效途径[29-31]。
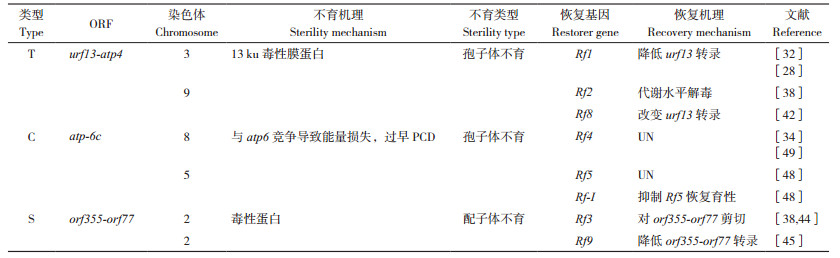
3 玉米细胞质雄性不育基因及其不育机理研究 3.1 玉米细胞质雄性不育基因的发现1986年Dewey利用不育系和可育系的线粒体RNA,分别同不育系线粒体DNA文库进行差减杂交,鉴定到1个T型不育系特有的基因片段,该片段包含2个开放阅读框(ORF)T-urf13和orf25。进一步发现orf25为普通的线粒体基因,而T-urf13编码一个大小为13 ku多肽为T型不育系特有。该基因是玉米中最先发现的不育基因,进一步证明URF13是一个线粒体内膜蛋白,URF13通过影响线粒体内层膜通透性造成电子传递过程受损能量代谢异常,最终引起花粉败育[32-33]。Yang等报道了CMS-C的不育基因是线粒体基因atp6c(表 1)[34]。ATP合成酶又称F1F0-ATP合成酶,在线粒体内催化能量物质ATP的合成,由催化亲水性的F1组分和质子转运的F0组分组成。在呼吸作用过程中,电子传递链释放的能量首先转变为跨膜质子(H+) 梯差,最后质子流顺质子梯差利用ATP合酶使ADP+Pi合成ATP,满足植物体生长发育对能量的需求。线粒体基因atp6和atpβ分别编码F0和F1组分的亚基,在87-1不育系中F1F0-ATP合成酶复合物积累减少,但F1′组件数量和活性均有增加,造成此现象的原因是不育系线粒体中ATP6C蛋白与ATP8蛋白和ATP9蛋白的相互作用能力强于ATP6与ATP8蛋白和ATP9蛋白的相互作用,ATP6C与ATP6的竞争使得具有功能活性F1F0-ATP合成酶的组装数量的大量减少[34]。同时由于ATP合成酶为线粒体电子传递链得最后一个复合物,F1F0-ATP合成酶组装减少时,将会引起线粒体内膜空间中超氧阴离子和过氧化氢大量得积累,从而引发细胞内活性氧(ROS)暴发,造成了玉米花药绒毡层细胞程序性死亡(PCD)的发生时间改变,PCD的提前发生引起花粉败育,这一结果与水稻野败型不育基因WA352类似[34-36]。
|
在S型不育系小孢子发育过程中,花粉败育与嵌合基因orf355-orf77表达密切相关,orf355-orf77为组织特异性表达基因,在花粉表达量高而在其他组织中表达量极低。此外,玉米S型线粒体基因组以线性形式存在,而orf355恰好位于线性化线粒体基因组的端部,进而转录出导致不育的1.6 kb转录本[37]。Xiao等证明了orf355是S型的不育基因,作者通过酵母筛库鉴定到了一个基因ZmDREB1.7(为转录因子),该基因在花药中特异表达,基因的亚细胞定位结果显示其定位于细胞核、细胞质和线粒体,通过EMSA与酵母单杂交实验证明ZmDREB1.7能够结合到orf355基因的启动子区域并促进orf355的转录[38]。
研究发现不育基因Orf355诱导表达后能够显著增强线粒体逆向信号,进一步发现其为一个细胞毒性蛋白,ZmDREB1.7能快速响应Orf355表达后的线粒体逆向信号[38]。对ZmDREB1.7进行序列分析结果发现,ZmDREB1.7启动子区域含有一定数量的未折叠蛋白响应基序,该基序的存在对ZmDREB1.7响应线粒体逆向信号非常重要[38]。在主效恢复基因Rf3不存在的情况下,作者鉴定出一个缺失未折叠蛋白响应基序的单倍型,该单倍型能够部分恢复S组玉米的育性,表明其是S型不育系的弱恢复基因[38]。对于所有细胞质雄性不育而言,一直不清楚的问题是:不育基因为什么仅仅影响花药或花粉的发育,而对其他组织的生长发育没有影响?在S型中推测与花药特异表达的ZmDREB1.7有关,在花药中,ZmDREB1.7促进orf355表达,而orf355表达后积累增强线粒体反向信号,反过来促进ZmDREB1.7表达;因此ZmDREB1.7与orf355在S型玉米的小孢子中形成了一个正反馈调控机制,最终导致orf355蛋白的积累和花粉败育[38]。
3.2 玉米细胞质雄性不育基因来源细胞质雄性不育在植物界的出现是植物自然选择增加进化的一种结果,植物之所以选择杀死雄配子保留雌配子功能的原因是因为植物的雌配子不能随意移动,促进进化最简单、最经济的方法是杀死其雄配子以增加雌花吸收外来花粉的可能性,扩大自身基因的广泛传播并产生不同的后代,以利于植物自身的进化与选择,来适应环境的变化[12]。细胞质雄性不育属于母体遗传,线粒体基因重排的形成的新的ORF是引起花粉败育的直接原因,也是目前已发现大多不育基因的来源[12]。植物线粒体蛋白是由线粒体以及核基因共同编码,大约有10% 的核基因靶向线粒体,线粒体通过向细胞核发送信号以从核基因组产生各种蛋白,满足生命活动的需要[39]。在进化过程中,线粒体基因与细胞核基因如果不协调,就会引起线粒体基因发生非同源重组形成许多新的ORF,这些新的ORF常常参与到RNA编辑、能量缺失、细胞毒性、活性氧等方面最终会导致雄性不育现象的发生[12]。
4 玉米细胞质雄性恢复基因及其恢复机理研究 4.1 玉米CMS-T恢复基因的发现玉米T型胞质雄性不育属于孢子体不育,其育性恢复需要2个互补的显性核基因Rf1和Rf2[40-41]。Rf1的恢复机制是促进T-urf13转录本的加工,产生两个大小分别为1.6 kb和0.6 kb的转录本抑制了Turf13表达,使T-urf13编码的蛋白质URF13丰度降低80%,Rf1突变为rf1,T-urf13不能产生两个大小1.6 kb和0.6 kb的转录本[42]。另外2个T型的恢复基因Rf8和Rf*与Rf1的功能相同,但会产生更小的T-urf13转录本[42]。恢复基因Rf1并未成功克隆,在所有报道的恢复基因中第1个成功克隆的育性恢复基因是T型的恢复基因Rf2,其基因序列和哺乳动物乙醛脱氢酶基因同源;Cui等采用转座子标签法克隆了Rf2,它能部分抑制不育基因T-urf3导致的不育表型,但Rf2对不育基因T-urf13转录本加工和翻译后蛋白的丰度不产生影响[40]。推测恢复基因Rf2通过改变线粒体内的代谢水平,来消除毒性蛋白URF13对线粒体功能产生的损害。进一步研究结果表明:恢复基因Rf2只能部分减轻T型胞质中URF13毒蛋白引起的伤害,并未全部使小孢子的育性得到恢复,因此严格意义上来讲Rf2并非真正的育性恢复基因[31, 43]。
4.2 玉米CMS-S恢复基因的发现玉米S型主要恢复基因为Rf3,编码基因为PPR蛋白,是一类含有三角状五肽重复结构的编码蛋白。研究表明恢复基因Rf3具有靶向线粒体的信号肽能够进入线粒体。Rf3与线粒体基因orf77结合后抑制orf77基因的功能,通过未知的机制加快不育基因orf355的降解,从而使S型的不育表型得到恢复[44]。此外,同属于S型的恢复基因Rf9,作用是减少线粒体基因orf355-orf77亚基因组的数量来恢复育性,但Rf9由于同时受核背景和环境温度的影响,与恢复基因Rf3相比,育性恢复效果较差[45]。
4.3 玉米CMS-C恢复基因的发现在C型不育系中目前已发现了两个恢复基因,分别位于8号和5号染色体上的Rf4和Rf5,Rf4为显性恢复基因可以恢复目前发现的所有的C型不育材料,而Rf5仅能恢复Rf-I基因缺失的C型不育材料;且两个基因存在加性效应,Rf-I基因作为育性抑制基因能抑制Rf5的育性恢复功能[46-48]。Jennifer等报道了CMS-C主要恢复基因Rf4是一个bHLH类型的转录因子,通过CRISPR/ cas9编辑后的遗传转化证明了Rf4表型,但并未对其功能进行解析[49]。至今关于C型恢复基因Rf4与不育基因atp6c的作用机理仍不清楚[49-50]。
4.4 玉米细胞质雄性不育恢复基因的来源自然界进化过程中随着不育基因的出现,从进化角度来讲必然要有恢复基因的存在恢复不育的表型,这样才能产生有活性的花粉进行后代繁衍。恢复基因的功能解析对于CMS的分子机制研究至关重要,有关玉米细胞质雄性不育恢复基因除了T型恢复基因Rf2与S型恢复基因Rf3被克隆之外,关于恢复基因的报道还很少。关于其它作物研究发现多数恢复基因编码PPR蛋白并靶向线粒体发挥而作用,其恢复过程均涉及到了细胞核基因与线粒体基因的互作,而恢复作用则发生在基因水平、转录水平、翻译水平、代谢水平等不同方面[12]。虽然目前对玉米细胞质雄性不育的分子机理的解析还不够深入,恢复基因与不育基因的互作相对复杂,如C型不育基因atp6c为线粒体基因,已经克隆并进行了功能研究,C型恢复基因Rf4是一个转录因子是细胞核基因,细胞核基因Rf4是怎样进入线粒体与atp6c发生作用,目前仍未被解析。
5 玉米细胞质雄性不育利用存在问题与展望我国科研工作者利用雄性不育这一特性,实现农作物的杂交育种和杂种优势利用[51-52]。1976年全国开始在推广“三系”杂交稻以来,杂交水稻的种植面积快速达到了全国水稻栽培面积的50%,产量增加20%~30%,创造了世界粮食增产的伟大壮举,使我国的水稻育种一直处在世界领先水平[53]。玉米作为我国重要的粮饲作物,同样是杂种优势利用最成功的作物之一,采用细胞质雄性不育进行玉米杂交种生产不仅可以节约制种成本,而且可以提高种子纯度与产量。但目前利用玉米细胞质雄性不育与恢复进行制种并没有得到广泛的应用,总结起来有以下几个方面:
(1)玉米品种选育与制种过程中因其异花授粉的属性,使两亲本之间的杂交相对于小麦、水稻等自花授粉作物而言非常容易。由于这一特征,使得玉米容易利用具有优良性状的自交系进行杂交育种,获得的杂交种性状整齐、抗性更强及稳定性更好。因此基本不采用不育系/ 恢复系进行制种。
(2)遗传背景单一的农作物在生产上大面积推广,使得其对生物或非生物胁迫的抵抗能力下降,存在作物大面积感病、受灾减产甚至绝收的风险[8, 54]。单一化大面积推广细胞质雄性不育胞质杂交种,具有潜在的遗传脆弱性且存在病菌生理小种专化侵染的风险。例如美国在20世纪50年代玉米生产上开始推广T型不育胞质杂交种,给玉米生产带来可观的经济效益。但玉米T型的不育基因T-urf13,同时也是造成玉米对叶斑病原菌敏感的关键基因,因此T型胞质杂交种的大面积推广利用,直接导致了玉米小斑病T小种在美国暴发流行,使美国玉米生产遭受巨大的经济损失,最终T型不育胞质杂交种退出生产。
(3)玉米细胞质雄性不育与恢复机理尚未得到全面解析且不育胞质的强恢复基因资源缺乏,应用过程中亲本导入恢复基因的方法周期长、繁琐复杂。目前对于玉米细胞质雄性不育系相关分子基础研究已有很大突破,如CMS-S的不育与恢复机制已经基本解释清楚,但是由于S型不育属于配子体不育,容易受到环境条件的影响,在利用过程中存在较大风险。CMS-C的不育机制已经解释清楚,但恢复基因的研究相对滞后,其内在的分子机理仍不清楚。与此同时,稳定不育材料与含有强恢复基因材料的发现与获得同样是限制其利用的重要方面[55]。
2019年以来,由于受到新冠疫情与国际贸易环境的影响且由于气候条件的变化,玉米生产环境也在不断恶化,极端气候频繁出现,病虫害频发,只有进一步提高玉米单位面积的产量,选育丰产性、抗逆性广的优良品种,减少玉米生产成本,才能满足经济发展与人们对玉米消费持续增长的需求。根据国家“十四五”时期规划纲要,要深化农业供给结构性改革,优化农业农村生产布局的指导方针。随着农村劳动力人数减少,而玉米制种属于劳动密集型产业,不育化制种技术的开发与应用是解决这一问题的一个重要技术手段,不但可以保证玉米杂交种子的纯度与质量,进一步提高单位面积的单产,而且可以节约经济成本,释放制种过程中消耗的大量劳动力,减少劳动成本的投入。相信随着科学技术的不断进步,带动了分子生物学技术的迅速发展,新技术不断应用到植物基因工程和分子育种过程种。相信高新育种技术会很好地解决玉米细胞质雄性不育应用中的问题,玉米细胞质雄性不育的应用会有广阔的发展前景。
| [1] |
MIR C, ZERJAL T, COMBES V, DUMAS F, MADUR D, BEDOYA C, DREISIGACKER S, FRANCO J, GRUDLOYMA P, HAO P X, HEARNE S, JAMPATONG C, LALOË D, MUTHAMIA Z, NGUYEN T, PRASANNA B M, TABA S, XIE C X, YUNUS M, ZHANG S, WARBURTON M L, CHARCOSSET A. Out of America: tracing the genetic footprints of the global diffusion of maize[J]. Theoretical and Applied Genetics, 2013, 126(11): 2671-2682. DOI:10.1007/s00122-013-2164-z |
| [2] |
TANUMIHARDJO S A, MCCULLEY L, ROH R, LOPEZ-RIDAURA S, PALACIOS-ROJAS N, GUNARATNA N S. Maize agro-food systems to ensure food and nutrition security in reference to the Sustainable Development Goals[J]. Global Food Security, 2019, 100327. DOI:10.1016/j.gfs.2019.100327 |
| [3] |
王丰. 杂交水稻育种成就与展望——广东省农业科学院杂交水稻研究50年回顾[J]. 广东农业科学, 2020, 47(12): 1-11. DOI:10.16768/j.issn.1004-874X.2020.12.001 WANG F. Achievements and prospects of hybrid rice breeding—review of 50 Years' research on hybrid rice by Rice Research Institute of Guangdong Academy of Agricultural Sciences[J]. Guangdong Agricultural Sciences, 2020, 47(12): 1-11. DOI:10.16768/j.issn.1004-874X.2020.12.001 |
| [4] |
ZHENG M M, YANG T, LIU X W, LÜ G H, ZHANG P, JIANG B, ZHOU S F, LU Y L, LAN H, ZHANG S Z, LI C, RONG T Z, CAO M J. qRf8-1, a novel QTL for the fertility restoration of maize CMS-C identified by QTL-seq[J]. G3: Genes Genomes Genetics, 2020, 10(7): 2457-2464. DOI:10.1534/g3.120.401192 |
| [5] |
张艳, 陈汉才, 李桂花, 黎庭耀. 菜心Hau CMS雄性不育系的转育研究[J]. 广东农业科学, 2016, 43(1): 30-33. DOI:10.16768/j.issn.1004-874X.2016.01.006 ZHANG Y, CHEN H C, LI G H, LI T Y. Trans-breeding Hau cytoplasmic male sterile line in Chinese flowering cabbage[J]. Guangdong Agricultural Sciences, 2016, 43(1): 30-33. DOI:10.16768/j.issn.1004-874X.2016.01.006 |
| [6] |
李颖, 王恒明, 徐小万, 徐晓美, 王得元, 李乃坚, 余小林. 华南地区辣椒品种选育及育种技术研究进展[J]. 广东农业科学, 2020, 47(11): 60-69. DOI:10.16768/j.issn.1004-874X.2020.11.007 LI Y, WANG H M, XU X W, XU X M, WANG D Y, LI N J, YU X L. Breeding of pepper cultivars in South China and research progress in pepper breeding technology[J]. Guangdong Agricultural Sciences, 2020, 47(11): 60-69. DOI:10.16768/j.issn.1004-874X.2020.11.007 |
| [7] |
KAUL M L H. Male Sterility in Higher Plants[M]. New York: 1988, Springer-Verlag.
|
| [8] |
李宏, 周少川, 黄道强, 赖穗春, 王志东, 周德贵, 王重荣, 方小龙. 利用水稻细胞质雄性不育系的育种策略与实践[J]. 广东农业科学, 2015, 42(4): 1-3. DOI:10.16768/j.issn.1004-874X.2015.04.015 LI H, ZHOU S C, HUANG D Q, LAI S C, WANG Z D, ZHOU D G, WANG C R, FANG X L. Rice breeding strategy and practices by using CMS line[J]. Guangdong Agricultural Sciences, 2015, 42(4): 1-3. DOI:10.16768/j.issn.1004-874X.2015.04.015 |
| [9] |
TAJAMUL R S, KAMLESH P, PRADYUMAN K. Maize A potential source of human nutrition and health: A review[J]. Cogent Food & Agriculture, 2016, 2(1): 1166995. DOI:10.1080/23311932.2016.1166995 |
| [10] |
WU F, GUCLU H. Global maize trade and food security: Implications from a social network model[J]. Risk Analysis, 2013, 33(12): 2168-2178. DOI:10.1111/risa.12064 |
| [11] |
TESTER M, LANGRIDGE P. Breeding technologies to increase crop production in a changing world[J]. Science, 2010, 327(5967): 818-822. DOI:10.1126/science.1183700 |
| [12] |
CHEN L, LIU Y. Male sterility and fertility restoration in crops[J]. Annual Review of Plant Biology, 2014, 65(1): 579-606. DOI:10.1146/annurev-arplant-050213-040119 |
| [13] |
AVERSA R, VICTORIA V R, APICELLA A, TPETRESCU F I. Mitochondria are naturally micro robots a review[J]. American Journal of Engineering and Applied Sciences, 2016, 9(4): 991-1002. DOI:10.3844/ajeassp.2016.991.1002 |
| [14] |
CHEN Z, HUA J, NIE H, WENDEL JF, ZHAO N, LI S, GROVER C E. Plant mitochondrial genome evolution and cytoplasmic male sterility[J]. Critical Reviews in Plant Sciences, 2017, 36(1): 55-69. DOI:10.1080/07352689.2017.1327762 |
| [15] |
RANUM P, PENA JP, GARCIACASAL MN. Global maize production, utilization, and consumption[J]. Annals of the New York Academy of Sciences, 2014, 1312(1): 105-112. DOI:10.1111/nyas.12396 |
| [16] |
范彦君, 王瑜, 刘齐元, 周清明, 周玮. 植物细胞质雄性不育研究进展[J]. 中国农学通报, 2016, 32(18): 70-75. DOI: 10.CNKI:SUN:ZNTB.0.2016-18-015. FAN Y J, WANG Y, LIU Y Q, ZHOU Q M, ZHOU W. Advances in cytoplasmic male sterility in plants[J]. Chinese Agricultural Science Bulletin. 2016 32(18): 70-75. DOI: 10.CNKI:SUN:ZNTB.0.2016-18-015. |
| [17] |
杨慧丽, 杨露, 张怀胜, 林亚楠, 李冰, 薛亚东. 植物CMS不育基因的研究进展[J]. 广东农业科学, 2018, 45(10): 9-16. DOI:10.16768/j.issn.1004-874X.2018.10.002 YANG H L, YANG L, ZHANG H S, LIN Y N, LI B, XUE Y D. Advanced studies on the cytoplasm male sterility in plants[J]. Guangdong Agricultural Sciences, 2018, 45(10): 9-16. DOI:10.16768/j.issn.1004-874X.2018.10.002 |
| [18] |
SEARS E R. Nullisomic tetrasomic combinations in hexaploid wheat. Chromosome manipulations and plant genetics[J]. Springer US, 1966, 20: 29-45. DOI:10.1007/978-1-4899-6561-5-4 |
| [19] |
EDWARDSON J R, CORBETT M K. A sexual transmission of cytoplasmic male sterility[J]. Proceedings of the National Academy of Sciences of the United States of America, 1961, 47(3): 390-396. DOI:10.1073/pnas.47.3.390 |
| [20] |
FORDE B G, LEAVER C J. Nuclear and cytoplasmic genes controlling synthesis of variant mitochondrial polypeptides in male-sterile maize[J]. Proceedings of the National Academy of Sciences of the United States of America, 1980, 77(1): 418-422. DOI:10.1073/pnas.77.1.418 |
| [21] |
BECKETT J B. Classification of male-sterile cytoplasms in maize (Zea mays L.)[J]. Crop Science, 1971, 11(5): 724-727. DOI:10.1007/BF02862061 |
| [22] |
郑用琏. 若干玉米细胞质雄性不育类型(CMS)育性机理的研究[J]. 华中农学院学报, 1982(1): 44-68. DOI:10.13300/j.cnki.hnlkxb.1982.01.005 ZHENG Y L. Studies on the fertility mechanism of several cytoplasmic male sterility (CMS) types in maize[J]. Journal of Huazhong Agricultural College, 1982(1): 44-68. DOI:10.13300/j.cnki.hnlkxb.1982.01.005 |
| [23] |
KIM Y J, ZHANG D B. Molecular control of male fertility for crop hybrid breeding[J]. Trends in Plant Science, 2018, 23(1): 53-65. DOI:10.1016/j.tplants.2017.10.001 |
| [24] |
LIU Y M, WEI G, XIA Y Y, LIU X W, TANG J, LU Y L, LAN H, ZHANG S Z, LI C, CAO M J. Comparative transcriptome analysis reveals that tricarboxylic acid cycle-related genes are associated with maize CMS-C fertility restoration[J]. BMC Plant Biology, 2018, 18(1): 1-14. DOI:10.1186/s12870-018-1409-z |
| [25] |
STORCHOVA H. The role of non-coding RNAs in cytoplasmic male sterility in flowering plants[J]. International Journal of Molecular Sciences, 2017, 18(11): 2429. DOI:10.3390/ijms18112429 |
| [26] |
柳武革, 王丰, 李金华, 朱满山, 廖亦龙, 付崇允, 刘迪林, 曾学勤, 马晓智, 霍兴, 孔乐. 水稻三系不育系的分子设计改良与应用[J]. 广东农业科学, 2021, 48(10): 69-77. DOI:10.16768/j.issn.1004-874X.2021.10.008 LIU W G, WANG F, LI J H, ZHU M S, LIAO Y L, FU C Y, LIU D L, ZENG X Q, MA X Z, HUO X, KONG L. Improvement of three-line rice male sterile lines by molecular design and their application[J]. Guangdong Agricultural Sciences, 2021, 48(10): 69-77. DOI:10.16768/j.issn.1004-874X.2021.10.008 |
| [27] |
潘大建, 李晨, 范芝兰, 孙炳蕊, 陈文丰, 江立群, 张静, 吕树伟, 刘清, 毛兴学. 广东省农业科学院水稻种质资源研究60年: 成就与展望[J]. 广东农业科学, 2020, 47(11): 18-31. DOI:10.16768/j.issn.1004-874X.2020.11.003 PAN D J, LI C, FAN Z L, SUN B R, CHEN W F, JIANG L Q, ZHANG J, LYU S W, LIU Q, MAO X X. Sixty years' researches on rice germplasm resources of Guangdong Academy of Agricultural Sciences: Achievements and prospects[J]. Guangdong Agricultural Sciences, 2020, 47(11): 18-31. DOI:10.16768/j.issn.1004-874X.2020.11.003 |
| [28] |
LEVINGS C R. Thoughts on cytoplasmic male sterility in CMS-T maize[J]. Plant Cell, 1993, 5(10): 1285-1290. DOI:10.1105/tpc.5.10.1285 |
| [29] |
刘克明, 吴全安, 刘俊芳, 梁克恭, 魏建昆. 玉米小斑病菌三个生理小种生物学特征比较的初步研究[J]. 华北农学报, 1989(2): 74-78. DOI:10.3321/j.issn:1000-7091.1989.02.013 LIU K M, WU Q A, LIU J F, LIANG K G, WEI J K. Preliminary studies on comparative biological traits of three races of bipolaris maydis[J]. Acta Agriculturae Boreali-Sinica, 1989(2): 74-78. DOI:10.3321/j.issn:1000-7091.1989.02.013 |
| [30] |
时子文, 何青, 赵卓凡, 刘孝伟, 张鹏, 曹墨菊. 玉米雄性不育资源的发掘与利用[J]. 遗传, 2022, 44(2): 134-152. DOI:10.16288/j.yczz.21-327 SHI Z W, HE Q, ZHAO Z F, LIU X W, ZHANG P, CAO M J. Exploration and utilization of maize male sterility resources[J]. Genetic, 2022, 44(2): 134-152. DOI:10.16288/j.yczz.21-327 |
| [31] |
苏爱国, 宋伟, 王帅帅, 赵久然. 玉米细胞质雄性不育及其育性恢复基因的研究进展[J]. 中国生物工程杂志, 2018, 38(1): 108-114. DOI:10.13523/j.cb.20180113 SU A G, SONG W, WANG S S, ZHAO J R. Advance on cytoplasmic male sterility and fertility restoration genes in maize[J]. China Biotechnology, 2018, 38(1): 108-114. DOI:10.13523/j.cb.20180113 |
| [32] |
DEWEY R E, LEVINGS C S, TIMOTHY D H. Novel recombinations in the maize mitochondrial genome produce a unique transcriptional unit in the texas male-sterile cytoplasm[J]. Cell, 1986, 44(3): 439-449. DOI:10.1016/0092-8674(86)90465-4 |
| [33] |
LEVINGS C R. The Texas cytoplasm of maize: cytoplasmic male sterility and disease susceptibility[J]. Science, 1990, 250(4983): 942-947. DOI:10.1007/BF00015611 |
| [34] |
YANG H L, XUE Y D, LI B, LI H C, GUO Z Y, LI W H, FU Z Y, DING D, TANG J H. The chimeric gene atp6c confers cytoplasmic male sterility in maize by impairing the assembly of the mitochondrial ATP synthase complex[J]. Molecular Plant, 2022. DOI:10.1016/j.molp.2022.03.002 |
| [35] |
LUO D P, XU H, LIU Z L, GUO J X, LI H Y, CHEN L T, FANG C, ZHANG Q Y, BAI M, YAO N, WU H, WU H, JI C H, ZHENG H Q, CHEN Y L, YE S, LI X Y, ZHAO X C, LI R Q, LIU Y G. A detrimental mitochondrial-nuclear interaction causes cytoplasmic male sterility in rice[J]. Nature Genetics, 2013, 45(5): 573-577. DOI:10.1038/ng.2570 |
| [36] |
TORIYAMA K. Molecular basis of cytoplasmic male sterility and fertility restoration in rice[J]. Plant Biotechnology, 2021(38): 285-295. DOI:10.5511/plantbiotechnology.21.0607a |
| [37] |
MATERA J T, MONROE J, SMELSER W, GABAY-LAUGHNAN S, NEWTON K J. Unique changes inmitochondrial genomes associated with reversions of S-type cytoplasmic male sterility in maizemar[J]. PLoS One, 2011, 6(8): 23405. DOI:10.1371/journal.pone.0023405 |
| [38] |
XIAO S L, ZANG J, PEI Y R, LIU J, LIU J, SONG W, SHI Z, SU A G, ZHAO J R, CHEN H B. Activation of mitochondrial orf355 gene expression by a nuclear-encoded DREB transcription factor causes cytoplasmic male sterility in maize[J]. Molecular Plant, 2021, 13(9): 1270-1283. DOI:10.1016/j.molp.2020.07.002 |
| [39] |
CHEN Z, ZHAO N, LI S, GROVER CE, NIE H, WENDEL JF, HUA J. Plant mitochondrial genome evolution and cytoplasmic male sterility[J]. Critical Reviews in Plant Sciences, 2017, 36(1): 55-69. DOI:10.1080/07352689.2017.1327762 |
| [40] |
CUI X Q, WISE R P, SCHNABLE P S. The rf2 nuclear restorer gene of male-sterile T-cytoplasm maize[J]. Science, 1996, 1(8): 260-268. DOI:10.1126/science.272.5266.1334 |
| [41] |
WISE P R, GOBELMAN W K. Mitochondrial transcript processing and restoration of male fertility in Tcytoplasm maize[J]. The Journal of Heredity, 1999, 90(3): 380-385. DOI:10.1093/jhered/90.3.380 |
| [42] |
DILL C L, WISE R P, SCHNABLE P S. Rf8 and Rf* mediate unique T-urf13-transcript accumulation, revealing a conserved motif associated with RNA processing and restoration of pollen fertility in T-cytoplasm maize[J]. Genetics, 1997, 147(3): 1367-1372. DOI:10.1046/j.1365-2443.1997.1550353.x |
| [43] |
BUDAR F, TOUZET P, DE P R. The nucleo-mitochondrial conflict in cytoplasmic male sterilities revisited[J]. Genetics, 2003, 117(1): 3-16. DOI:10.1023/a:1022381016145 |
| [44] |
QIN X E, TIAN S K, ZHANG W L, ZHENG Q, WANG H, FENG Y, LIN Y N, TANG J H, WANG Y, YAN J B, DAI M Q, ZHENG Y L, YUE B. The main restorer Rf3 of maize S type cytoplasmic male sterility encodes a PPR protein that functions in reduction of the transcripts of orf355[J]. Molecular Plant, 2021, 14(12): 1961-1964. DOI:10.1016/j.molp.2021.10.001 |
| [45] |
SUSAN G L, EVGENY V K, JESSICA M, LEAH R, KATHLEEN J N. Characterization of a novel thermosensitive restorer of fertility for cytoplasmic male sterility in maize[J]. Genetics, 2009, 182(1): 91-103. DOI:10.1534/genetics.108.099895 |
| [46] |
SISCO P H. Duplications complicate genetic mapping of Rf4, are storer gene for CMS-C cytoplasmic male sterility in corn[J]. Crop Science, 1991, 31(5): 1263-1266. DOI:10.2135/cropsci1991.0011183X003100050036x |
| [47] |
LIU Y M, ZHAO Z F, LU Y L, LI C, WANG J, DONG B X, LIANG B, QIU T, ZENG W B, CAO M J. A preliminary identification of Rf*-A619, a novel restorer gene for CMS-C in maize (Zea mays L.)[J]. Peer J, 2016, 4(4): 2719. DOI:10.7717/peerj.2719 |
| [48] |
HU Y M, TANG J H, YANG H, XIE H L, LU X M, NIU J H, CHEN W C. Identification and mapping of Rf-I an inhibitor of the Rf5 restorer gene for Cms-C in maize (Zea mays L.)[J]. Theoretical and Applied Genetics, 2006, 113(2): 357-360. DOI:10.1007/s00122-006-0302-6 |
| [49] |
JAQUETH J S, HOU Z L, ZHENG P Z, REN R H, NAGEL B A, CUTTER G, NIU X M, VOLLBRECHT E, GREENE T W, KUMPATLA S P. Fertility restoration of maize CMS-C altered by a single amino acid substitution within the Rf4 bHLH transcription factor[J]. The Plant Journal, 2020, 101(1): 101-111. DOI:10.1111/tpj.14521 |
| [50] |
ZHANG H S, WANG B, LI B, LIN Y N, YANG H L, DING D, XUE Y D, TANG J H. Comparative proteomic analysis of mitochondrial proteins from maize CMS-C sterile, maintainer and restorer anthers[J]. The Plant Genome, 2020, 13(2): 20022. DOI:10.1002/tpg2.20022 |
| [51] |
欧阳亦聃, 陈乐天. 作物育性调控和分子设计杂交育种前沿进展与展望[J]. 中国科学: 生命科学, 2021, 51(10): 1385-1395. DOI:10.1360/SSV-2021-0172 OUYANG Y D, CHEN L T. Fertility regulation and molecular design hybrid breeding in crops[J]. Science China Life Sciences, 2021, 51(10): 1385-1395. DOI:10.1360/SSV-2021-0172 |
| [52] |
刘倩, 张国豪, 车万均, 肖瑶, 张杰, 胡运高. 杂交水稻重要亲本农艺性状配合力遗传力分析[J]. 广东农业科学, 2020, 47(1): 1-8. DOI:10.16768/j.issn.1004-874X.2020.01.001 LIU Q, ZHANG G H, CHE W J, XIAO Y, ZHANG J, HU Y G. Analysis on combining abilityand heritability in agronomic traits of key parents of hybrid rice[J]. Guangdong Agricultural Sciences, 2020, 47(1): 1-8. DOI:10.16768/j.issn.1004-874X.2020.01.001 |
| [53] |
陈乐天, 刘耀光. 水稻野败型细胞质雄性不育的发现利用与分子机理[J]. 科学通报, 2016, 61(35): 3804-3812. DOI:10.1360/N972016-01044 CHEN L T, LIU Y G. Discovery, utilization and molecular mechanisms of CMS-WA in rice[J]. Chinese Science Bulletin, 2016, 61(35): 3804-3812. DOI:10.1360/N972016-01044 |
| [54] |
TANG H W, XIE Y Y, LIU Y G, CHEN L T. Advances in understanding the molecular mechanisms of cytoplasmic male sterility and restoration in rice[J]. Plant Reproduction, 2017, 30(4): 179-184. DOI:10.1007/s00497-017-0308-z |
| [55] |
赵卓凡, 黄玲, 刘永明, 张鹏, 魏桂, 曹墨菊. 玉米CMS-C同质异核不育系育性恢复的遗传研究[J]. 遗传, 2018, 40(5): 402-414. DOI:10.16288/j.yczz.17-401 ZHAO Z F, HUANG L, LIU Y M, ZHANG P, WEI G, CAO M J. Genetics of fertility restoration in the isocytoplasm allonuclear C-group of cytoplasmic male sterility in maize[J]. Genetics, 2018, 40(5): 402-414. DOI:10.16288/j.yczz.17-401 |
(责任编辑 杨贤智)
 2022, Vol. 49
2022, Vol. 49