文章信息
基金项目
- 广东省重点领域研发计划项目(2022B0202060002);广东省农业科学院协同创新中心项目(XT202218)
作者简介
- 邢俊连(1990—),女,硕士,研究实习员,研究方向为水稻遗传资源收集保存鉴定与创新利用,E-mail:834430993@qq.com; 彭歆,2021年获华南农业大学作物遗传育种专业博士学位,韩国KyungHee University访问学者(2019—2020年)。2022年入职广东省农业科学院水稻研究所。主要研究方向是基于多组学技术和手段开展水稻及水稻野生近缘种优异基因挖掘和创新应用。参与国家自然科学基金-云南省联合基金、国家自然科学基金、广东省自然科学基金项目多项。在Plant Biotechnology Journal、Frontiers in Plant Science、Crop Science、Journal of Integrative Agriculture等重要植物学杂志上发表论文10余篇,其中第一作者(含共同第一作者)论文5篇.
通讯作者
- 彭歆(1991—),男,博士,助理研究员,研究方向为水稻及水稻野生近缘种优异基因挖掘与创新应用,E-mail:xinpenglyl@163.com.
文章历史
- 收稿日期:2022-07-18
盐碱胁迫是抑制作物生长和产量的主要环境胁迫因子,我国有1亿多hm2土地受到盐碱胁迫影响,其中有约670万hm2适合种植水稻的土地因盐碱胁迫而减产或被迫荒废[1]。铝(Aluminum, Al)通常以硅酸盐或其他沉淀物形式存在,是酸性土壤中盐碱胁迫的主要成分。当土壤pH < 5时,铝以离子状态从矿物中释放出来,使土壤中可溶性铝含量增加[2]。A13+是一种活性很强的金属离子,可与细胞壁、质膜、细胞骨架和细胞核等多种亚细胞器结合,影响它们的功能,进而通过影响植物根的生长发育来抑制地上部分生长和作物产量[3-4]。“三废”污染、化肥的大量使用以及酸雨的高频率发生,导致土壤的酸化越来越严重,全球超过50% 的耕地分布在酸性土壤地区,13% 的水稻(Oryza sativa L.)种植在酸性土壤中[5]。酸性土壤限制植物生长及作物的产量,主要是因为酸性环境使得植物对Ca、Mg、P的吸收减少,同时使作物更易受Mn、Al等金属离子的胁迫。虽然有些措施已经应用于酸性土壤的治理,如施用硅肥改良土壤[6-7],但也只是一种缓解铝毒害的暂时可靠的方法,并不适合大面积推广。
水稻是人类主要的粮食作物之一,给全世界2/3的人口提供了口粮[8-9],同时也是我国最重要的粮食作物,2021年水稻产量占全国粮食总产量的43.8%[10-11]。据FAO报告,到2050年,世界人口预计接近100亿,比2020年增加近20亿,这意味着每年将增加10亿t的粮食需求。因此,如何增加水稻等粮食作物的产量以保障人类粮食供给,是一个亟待解决的问题。在小粒谷类作物中,水稻具有优越的耐铝性,这主要与其具有更强的外部排斥机制和更完善的内部忍耐机制有关[5],但是在酸性旱地、酸性硫酸盐水田和pH < 5的水田中,铝毒显著降低了水稻产量[12]。近10年来,育种家已育成一批具有高产潜力的水稻品种,然而这些品种的遗传潜力却受到多种胁迫的限制。因此,提高酸性土壤上的农作物产量,选育和推广耐铝毒的高产品种,开展作物耐铝机理研究具有重大的理论与实践意义。
本文在前人研究的基础上,结合国内外有关研究的最新动态,综述水稻耐铝遗传和QTL定位、水稻耐铝毒的生理机制和分子机理,分析该领域的研究方向和研究热点,为水稻耐铝分子机制研究和耐铝育种提供有用信息。
1 水稻耐铝遗传和QTL定位水稻耐铝性状是受多基因控制的数量性状,易受环境的影响。数量性状是指在分离群体中各个体的性状表现呈连续分布,只能用数值来衡量的一类性状。数量性状基因座(Qantitative trait locus, QTL)定位是以分子标记遗传连锁图谱为基础,利用高饱和遗传图谱将控制数量性状的QTL定位在染色体特定片段,然后将各个QTL分解,分别研究其效应和作用方式的方法。数量性状变异的遗传基础为分子标记辅助育种提供连锁标记的有力工具,前人的研究通过使用不同的作图群体和表型指标已经定位了许多水稻耐铝相关QTL。Xue等[13]利用水稻铝敏感品种IR64和耐铝品种Asominori构建的重组自交系,以根相对伸长量为指标,在1号(qRRE-1)、9号(qRRE-9)和11号(qRRE-11)染色体上共检测到3个耐铝相关QTL;Jahan等[14]利用F2:3群体,鉴定到35个与种子萌发相关的耐铝相关QTL和11个与苗期耐铝相关QTL;Adan[15]利用回交重组自交系,用SNP标记构建图谱,定位到6个苗期耐铝相关的QTL。
全基因组关联分析(Genome-wide association study,GWAS)是一种利用高通量测序技术分析数以万计的单核苷酸多态性(Single nucleotide polymorphism,SNP)与目标性状相关性的高通量QTL鉴定方法。GWAS以连锁不平衡为基础,可以直接利用自然群体,快速高效地鉴定QTL位点。Famoso等[16]首次使用GWAS研究了水稻耐铝性,共鉴定到了48个耐铝相关的QTL,发现粳稻的耐铝性是籼稻的2倍,提出了以耐铝的粳稻为背景通过籼粳杂交提高籼稻品种耐铝性的设想。Zhang等[17-18]以根的相对伸长量为指标,对150份种质进行GWAS分析,获得23个耐铝相关QTL,进而对150份水稻核心种质进行耐铝GWAS和转录组分析,鉴定到17个耐铝相关的候选基因,包括已克隆的水稻耐铝相关基因OsNrat1、ART1和STAR1,这为进一步利用核心种质的优良基因来提高水稻耐铝能力提供了重要信息。Zhao等[19]利用67 511个SNP标记,对150份水稻地方品种核心种质的耐铝性进行GWAS分析,共鉴定到25个耐铝相关的QTL,分别分布在第1、4、6、7、9和11号染色体上。Tao等[20]对211份籼稻核心种质的耐铝性进行了全基因组关联分析,以株高、根长、根干重、根鲜重、幼苗干重和幼苗干重为指标,在7个QTL中鉴定到21个耐铝相关的候选基因,包括已克隆的OsNrat1。综上所述,已有大量的水稻耐铝相关QTL被定位,然而,仍然只有少部分的QTL被克隆。此外,鉴定到的种子萌发和苗期耐铝相关的QTL较多,而铝毒害对水稻孕穗和开花的影响研究较少。
2 水稻耐铝毒害的生理机制铝能与细胞壁果胶和半纤维素结合,改变细胞壁多糖代谢,从而抑制水稻根的生长,进而导致根和茎伸长受抑和鲜重下降。在小粒谷类作物中,水稻具有优越的耐铝性,主要是因为水稻具有更强的外部排斥机制和更完善的内部忍耐机制[5]。外部排斥机制是植物根细胞通过自身反应途径将铝离子阻隔在原生质体外,使其无法正常进入细胞的过程[21],主要包括细胞壁对铝的固定、质膜对铝的选择性渗透、诱导产生根际pH屏障、鳌合配体A13+被主动输出到细胞外等。内部忍耐机制主要指细胞质中有机酸、蛋白质及其他有机配体对铝的螯合、液泡的区室化、耐铝胁迫适应酶的诱导及酶活性的提高等[5]。
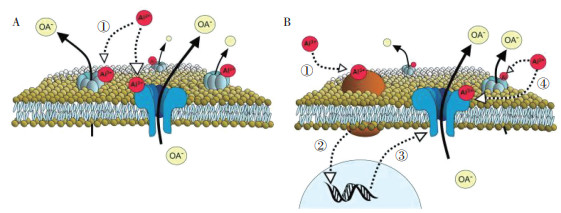
2.1 有机酸在众多耐铝生理机制中,根系分泌有机酸是研究最充分且被认为最重要的植物耐铝机制[5]。铝诱导植物根系有机酸分泌存在两种模式,第一种是铝处理和有机酸分泌之间没有明显的时间间隔(图 1A),第二种是铝处理几小时后根系才分泌有机酸(图 1B)。A13+通过与质膜中的蛋白质直接相互作用来激活有机酸阴离子(OA-)流出(图 1A中箭头①所示)。另外一条铝胁迫信号转导途径是A13+首先与特定受体结合(图 1B箭头②③所示)诱导蛋白质表达,进而A13+通过与质膜中新合成的蛋白质相互作用来激活OA-流出(图 1B箭头④所示)。有机酸能够与铝形成稳定的复合物,从而阻止铝与胞内的成分结合,可以调节铝胁迫下根系细胞线粒体中活性氧清除酶的活性,从而部分缓解发芽期水稻幼苗的铝毒害[22]。水稻有机酸的分泌属于第二种模式(图 1B),且参与缓解水稻铝毒害的有机酸主要是柠檬酸和苹果酸(图 2)[23]。Ma等[24]发现,在耐铝水稻和铝敏感水稻品种中,铝诱导的柠檬酸分泌在两个品种间没有差异,因而有机酸可能不是水稻耐铝的主要机制。目前的研究主要关注水稻分泌有机酸的种类及数量上,对铝胁迫下有机酸合成代谢途径及释放的生理和分子机制仍有待进一步研究。
|
| A、B代表铝诱导植物根系有机酸分泌的两种不同模式;①②③④为4种不同铝胁迫受体信号转导途径;OA-为有机阴离子 A and B: Two patterns of Al-stimulated secretion of organic acids from plant root; ①②③④ : Four signal transduction pathways of different aluminum stress receptors; OA-: organic anions 图 1 铝诱导植物根系有机酸分泌模式[23] Fig. 1 Models for the Al-stimulated secretion of organic acid from plant roots[23] |
2.2 活性氧清除系统
Jan等[25]发现耐铝水稻品种能够在铝胁迫下保持根细胞中蛋白质含量和酶活性,而敏感品种在铝胁迫下蛋白质从细胞质向细胞壁重新分配,与师瑞红[22]的研究结果类似。生理学和组织化学研究发现,在同样浓度的AlCl3处理下,铝敏感水稻品种较耐铝品种幼苗根茎中具有更高的O2-、H2O2、羟基和脂质过氧化物含量,而耐铝品种则能保持较高的SOD、CAT和GPX等过氧化物酶活性[26]。马宝慧[27]研究发现细胞壁过氧化物酶和NADPH氧化酶与铝诱导产生的H2O2有关。在水稻种子萌发过程中,抗氧化酶具有清除铝诱导产生过量H2O2的作用,说明较低的ROS含量和较高的过氧化物酶活性是水稻耐铝的原因之一。
2.3 植物激素植物激素是小信号分子,调节植物生长发育的各个环节,在植物对生物和非生物胁迫的耐受性方面起着重要作用。生长素、乙烯、细胞分裂素、水杨酸、茉莉酸和脱落酸等植物激素通过调节活性氧信号、细胞壁修饰、根系有机酸分泌在控制根对铝毒性的反应中发挥至关重要的作用。其中,生长素可以作为信号分子来响应铝胁迫以及调节细胞内的铝分布,其可能是调节ROS水平和决定ROS在氧化应激中作用的枢纽[5]。此外,生长素输入载体OsAUX3参与铝毒害对水稻根系生长的抑制,OsAUX3突变体对铝处理敏感[28]。Liu等[29]发现外施乙烯合成抑制剂AVG可以缓解铝毒害对水稻根的抑制作用。Pandey等[30]研究表明,外源水杨酸可以抑制根系对铝的吸收,降低ROS浓度和调节抗氧化酶活性,进而减轻铝毒害对水稻幼苗的影响。脱落酸ABA作为逆境激素,广泛参与到植物对氧化胁迫的调节,高浓度ABA引起氧化损伤,而低浓度ABA可以启动抗氧化防御系统。Saha等[31]发现ABA可能通过诱导QTL sub1A参与水稻耐铝性调控,Zhu等[32]发现腐胺通过以乙烯依赖性方式降低细胞壁中的铝含量来减轻水稻中铝的毒性。
此外,水稻耐铝胁迫的其他生理响应机制也有报道,主要包括:细胞壁甾醇甲基化以减少铝的吸附[33];降低质膜磷脂△5-甾醇化的比率,从而减少铝的结合位点[34];将铝固定在液泡中,阻止铝向地上部分转移[35]。
2.4 能量代谢和离子拮抗作用铝结合蛋白以及耐铝酶的形成在植物内部忍耐机制中发挥着重要的作用。研究表明,在蛋白质水平上,敏感品种和耐性品种对铝毒的响应不同。糖酵解/糖异生途径是最有可能在水稻铝胁迫中特异调控的代谢途径,编码糖酵解/糖异生过程关键酶的基因可能通过调节有效利用能量来提高植物耐铝性[36];当水稻遭到铝胁迫时会诱导一系列衰老相关基因的表达,这种积极的衰老响应可以帮助植物以多种方式适应铝胁迫。研究表明,在酸性土壤中,铝毒通常会导致植物磷缺乏,而紫色酸性磷酸酶PAP的增加则可以增强植物磷的吸收和利用,且OsPAP1的表达水平在耐铝品种中比铝敏感品种高,进一步说明耐铝品种可以通过增加磷吸收来缓解铝毒害[37]。综上所述,当水稻遭到铝胁迫时,耐性品种可以更好地控制蛋白翻译和补给呼吸作用,从而使它们表现出更强的耐铝性。目前,有关水稻应答铝毒害的蛋白质组学研究还主要集中在根系蛋白的研究上,而铝毒害对地上部分蛋白的影响,以及耐铝蛋白之间相互作用的研究尚少。
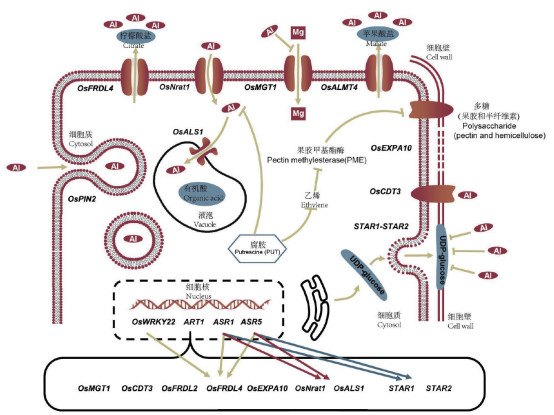
3 水稻耐铝毒害的分子机制大麦和高粱的耐铝性主要由单基因控制,而玉米、水稻的耐铝性则是由多基因控制的数量性状。自从在小麦中发现第1个耐铝基因ALMT1[38]后,已陆续挖掘出很多耐铝基因,目前已有超过20个水稻耐铝相关基因被克隆,这些基因有些作为转运蛋白参与水稻耐铝胁迫响应,有些转录因子介导调控的铝胁迫响应(表 1、图 2)。
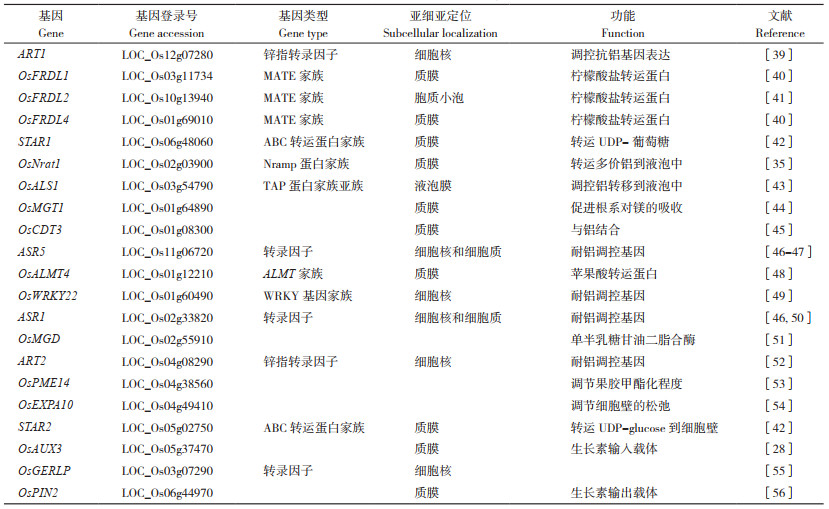
3.1 膜转运蛋白参与水稻铝胁迫响应
3.1.1 有机酸转运载体 禾本科植物中,已经确定了控制根系分泌苹果酸和柠檬酸分泌的基因,分别是铝活化苹果酸转运子基因(Aluminum-Activated Malate Transporter, ALMT)和多毒有害复合物排出基因/铝活化柠檬酸转运子基因(Multidrug and Toxic Compound Extrusion/Aluminum Activated Citrate Transporter, MATE/AACT)。在铝毒诱导下,植物ALMT蛋白将苹果酸从细胞膜内转移至细胞膜外,在细胞膜外铝可与苹果酸形成无毒的络合物降低铝毒对植物的伤害。此外,ALMT参与转运营养和调节保卫细胞的气孔运动,过表达OsALMT4能增加苹果酸外排作用并提高水稻耐铝性[48]。MATE在水稻的外部排斥机制中也发挥重要作用,部分MATE家族成员有转运柠檬酸、生物碱、类黄酮等物质的能力,过表达MATE可增加植物对铝的抗性[57]。目前水稻MATE家族成员,柠檬酸盐转运子基因OsFRDL1、OsFRDL2和OsFRDL4被克隆并得到了功能验证。OsFRDL1定位在中柱鞘细胞,与拟南芥AtFRD3和大豆GmMATE蛋白同源,通过向木质部分泌柠檬酸与铁形成鳌合物,将铁以铁-柠檬酸盐的形式从植物根部运送到叶部,从而通过增加铁的有效吸收,缓解铝毒害[40]。OsFRDL2定位在细胞质膜,主要在根中表达,其表达不受铁缺乏的诱导,但在铝的诱导下迅速上调,OsFRDL2参与了铝诱导的柠檬酸分泌,但对水稻铝耐受的贡献相对较小(图 2)[41]。此外,OsFRDL2的表达受C2H2型锌指转录因子ART1调控,敲除OsFRDL2不影响铁从根向芽的转运[41]。OsFRDL4是质膜上的柠檬酸通道蛋白,当水稻受铝胁迫时,细胞受体感知铝胁迫信号,通过信号传递、酶活化等一系列途径,将胁迫信号传递给转录因子ART1,特异性地调控水稻根尖OsFRDL4的表达,促进柠檬酸分泌以鳌合外界的铝离子,从而缓解铝毒害(图 2)[40, 58]。
3.1.2 金属离子转运载体 OsNrat1是定位在质膜的铝转运蛋白,介导铝离子转运到根细胞中。Xia等[59]发现OsNrat1基因敲除导致铝摄取减少,而OsNrat1的过表达使铝摄取增加。将耐铝种质中含有OsNrat1的染色体片段替换为铝敏感型种质染色体片段会降低OsNrat1表达、铝摄取量和耐铝性,但是会增加铝与细胞壁的结合。镁转运蛋白OsMGT1定位于质膜,通过增加镁的摄取来参与铝耐受进程,在铝胁迫下,野生型对镁的吸收显著增强,而OsMGT1基因敲除转基因株对镁的吸收没有明显变化[44]。因此,通过OsMGT1增加胞质溶胶中镁浓度有助于提高水稻的耐铝性。
ABC转运蛋白OsALS1是受ART1调节的TAP亚基成员,定位在液泡膜,其快速并特异性地受根部铝的诱导表达[43]。在3个OsALS1敲除株系中,铝的敏感性显著增加,但对其他金属和低pH的敏感性没有影响。比较野生型和OsALS1突变体之间的铝积累模式发现,野生型和突变体之间根尖细胞液中的铝含量没有显著差异,OsALS1在细胞质和细胞核中积累更多的铝[43]。这些结果表明,OsALS1基因是水稻内部耐铝机制的重要成员,它负责将铝固定在液泡中(图 2)。
3.2 ART1介导的水稻耐铝调控ART1(Al Resistance Transcription Factor 1)编码一个C2H2锌指蛋白,其本身不受铝影响,通过结合到下游基因的启动子上参与调控其他耐铝相关基因的表达(图 2)[60]。ART1下游基因广泛涉及外部拆铝和内部耐铝机制,这些基因大部分在铝毒害处1 h后表达上调,微阵列分析表明,ART1至少调控31个耐铝相关基因的表达[61],这些基因的翻译产物均定位在根系细胞中,但在耐铝胁迫中所起的作用不尽相同[35, 40, 42-43, 45]。此外,ART1的同源基因ART2也参与调控水稻的耐铝性,但是其调控作用远小于ART1[52]。
研究表明,受ART1调控的水稻耐铝相关基因包括STAR1、STAR2、OsMGT1、OsCDT3、OsFRDL2、OsFRDL4、OsEXPA10、OsNrat1、OsALS1(图 2)。STAR1和STAR2分别编码ATP结合蛋白和膜结合蛋白,它们的表达受到ART1的调控。STAR1-STAR2复合物位于囊泡上,负责转运UDP-葡萄糖,这个过程可能参与了细胞壁的修饰,从而使细胞壁吸附的铝减少[42](图 2)。柠檬酸转运蛋白OsFRDL2和OsFRDL4调控柠檬酸的分泌,而其表达受ART1的调控[40],敲除受ART1调控的基因,会导致水稻对Al的敏感性不同程度的增加,且OsFRDL4与水稻的耐铝性有很好的相关性[40]。在籼稻aus亚种中,OsNrat1基因的变异可解释40% 的耐铝性[16]。OsNrat1的表达受ART1的调控,其参与转运多价铝到液泡中,从而将铝隔离[35](图 2)。这些发现表明,OsFRDL4和OsNrat1可能是水稻耐铝调控的主要基因,这两个基因的不同单倍型组合可能决定了水稻品种的耐铝性差异。OsCDT3(53-amino acid peptide rich in cysteine)表现出与铝的结合活性,能够阻止铝进入根系细胞中[45]。铝能够诱导OsMGT1表达上调,增加植株对Mg的吸收,从而缓解内源铝的毒害[44]。OsEXPA10编码一个铝诱导的扩展蛋白,参与调控水稻根细胞伸长。在没有铝胁迫的情况下,敲除OsEXPA10会导致根系细胞伸长显著降低。在铝胁迫下,敲除OsEXPA10基因不会改变通过相对根伸长评估的铝敏感性,但与野生型相比,敲除系的根细胞壁积累的铝更少。这些结果表明,根尖表达的OsEXPA10是根细胞伸长所必需的,但该基因对水稻铝耐性的贡献仍然有待进一步研究[54]。OsALS1不仅作为金属离子转运载体参与到水稻耐铝调控,其表达也受到ART1的调控[43]。有趣的是,在绒毛草中,ART1的同源基因HlART1参与调控耐铝基因HlALMT1的表达,这表明ART1介导的耐铝胁迫响应在禾本科植物中高度保守[62]。
3.3 ASRs介导的水稻耐铝调控ASR1和ASR5是ASR家族成员,定位在细胞核和细胞质。Arenhart等[46-47]研究发现,ASR1和ASR5是调控铝响应基因的互补转录因子,ASR5蛋白可以结合STAR1启动子并调节STAR1、OsNrat1和OsFRDL4的表达(图 2)。用MicroRNA(miRNA)沉默引入了ASR1水稻植株的ASR5基因,然而并未得到铝敏感转化株。ASR1与ASR5的顺式调控元件结合,调控ASR5及其下游基因。在某些条件下,ASR1可以代替ASR5发挥作用[46, 50]。因此,在响应铝胁迫的过程中,ASR1和ASR5协调互补地调控有关基因的表达。敲除ASRs基因,不仅会导致水稻耐铝性的减弱,也使水稻对干旱和盐等其他胁迫的抗性减弱[50],说明除了耐铝胁迫响应外,ASRs还广泛参与对其他非生物胁迫的调控。
3.4 WRKY转录因子介导的水稻耐铝调控植物特异WRKY转录因子在水稻生长发育及抵御非生物胁迫和生物胁迫过程中发挥重要的调控作用。水稻有103个WRKY转录因子,但有关WRKY基因参与水稻耐铝遗传调控的报道较少[63]。T-DNA插入失活突变体OsWRKY22对铝的敏感性增加,且铝诱导的柠檬酸分泌减少,进一步研究表明,OsWRKY22定位在细胞核,通过与OsFRDL4启动子W-box顺式作用元件结合来促进OsFRDL4的表达,并导致柠檬酸分泌增加和铝胁迫耐受性增加[49]。
3.5 其他基因除上述基因外,OsPIN2、OsPME14和OsGERLP也参与到水稻的耐铝调控(图 2)。OsPINs在根系表层细胞高度表达,参与生长素的极性运输和非对称分布的调控。铝诱导OsPIN2的转录表达,进而增强水稻对P、Ca、Mg的吸收,减少铝在根系和根茎连接处的累积,从而缓解铝对水稻根系和分蘖的毒害作用[56](图 2)。果胶甲基酯酶PME属于碳水化合物酯酶的第8类,释放甲醇和质子,并生成带负电羧基。根尖细胞壁的主要成分果胶和半纤维素所携带的负电荷可以结合细胞壁中的A13+[53](图 2)。Yang等[53]对铝敏感品种根尖中35个PME基因家族成员在铝胁迫下的表达谱进行研究发现,有8个PME基因转录产物丰度增加。OsPME14过表达株系相比野生型显示出更高PME活性,且根尖细胞壁中具有更高的铝含量。Miftahudin等[55]从印度尼西亚一个本土水稻品种中分离鉴定出耐铝基因OsGERLP,其主要在水稻根尖高度表达。在水稻中,OsGERLP沉默转基因株系对Al的敏感性增加,进一步分析发现,OsGERLP沉默伴随着OsFRDL4的表达下调。在烟草过表达OsGERLP株系中,MATE基因的表达增加,而MATE通过调控柠檬酸的分泌和根系的生长参与对铝胁迫的调控[55]。
半乳糖苷单半乳糖基二酰基甘油(MGDG)和二半乳糖酰甘油(DGDG)是植物生物膜的主要成分。单半乳糖基二酰基甘油合酶(OsMGD)是半乳糖生物合成的关键酶之一,其生物合成受OsMGD的调控。与野生型相比,在烟草中过表达OsMGD,转基因株系受脂质过氧化的破坏较小,且细胞膜能保持较好的完整性,但野生型和转基因植株的铝积累没有差异。在野生型中,铝诱导显著降低了细胞膜中MGDG的含量,且MGDG与DGDG的比例降低[51]。这些结果表明,在铝胁迫下,半乳糖脂生物合成的调节可以在维持膜结构和功能方面发挥重要作用。NAC转录因子超家族是植物特异性转录因子家族之一,拥有150多个成员,具有转录激活活性,其广泛参与器官发育、二次细胞壁合成、衰老和响应非生物胁迫等生理过程。尽管在水稻中尚没有参与耐铝胁迫响应的NAC基因报道,但在赤小豆(Vigna umbellata)中,NAC型转录因子VuNAR1通过与调节细胞壁相关受体激酶WAK1的启动子结合,调控WAK1的表达,进而参与调控耐铝胁迫响应[64]。
4 展望铝毒害是酸性土壤中限制作物生长的主要因素之一,水稻作为耐铝性较强的作物,有着精细的耐铝机制。铝通过与细胞壁果胶和半纤维素结合,改变了细胞壁多糖代谢,从而抑制水稻根的生长,进而导致根和茎伸长受抑,鲜重下降。近10年来,水稻对铝毒害响应的生理和分子机制得到了广泛研究,有机酸阴离子、活性氧清除系统、植物激素、能量代谢和其他离子拮抗作用在水稻对铝毒害的响应中起重要作用。目前,已有20余个水稻耐铝相关基因被克隆,其中,OsFRDL4和OsNrat1可能是水稻耐铝调控的主要基因,这两个基因的不同单倍型组合可能决定了水稻品种的耐铝性差异。ART1在水稻耐铝胁迫中起重要作用,其至少参与调控了31个耐铝基因的表达。目前,OsMGT1、OsCDT3、OsFRDL2、OsFRDL4、OsEXPA10、OsNrat1、OsALS1、STAR1、STAR2等ART1下游基因功能已被报导,然而其上游途径依然未知,且ART1下游的其他基因功能仍然有待进一步研究。此外,ART1的表达和定位都不受铝影响,因此必然有一个ART1的激活机制来调控其表达。我们前期的研究发现,ART1上存在miRNA的潜在靶点。因此,miRNA可能参与ART1的激活机制,相关实验验证正在开展中。
前人研究通过使用不同的作图群体和GWAS,已经定位到了许多水稻耐铝相关QTL,后续还需要进一步对这些QTL进行精细定位和功能研究。此外,大部分水稻耐铝相关的QTL定位和GWAS研究主要是在种子萌发和苗期开展,铝胁迫对分蘖期、孕穗期和成熟期的影响和相关QTL定位仍然有待进一步研究。GWAS具有可以直接利用自然群体遗传多样性和显著遗传变异的特点,是水稻耐铝QTL定位的一项重要的现代基因分型技术。基于传统杂交组合和系谱选育的方法,育种家已育成一批具有高产潜力的水稻品种,这对于提高水稻在酸性土壤中的产量具有重要意义。近年来,随着分子设计育种概念的提出,将生物遗传学理论与杂交育种相结合,基于对控制作物重要性状的关键基因及其调控网络的认识,利用基因组学、表型组学等多组学数据进行生物信息学的解析、整合、筛选和优化,从而获取育种目标的最佳基因型,最终高效精准地培育出目标新品种,分子设计育种将是未来作物育种的趋势。在水稻耐铝相关基因功能和调控网络清楚解析的基础上,开展水稻耐铝相关的分子设计和模块化育种,将可能极大地提高水稻耐铝育种效率。
| [1] |
PENG Y, CHEN Y, YUAN Y, LIU B, YU P, SONG S, YI Y, TENG Z, YI Z, ZHANG J, MENG S, YE N, DUAN M. Post-anthesis salinealkali stress inhibits grain filling by promoting ethylene production and signal transduction[J]. Food and Energy Security, 2022, e384. DOI:10.1002/fes3.384 |
| [2] |
RANJAN A, SINHA R, LAL SK, BISHI SK, SINGH AK. Phytohormone signalling and cross-talk to alleviate aluminium toxicity in plants[J]. Plant Cell Reports, 2021, 40(8): 1331-1343. DOI:10.1007/s00299-021-02724-2 |
| [3] |
王宝兴. 铝毒害对植物生长发育的影响及耐铝相关基因的功能解析[D]. 哈尔滨: 东北林业大学, 2014. WANG B X. The effect of aluminum toxicity on plant growth and aluminum related gene function analysis[D]. Harbin: Northeastern Forestry University, 2014. |
| [4] |
KOCHIAN L V, PINEROS M A, LIU J, MAGALHAES J V. Plant adaptation to acid soils: the molecular basis for crop aluminum resistance[J]. Annual Review of Plant Biology, 2015, 66: 571-598. DOI:10.1146/annurev-arplant-043014-114822 |
| [5] |
CHEN J, LAI Q, ZENG B, GUO L, YE G. Progress on molecular mechanism of aluminum resistance in rice[J]. Rice Science, 2020, 27(6): 454-467. DOI:10.1016/j.rsci.2020.09.003 |
| [6] |
王茂辉, 聂金泉, 任勇, 林肖楠, 李珂清, 钟春燕. 不同硅肥用量对水稻生长的影响研究[J]. 广东农业科学, 2020, 47(2): 61-67. DOI:10.16768/j.issn.1004-874X.2020.02.009 WANG M H, NIE J Q, REN Y, LIN X N, LI K Q, ZHONG C Y. Effects of different application rates of silion fertilizer on rice growth[J]. Guangdong Agricultural Sciences, 2020, 47(2): 61-67. DOI:10.16768/j.issn.1004-874X.2020.02.009 |
| [7] |
彭歆, 金晨钟, 刘秀, 李静波, 陈俐, 周琴. 硅对铝酸毒害下黄瓜生长发育的影响[J]. 南方园艺, 2015, 26(2): 26-28. PENG X, JIN C Z, LIU X, LI J B, CHEN L, ZHOU Q. Effect of silicon on cucumber growth under aluminum acidic toxicity[J]. Southern Horticulture, 2015, 26(2): 26-28. |
| [8] |
王晓飞, 陆展华, 刘维, 卢东柏, 王石光, 巫浩翔, 方志强, 何秀英. "绿色革命"以来水稻抗倒伏研究进展[J]. 广东农业科学, 2022, 49(3): 1-13. DOI:10.16768/j.issn.1004-874X.2022.03.001 WANG X F, LU Z H, LIU W, LU D B, WANG S G, WU H X, FANG Z Q, HE X Y. Advanced in lodging resistance of rice since the"green revolution"[J]. Guangdong Agricultural Sciences, 2022, 49(3): 1-13. DOI:10.16768/j.issn.1004-874X.2022.03.001 |
| [9] |
AWIKA J M. Major cereal grains production and use around the world[J]. Acs Symposium Series, 2011, 1089: 1-13. DOI:10.1021/bk-2011-1089.ch001 |
| [10] |
林妙君, 林敏丹, 许展颖, 冯婷诗, 陈小梅. 酸雨胁迫对水稻萌芽及幼苗生长的影响[J]. 广东农业科学, 2022, 49(4): 1-7. DOI:10.16768/j.issn.1004-874X.2022.04.001 LIN M J, LIN M D, XU Z Y, FENG T S, CHEN X M. Effects of acid rain on germination of seeding growth of rice[J]. Guangdong Agricultural Sciences, 2022, 49(4): 1-7. DOI:10.16768/j.issn.1004-874X.2022.04.001 |
| [11] |
潘大建, 李晨, 范芝兰, 孙炳蕊, 陈文丰, 江立群, 张静, 吕树伟, 刘清, 毛兴学. 广东省农业科学院水稻种质资源研究60年: 成就与展望[J]. 广东农业科学, 2020, 47(11): 18-31. DOI:10.16768/j.issn.1004-874x.2020.11.003 PAN D J, LI C, FAN Z L, SUN B R, CHEN W F, JIANG L Q, ZHANG J, LYU S W, LIU Q, MAO X X. Sixty years' researchs on rice germplasm resources of Guangdong Academy of Agricultural Sciences: achievements and prospects[J]. Guangdong Agricultural Sciences, 2020, 47(11): 18-31. DOI:10.16768/j.issn.1004-874x.2020.11.003 |
| [12] |
黄巧义, 唐拴虎, 黄旭, 张发宝, 杨少海, 易琼, 逄玉万, 张木. 广东省酸性硫酸盐水稻土作物产量的主要限制因子分析[J]. 植物营养与肥料学报, 2016, 22(1): 180-191. DOI:10.11674/zwyf.14390 HUANG Q Y, TANG S H, HUANG X, ZHANG F B, YANG S H, YI Q, PANG Y W, ZHANG M. Analysis on the limiting hazardous chemical factors of acid sulfate paddy soils in Guangdong Province[J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(1): 180-191. DOI:10.11674/zwyf.14390 |
| [13] |
XUE Y, WAN J M, JIANG L, LIU L L, SU N, ZHAI H Q, MA J F. QTL Analysis of aluminum resistance in rice (Oryza Sativa L.)[J]. Plant and Soil, 2006, 287(1): 375-383. DOI:10.1007/s11104-006-9086-3 |
| [14] |
JAHAN N, JAVED M A, KHAN A, MANAN F A, TABASSUM B. Genetic architecture of A13+ toxicity tolerance in rice F2:3 populations determined through QTL mapping[J]. Ecotoxicology, 2021, 30(5): 794-805. DOI:10.1007/s10646-021-02413-6 |
| [15] |
ADAN R. Identification of QTL for rice (Oryza Sativa L) tolerance to aluminum, ferrous iron and cadmium toxicity at seedling related traits using a Japonica Cv. 02428/Changhui 891 Brils population[D]. Nanchang: Jiangxi Agricultural University, 2021. DOI: 10.27177/d.cnki.gjxnu.2021.000211.
|
| [16] |
FAMOSO A N, ZHAO K, CLARK R T, TUNG C W, WRIGHT M H, BUSTAMANTE C, KOCHIAN L V, MCCOUCH S R. Genetic architecture of aluminum tolerance in rice (Oryza Sativa) determined through genome-wide association analysis and QTL mapping[J]. Plos Genetics, 2011, 7(8): e1002221. DOI:10.1371/journal.pgen.1002221 |
| [17] |
ZHANG P, ZHONG K, TONG H, SHAHID M Q, LI J. Association mapping for aluminum tolerance in a core collection of rice landraces[J]. Frontiers in Plant Science, 2016, 7: 1415. DOI:10.3389/fpls.2016.01415 |
| [18] |
ZHANG P, ZHONG K, ZHONG Z, TONG H. Mining candidate gene for rice aluminum tolerance through genome wide association study and transcriptomic analysis[J]. BMC Plant Biology, 2019, 19(1): 490. DOI:10.1186/s12870-019-2036-z |
| [19] |
ZHAO M, SONG J, WU A, HU T, LI J. Mining beneficial genes for aluminum tolerance within a core collection of rice landraces through genome-wide association mapping with high density SNPs from specific-locus amplified fragment sequencing[J]. Frontiers in Plant Science, 2018, 9: 1838. DOI:10.3389/fpls.2018.01838 |
| [20] |
TAO Y, NIU Y, WANG Y, CHEN T, NAVEED S A, ZHANG J, XU J, LI Z. Genome-wide association mapping of aluminum toxicity tolerance and fine mapping of a candidate gene for Nrat1 in rice[J]. PLOS ONE, 2018, 13(6): e198589. DOI:10.1371/journal.pone.0198589 |
| [21] |
宋佳谕. 利用全基因组关联分析法挖掘水稻核心种质优异耐冷耐铝基因[D]. 沈阳: 沈阳农业大学, 2019. DOI: 10.27327/d.cnki.gshnu.2019.000003. SONG J Y. Ming excellent aluminum tolerance and cold tolerance genes in rice using microcore germplasm-whole genome association analysis[D]. Shenyang: Shenyang Agricultural University, 2019. DOI: 10.27327/d.cnki.gshnu.2019.000003. |
| [22] |
师瑞红. 水稻幼苗适应铝胁迫的生理特性研究[D]. 武汉: 华中农业大学, 2007. SHI R H. Physiological characterization of rice seeding responding to aluminum stress[D]. Wuhan: Huazhong Agricultural University, 2007. |
| [23] |
DELHAIZE E, GRUBER B D, RYAN P R. The roles of organic anion permeases in aluminium resistance and mineral nutrition[J]. FEBS Letters, 2007, 581(12): 2255-2262. DOI:10.1016/j.febslet.2007.03.057 |
| [24] |
MA J F. Syndrome of aluminum toxicity and diversity of aluminum resistance in higher plants[J]. International Review of Cytology, 2007, 264: 225-252. DOI:10.1016/S0074-7696(07)64005-4 |
| [25] |
JAN F, YAMASHITA K, MATSUMOTO H, MAEDA M. Protein and peroxidase changes in various root-cell fractions of two upland rice cultivars differing in Al tolerance[J]. Environmental and Experimental Botany, 2001, 46(2): 141-146. DOI:10.1016/S0098-8472(01)00091-0 |
| [26] |
PANDEY P, SRIVASTAVA R K, RAJPOOT R, RANI A, PANDEY A K, DUBEY R S. Water deficit and aluminum interactive effects on generation of reactive oxygen species and responses of antioxidative enzymes in the seedlings of two rice cultivars differing in stress tolerance[J]. Environmental Science Pollution Research, 2016, 23(2): 1516-1528. DOI:10.1007/s11356-015-5392-8 |
| [27] |
马宝慧. 水稻(Oryza Sativa L. )铝毒害及耐性机理[D]. 南京: 南京农业大学, 2007. MA B H. the mechanisms of aluminum toxicity and tolerance in rice(Oryza Sativa L.)[D]. Nanjing: Nanjing Agricultural University, 2007. |
| [28] |
WANG M, QIAO J, YU C, CHEN H, SUN C, HUANG L, LI C, GEISLER M, QIAN Q, JIANG D, QI Y. The auxin influx carrier, OsAUX3, regulates rice root development and responses to aluminium stress[J]. Plant, Cell & Environment, 2019, 42(4): 1125-1138. DOI:10.1111/pce.13478 |
| [29] |
LIU S, GAO H, WU X, FANG Q, CHEN L, ZHAO F J, HUANG C F. Isolation and characterization of an aluminum-resistant mutant in rice[J]. Rice (NY), 2016, 9(1): 60. DOI:10.1186/s12284-016-0132-3 |
| [30] |
PANDEY P, SRIVASTAVA R K, DUBEY R S. Salicylic acid alleviates aluminum toxicity in rice seedlings better than magnesium and calcium by reducing aluminum uptake, suppressing oxidative damage and increasing antioxidative defense[J]. Ecotoxicology, 2013, 22(4): 656-670. DOI:10.1007/s10646-013-1058-9 |
| [31] |
SAHA I, SARKAR B, GHOSH A, DE AK, ADAK M K. Abscisic acid induced cellular responses of sub1A QTL to aluminium toxicity in rice (Oryza Sativa L.)[J]. Ecotoxicology and Environmental Safety, 2019, 183: 109600. DOI:10.1016/j.ecoenv.2019.109600 |
| [32] |
ZHU C Q, CAO X C, BAI Z G, ZHU L F, HU W J, HU A Y, ABLIZ B, ZHONG C, LIANG Q D, HUANG J, ZHANG J H, JIN Q Y. Putrescine alleviates aluminum toxicity in rice (Oryza Sativa) by reducing cell wall Al contents in an ethylene-dependent manner[J]. Physiologia Plantarum, 2019, 167(4): 471-487. DOI:10.1111/ppl.12961 |
| [33] |
YANG J L, LI Y Y, ZHANG Y J, ZHANG S S, WU Y R, WU P, ZHENG S J. Cell wall polysaccharides are specifically involved in the exclusion of aluminum from the rice root apex[J]. Plant Physiology, 2008, 146(2): 602-611. DOI:10.1104/pp.107.111989 |
| [34] |
KHAN M S, TAWARAYA K, SEKIMOTO H, KOYAMA H, KOBAYASHI Y, MURAYAMA T, CHUBA M, KAMBAYASHI M, SHIONO Y, UEMURA M, ISHIKAWA S, WAGATSUMA T. Relative abundance of Delta(5)-sterols in plasma membrane lipids of root-tip cells correlates with aluminum tolerance of rice[J]. Physiologia Plantarum, 2009, 135(1): 73-83. DOI:10.1111/j.1399-3054.2008.01175.x |
| [35] |
XIA J, YAMAJI N, KASAI T, MA J F. Plasma membrane-localized transporter for aluminum in rice[J]. Proceedings of the National Academy of Science of USA, 2010, 107(43): 18381-18385. DOI:10.1073/pnas.1004949107 |
| [36] |
王占旗. 水稻应答铝毒害的根蛋白质组学研究及OsTCTP功能分析[D]. 杭州: 浙江大学, 2014. WANG Z Q, Proteomics study response of rice root to aluminum stress and functional analysis of OsTCTP[D]. Hangzhou: Zhejiang University, 2014. |
| [37] |
LIANG C, TIAN J, LAM H M, LIM B L, YAN X, LIAO H. Biochemical and molecular characterization of PvPAP3, a novel purple acid phosphatase isolated from common bean enhancing extracellular ATP utilization[J]. Plant Physiology, 2010, 152(2): 854-865. DOI:10.1104/pp.109.147918 |
| [38] |
SASAKI T, YAMAMOTO Y, EZAKI B, KATSUHARA M, AHN S J, RYAN P R, DELHAIZE E, MATSUMOTO H. A wheat gene encoding an aluminum-activated malate transporter[J]. Plant Journal, 2004, 37(5): 645-653. DOI:10.1111/j.1365-313x.2003.01991.x |
| [39] |
LIU J, MAGALHAES J V, SHAFF J, KOCHIAN L V. Aluminum-activated citrate and malate transporters from the MATE and ALMT families function independently to confer Arabidopsis aluminum tolerance[J]. Plant Journal, 2009, 57(3): 389-399. DOI:10.1111/j.1365-313X.2008.03696.x |
| [40] |
YOKOSHO K, YAMAJI N, MA J F. An Al-inducible MATE gene is involved in external detoxification of Al in rice[J]. Plant Journal, 2011, 68(6): 1061-1069. DOI:10.1111/j.1365-313X.2011.04757.x |
| [41] |
YOKOSHO K, YAMAJI N, FUJⅡ-KASHINO M, Ma J F. Functional analysis of a MATE gene OsFRDL2 revealed its involvement in Alinduced secretion of citrate, but a lower contribution to Al tolerance in rice[J]. Plant and Cell Physiology, 2016, 57(5): 976-985. DOI:10.1093/pcp/pcw026 |
| [42] |
HUANG C F, YAMAJI N, MITANI N, YANO M, NAGAMURA Y, Ma J F. A bacterial-type ABC transporter is involved in aluminum tolerance in rice[J]. Plant Cell, 2009, 21(2): 655-667. DOI:10.1105/tpc.108.064543 |
| [43] |
HUANG C F, YAMAJI N, CHEN Z, MA J F. A tonoplast-localized half-size ABC transporter is required for internal detoxification of aluminum in rice[J]. Plant Journal, 2012, 69(5): 857-867. DOI:10.1111/j.1365-313X.2011.04837.x |
| [44] |
CHEN Z C, YAMAJI N, MOTOYAMA R, NAGAMURA Y, MA J F. Up-regulation of a magnesium transporter gene OsMGT1 is required for conferring aluminum tolerance in rice[J]. Plant Physiology, 2012, 159(4): 1624-1633. DOI:10.1104/pp.112.199778 |
| [45] |
XIA J, YAMAJI N, MA J F. A plasma membrane-localized small peptide is involved in rice aluminum tolerance[J]. Plant Journal, 2013, 76(2): 345-355. DOI:10.1111/tpj.12296 |
| [46] |
ARENHART R A, SCHUNEMANN M, BUCKER N L, MARGIS R, WANG Z Y, MARGIS-PINHEIRO M. Rice ASR1 and ASR5 are complementary transcription factors regulating aluminium responsive genes[J]. Plant Cell and Environment, 2016, 39(3): 645-651. DOI:10.1111/pce.12655 |
| [47] |
ARENHART R A, BAI Y, DE OLIVEIRA L F, NETO L B, SCHUNEMANN M, MARASCHIN F S, MARIATH J, SILVERRIO A, SACHETTO-MARTINS G, MARGIS R, WANG Z Y, MARGISPINHEIRO M. New insights into aluminum tolerance in rice: The ASR5 protein binds the STAR1 promoter and other aluminum-responsive genes[J]. Molecular Plant, 2014, 7(4): 709-721. DOI:10.1093/mp/sst160 |
| [48] |
LIU J, ZHOU M, DELHAIZE E, RYAN P R. Altered expression of a malate-permeable anion channel, OsALMT4, disrupts mineral nutrition[J]. Plant Physiology, 2017, 175(4): 1745-1759. DOI:10.1104/pp.17.01142 |
| [49] |
LI G Z, WANG Z Q, YOKOSHO K, DING B, FAN W, GONG Q Q, LI G X, WU Y R, YANG J L, MA J F, ZHENG S J. Transcription factor WRKY22 promotes aluminum tolerance via activation of OsFRDL4 expression and enhancement of citrate secretion in rice (Oryza Sativa)[J]. New Phytologist, 2018, 219(1): 149-162. DOI:10.1111/nph.15143 |
| [50] |
ARENHART R A, LIMA J C, PEDRON M, CARVALHO F E, SILVEIRA J A, ROSA S B, CAVERZAN A, ANDRADE C M, SCHUNEMANN M, MARGIS R, MARGIS-PINHEIRO M. Involvement of ASR genes in aluminium tolerance mechanisms in rice[J]. Plant Cell and Environment, 2013, 36(1): 52-67. DOI:10.1111/j.1365-3040.2012.02553.x |
| [51] |
ZHANG M, DENG X, YIN L, QI L, WANG X, WANG S, LI H. Regulation of galactolipid biosynthesis by overexpression of the rice MGD gene contributes to enhanced aluminum tolerance in tobacco[J]. Frontiers in Plant Science, 2016, 7: 337. DOI:10.3389/fpls.2016.00337 |
| [52] |
CHE J, TSUTSUI T, YOKOSHO K, YAMAJI N, MA J F. Functional characterization of an aluminum (Al)-inducible transcription factor, ART2, revealed a different pathway for Al tolerance in rice[J]. New Phytologist, 2018, 220(1): 209-218. DOI:10.1111/nph.15252 |
| [53] |
YANG X Y, ZENG Z H, YAN J Y, FAN W, BIAN H W, ZHU M Y, YANG J L, ZHENG S J. Association of specific pectin methylesterases with Al-induced root elongation inhibition in rice[J]. Physiol Plant, 2013, 148(4): 502-511. DOI:10.1111/ppl.12005 |
| [54] |
TAN J, WANG M, SHI Z, MIAO X. OsEXPA10 mediates the balance between growth and resistance to biotic stress in rice[J]. Plant Cell Reports, 2018, 37(7): 993-1002. DOI:10.1007/s00299-018-2284-7 |
| [55] |
MIFTAHUDIN M. OsGERLP: A novel aluminum tolerance rice gene isolated from a local cultivar in Indonesia[J]. Plant Physiology and Biochemistry, 2021, 162: 86-99. DOI:10.1016/j.plaphy.2021.02.019 |
| [56] |
MARKUS S, STEFANO M, FRANTISEK B. Aluminium toxicity targets PIN2 in Arabidopsis root apices: effects on PIN2 endocytosis, vesicular recycling, and polar auxin transport[J]. Chinese Science Bulletin, 2008(16): 2480-2487. DOI:10.1007/s11434-008-0332-3 |
| [57] |
YANG Z B, HE C, MA Y, HERDE M, DING Z. Jasmonic acid enhances Al-induced root growth inhibition[J]. Plant Physiology, 2017, 173(2): 1420-1433. DOI:10.1104/pp.16.01756 |
| [58] |
DELHAIZE E, MA J F, RYAN P R. Transcriptional regulation of aluminium tolerance genes[J]. Trends in Plant Science, 2012, 17(6): 341-348. DOI:10.1016/j.tplants.2012.02.008 |
| [59] |
XIA J, YAMAJI N, MA J F. Further characterization of an aluminum influx transporter in rice[J]. Plant Signaling and Behavior, 2011, 6(1): 160-163. DOI:10.4161/psb.6.1.14319 |
| [60] |
SUN L M, CHE J, MA J F, SHEN R F. Expression level of transcription factor ART1 is responsible for differential aluminum tolerance in Indica rice[J]. Plants (Basel), 2021, 10(4): 634. DOI:10.3390/plants10040634 |
| [61] |
TSUTSUI T, YAMAJI N, FENG M J. Identification of a cis-acting element of ART1, a C2H2-type zinc-finger transcription factor for aluminum tolerance in rice[J]. Plant Physiology, 2011, 156(2): 925-931. DOI:10.1104/pp.111.175802 |
| [62] |
CHEN Z C, YOKOSHO K, KASHINO M, ZHAO F J, YAMAJI N, MA J F. Adaptation to acidic soil is achieved by increased numbers of cisacting elements regulating ALMT1 expression in Holcus Lanatus[J]. Plant Journal, 2013, 76(1): 10-23. DOI:10.1111/tpj.12266 |
| [63] |
SONG G, SON S, LEE K S, PARK Y J, SUH E J, LEE S I, PARK S R. OsWRKY114 negatively regulates drought tolerance by restricting stomatal closure in rice[J]. Plants (Basel), 2022, 11(15): 1938. DOI:10.3390/plants11151938 |
| [64] |
LOU H Q. A NAC-type transcription factor confers aluminium resistance by regulating cell wall-associated receptor kinase 1 and cell wall pectin[J]. Plant, Cell & Environment, 2019, 43(2): 463-478. DOI:10.1111/pce.13676 |
(责任编辑 邹移光)
 2022, Vol. 49
2022, Vol. 49