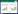文章信息
作者简介
- 江学斌(1969—),男,博士,讲师,研究方向为发酵工程,E-mail:jxbcalvin@126.com.
文章历史
- 收稿日期:2022-01-04
2. 华南农业大学生命科学学院 / 广东省农业生物蛋白质功能与调控重点实验室,广东 广州 510642
2. College of Life Sciences, South China Agricultural University/Guangdong Key Laboratory of Protein Function and Regulation in Agricultural Organisms, Guangzhou 510642, China
【研究意义】纤维素广泛存在于各种生物质中,是地球上最丰富的多糖物质和天然可再生有机物质。我国农业生产中的纤维素主要为麦麸、秸秆等农业副产品,每年可生产约10.4亿t[1]。纤维素酶是一种能够通过生物催化作用降解纤维素并生成葡萄糖的酶,但它并不是一种由单一酶系构成的单体酶,而是一种具有协同作用、具有多个组分酶系组成的复合酶,其主要组分有外切β-葡聚糖酶、内切β-葡聚糖酶和β-葡萄糖苷酶等,还含有很高活力的木聚糖酶[2]。目前,纤维素酶在食品加工[3-5]、纺织[6]、造纸[7-8]、生物炼制[9-10]和生物燃料[11-12]等行业均有应用。纤维素酶最早应用于动物饲料工业[13],纤维素是草食家畜饲料的主要来源,但是除反刍动物借助瘤胃微生物可利用部分纤维素外,其他动物(如猪、鸡等单胃动物)不能利用纤维素[14]。研究发现,使用纤维素酶和发酵菌剂等饲料添加剂能够降低秸秆饲料中纤维素和半纤维素的含量,增加可溶性碳水化合物、粗蛋白的含量,提高秸秆饲料的营养价值,增强畜禽免疫力[15-17]。因此,鉴定和筛选纤维素酶高产菌株,对畜禽的健康养殖、环境保护、资源再生与可循环利用等均具有重要意义。【前人研究进展】纤维素酶来源广泛,目前筛选纤维素酶高产菌株通常从一些富含腐殖质的土壤、反刍动物的瘤胃及其粪便等获得菌株,也有从植物内生菌中分离具有纤维素酶的菌株,经过初筛和复筛后,对纤维素降解能力较高的菌株进行酶活力测定[18-19]。许云等[20]对从不同大薯根部土壤中分离出1株高产纤维素酶蜡状芽孢杆菌菌株,在最优培养条件下纤维素酶活力为137.10 U/mL;葛永怡等[21]从畜禽养殖场土壤中分离到3株产纤维素酶的真菌菌株,通过复筛,获得1株酶活性较高的青霉属菌株;王大为等[22]从富含腐殖质的土壤样品中分离到一批纤维素分解菌株,复筛得到1株纤维素降解能力较强的菌株,羧甲基纤维素酶活达65.89 U/mL。另有研究报道从重楼根茎[23]、香樟叶片[24]中分离出可降解纤维素的内源真菌。【本研究切入点】根据现有研究可知,真菌、细菌和放线菌均具有产生纤维素酶的能力,且因微生物来源的酶易获取且可大规模生产,鉴定和筛选纤维素酶高产菌株逐渐成为研究热点。【拟解决的关键问题】本研究对前期实验室分离得到的14株细菌,通过刚果红平板染色和酶活测定法筛选产纤维素酶菌株,采用形态特征观察及16S rDNA序列对菌株进行鉴定,以期为新型饲料添加剂提供菌种资源。
1 材料与方法 1.1 试验材料实验菌株:14株未鉴定菌株,由华南农业大学生命科学学院广东省农业生物蛋白质功能与调控重点实验室保存。
主要试剂:质量分数1% 刚果红溶液、1 mol/L氯化钠溶液、0.1 mol/L pH 5.5乙酸- 乙酸钠缓冲溶液、1.0 mg/mL葡萄糖溶液、8 mg/mL羧甲基纤维素钠溶液、DNS试剂。细菌通用引物27F(5'AGAGTTTGATCCTGGCTCAG-3')、1492R(5'TACGGCTACCTTGTACGACTT-3')购自广州生工生物科技有限公司,PCR mix购自南京诺唯赞生物科技股份有限公司。
培养基:YPD固体培养基(1 g酵母粉、2 g蛋白胨、2 g蔗糖、1.6 g琼脂,溶于100 mL水,pH 6.8~7.0),纤维素酶活筛选培养基(在YPD固体培养基的基础上,加入0.1% 羧甲基纤维素钠),液体发酵产酶培养基(1 g酵母粉、2 g蛋白胨、2 g羧甲基纤维素钠,溶于100 mL水,pH 6.8~7.0),羧甲基纤维素钠琼脂培养基(2 g羧甲基纤维素钠、2 g琼脂粉,溶于100 mL水)。
1.2 试验方法1.2.1 菌株筛选与鉴定 (1)菌种活化:将超低温冰箱保存的14株未鉴定菌种接种于YPD固体培养基上,37℃过夜培养,在平板上纯化2次,观察并记录菌落形态。
(2)产纤维素酶菌株初筛:采用点接法从YPD平板上挑取单菌落接种于纤维素酶活筛选平板,37℃过夜培养。培养结束后,用1% 刚果红溶液浸没平板,并在室温下孵育30 min,然后用适量1 mol/L氯化钠溶液脱色2次,每次约20 min,观察菌落周围是否有透明圈,初步筛选产纤维素酶菌株。
(3)菌种鉴定:对产纤维素酶菌株进行16S rDNA序列PCR扩增。引物为通用引物27F、1492R。PCR反应体系(40 μL):模板DNA(菌液)5 μL、2×Champagne Taq Buffer(Mg2+plus)20 μL、27F(10 μmol/L)1.6 μL、1492R(10 μmol/L)1.6 μL、dNTP Mixture(10 mmol/L)0.8 μL、Champagne Taq DNA polymerase(2.5 U/mL)0.8 μL,补足ddH2O至40 μL。PCR反应条件:98℃变性5 min;95℃变性15 s、57.5 ℃退火15 s、72 ℃延伸100 s,33次循环;72℃延伸5 min,使反应产物扩增充分,目标片段约1 600 bp。PCR产物由北京擎科生物科技公司进行测序,将获得的序列在NCBI数据库进行BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)同源性分析。
1.2.2 粗酶液制备 将产纤维素酶菌株接种于10 mL液体发酵产酶培养基中,37℃摇床培养1 d,菌液经0.22 μm微滤膜过滤,所得滤液即为粗酶液。
1.2.3 菌株降解纤维素能力比较 (1)刚果红染色法初步比较粗酶液的纤维素酶活性:用打孔器对羧甲基纤维素钠琼脂平板进行打孔,孔直径为2 mm,每孔注入10 μL粗酶液,37℃培养1 d,经刚果红染色和脱色后,观察对比平板各透明圈大小,可作为各菌种纤维素酶活性的依据之一。
(2)纤维素酶活力定量检测:葡萄糖标准曲线绘制:分别在各比色管中加入1.0 mg/mL葡萄糖溶液标准溶液0.0、0.1、0.15、0.2、0.25、0.3、0.35、0.4 mL,各管分别添补0.1 mol/L乙酸-乙酸钠缓冲液(pH 5.5)至1 mL,再加入1.5 mL DNS试剂,充分摇匀后沸水浴5 min,冰水浴迅速冷却后定容至5.0 mL。以不加葡萄糖标准液为空白,540 nm下测定吸光度,作标准曲线。纤维素酶活力检测:待测粗酶液1倍稀释后使用,以8 mg/mL羧甲基纤维素钠溶液作为底物,与待测粗酶液于恒温水浴锅中50℃预热5 min。取3支比色管,在第1、第2根比色管中各加入8 mg/mL纤维素钠溶液0.5 mL、待测酶液0.5 mL,在50 ℃水浴锅中计时准确反应15 min,加入1.5 mL DNS试剂,并在第3根比色管中加入待测酶液0.5 mL,充分摇匀,沸水浴5 min,迅速冷却定容至5.0 mL。以第3支比色管中试液作为对照,测定540 nm波长下第1、第2根比色管试液的吸光度。以上试验3次重复,取平均值。
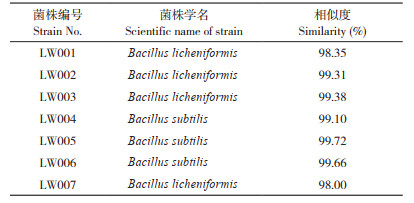
酶活力计算:50℃、pH 5.5条件下,每分钟从8 mg/mL羧甲基纤维素钠溶液中降解释放出1 μmol还原糖所需要的酶量为1个酶活力单位(U),还原糖以葡萄糖等量值计算:
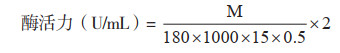
|
式中,M为产生葡萄糖量(mg);180为葡萄糖分子量(mg/μmol);15为待测粗酶液与底物反应时间(min);0.5为加入反应的待测粗酶液的量(mL);2为粗酶液样品的稀释倍数。
试验数据用Excel软件进行初步处理后,用GraphPad Prism 9统计软件进行t检验。
2 结果与分析 2.1 菌株筛选与鉴定14株细菌用纤维素酶活筛选平板培养1 d,经刚果红染色和脱色后,有7株细菌的菌落周围形成透明圈,可知这7株细菌产纤维素酶,分别编号为LW001~LW007。挑取菌落在YPD平板上划线纯化,37 ℃培养20 h后,LW001呈白色微黄,梭子椭圆形,干燥无褶皱;LW002呈白色偏黄,梭子椭圆形,干燥无褶皱;LW003呈白色偏黄,不规则圆形,边缘波浪状,表面干燥光滑;LW004呈白色,多为圆形,少数不规则,表面干燥光滑;LW005呈白色偏黄,多为圆形,少数不规则,表面干燥光滑;LW006偏黄,略透明,微微隆起,边缘有褶皱,湿润黏稠;LW007偏黄,呈不规则圆形,有褶皱(图 1)。
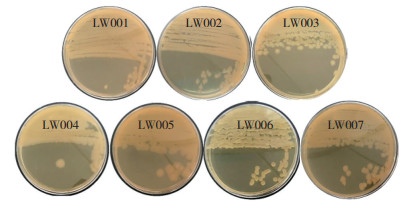
|
| 图 1 菌落形态 Fig. 1 Colony of morphologies |
对7株产纤维素酶菌株进行16S rDNA序列PCR扩增,PCR扩增产物测序后,采用Contig Express软件将序列结果进行拼接,拼接后的完整序列经BLAST比对(表 1),结果(表 2)显示7株细菌均为芽孢杆菌属,其中LW001、LW002、LW003、LW007为地衣芽孢杆菌(Bacillus licheniformis),LW004、LW005、LW006为枯草芽孢杆菌(Bacillus subtilis)。

|
2.2 菌株降解纤维素能力比较
采用刚果红染色法初步比较粗酶液的纤维素酶活性,结果(图 2)显示,在打孔区域周围形成透明圈,根据透明圈大小,初步判定7株芽孢杆菌产纤维素酶能力大小为LW006 > LW005 > LW 004 > LW002 > LW007 > LW003 > LW001。其中,菌株LW001降解纤维素能力最弱,透明圈直径为8 mm;菌株LW006降解纤维素能力最强,透明圈直径为22.5 mm。虽然各粗酶液产生的透明圈可直观,其大小可作为初步判断各粗酶液纤维素酶活性高低的依据之一,但不能作为菌株纤维素酶活性的唯一定量指标,因此需进一步测定这些菌株的产酶能力。
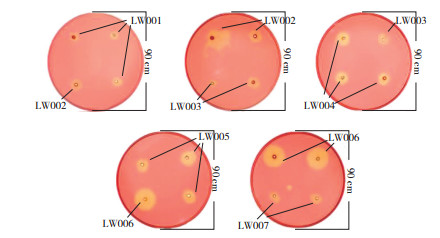
|
| 图 2 7株产纤维素酶菌株形成的透明圈大小比较 Fig. 2 Comparison of transparent circles formed by 7 celllulase-producing strains |
以葡萄糖含量为横坐标、A540为纵坐标,绘制葡萄糖标准曲线(图 3),标准曲线方程为:y = 0.0026x-0.0568,相关系数R2 = 0.9909。

|
| 图 3 葡糖糖标准曲线 Fig. 3 Glucose standard curve |
根据葡萄糖标准曲线及酶活力计算公式,计算出7株芽孢杆菌粗酶液中纤维素酶的活力大小,结果(图 4)显示,LW006 > LW005 > LW0 04 > LW007 > LW003 > LW002 > LW001。其中,菌株LW001纤维素酶活力最低,为0.19(±0.00)U/mL;菌株LW006纤维素酶活力最高、为1.22(±0.07)U/mL,与菌株LW001差异极显著,与刚果红染色法透明圈试验所得结果相同。

|
| 图 4 7株产纤维素酶菌株的纤维素酶活力测定结果 Fig. 4 Cellulase activity assay results of 7 cellulase-producing strains |
由图 4可知,枯草芽孢杆菌LW004、LW005、LW006降解纤维素能力比地衣芽孢杆菌LW001、LW002、LW003、LW007强。不同菌种产纤维素酶能力不同,同一菌种的不同菌株降解纤维素能力也存在差异。地衣芽孢杆菌中,以LW001降解纤维素能力最弱;枯草芽孢杆菌中,以LW006降解纤维素能力最强。
3 讨论自然界中广泛存在产纤维素酶的微生物,其中土壤中的优势菌属芽孢杆菌属种类丰富。李菲等[25]从广西红树林土壤中筛选出9株具有显著纤维素酶活性的芽孢杆菌,其中4株菌株在40~60℃条件下生长良好,在60℃时纤维素分解能力达到最高,具有显著的热稳定性。本研究对实验室保存的14株菌株进行纤维素酶活性筛选,初步选出7株具有一定纤维素酶活性的菌株,经16S rDNA测序鉴定,其中3株为枯草芽孢杆菌、4株为地衣芽孢杆菌,是土壤中常见的芽孢杆菌。芽孢杆菌所产酶的种类也较多[14],除纤维素酶、木聚糖酶等木质纤维降解酶外,还可分泌蛋白酶和淀粉酶。不同菌种的生长条件、产酶条件及其酶的活力均存在差异。在酶活力单位定义相同时,吴静[26]筛选出一株降解纤维素的青霉菌,在最佳培养条件下酶活达3.79(±0.11)U/mL;赵龙妹等[27]获得产纤维素酶菌株巨大芽孢杆菌,该菌30℃生长20 h时所产纤维素酶活力最高、达0.774 U/mL;郑丽等[28]从298个菌株中筛选出57个可产纤维素酶菌株,其中水解圈最大直径达15 mm,菌株HWY-3-9(解淀粉芽孢杆菌)酶活力最高、为0.0012 U/mL;何深宏等[29]从57株菌株中筛选出10株有较高纤维素酶活性,其中菌株X10(解淀粉芽孢杆菌)的纤维素酶活最高、为0.177 U/mL。本研究筛选出的7株产纤维素酶菌株,在37℃下培养1 d后产酶能力不同,其中菌株LW006(枯草芽孢杆菌)降解纤维素能力最强,其透明圈直径为22.5 mm,产纤维素酶的酶活力最高、为1.22(±0.07)U/mL,与上述学者分离所得的产纤维素酶菌株相比处于较高水平,后续对其培养条件进行优化、蛋白质工程和基因工程等改造[30-31],菌株将可能获得更高的纤维素酶活力,具有较高的开发潜力。
4 结论本研究从实验室的14株菌种初步筛选出7株产纤维素酶菌株,经16S rDNA同源性分析鉴定,其中4株为地衣芽孢杆菌、3株为枯草芽孢杆菌。通过刚果红染色得到1株纤维素降解能力较强的菌株LW006(枯草芽孢杆菌),经DNS法测定,其纤维素酶活力可达1.22(±0.07)U/mL(P < 0.01)。无抗养殖是大势所趋,本研究筛选的7株产纤维素酶菌株为微生物添加剂提供新的菌种资源,在家禽的健康养殖中具有重要意义。
| [1] |
刘海燕, 王秀飞, 王彦靖, 赵新颖, 刘鹏. 秸秆黄贮的研究进展[J]. 饲料研究, 2021, 44(19): 153-156. DOI:10.13557/j.cnki.issn1002-2813.2021.19.033 LIU H Y, WANG X F, WANG Y J, ZHAO X Y, LIU P. Research progress of stover silage[J]. Feed Research, 2021, 44(19): 153-156. DOI:10.13557/j.cnki.issn1002-2813.2021.19.033 |
| [2] |
张俊, 许超, 张宇, 梁翠谊, 许敬亮. 纤维素酶降解机理的研究进展[J]. 华南理工大学学报(自然科学版), 2019, 47(9): 121-130. DOI:10.12141/j.issn.1000-565X.180560 ZHANG J, XU C, ZHANG Y, LIANG C Y, XU J L. Research progress on cellulase biodegradation mechanism[J]. Journal of South China University of Technology (Natural Science Edition), 2019, 47(9): 121-130. DOI:10.12141/j.issn.1000-565X.180560 |
| [3] |
GENG D H, LIN Z X, LIU L, QIN W Y, WANG A X, WANG F Z, TONG L T. Effects of ultrasound-assisted cellulase enzymatic treatment on the textural properties and in vitro starch digestibility of brown rice noodles[J]. LWT -Food Science and Technology, 2021, 146: 111543. DOI:10.1016/j.lwt.2021.111543 |
| [4] |
RICARDO H B, LUDMILLA D C O, MARINA V G, MÁRIO R M J, MARCELO C. Modification of coffee coproducts by-products by dynamic high pressure, acetylation and hydrolysis by cellulase: A potential functional and sustainable food ingredient[J]. Innovative Food Science & Emerging Technologies, 2021(68): 102608. |
| [5] |
郑自强, 卫春会, 邓杰, 黄治国, 仲济宇, 任志强. 一株产纤维素酶枯草芽孢杆菌的麸曲制作及其产酶特性研究[J]. 食品与机械, 2021, 37(10): 12-17. DOI:10.13652/j.issn.1003-5788.2021.10.003 ZHENG Z Q, WEI C H, DENG J, HUANG Z G, ZHONG J Y, REN Z Q. Study on production of Fuqu and the characteristics of enzyme about a cellulase producing Bacillus subtilis[J]. Food & Machinery, 2021, 37(10): 12-17. DOI:10.13652/j.issn.1003-5788.2021.10.003 |
| [6] |
ZHONG C Y, SUN S, ZHANG D J, LIU L, ZHOU S, ZHOU J G. Production of a bioflocculant from ramie biodegumming wastewater using a biomass-degrading strain and its application in the treatment of pulping wastewater[J]. Chemosphere, 2020, 253: 126727. DOI:10.1016/j.chemosphere.2020.126727 |
| [7] |
WELLINGTON A, DANIE D, GERHARDT C, EUGENE V R, JOHANN F G. Kinetic modelling of cellulase recycling in paper sludge to ethanol fermentation[J]. Journal of Environmental Chemical Engineering, 2021, 9(5): 105981. DOI:10.1016/j.jece.2021.105981 |
| [8] |
DONG M Y, WANG S Y, XU F Q, XIAO G Q, BAI J. Efficient utilization of waste paper as an inductive feedstock for simultaneous production of cellulase and xylanase by Trichoderma longiflorum[J]. Journal of Cleaner Production, 2021, 308: 127287. DOI:10.1016/j.jclepro.2021.127287 |
| [9] |
ANA C Q S, ARMANDO J D S, CARMEN S R F, CARLA V. Improving the adsorption performance and surface roughening of rayon fibers via enzymatic treatment with cellulase[J]. Textile Research Journal, 2021, 91(5/6): 303-365. |
| [10] |
KUMAR A. Dissolving pulp production: cellulases and xylanases for the enhancement of cellulose accessibility and reactivity[J]. Physical Sciences Reviews, 2021, 6(5): 111-129. DOI:10.1515/psr-2019-0047 |
| [11] |
解先利, 刘云云, 曹运齐, 赵元元, 陈世贤. 木质纤维素酶水解分形动力学的研究进展[J]. 新能源进展, 2021, 9(5): 426-433. DOI:10.3969/j.issn.2095-560X.2021.05.009 JIE X L, LIU Y Y, CAO Y J, ZHAO Y Y, CHEN S X. Research progress on fractal dynamics of enzymatic hydrolysis of lignocellulose[J]. Advances in New and Renewable Energy, 2021, 9(5): 426-433. DOI:10.3969/j.issn.2095-560X.2021.05.009 |
| [12] |
刘登, 刘均洪. 嗜热性木质纤维素酶在纤维素乙醇生产中的研究进展[J]. 生物技术通报, 2020, 36(8): 185-193. DOI:10.13560/j.cnki.biotech.bull.1985.2019-1267 LIU D, LIU J H. Research progress of thermophilic lignocellulase in cellulose ethanol production[J]. Biotechnology Bulletin, 2020, 36(8): 185-193. DOI:10.13560/j.cnki.biotech.bull.1985.2019-1267 |
| [13] |
LIU L R, HUANG W C, LIU Y, LI M. Diversity of cellulolytic microorganisms and microbial cellulases[J]. International Biodeterioration & Biodegradation, 2021, 163: 105277. DOI:10.1016/j.ibiod.2021.105277 |
| [14] |
张民. 酶制剂在畜禽养殖中的应用研究进展[J]. 生物产业技术, 2019(3): 91-98. ZHANG M. Research progress on application of enzyme preparation in livestock and poultry breeding[J]. Biotechnology & Business, 2019(3): 91-98. |
| [15] |
马峥. 不同添加量的纤维素酶和木聚糖酶对玉米秸秆黄贮的影响[D]. 太原: 山西农业大学, 2015. MA Z. Effect of different amounts of cellulase and xylanase on the yellow storage of corn straw[D]. Taiyuan: Shanxi Agricultural University, 2015. |
| [16] |
李鸿, 蒋志成, 冯定明, 周茂林. 玉米青贮、黄贮研究进展及展望[J]. 南方农业, 2021, 15(1): 79-81. DOI:10.19415/j.cnki.1673-890x.2021.01.019 LI H, JIANG Z C, MA D M, ZHOU M L. Research progress and prospect of corn silage and yellow corn silage[J]. South China Agriculture, 2021, 15(1): 79-81. DOI:10.19415/j.cnki.1673-890x.2021.01.019 |
| [17] |
刘海燕, 张鹏举, 王秀飞, 王彦靖, 李信涛, 刘晓辉, 王伟霞, 谭成成, 刘鹏, 张永锋. 正交试验法优化玉米秸秆穰叶青贮发酵剂的研究[J]. 中国饲料, 2018(11): 74-79. DOI:10.15906/j.cnki.cn11-2975/s.20181115 LIU H Y, ZHANG P J, WANG X F, WANG Y J, LI X T, LIU X H, WANG W X, TAN C C, LIU P, ZHANG Y F. Optimization of the silage additives for leaf and pith of corn stalk by orthogonal test[J]. China Feed, 2018(11): 74-79. DOI:10.15906/j.cnki.cn11-2975/s.20181115 |
| [18] |
王炳坤, 郭立炜, 王刚, 张斯童, 张宏泽, 陈欢, 陈光. 秸秆降解菌筛选及其应用研究进展[J/OL]. 分子植物育种, 2021: 1-11(2021-11-09)[2021-12-15]. http://kns.cnki.net/kcms/detail/46.1068.S.20211109.1357.004.html. WANG B K, GUO L W, WANG G, ZHANG S T, ZHANG H Z, CHEN H, CHEN G. Screening and application research progress of straw degrading bacteria[J/OL]. Molecular Plant Breeding: 2021: 1-11(2021-11-09)[2021-12-15]. http://kns.cnki.net/kcms/detail/46.1068.S.20211109.1357.004.html. |
| [19] |
郑秋燕, 刘旭川, 李清, 樊月圆, 张春勇, 杨舒黎, 毛华明, 冷静. 瘤胃纤维素酶来源的微生物及其作用机制[J]. 广东农业科学, 2015, 42(12): 105-110. DOI:10.16768/j.issn.1004-874X.2015.12.002 ZHENG Q Y, LIU X C, LI Q, FAN Y Y, ZHANG C Y, YANG S L, MAO H M, LENG J. Microorganisms of rumen cellulase source and its mechanism[J]. Guangdong Agricultural Sciences, 2015, 42(12): 105-110. DOI:10.16768/j.issn.1004-874X.2015.12.002 |
| [20] |
许云, 汪倩, 易太鲜, 赵同建. 一株产纤维素酶细菌的分离鉴定及产酶条件初探[J]. 广东农业科学, 2014, 41(19): 150-153, 237. DOI:10.16768/j.issn.1004-874X.2014.19.004 XU Y, WANG Q, YI T X, ZHAO T J. Isolation and identification of a cellulase-producing bacteria and preliminary study on its fermentation conditions[J]. Guangdong Agricultural Sciences, 2014, 41(19): 150-153, 237. DOI:10.16768/j.issn.1004-874X.2014.19.004 |
| [21] |
葛永怡, 蒙禹势, 李祝, 刘永霞, 郭晓沙, 张传萍. 畜禽粪污土壤中产纤维素酶真菌的筛选及产酶条件研究[J]. 广东农业科学, 2012, 39(21): 175-177. DOI:10.16768/j.issn.1004-874X.2012.21.007 GE Y Y, MENG Y S, LI Z, LIU Y X, GUO X S, ZHANG C P. Screening of cellulase-producting fungi from livestock feces soil and optimization of fermentation conditions[J]. Guangdong Agricultural Sciences, 2012, 39(21): 175-177. DOI:10.16768/j.issn.1004-874X.2012.21.007 |
| [22] |
王大为, 王影, 迟燕平. 纤维素降解菌的分离筛选及酶活测定[J]. 食品工业, 2013, 34(5): 219-221. WANG D W, WANG Y, CHI Y P. Isolation and screening of strains producing cellulase and their enzyme activity determination[J]. The Food Industry, 2013, 34(5): 219-221. |
| [23] |
张功友, 王一涵, 郭敏, 张婷婷, 王兵, 刘红美. 重楼中一株产纤维素酶内生真菌的分离及鉴定[J]. 生物技术通报, 2022, 38(2): 95-104. DOI:10.13560/j.cnki.biotech.bull.1985.2021-0266 ZHANG G Y, WANG Y H, GUO M, ZHANG T T, WANG B, LIU H M. Isolation and identification of a cellulase-producing endophytic fungus in Paris polyphylla var. Yunnanensis[J]. Biotechnology Bulletin, 2022, 38(2): 95-104. DOI:10.13560/j.cnki.biotech.bull.1985.2021-0266 |
| [24] |
林永慧, 何香燕, 何兴兵, 黄玉霞, 陈友富. 一株可降解纤维素内源真菌的产酶条件优化及酶学性质分析[J]. 广东农业科学, 2012, 39(19): 134-137. DOI:10.16768/j.issn.1004-874X.2012.19.005 LIN Y H, HE X Y, HE X Q, HUANG Y X, CHEN Y F. Optimization of enzyme-producing conditions and cellulases characteristics of a cellulose-decompsing endophyte[J]. Guangdong Agricultural Sciences, 2012, 39(19): 134-137. DOI:10.16768/j.issn.1004-874X.2012.19.005 |
| [25] |
李菲, 李喆, 覃仙玲, 黄庶识, 苏芯莹, 潘信利. 山口红树林土壤芽孢杆菌多样性及纤维素酶活性筛选研究[J]. 广西科学, 2021, 28(5): 473-481. DOI:10.13656/j.cnki.gxkx.20211202.002 LI F, LI Z, QIN X L, HUANG S S, SU X Y, PAN X L. Diversity analysis and screening of cellulase activity of Bacillus-like species isolated from Shankou Mangrove soil[J]. Guangxi Sciences, 2021, 28(5): 473-481. DOI:10.13656/j.cnki.gxkx.20211202.002 |
| [26] |
吴静. 高产纤维素酶霉菌的筛选及纤维素酶系的分离纯化[D]. 贵阳: 贵州大学, 2020. DOI: 10.27047/d.cnki.ggudu.2020.000175. WU J. Isolation of molds with high-activity of cellulase and the purification of cellulase system[D]. Guiyang: Guizhou University, 2020. DOI: 10.27047/d.cnki.ggudu.2020.000175. |
| [27] |
赵龙妹, 陈林, 杜东晓, 董惠心, 李旺, 李元晓, 何万领, 曹平华. 产纤维素酶细菌的筛选鉴定与特性分析[J]. 中国农学通报, 2021, 37(30): 83-88. ZHAO L M, CEHN L, DU D X, DONG H X, LI W, LI Y X, HE W L, CAO P H. Screening, identification and characteristic analysis of cellulase-producing bacteria[J]. Chinese Agricultural Science Bulletin, 2021, 37(30): 83-88. |
| [28] |
郑丽, 张海鹏, 宋艳培, 刘孟浩, 何时雨, 马旭东, 覃新导, 李伯松. 纤维素降解菌的筛选、鉴定和糖化水平研究[J]. 广东农业科学, 2017, 44(2): 104-111. DOI:10.16768/j.issn.1004-874X.2017.02.016 ZHENG L, ZHANG H P, SONG Y P, LIU M H, HE S Y, MA X D, QIN X D, LI B S. Isolation, identification and saccharification level of cellulose degrading bacteria[J]. Guangdong Agricultural Sciences, 2017, 44(2): 104-111. DOI:10.16768/j.issn.1004-874X.2017.02.016 |
| [29] |
何深宏, 程方俊, 罗干, 张耕, 杜亚楠, 康霞梅, 王晓涵, 赵自亮, 任绍科, 郭建华. 解淀粉芽孢杆菌高产纤维素酶菌株的筛选与鉴定[J]. 福建农业学报, 2020, 35(7): 781-787. DOI:10.19303/j.issn.1008-0384.2020.07.012 HE S H, CHENG F J, LUO G, ZHANG G, DU Y N, KANG X M, WANG X H, ZHAO Z L, REN S K, GUO J H. Screening and identifying cellulase-producing Bacillus amyloliquefaciens[J]. Fujian Journal of Agricultural Sciences, 2020, 35(7): 781-787. DOI:10.19303/j.issn.1008-0384.2020.07.012 |
| [30] |
赵情. 纤维素酶枯草芽孢杆菌表达系统的建立及初步应用[D]. 泰安: 山东农业大学, 2019. ZHAO Q. Establishment and application of Bacillus subtilis system expressing cellulase[D]. Taian: Shandong Agriculture University, 2019. |
| [31] |
周姗娜, 胡艳梅, 乔琦茗, 李华南, 江正兵. 融合荧光蛋白的纤维素酶表达与性质分析[J/OL]. 生物加工过程, 2021: 1-9(2021-10-28)[2021-12-15]. http://kns.cnki.net/kcms/detail/32.1706.q.20211026.1511.002.html. ZHOU S N, HU Y M, QIAO Q M, LI H N, JIANG Z B. Expression and properties analysis of cellulases fusing fluorescent protein[J/OL]. Chinese Journal of Bioprocess Engineering, 2021: 1-9(2021- 10-28)[2021-12-15]. http://kns.cnki.net/kcms/detail/32.1706.q.20211026.1511.002.html. |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49